Похожие презентации:
Электроды. Гальванические элементы. Потенциометрия
1.
Кафедра химииЭлектроды.
Гальванические элементы.
Потенциометрия
Тема лекции:
2.
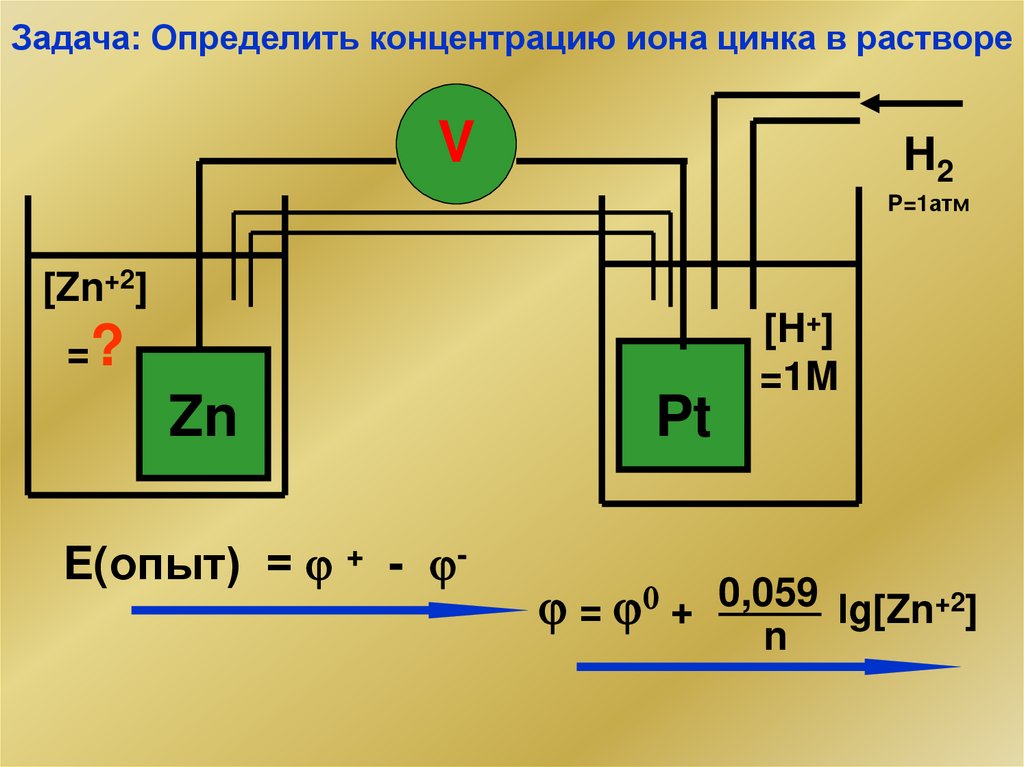
Задача: Определить концентрацию иона цинка в раствореV
H2
P=1атм
[Zn+2]
=?
Zn
E(опыт) = + - -
Pt
[H+]
=1M
= 0 + 0,059 lg[Zn+2]
n
3.
Потенциометрический методанализа состава раствора
Основан на измерении электрохимического (мембранного)
потенциала электрода, величина которого является
функцией активности ионов в растворе. Такие электроды
называют индикаторными (электродами определения).
V
Электрод
определения
Электрод
сравнения
Исследуемый
раствор [aM = X]
Стандартный
раствор
4.
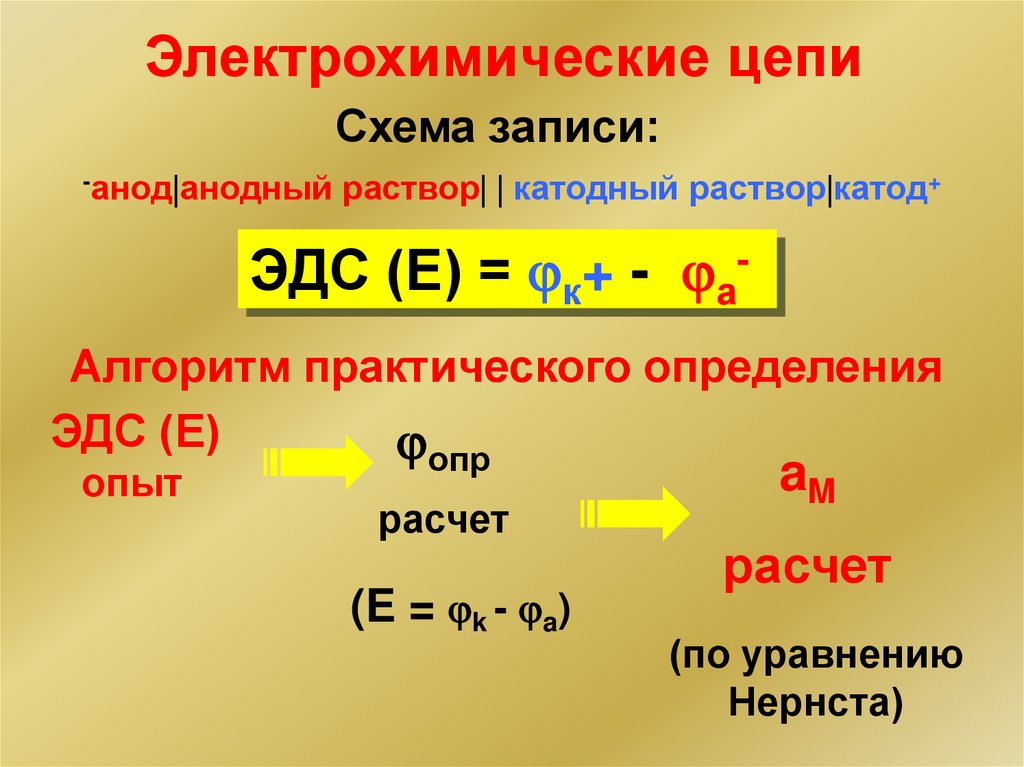
Электрохимические цепиСхема записи:
-анод анодный раствор катодный раствор катод+
ЭДС (Е) = к+ - аАлгоритм практического определения
ЭДС (Е)
опыт
опр
расчет
(E = k - a)
aM
расчет
(по уравнению
Нернста)
5.
Электроды определенияпотенциал зависит от активности определяемых ионов
рН-зависимые электроды определения
1. Водородный электрод (Электрод I рода)
Редокс-реакция: 2Н++ 2е- H2
Схема записи: H2(Pt) H+
Уравнение Нернста:
2H+/H2 = - 0,059pH(В)
Достоинства:
высокая точность
Недостатки:
капризен в работе
6.
2. Хингидронный электродOH
O
OH
O
+
OH
O
хингидрон
OH
гидрохинон
O
хинон
Редокс-реакция:
Хинон + 2Н+ + 2е- Гидрохинон
Схема записи:
Pt х,гх, рН
0 = 0,699В
0
хг = хг – 0,059рН (В) хг
Достоинства:
- простота изготовления
Недостатки:
- вносит постороннее вещество
- работает лишь при рН менее 8
7.
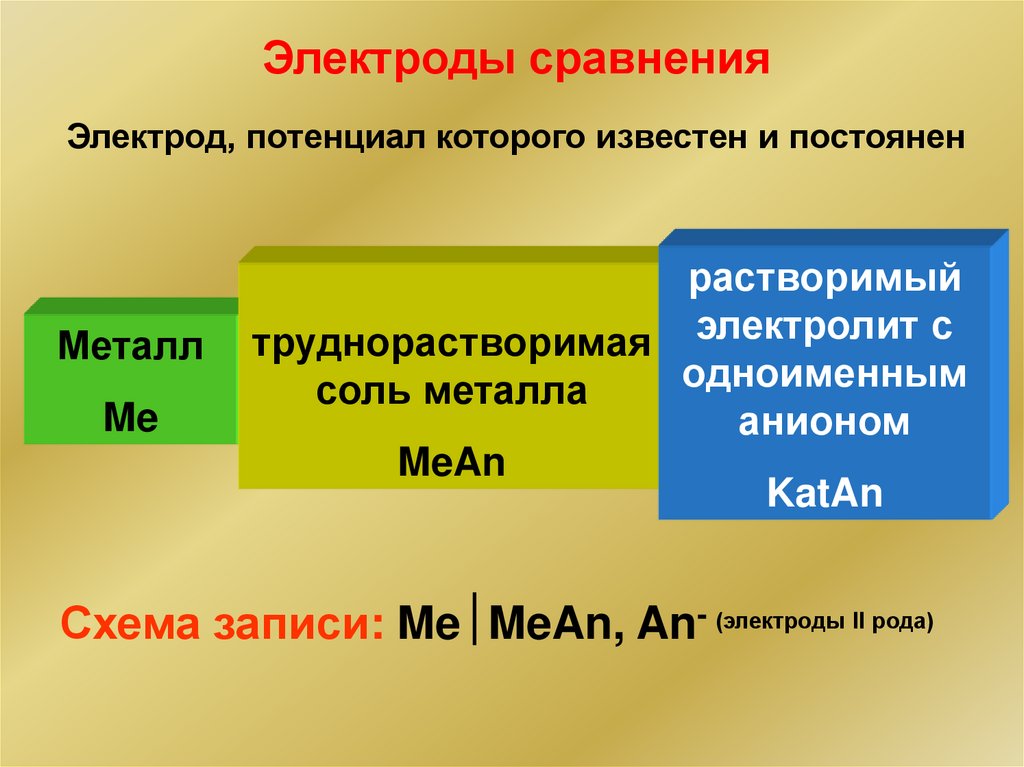
Электроды сравненияЭлектрод, потенциал которого известен и постоянен
Металл
Me
растворимый
труднорастворимая электролит с
одноименным
соль металла
анионом
MeAn
KatAn
Схема записи: Me MeAn, An- (электроды II рода)
8.
Хлорсеребряный электродРедокс-реакция:
Ag+ + e- Ag
Ag+ + Cl- AgCl
Схема записи:
Ag AgCl, Cl-
хс = 0хс – 0,059 lgaCl- хс0 = 0,222 В
хс(в насыщенном KCl) = 0,202 В
9.
Электрические цепи гальваническогоэлемента
Химические цепи
состоят из электродов различной природы
Концентрационные цепи
состоят из одинаковых электродов,
погруженных в растворы с разной концентрацией
одного и того же иона
10.
Определение рН раствора спомощью хлорсеребряно водородной химической цепи
1. Определение электрода – катода.
хс( насыщ.) = 0,202 В >
катод
катода > анода
н0 = 0
анод
2. Запись цепи.
- H (Pt) H+ AgCl, KCl(нас.) Ag +
2
x
3. Расчет ЭДС.
Е(опыт) = хс - Н = 0,202 – (-0,059 рНx)
4. Расчет рН.
рНx =
Е- 0,202
0,059
11.
Определение рН раствора с помощьюхингидрон-хингидронной
концентрационной цепи
1. Определение электрода – катода.
Катод – электрод, погруженный в более концентрированный
раствор (для рН – зависимых электродов).
рН раствора
в электроде сравнения = 2
катод
Исследуемый раствор –
моча (рН>2)
анод
2. Запись цепи.
- Pt pH
+
х,
гх
pH
=
2,
х,
гх Pt
x,
3. Расчет ЭДС.
Е(опыт) = 0,699 – 0,059рНстанд. – 0,699 + 0,059pHx
Е
рН х
рН станд
0,059
12.
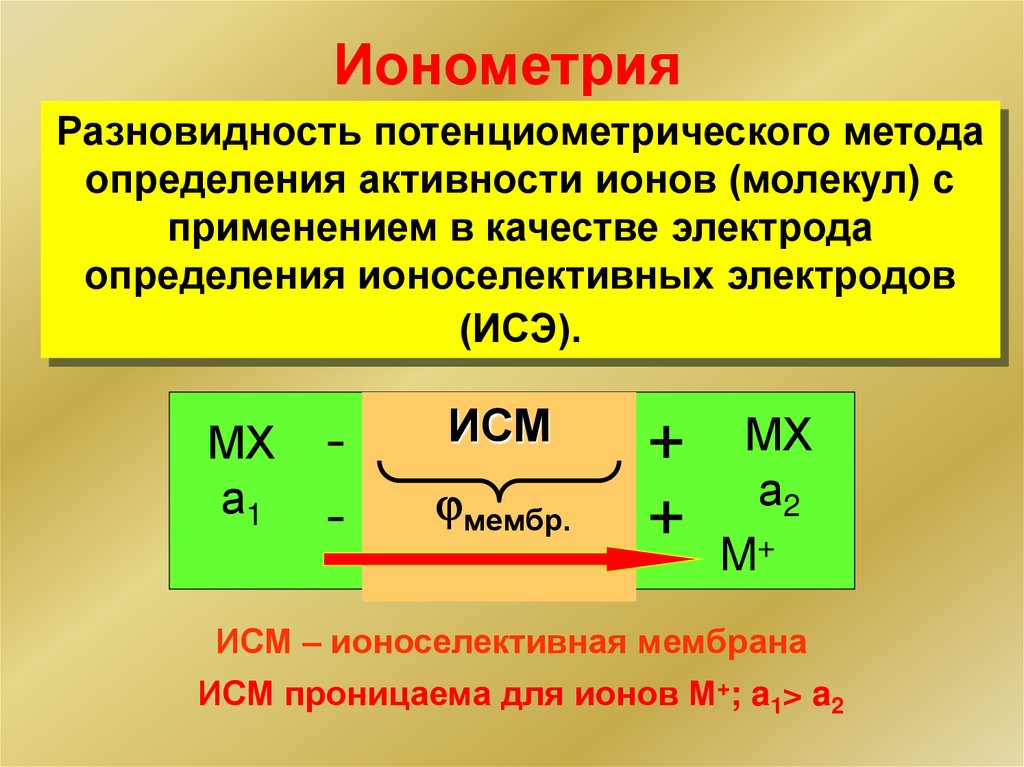
ИонометрияРазновидность потенциометрического метода
определения активности ионов (молекул) с
применением в качестве электрода
определения ионоселективных электродов
(ИСЭ).
МХ
а1
-
ИСМ
мембр.
+
+
МХ
а2
M+
ИСМ – ионоселективная мембрана
ИСМ проницаема для ионов М+; a1> a2
13.
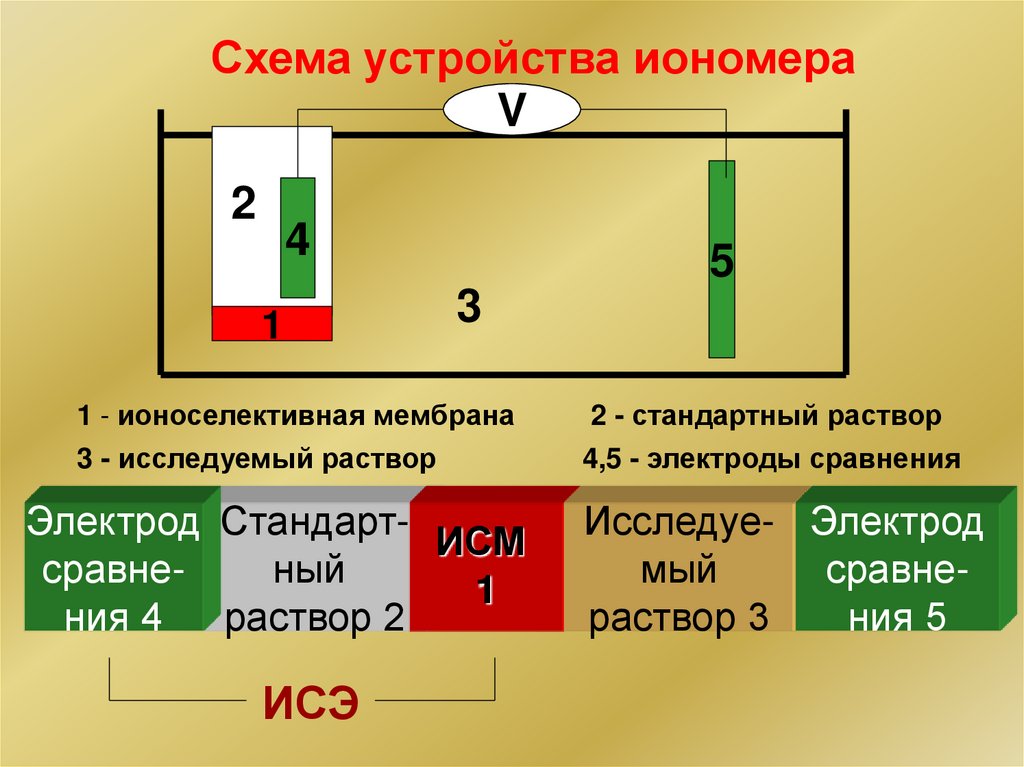
Схема устройства иономераV
2
4
1
5
3
1 - ионоселективная мембрана
3 - исследуемый раствор
2 - стандартный раствор
4,5 - электроды сравнения
Электрод СтандартИСМ
сравненый
1
ния 4
раствор 2
Исследуе- Электрод
мый
сравнераствор 3
ния 5
ИСЭ
14. Мембранный потенциал
Расчет активных ионных концентраций дляидеального электрода
Мембранный потенциал
0,059
м ем бр сonst
lg a1
Z
Z – заряд мигрирующего иона
2,3RT
E E
lg aM
zF
0
E – э.д.с. системы
Е0 – const для данного прибора
+ (-) – для катионов (анионов), соответственно
15.
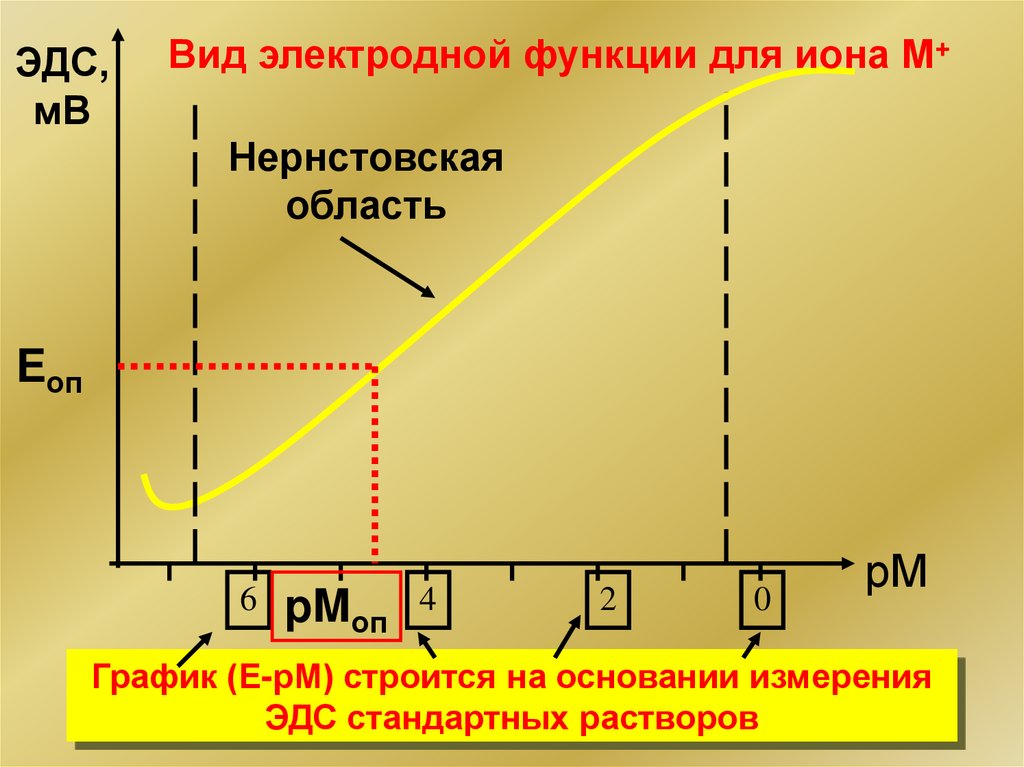
ЭДС,мВ
Вид электродной функции для иона М+
Нернстовская
область
Eоп
6
pMоп 4
2
0
рМ
График (Е-рМ) строится на основании измерения
ЭДС стандартных растворов
16.
Типы ИСЭСтеклянные
Твердофазные
С жидкой мембраной
Ферментные
Биологические сенсоры
Газовые
17.
Стеклянные электродыНатрий
Кислород
Кремний
3
2
4
1
1- ИСМ
2 - стандартный раствор
3 - электрод сравнения
4 - корпус
xNa2O ySiO2
Важнейшие стеклянные электроды – pH, pNa
18.
Твердофазные электроды3
2
4
1 - ИСМ
2 - стандартный раствор
3 - электрод сравнения
4 - корпус
Возможно определение ионов,
входящих в состав мембраны,
а также ионов, способных
взаимодействовать с ее
активными центрами.
1
Материал мембран –
LaF3, AgCl, Ag2S, CuS, др.
Монокристаллические
Поликристаллические
Важнейшие твердофазные электроды –
pAg, pF, pCl, pS, pBr, pCN, pCu, pPb
19.
Электроды с жидкой мембраной3
2
4
1
1 - ИСМ
2 - стандартный раствор
3 - электрод сравнения
4 - корпус
Электрод представляет собой
диафрагму, поры которой заполнены раствором активного
вещества в орг. растворителе.
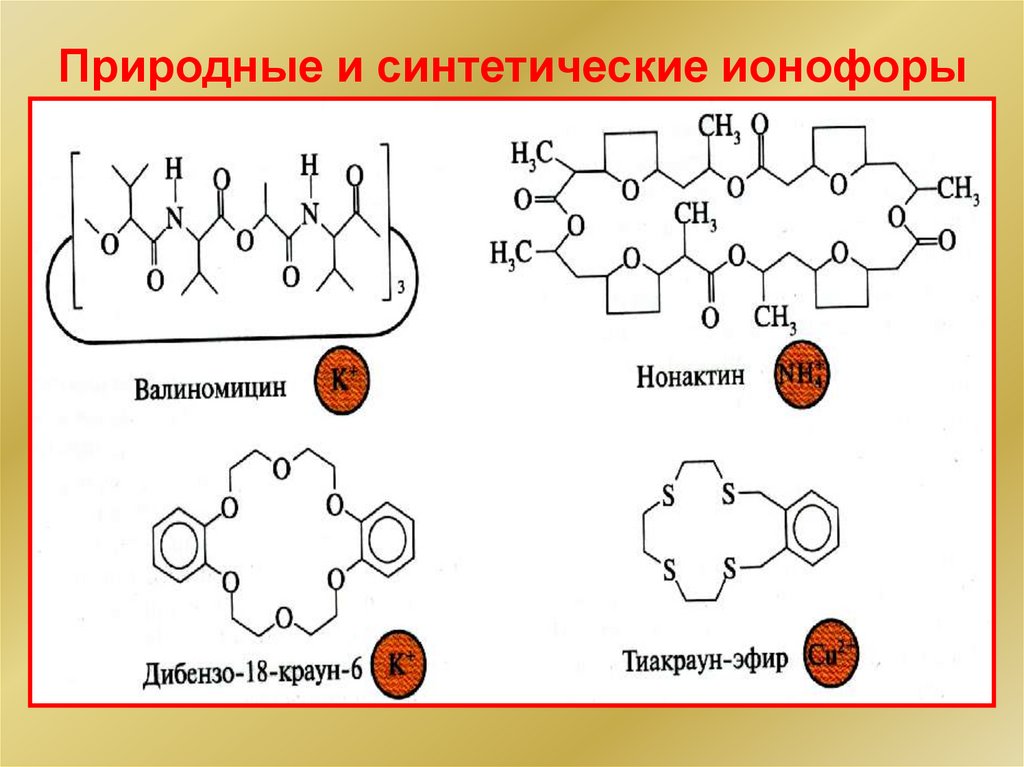
Активные компоненты жидких мембран
Ионообменники
Комплексоны
Нейтральные переносчики
Важнейшие жидкостные электроды –
pK, pCa, pMg, pNO3
20.
Природные и синтетические ионофоры21.
Газовые электродыИспользуется промежуточная реакция,
в ходе которой из молекул определяемых веществ
образуются ионы, активность которых
может быть определена одним из
рассмотренных ранее ИСЭ
СO2 + H2O H+ + HCO3-
Газовые электроды: pCO2, pNH3, pH2S
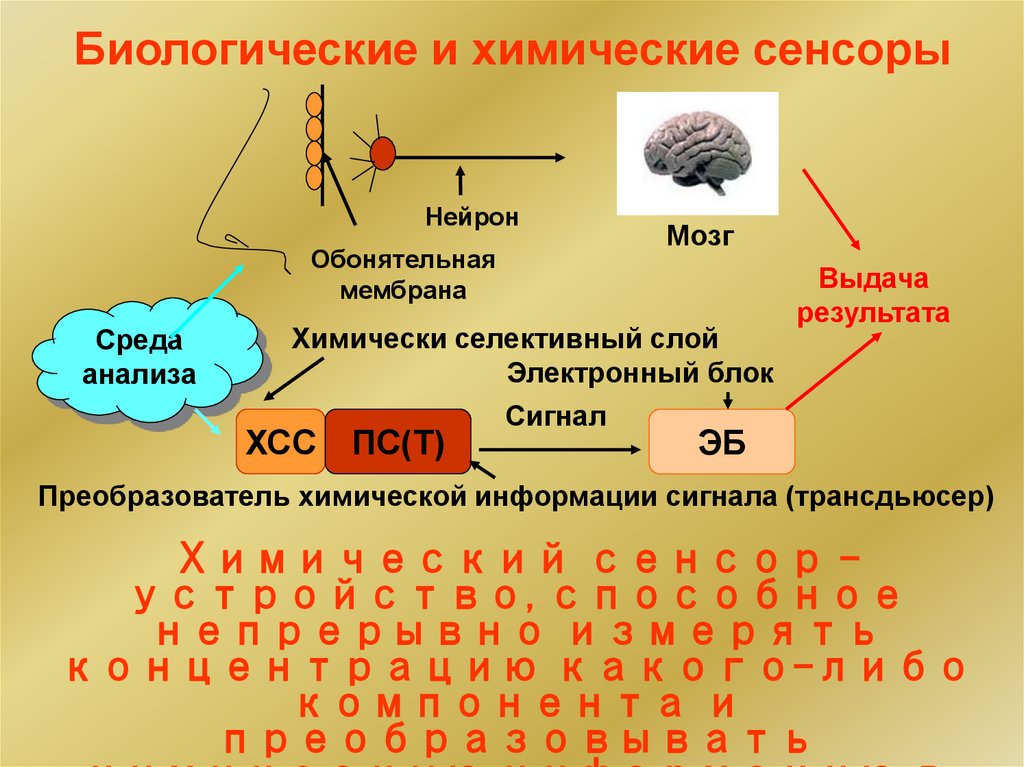
22. Биологические и химические сенсоры
НейронОбонятельная
мембрана
Среда
анализа
Мозг
Химически селективный слой
Электронный блок
ХСС
ПС(Т)
Сигнал
Выдача
результата
ЭБ
Преобразователь химической информации сигнала (трансдьюсер)
Химический сенсор –
устройство, способное
непрерывно измерять
концентрацию какого-либо
компонента и
преобразовывать
23.
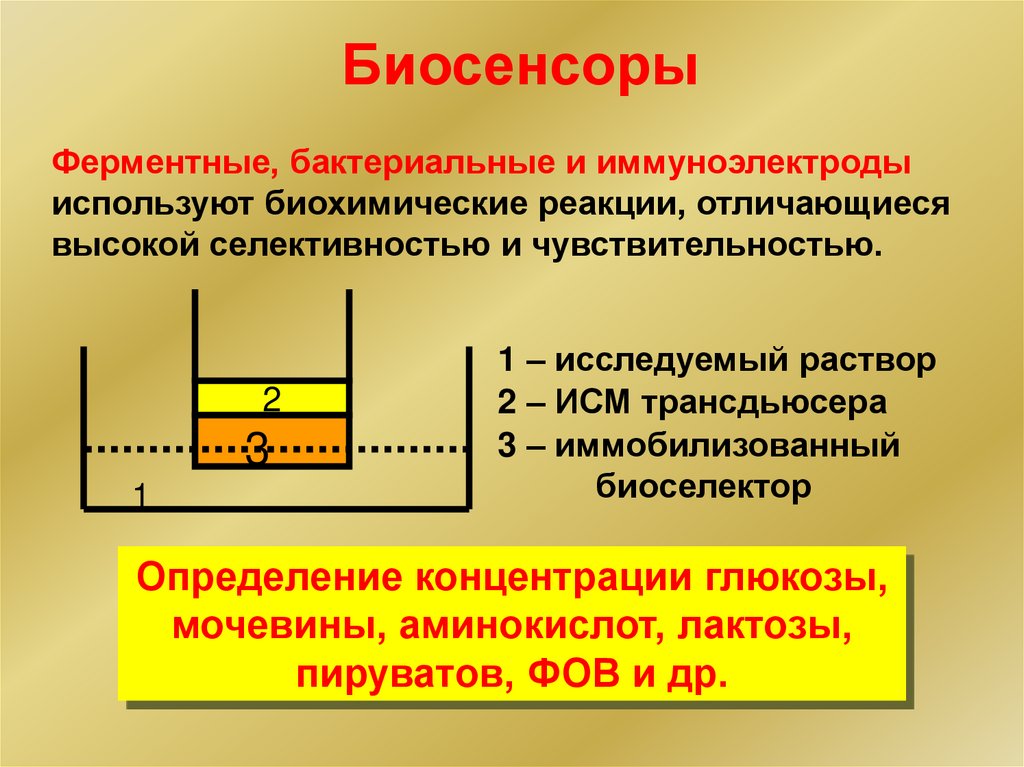
БиосенсорыФерментные, бактериальные и иммуноэлектроды
используют биохимические реакции, отличающиеся
высокой селективностью и чувствительностью.
2
3
1
1 – исследуемый раствор
2 – ИСМ трансдьюсера
3 – иммобилизованный
биоселектор
Определение концентрации глюкозы,
мочевины, аминокислот, лактозы,
пируватов, ФОВ и др.
24.
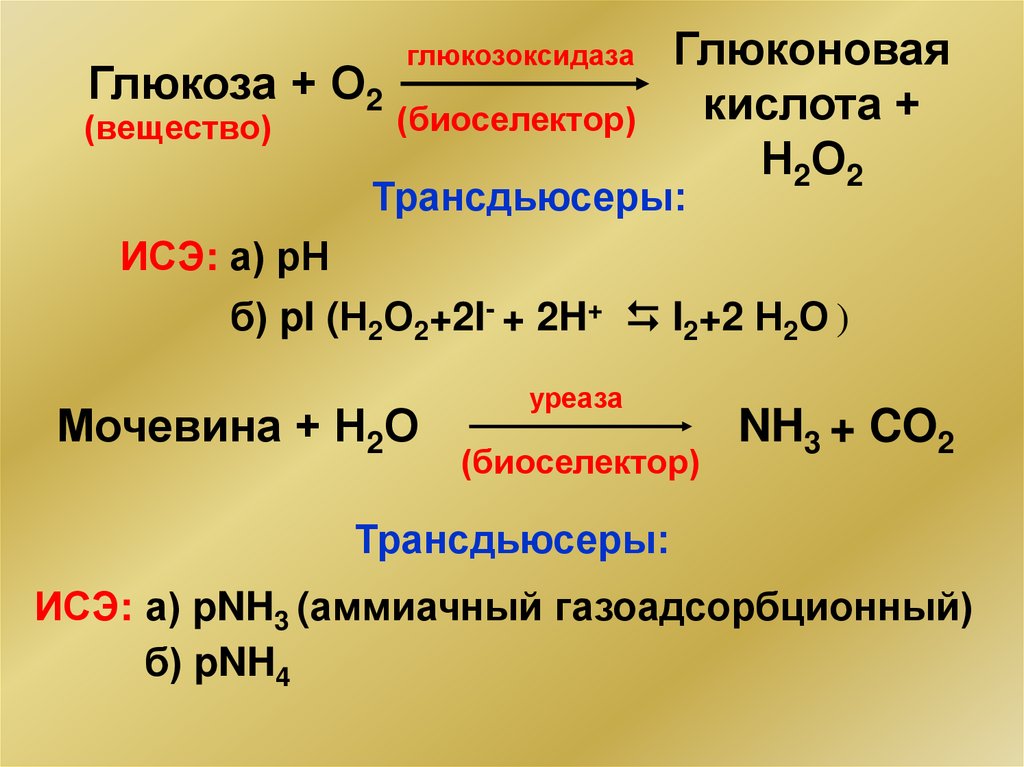
Глюкоза + О2(вещество)
глюкозоксидаза
(биоселектор)
Глюконовая
кислота +
Н 2О 2
Трансдьюсеры:
ИСЭ: а) рН
б) pI (Н2О2+2I- + 2H+ I2+2 Н2О )
Мочевина + Н2О
уреаза
(биоселектор)
NH3 + CO2
Трансдьюсеры:
ИСЭ: а) pNH3 (аммиачный газоадсорбционный)
б) pNH4
25.
Преимущества ионометрииОпределение активности иона на фоне его общей
концентрации (уникальность метода);
возможны измерения в окрашенных, мутных и вязких
растворах;
проба не разрушается;
время измерения составляет несколько секунд;
унифицированность аппаратуры для определения
активности различных ионов;
диапазон измеряемых концентраций от 1 до 10-6 М;
сравнительная дешевизна приборов;
возможность автоматизации измерений.
26.
Применение ионометрии в медицинеКонтроль (и автоматический)
биологически активной концентрации ионов и
молекул биосред (H+, K+, Na+, Ca2+, HPO42-,
глюкоза, мочевина и др.);
состояния воздуха (СО, СО2, NO, NO2, SO2, H2S
и др.);
состояния природных вод (H+,Ca2+, Mg2+, Hg2+,
Pb2+, NH4+, S2-, HPO42- , NO3-, остатки пестицидов,
гербицидов и др.)
















 Химия
Химия








