Похожие презентации:
Реакции в растворах электролитов
1.
2.
• Полные ионные уравнения –это запись всех веществ в ионной
форме, кроме веществ, вышедших из
сферы деятельности реакции.
• Сокращенное ионное уравнение
– уравнение, в котором не
указываются ионы, не принимающие
участие в реакции.
3.
2NaCl + Ca(OH)2 = CaCl2 + 2NaOH+
_
2+
_
2+
_
+
_
2Na + 2Cl + Ca + 2OH = Ca + 2Cl + 2Na + 2OH
4. Взаимодействие цинка с серной кислотой
• В пробирку поместите 1гранулу цинка и
прилейте 1 мл
концентрированной
серной кислоты.
• Что наблюдаете?
• Кислоту с цинком
перелейте в другую
пробирку с 5 мл воды.
• Какие произошли
изменения?
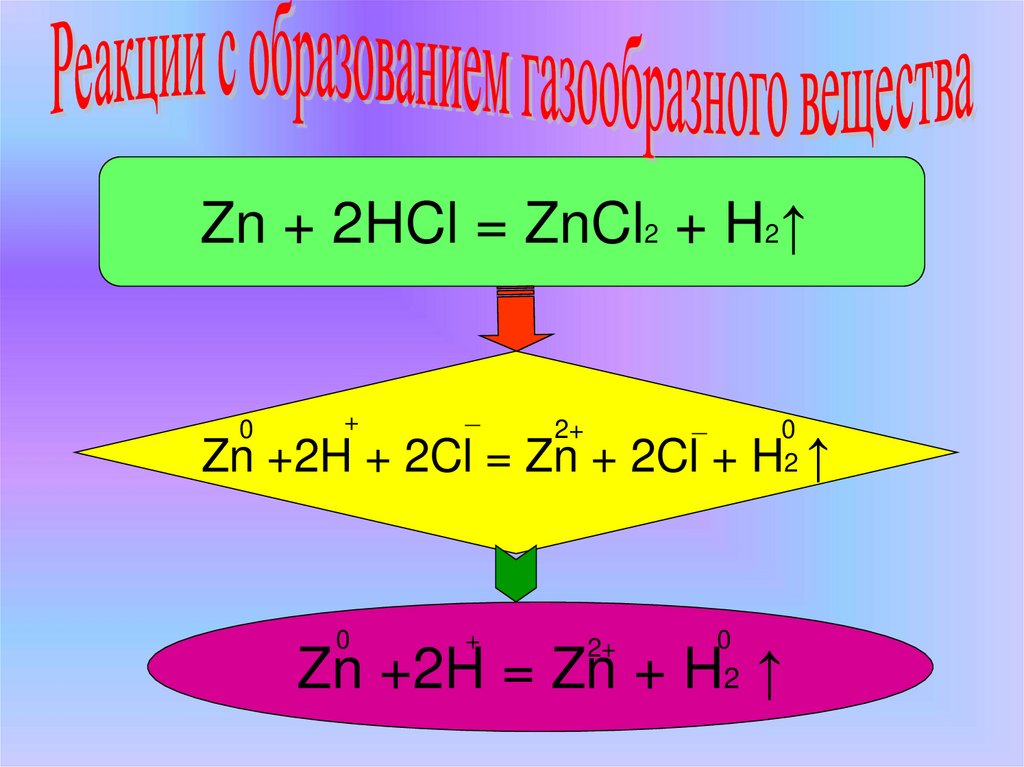
5.
Zn + 2HCl = ZnCl2 + H2↑0
+
_
0
+
_
2+
0
2
Zn +2H + 2Cl = Zn + 2Cl + H ↑
0
Zn +2H = Zn + H2 ↑
2+
6.
7.
H2SO4 + BaCl2 = BaSO4↓+ 2HCL22+
+
2H + SO4 + Ba + 2Cl = BaSO4 ↓+ 2H + 2Cl
+
2-
2+
SO4 + Ba = BaSO4↓
8.
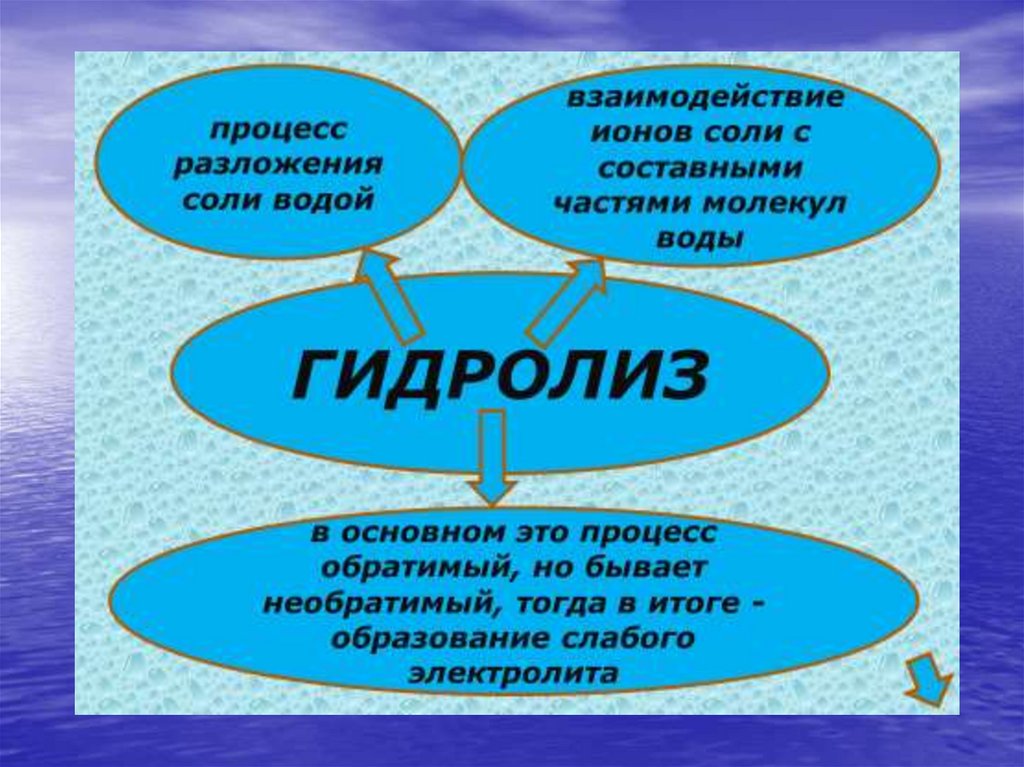
1. Если образовался осадок.2. Если выделяется газообразное
вещество.
3. Если образуется
малодиссоциированное вещество
(например: вода)
9.
10.
Сильные кислоты – кислоты, являющиеся сильнымиэлектролитами (H2SO4, HCl, HNO3, HBr, HI, HClO4 и другие)
Слабые кислота – кислоты, являющиеся слабыми
электролитами (H2CO3, H2SO3, H2S, H2SiO3, H3PO4 и др)
Вспомним
Сильные основания – сильные электролиты щелочи (NaOH, KOH, Ca(OH)2 и другие)
Слабые основания – нерастворимые основания,
слабые электролиты (Cu(OH)2, Al(OH)3 и другие)
11.
12.
Алгоритм составленияуравнений гидролиза
Проверить растворимость соли.
Определить состав соли, т.е. указать, каким по
силе основанием и какой по силе кислотой
образована данная соль
Записать диссоциацию соли и подчеркнуть ион
слабого электролита
Записать уравнение взаимодействия иона слабого
электролита с водой
Определить среду раствора соли
Записать молекулярное уравнение
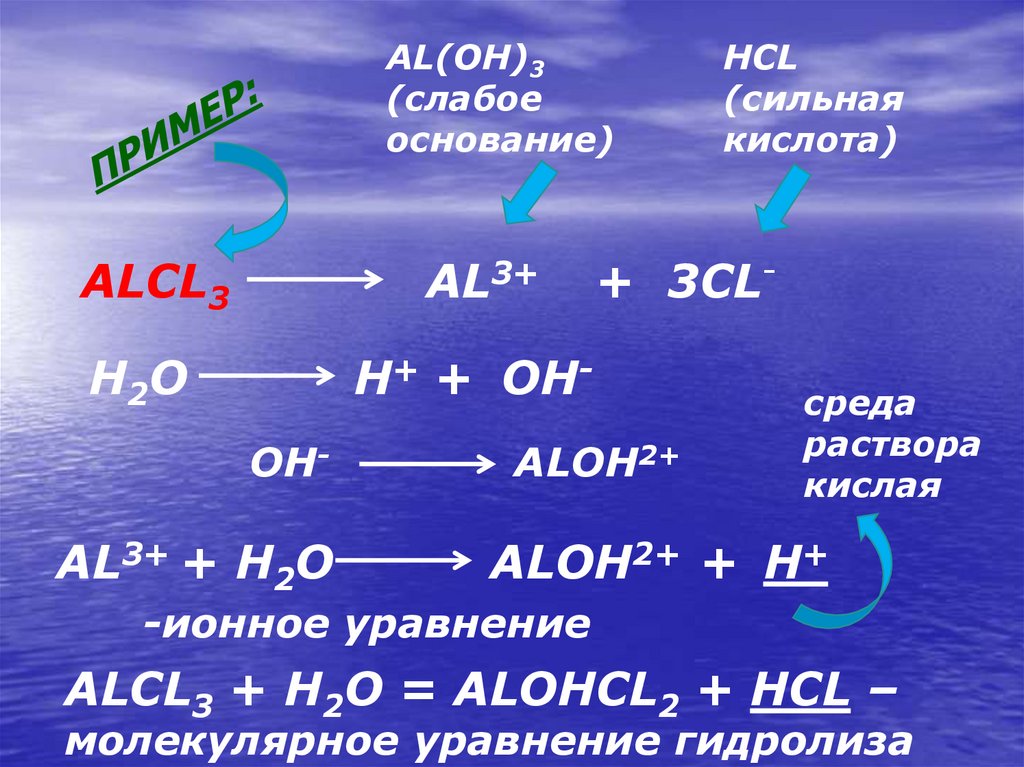
13.
AL(OH)3(слабое
основание)
ALCL3
AL3+
H2O
H+ + OHOH-
AL3+ + H2O
HCL
(сильная
кислота)
+ 3CL-
ALOH2+
среда
раствора
кислая
ALOH2+ + H+
-ионное уравнение
ALCL3 + H2O = ALOHCL2 + HCL –
молекулярное уравнение гидролиза
14. Домашнее задание
• составьте уравнение гидролиза• NH4NO3
• KNO2











 Химия
Химия








