Похожие презентации:
Азаиндолы. Синтeзы азаиндолов
1.
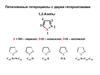
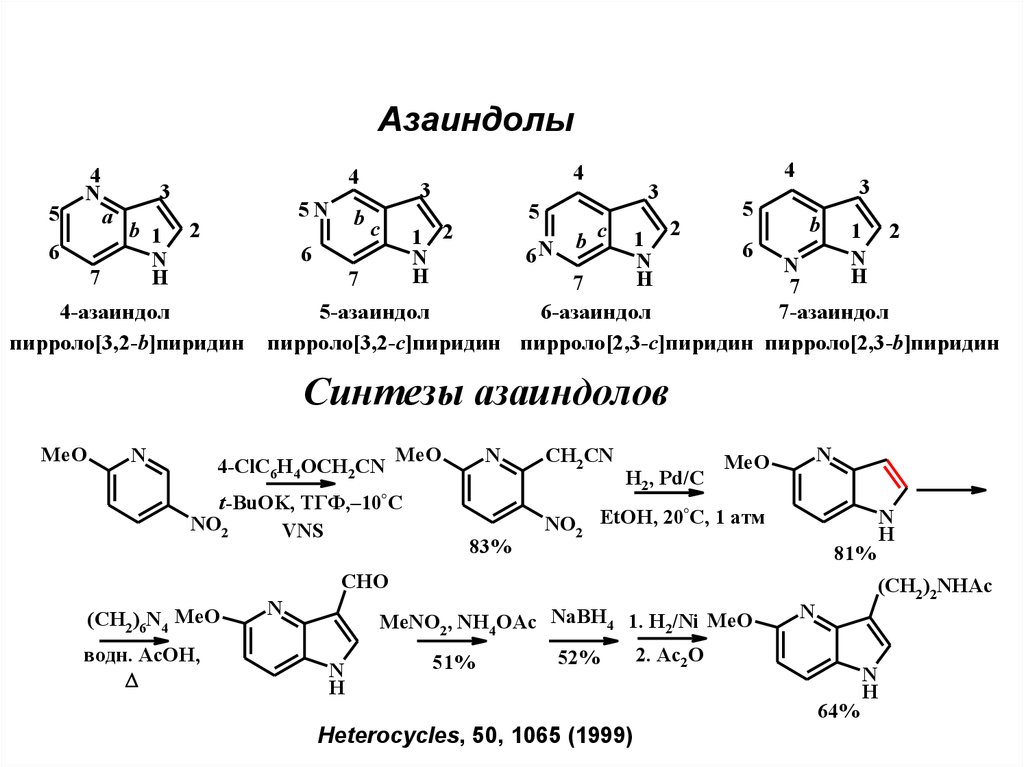
Азаиндолы5
4
N
6
7
4
3
a
5N
b 1 2
N
H
4-азаиндол
пирроло[3,2-b]пиридин
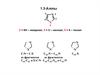
4
3
bc
5
4
3
3
5
b 1 2
1
b
6
6
6N
N
N
N
H
7
H
7
7
5-азаиндол
6-азаиндол
7-азаиндол
пирроло[3,2-с]пиридин пирроло[2,3-с]пиридин пирроло[2,3-b]пиридин
1 2
N
H
2
c
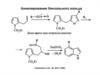
Синтeзы азаиндолов
MeO
N
4-ClC6H4OCH2CN
t-BuOK,
NO2
VNS
MeO
N
ТГФ,–10°С
83%
CH2 CN
H2, Pd/C
N
MeO
°
NO2 EtOH, 20 C, 1 атм
81%
CHO
(CH2)6N4 MeO
водн. AcOH,
N
MeNO2, NH4 OAc NaBH4 1. H2/Ni MeO
N
H
51%
N
H
52%
(CH2)2NHAc
N
2. Ac2O
64%
Heterocycles, 50, 1065 (1999)
N
H
2.
MeI
N
NH
Boc
HC CMe
CuI, ДМФА N
N
Cl2 Pd(PPh3 )2
Et3N, CuI, 20°C
NH
Boc
80°С
Me
N
Boc
84%
100%
Tetrahedron Lett., 39, 5355 (1998)
O
N
CH3 HNO3
O
CH3
N
H2SO4
O
Me2NCH(OMe)2
NO2
H2
Ni-Ra
N
N
H
84%
Синтез Леймгрубера-Бачо
Synthesis., N 20, 3581 (2005)
NMe2
N
NO2
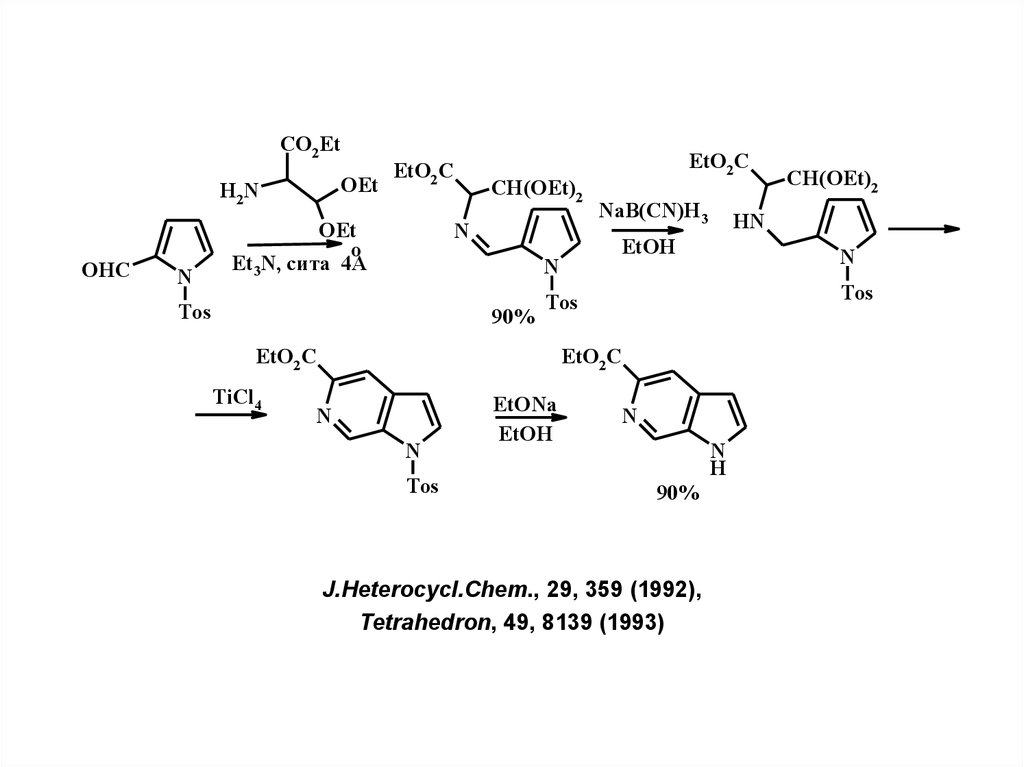
3.
CO2 EtOEt
H2N
OHC
N
EtO2 C
OEt
о
Et3N, сита 4А
CH(OEt)2
N
90%
N
Tos
EtO2 C
N
N
Tos
EtONa
EtOH
CH(OEt)2
HN
Tos
EtO2 C
TiCl4
NaB(CN)H3
EtOH
N
Tos
EtO2 C
N
N
H
90%
J.Heterocycl.Chem., 29, 359 (1992),
Tetrahedron, 49, 8139 (1993)
4.
I(CH2)2 OH
HO(CH2)2 C CSiEt3
Cl2 Pd(dppf),
N
N
LiCl, Na2CO3, ДМФА
H
77%
100°C
dppf - 1,1`-бис(дифeнилфосфино)фeрроцeн
NH2
N
Tetrahedron Lett., 39, 5355 (1998)
Li
Me
N
O
O Li
BuLi
N
N
H
2. HCl
N
H
1. ДМФА
N
O
NH
O
HCl
N
N
H
Synthesis., 877 (1996)
5.
OHO Me
CO2
Me C2 H2
N
N
HO
Me
H2O
N
O
Me
Me
N
~ 80%
CH2
O
O
75-80% O
HO
Me
N2 H4
N
N
Me
Me
ПФК
Me
NH2
N
N
NH2
32%
Н.Б.Чeрнышeва (ИОХ), Конфeрeнция Кост-2005, с. 354
6.
Химические свойства азаиндоловN
N
N
H
N
H
4-азаиндол
pKa (как основания)
+
HN
5-азаиндол
6.94
N
N
H
6-азаиндол
8.26
N
H
N
7-азаиндол
7.95
4.49
N
N
H
+
N
H
+
N
H
N
H
N
H
+
N
H
7.
Реакции электрофильного замещенияINO2
водн. NaOH, 20°C
+
N
N
H
Me
Me
100%
MeI, 20oC
N
N
H дым. HNO
3
83%
0 °C
Ac2 O
N
Br
Br2, CHCl3
N
0°C
N
H
N
Me2NH · HCl,
(HCHO)n
MeI, NaH
ксилол
N
N
N
N
H
81%
CH2NMe2
BuOH,
Ac
N
N
N
62%
N
H
99%
Me
ХГС, 496 (1978); Tetrahedron Lett., 1909 (1969)
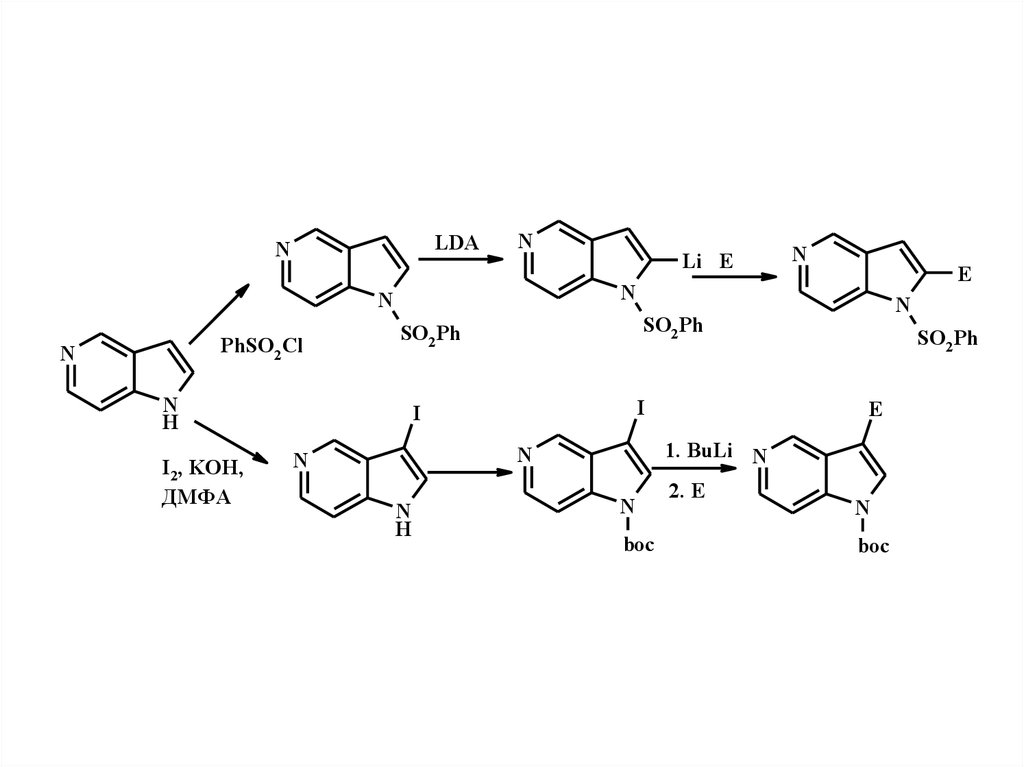
8.
LDAN
N
PhSO2 Cl
N
H
I2, KOH,
ДМФА
N
E
N
N
N
Li E
SO2 Ph
SO2 Ph
I
I
N
H
SO2 Ph
E
1. BuLi N
N
N
N
N
boc
2. E
N
boc
9.
Реакции нуклеофильного замещенияPh
N
Me
Cl
NH2
PhNH2
PhNHMe
N
N
H
180°C
N
N
H
N
180°C
N
PhNH2
NHPh
NHPh
N
N – PhNH2
H
Ph
NHPh
+ PhNH2
NHPh
N
N
H
– PhNH2
84% Ph
NHPh
N
NPh
N
NH2
J.Heterocycl.Chem., 26, 317 (1989)
N
NH2
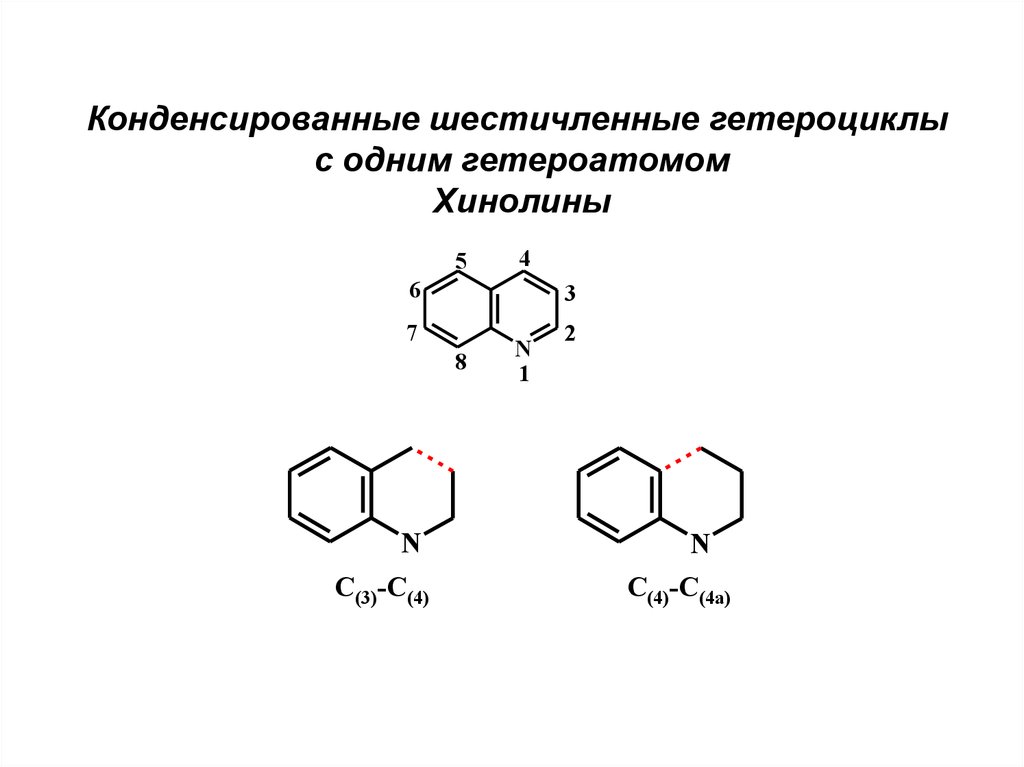
10.
Конденсированные шестичленные гетероциклыс одним гетероатомом
Хинолины
5
4
6
3
7
8
N
C(3)-C(4)
N
1
2
N
C(4)-C(4a)
11.
Образование связи С(3)-С(4)Синтез из о-ациланилинов и карбонильных соединений,
содержащих метиленовую группу (синтез Фридлендера)
O
Ph
Me
Ph
+
NH2
EtOH
Ph
O
Me
Me
AcOH
H2SO4
N
Me
88%
KOH
Ph
OH
NH2 O
Et
N
71%
Et
Конденсация с метилэтилкетоном с кислой и щелочной средах
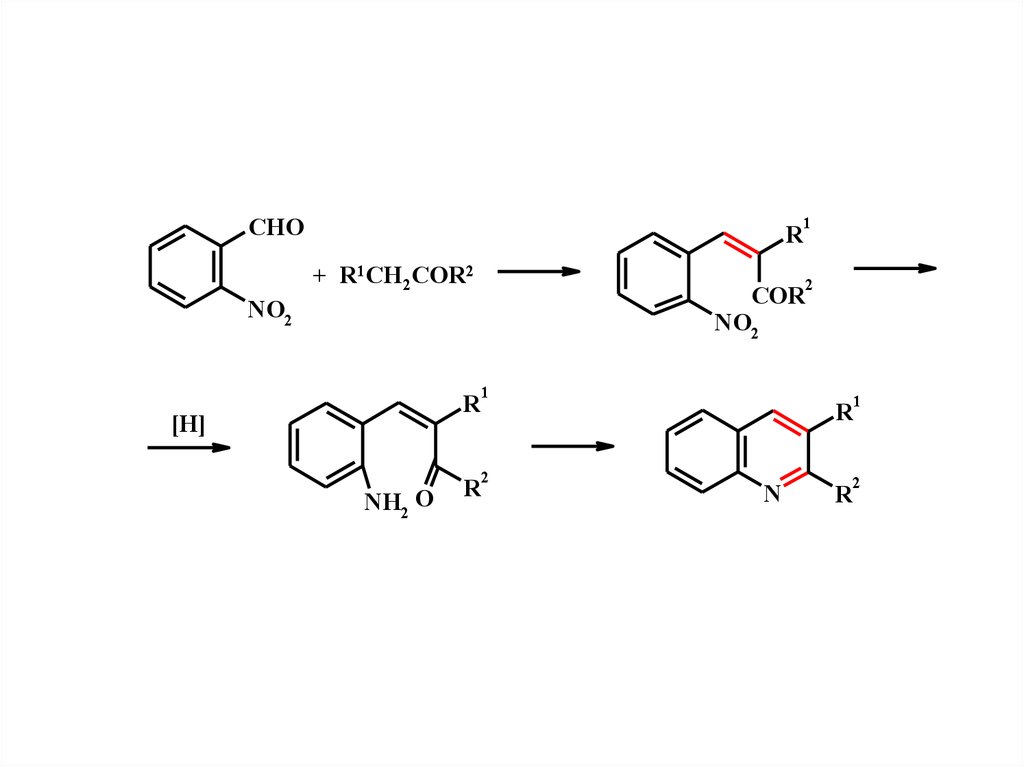
12.
CHOR
+ R1CH2COR2
2
COR
NO2
NO2
1
R
[H]
NH2 O
1
R
2
1
R
N
2
R
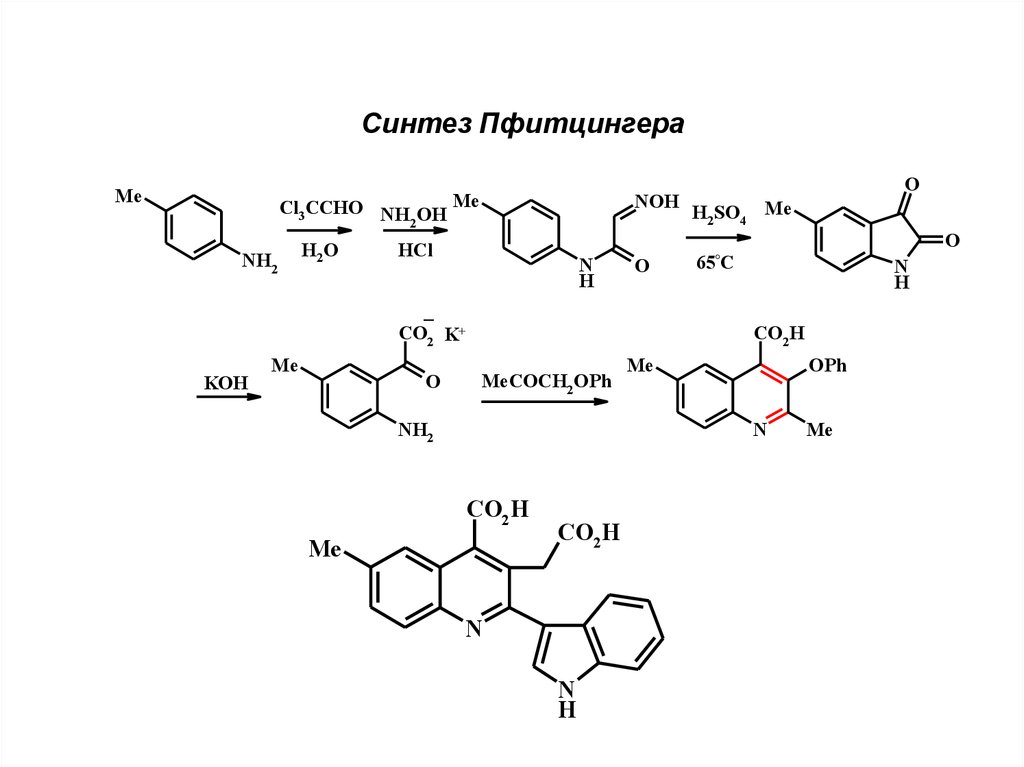
13.
Синтез ПфитцингераMe
Cl3 CCHO NH OH
2
NH2
H2 O
Me
H2SO4 Me
O
65°C
O
HCl
N
H
_
CO2 K+
KOH
Me
O
O
NOH
N
H
CO2 H
MeCOCH2 OPh
Me
OPh
N
NH2
CO2 H
Me
CO2 H
N
N
H
Me
14.
Конденсация о-нитроарилбензилсульфонов с эфирамималеиновой или фумаровой кислот
CO2 Et
SO2 Ph
Me
Me
CO2 Et
K2 CO3, MeCN
18-краун-6
NO2
CO2 Et
+
N
O-
[H]
CO2 Et
Образование связи С(4)-С(4а)
Синтез Скраупа – конденсация ариламинов с
, -непредельными карбонильными соединениями
HOCH2 CH(OH)CH2 OH
O
H2SO4
CH2=CHCHO
OH
H
H+
N
H
PhNH2
-H2O, -H2
N
H
нитробeнзол
N
15.
HOCH2 CH(OH)CH2 OHH2SO4
MeO
NH2
NO2
MeO
As2 O5
N
110-120°C
NO2
76%
Модификация Дебнера-Миллера
Me
PhNH2
Me
N
H+
O
N
Me
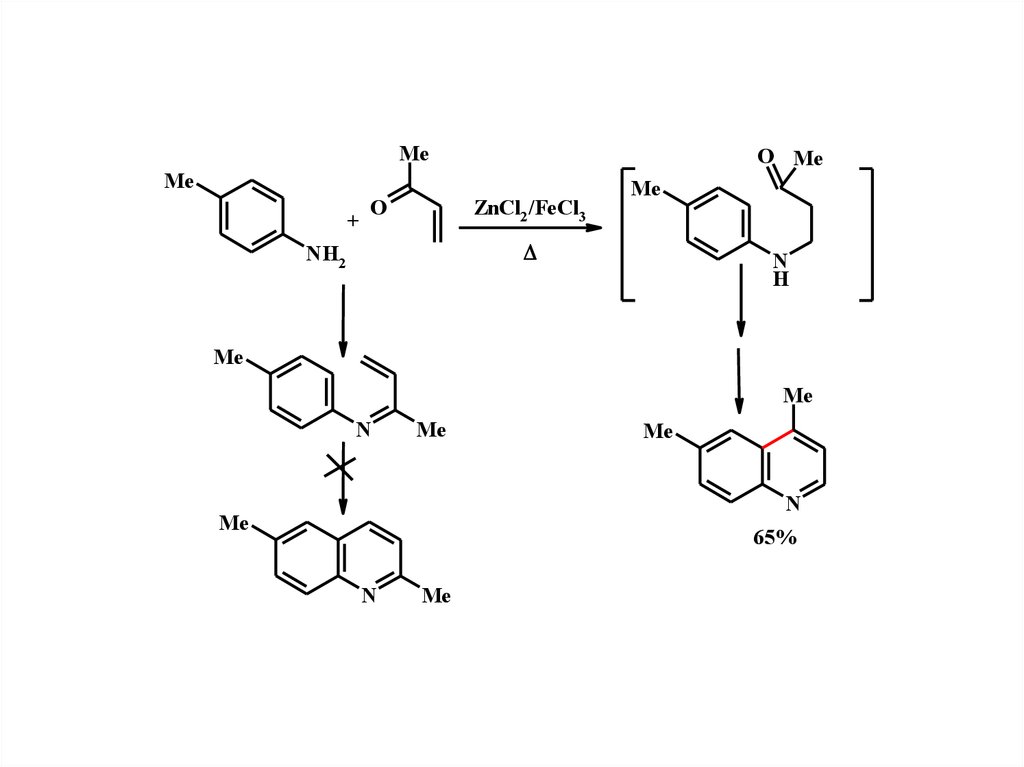
16.
MeO Me
Me
+
ZnCl2 /FeCl3
O
Me
NH2
N
H
Me
Me
N
Me
Me
N
Me
65%
N
Me
17.
Синтез Комба – конденсация ариламиновс 1,3-дикарбонильными соединениями
Me
Me
MeO
+
MeO
O
NH2
O
Me
MeO
O
MeO
Me
Me
Me
OH
H2SO4, конц. MeO
N
H
OH
MeO
+
MeO
N
H
MeO
Me
Me
– H2O
MeO
MeO
N
80%
Me
N
H
Me
18.
Синтез Конрада-Лимпаха-Кнорра –конденсация ариламинов с -кетоэфирами
OEt
+
Cl
NH2
O
AcOH
O
40°C
O
CO2Et
CO2 Et
O
20°C
5 дн
+ PhNH2
140°С
3ч
O
мин.масло
Cl
N
H
EtO
Me
OEt
CO2Et
Cl
N
H
CO2Et
O
O
250°C
20 мин
N
Me
H
Кинетический контроль
Me
N
H
70%
Me
Me
O
250°C
20 мин
N
O
H
Термодинамический контроль
N
H
50%
O
19.
Катализируемая палладием конденсация о-галогенанилинов саллиловыми спиртами. Синтез хинолонов-4 из о-галогенанилинов,
ацетилена и СО
I
PdI
+ Pd
NH2
H2 C
NH2
OH
OH
R
R
R
OH
PdI
NH2
– HPdI
NH2
Pd(0)
R
NH2
O
– H2O
N
R
– H2
R = Me (62%), R = Ph (50%)
N
R
20.
OO
Hal
CO
+
NH2
Ph
PdCl2 (PPh3 )2, Et3N
20 атм.,
NH2
120°С
Ph
N
H
90%
Ph
Tetrahedron Lett., 32, 237 (1991)
Изохинолины
6
5 4a 4
3
7
8
1a
N2
1
N
C-N
N
C(1a)-C(1)
N
C(4)-C(4a)
21.
Образование связи C-NЦиклизация 2-цианобензилцианидов под действием
галогенводородных кислот
R
R
CN
CN
NH2
1. HX
2. Na2CO3
N
J. Org. Chem., 27, 3953 (1962)
X
Образование связи С(1)-С(1а)
Синтез из активированных фенилэтиламинов с
формальдегидом (синтез Пикте-Шпенглера)
MeO
20% HCHO
MeO
NH2
20% HCl
N
H2C
100%
MeO
100oC
NH
70%
22.
OMeOMe
H+
20% HCHO
NH2
MeO
H2O,
MeO
N
H2 C
Циклизация ацилированных фенилэтиламинов
(синтез Бишлера-Напиральского)
MeCOCl
NH
NH2
O
95%
Me
93%
Me
83%
Me
MeO
N
N
POCl3
MeO
N
NH
Ph
O
88%
Ph
23.
POCl3NH
O2N
Ph
210°C
N
O2N
5% Ph
O
Получение 1-замещенных 3,4-дигидроизохинолинов из
-галогеналкилбензолов и нитрилов
(циклизация нитрилиевых солей)
SnCl4
Cl
+
N
R
+
N
R
R = Me (91%), Et (100%), Ph (65%), CH2Ph (50%)
N
R
24.
Образование связи С(4)-С(4а)Синтез Померанца-Фрича – получение изохинолинов
из бензальдегидов и аминоацеталей
EtO
OEt
H2NCH2 CH(OEt)2
H2SO4, конц.
N
95oC
CHO
Br
или P2O5, 160°C
Br
OEt
OEt
+
N
Br
N
– H+
Br
N
– EtOH
Br
30%
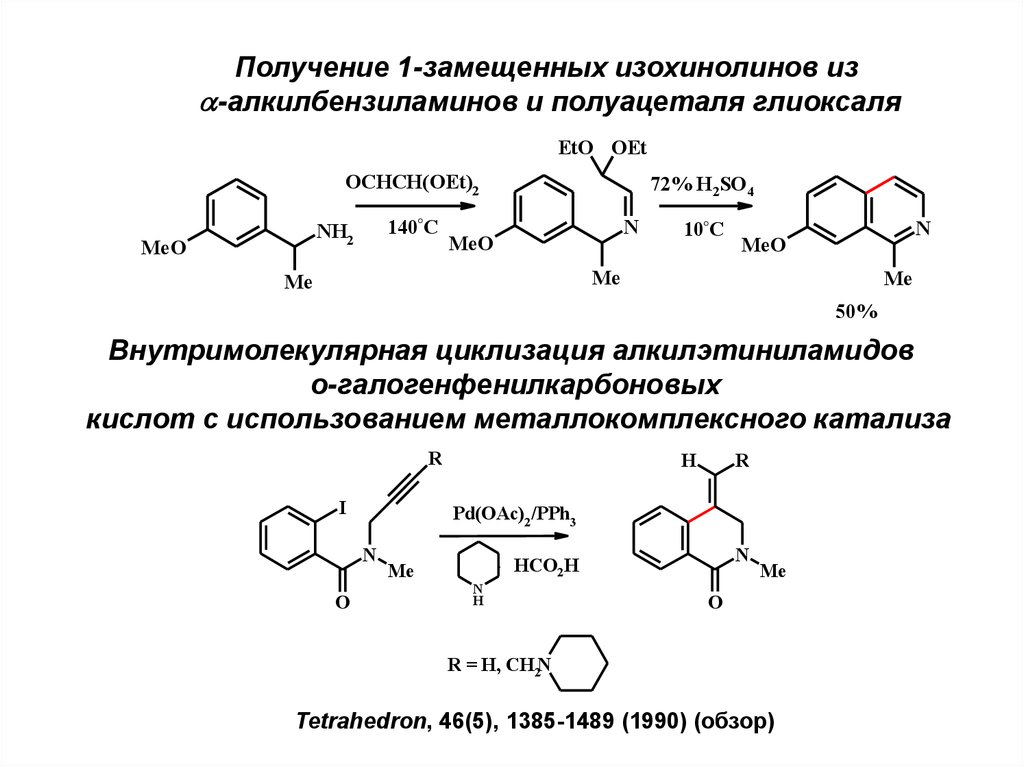
25.
Получение 1-замещенных изохинолинов из-алкилбензиламинов и полуацеталя глиоксаля
EtO OEt
OCHCH(OEt)2
140°C
NH2
MeO
72% H2SO4
N
MeO
10°C
N
MeO
Me
Me
Me
50%
Внутримолекулярная циклизация алкилэтиниламидов
о-галогенфенилкарбоновых
кислот с использованием металлокомплексного катализа
R
I
R
Pd(OAc)2 /PPh3
N
O
H
.
Me
N
HCO2H
N
H
Me
O
R = H, CH2N
Tetrahedron, 46(5), 1385-1489 (1990) (обзор)
26.
Синтез изохинолонов-1 Ni-катализируемым внедрением алкиновв 1,2,3-бензотриазин-4(3Н)-оны, сопровождающимся выделением азота
[Org.Lett., 10 (14), 3085 (2008)]
O
N
N
N
Ni(0)
5 mol % Ni(cod)2
PPh3 или PMe3
Ar
+ Bu
Bu
O
Ar
N
ТГФ, ~ 20°C
Bu
Bu
95-99%
-N2
-Ni(0)
O
O
Bu
Ar
N
NiLn
Bu
N Ar
NiL n
Bu
Bu
A
cod = циклоокта-1,5-диен
B
27.
MeO
Ph
N
N
+
5 mol % Ni(cod)2
10 vol % лиганд
Me
O
N
ТГФ
N
H
лиганд = 1,1`-бис(дифенилфосфино)ферроцен
лиганд = PMe3
N
+
Ph
H
Ph
89
25
Me
O
H
11
75
28.
Химические свойства хинолинов и изохинолиновЭлектрофил
Реагенты и условия
Основные
продукты
Хинолин
D+
D2SO4 (70%), 150oC
8-
NO2+
HNO3, H2SO4, 0oC
5- и 8- (1:1)
Br+
Br2, AlCl3, 80oC
5-*
SO3
H2SO4, SO3, 90oC
8-**
Изохинолин
D+
D2SO4 (90%), 180oC
5-
NO2+
HNO3, H2SO4, 0oC
5- и 8- (9:1)
Br+
Br2, AlCl3, 75oC
5-*** (78%)
•образуется некоторое количество 8-бромхинолина;
•при избытке брома получают 86% 5,8-дибромхинолина
** при 220оС образуется 5-хинолинсульфокислота, при 300оС 5- и
8-сульфопроизводные перегруппировываются в термодинамически более
стабильный 6-изомер
*** при использовании 2 моль брома образуется 5,8-дибромизохинолин.
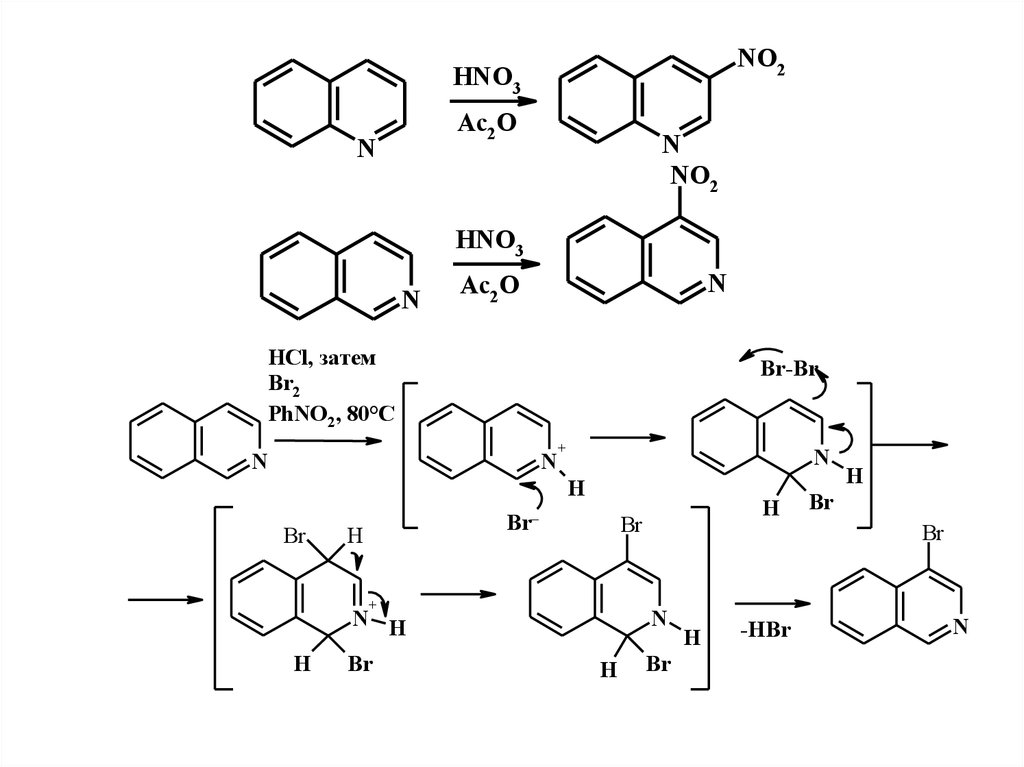
29.
NO2HNO3
Ac2 O
N
N
NO2
HNO3
N
N
Ac2 O
HCl, затем
Br2
PhNO2, 80°C
Br-Br
N
N
+
N
H
Br
Br–
H
Br
+
N H
H
Br
H
N
H
Br
H
-HBr
H
Br
Br
N
30.
Нуклеофильное замещениеY–
N
N
X
X
X
–
Y–
N
N
-
Y
X
X
Y
–N Y
CN
Ph
Cl
PhCH2 CN
Cl
NaNH2
N
Cl
N
Cl
Cl
N
Cl
CH2(CO2 Et)2
NaH, 140oC
N
CH(CO2 Et)2
31.
NaNH2N
N
жидк. NH3
NH2
NH2
Ba(NH2 )2
NaNH2
N
R
жидк. NH3
R =/ H
N
жидк. NH3
R
R=H
N
KOH
N
225°C
–
– H2
N
OH
K+ H
–
O K+
N
NaOCl
– HCl
+
N
N
Cl
Cl
OH
N
H
O
NH2
32.
X+Y–
N
X+
N
X
X
+
N
N
Y
+
N
Y–
N
X
Y
+
N
Me
OH-
H
N
Me
H
OH
X
33.
RCOClCN–
+
N
N
N
Cl–
COR
COR
NaOH
NaH, RX
N
NC
N
COPh
KMnO4 (OH )
N
COPh
H2 O
R
CO2 H
CO2 H
N
CO2 H
O
CO2 H
N
+
N
O
O
CO2 H
KMnO4 (OH )
N
R
NC
H
N
CN
N
34.
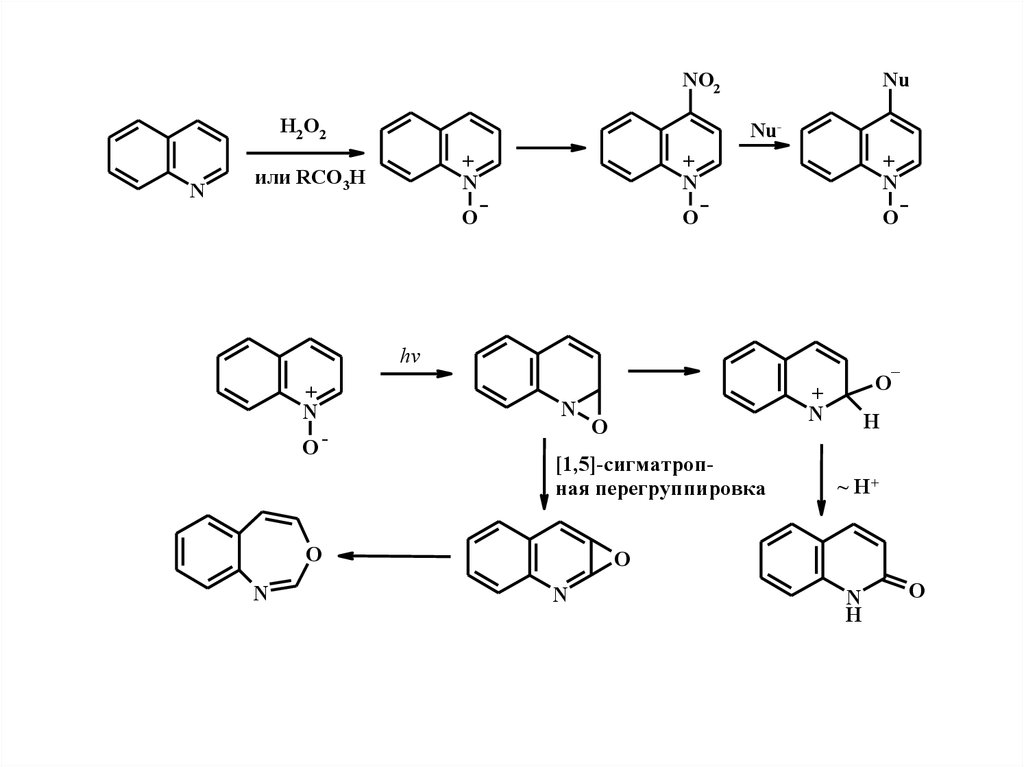
NO2H2 O2
N
Nu
Nu-
или RCO3H
+
N
+
N
+
N
O
O
O
hv
+
N
O-
_
N
N
O
[1,5]-сигматропная перегруппировка
O
O
+
N
H
~ H+
O
N
N
H
O
























 Химия
Химия