Похожие презентации:
Пиридин. Методы получения пиридина. Химические свойства. Биологически активные производные. (Леекция 5)
1. Химия биологически активных веществ
Лекция 5Пиридин
1. Методы получения пиридина
2. Химические свойства
3. Биологически активные производные
2.
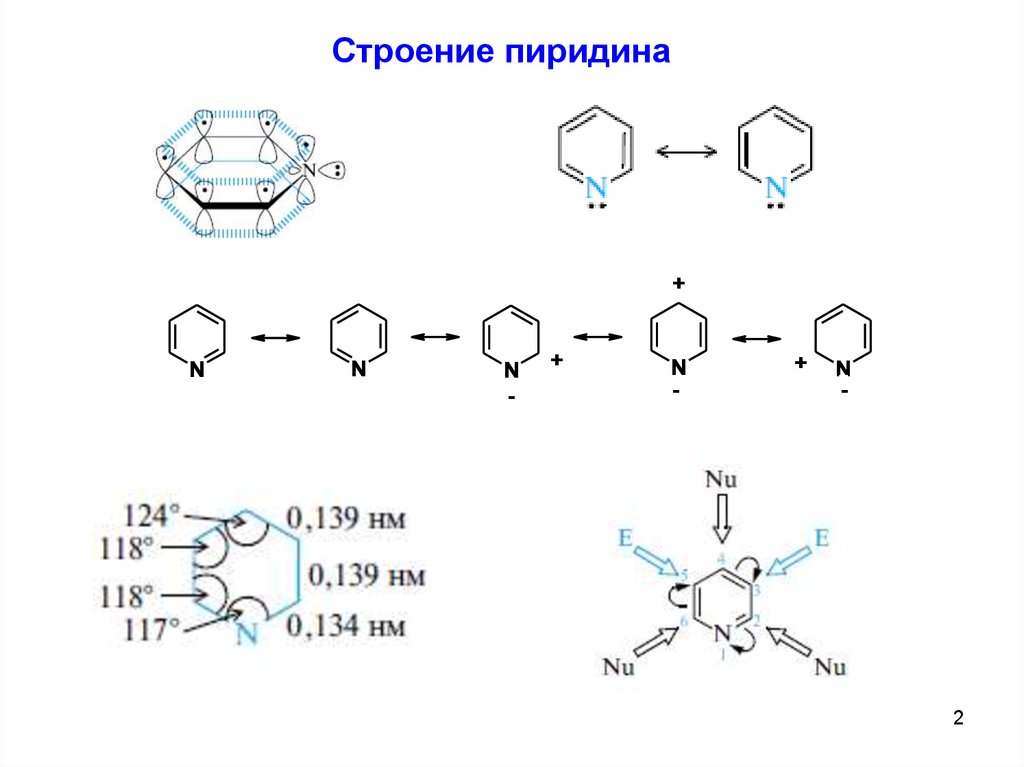
Строение пиридина+
N
N
N
-
+
N
-
+
N
-
2
3
3.
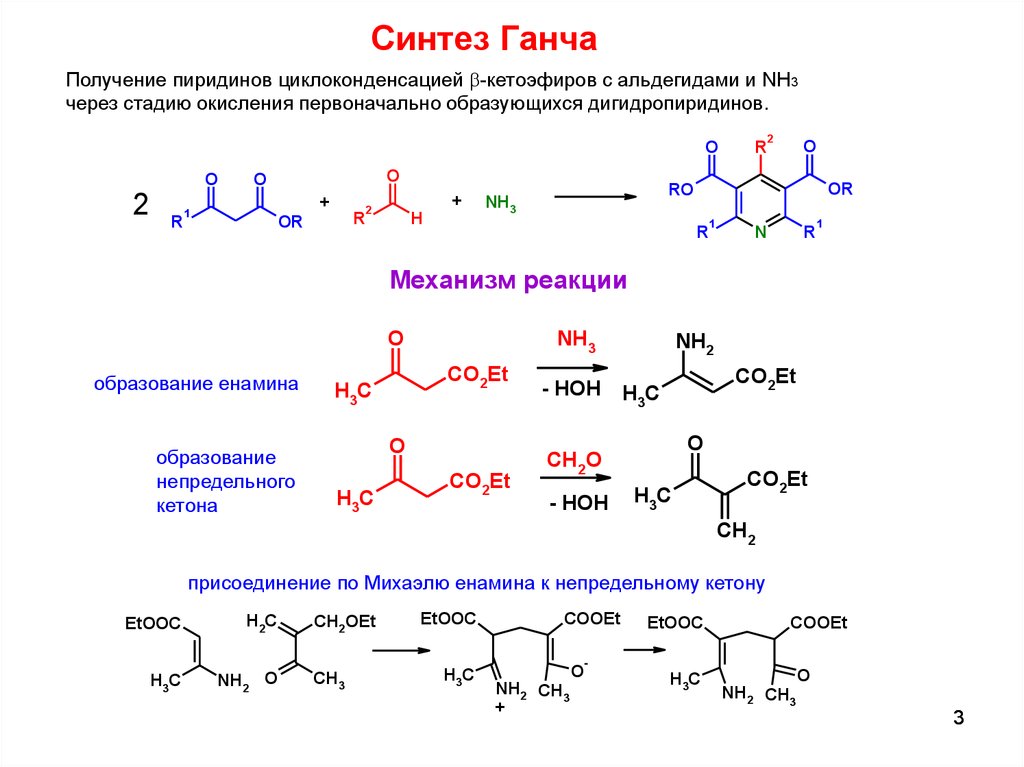
Синтез ГанчаПолучение пиридинов циклоконденсацией b-кетоэфиров с альдегидами и NH3
через стадию окисления первоначально образующихся дигидропиридинов.
O
O
2
R
O
O
+
1
R
OR
+
2
H
R
2
O
OR
RO
NH3
R
1
N
R
1
Механизм реакции
O
образование енамина
образование
непредельного
кетона
NH3
CO2Et
H3C
O
H3C
CO2Et
NH2
CO2Et
- HOH H C
3
O
CH2O
- HOH
H3C
CO2Et
CH2
присоединение по Михаэлю енамина к непредельному кетону
EtOOC
H2C
H3C
NH2 O
CH2OEt
CH3
EtOOC
H3C
COOEt
EtOOC
COOEt
-
O
NH2 CH3
+
H3C
O
NH2 CH3
36
4.
замыкание циклав результате атаки
атома азота
по карбонильной группе
COOEt
EtOOC
H3C
отщепление молекулы
воды с образованием
дигидропиридина
COOEt
EtOOC
O
H3C
NH2 CH3
H
N
H
CH3
O
EtOOC
COOEt
- HOH
N
H
H3C
CH3
окисление дигидропиридина
EtOOC
COOEt
HNO3
H3C
N
H
EtOOC
CH3
H3C
гидролиз
сложноэфирных групп
EtOOC
H3C
COOEt
N
CH3
-
H2O, HO
N
CH3
декарбоксилирование
HOOC
H3C
COOEt
COOH
N
CH3
CaO, t
H3C
N
CH3
4
5.
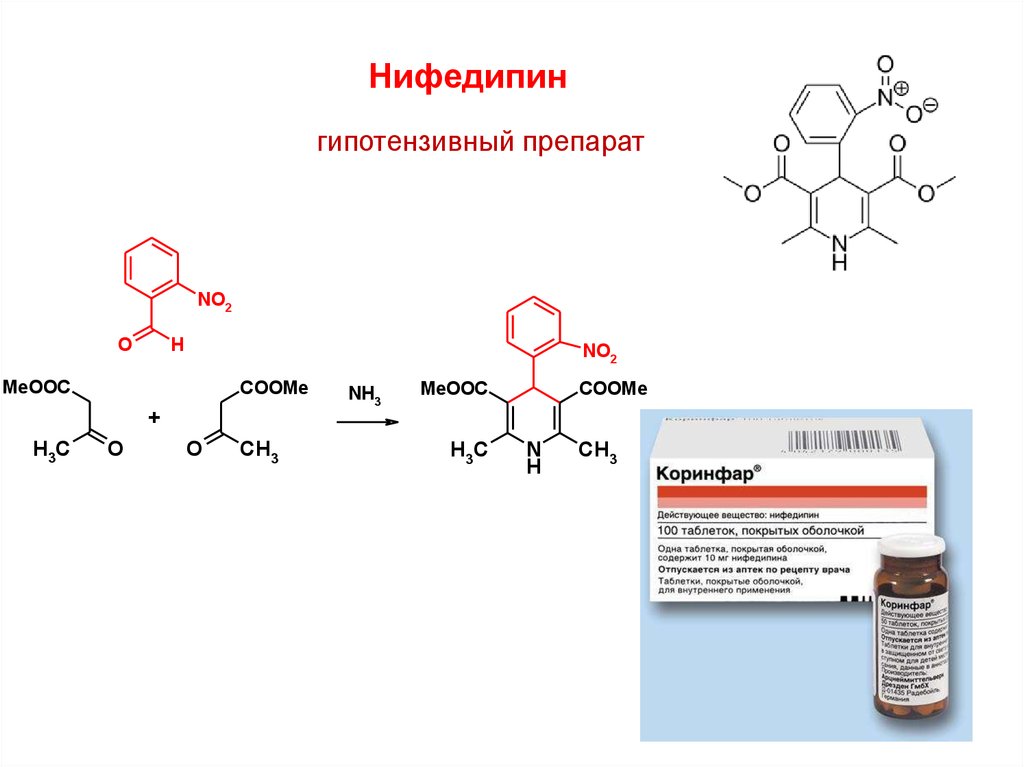
Нифедипингипотензивный препарат
NO2
O
H
NO2
MeOOC
COOMe
NH3
MeOOC
COOMe
+
H3C
O
O
CH3
H3C
N
H
CH3
5
6.
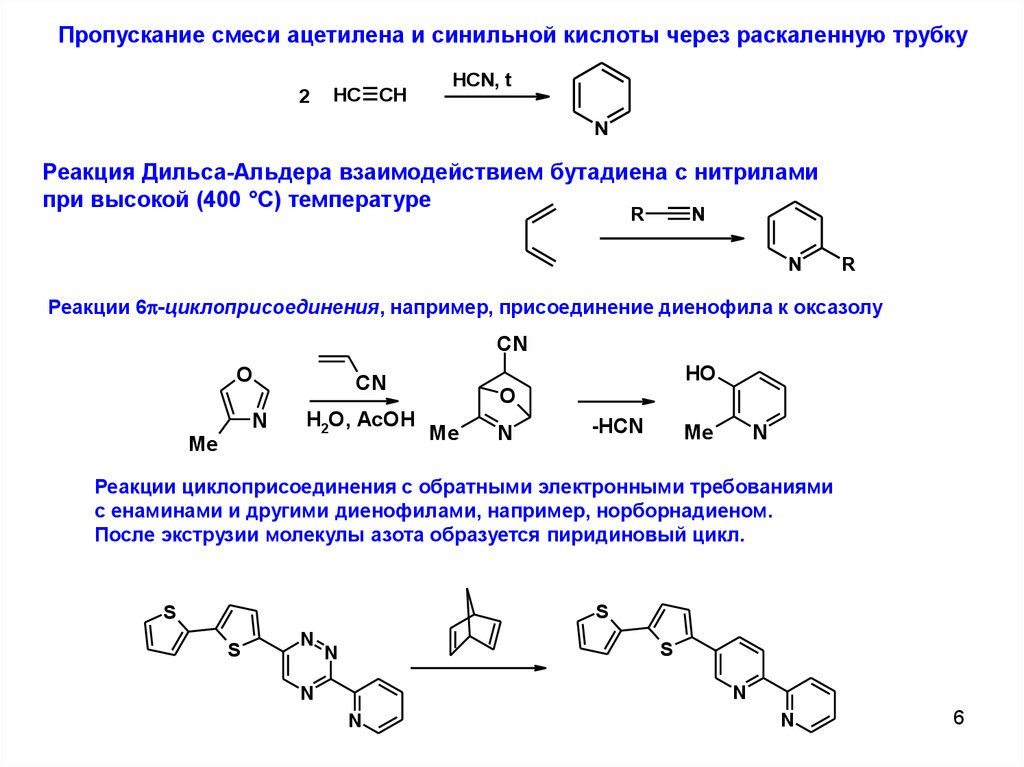
Пропускание смеси ацетилена и синильной кислоты через раскаленную трубку2
HC CH
HCN, t
N
Реакция Дильса-Альдера взаимодействием бутадиена с нитрилами
при высокой (400 °С) температуре
R
N
N
R
Реакции 6p-циклоприсоединения, например, присоединение диенофила к оксазолу
CN
O
N
Me
HO
CN
H2O, AcOH
O
Me
N
-HCN
Me
N
Реакции циклоприсоединения с обратными электронными требованиями
с енаминами и другими диенофилами, например, норборнадиеном.
После экструзии молекулы азота образуется пиридиновый цикл.
S
S
S
N
S
N
N
N
N
N
6
7.
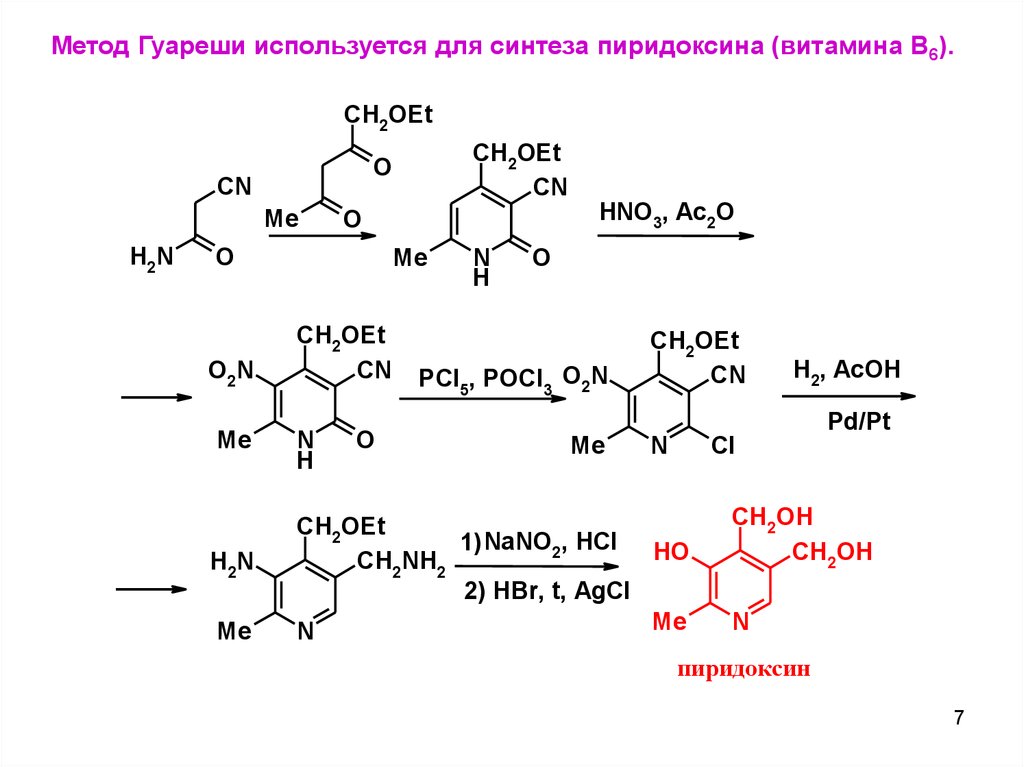
Метод Гуареши используется для синтеза пиридоксина (витамина В6).CH2OEt
CN
Me
H2N
Me
H2N
Me
HNO3, Ac2O
O
O
O2 N
CH2OEt
CN
O
Me
CH2OEt
CN
N
H
O
N
H
O
PCl5, POCl3 O2N
CH2OEt
CN
H2, AcOH
Pd/Pt
Me
N
Cl
CH2OEt
1) NaNO2, HCl HO
CH2NH2
2) HBr, t, AgCl
Me
N
CH2OH
CH2OH
N
пиридоксин
7
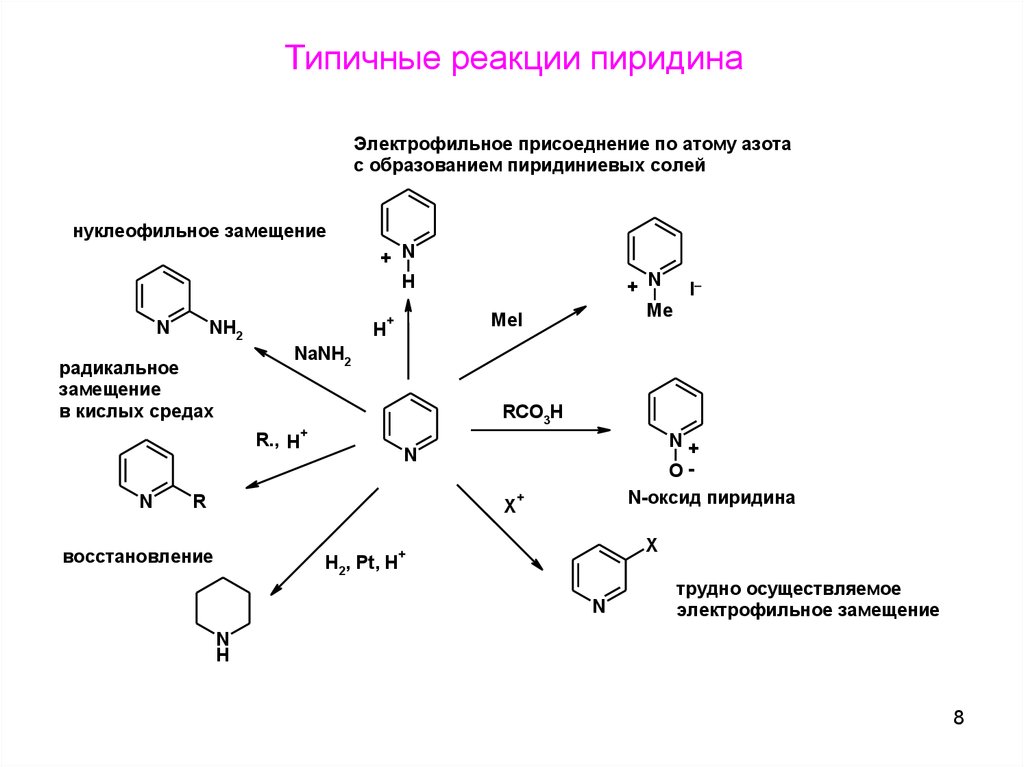
8.
Типичные реакции пиридинаЭлектрофильное присоеднение по атому азота
с образованием пиридиниевых солей
нуклеофильное замещение
+ N
H
N
NH2
H
MeI
+
NaNH2
радикальное
замещение
в кислых средах
RCO3H
R., H
N
_
+ N
I
Me
+
N+
O-
N
R
X
восстановление
H2, Pt, H
N-оксид пиридина
+
X
+
N
трудно осуществляемое
электрофильное замещение
N
H
8
10
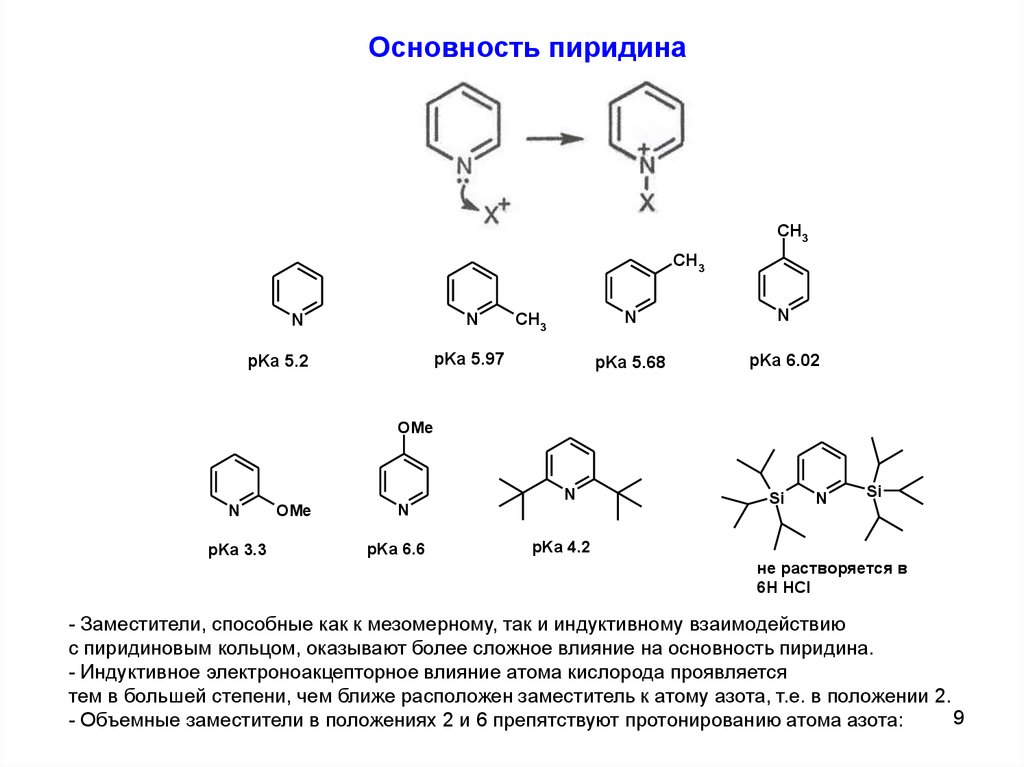
9.
Основность пиридинаCH3
CH3
N
N
CH3
pKa 5.97
pKa 5.2
N
N
pKa 5.68
pKa 6.02
OMe
N
N
pKa 3.3
OMe
N
pKa 6.6
Si
N
Si
pKa 4.2
не растворяется в
6Н HCl
- Заместители, способные как к мезомерному, так и индуктивному взаимодействию
с пиридиновым кольцом, оказывают более сложное влияние на основность пиридина.
- Индуктивное электроноакцепторное влияние атома кислорода проявляется
тем в большей степени, чем ближе расположен заместитель к атому азота, т.е. в положении 2.
9
- Объемные заместители в положениях 2 и 6 препятствуют протонированию атома азота:
10.
Реакции электрофильного замещения+
N
+
E
H
N
E
H
N
+
E
H
крайне
невыгодная
структура
E H
E H
E H
+
+
N
N
+ крайне
N
невыгодная
структура
H
H
N
E
+
H
+
E
E
+
N
N
Атака электрофила идет в положение 3. По реакционной способности в реакциях
электрофильного замещения пиридин напоминает нитробензол.
10
11.
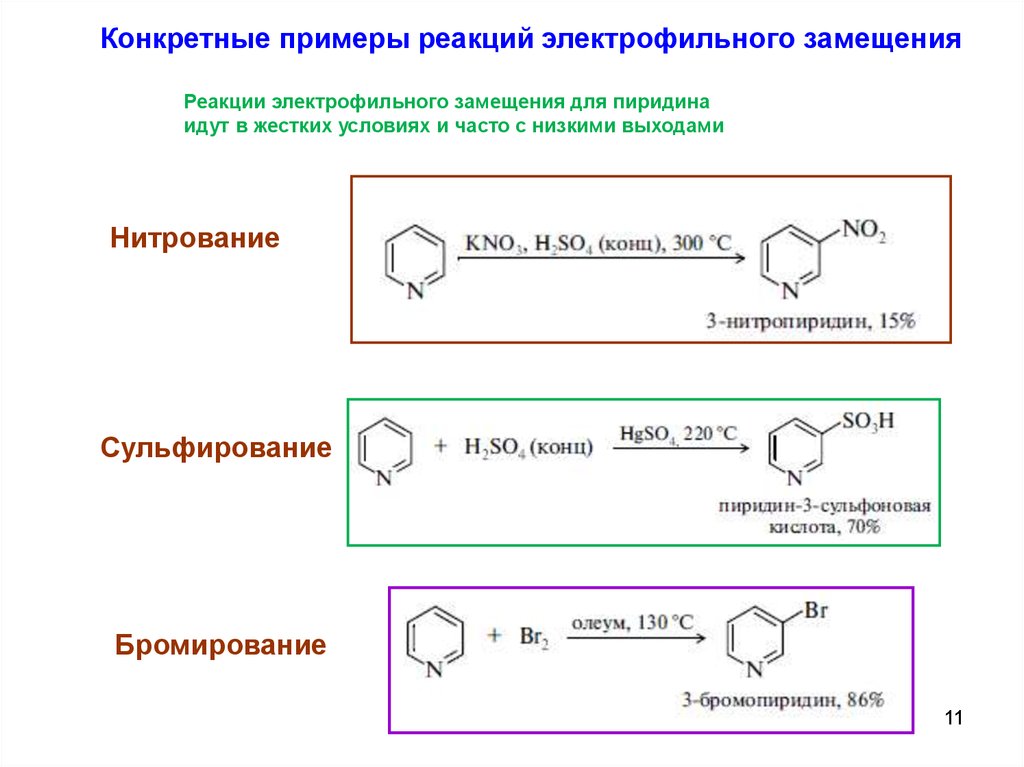
Конкретные примеры реакций электрофильного замещенияРеакции электрофильного замещения для пиридина
идут в жестких условиях и часто с низкими выходами
Нитрование
Сульфирование
Бромирование
11
12.
Введение электронодонорных заместителей облегчаеттечение процесса электрофильного замещения
OMe
OMe
E
+
E
N
N
OMe
N
E
OMe
+
N
E
NO2
N
H
O
N
OH
O2 N
NO2
+
+
N
H
O
N
H
O
12
13.
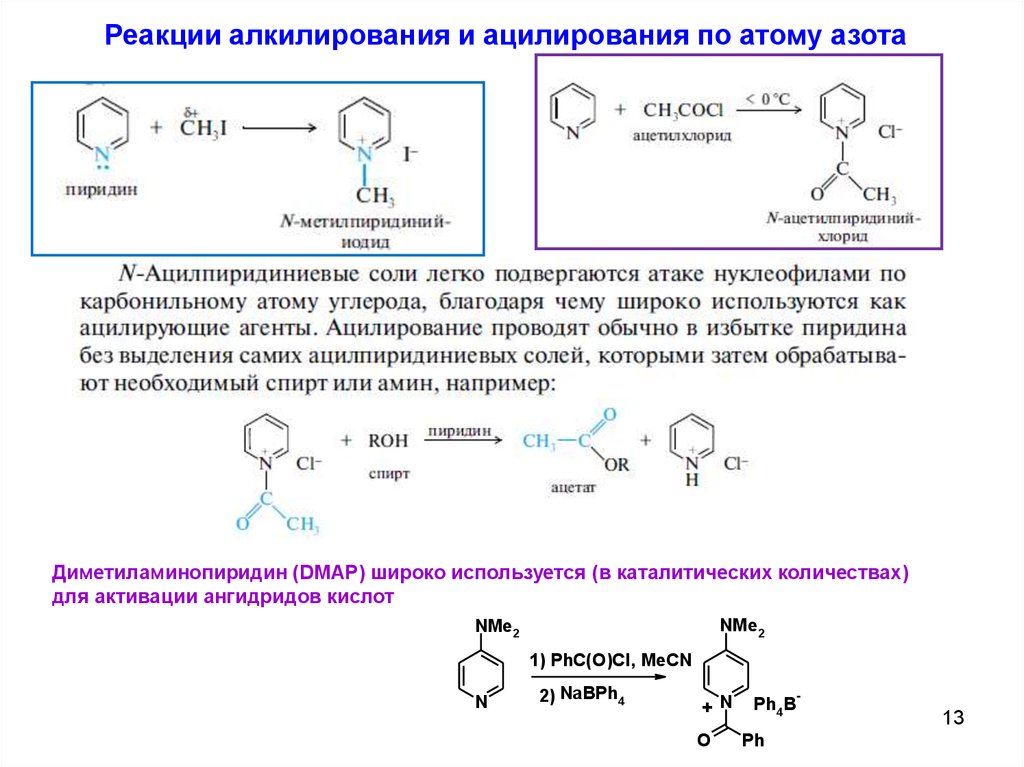
Реакции алкилирования и ацилирования по атому азотаДиметиламинопиридин (DMAP) широко используется (в каталитических количествах)
для активации ангидридов кислот
NMe2
NMe2
1) PhC(O)Cl, MeCN
N
2) NaBPh4
+ N
O
Ph4B
Ph
-
13
14.
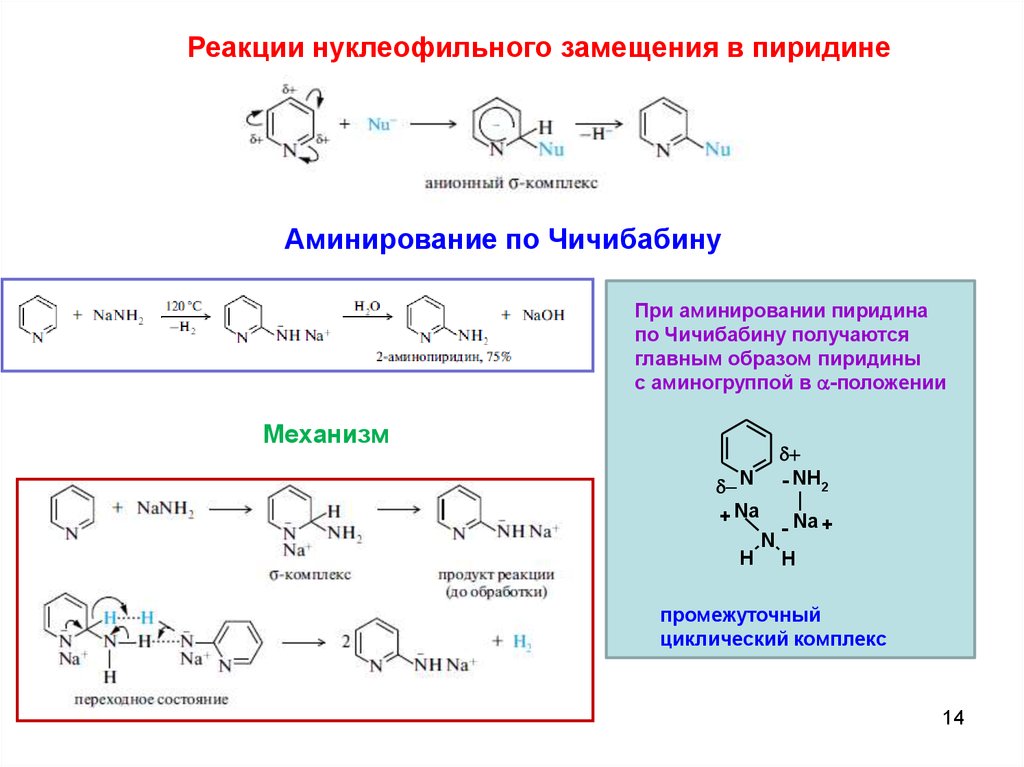
Реакции нуклеофильного замещения в пиридинеАминирование по Чичибабину
При аминировании пиридина
по Чичибабину получаются
главным образом пиридины
с аминогруппой в a-положении
Механизм
- NH2
N
+ Na
H
N
- Na +
H
промежуточный
циклический комплекс
14
15.
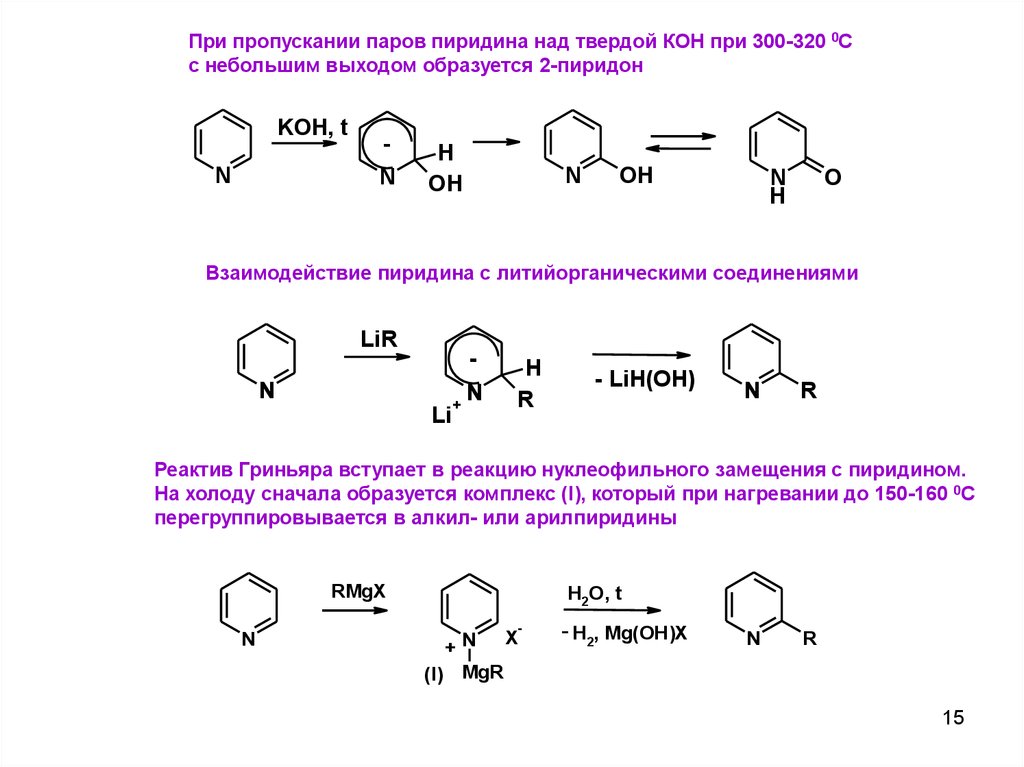
При пропускании паров пиридина над твердой КОН при 300-320 0Сс небольшим выходом образуется 2-пиридон
KOH, t
N
N
H
OH
N
OH
N
H
O
Взаимодействие пиридина с литийорганическими соединениями
LiR
N
Li
N
+
H
R
- LiH(OH)
N
R
Реактив Гриньяра вступает в реакцию нуклеофильного замещения с пиридином.
На холоду сначала образуется комплекс (I), который при нагревании до 150-160 0С
перегруппировывается в алкил- или арилпиридины
RMgX
N
H2O, t
-
X
+N
(I) MgR
- H2, Mg(OH)X
N
R
15
16.
Восстановление пиридинаH2, Ni
N
H
LiAlH4
N
H
N
H
H
1,2-дигидропиридин
пиперидин
Na, EtOH
H H
N
H
1,4-дигидропиридин
16
17.
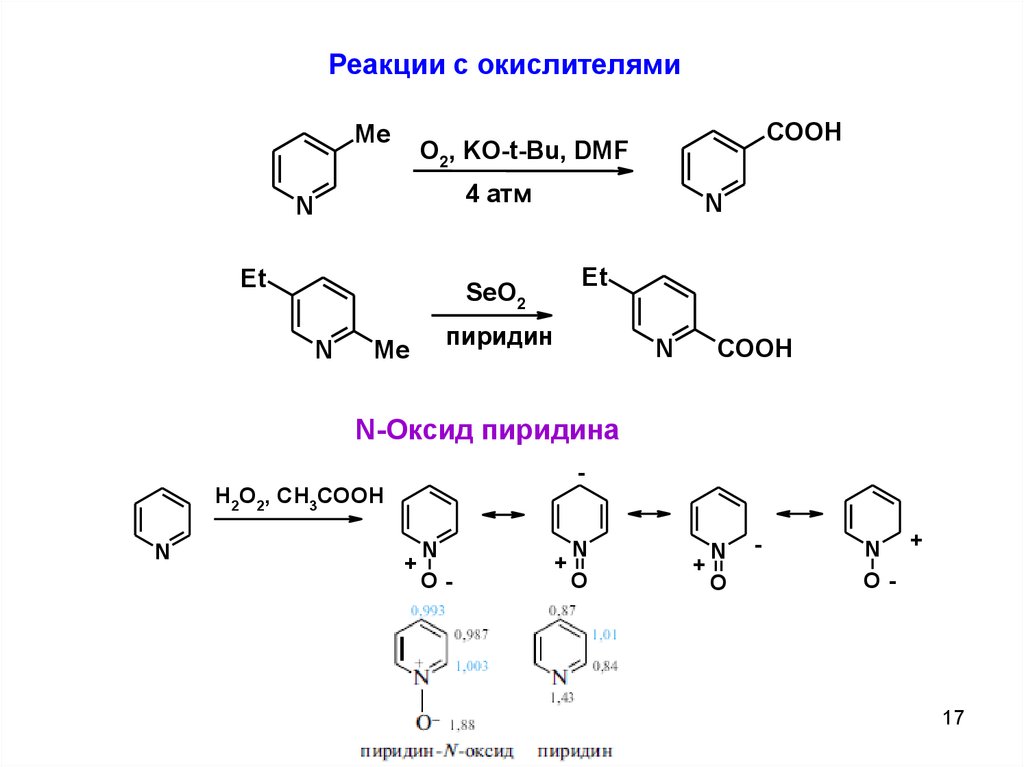
Реакции с окислителямиMe
COOH
O2, KO-t-Bu, DMF
4 атм
N
Et
SeO2
N
Me
N
Et
пиридин
N
COOH
N-Оксид пиридина
H2O2, CH3COOH
N
N
+
O-
N
+
O
N
+
O
-
N +
O-
17
18.
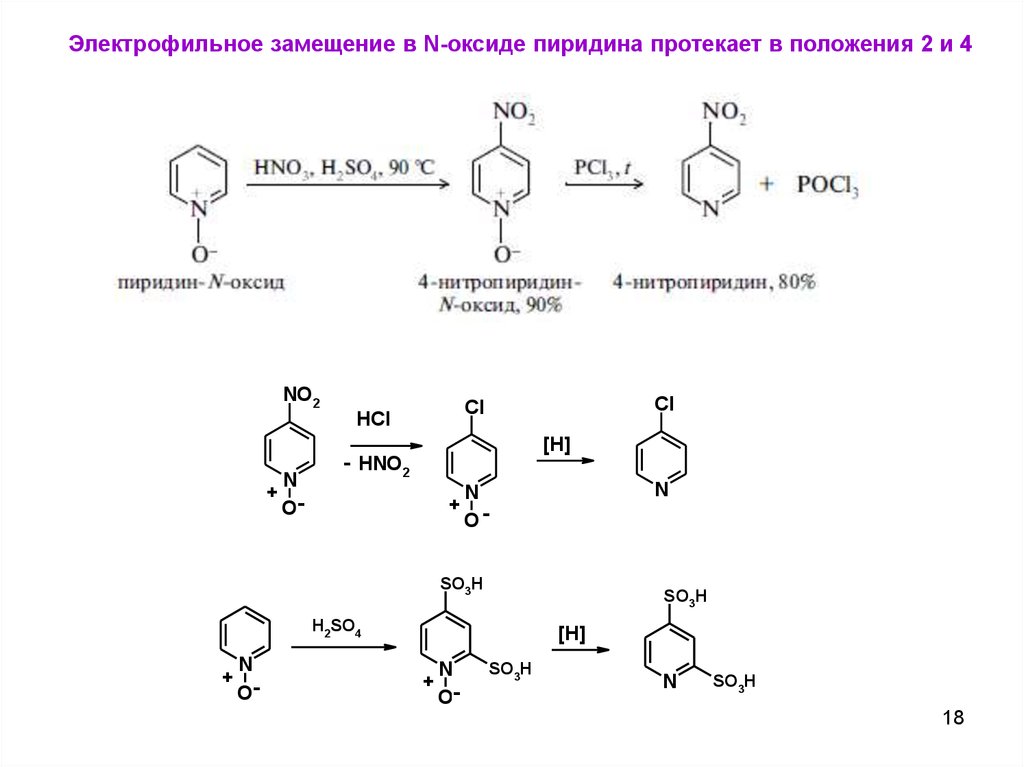
Электрофильное замещение в N-оксиде пиридина протекает в положения 2 и 4NO2
Cl
Cl
HCl
[H]
+
N
O-
- HNO2
+
N
N
O-
SO3H
SO3H
H2SO4
+
N
O-
[H]
+
N
O-
SO3H
N
SO3H
18
19.
АлкилпиридиныСвязи С-Н у a-углеродного атома боковой цепи алкилпиридинов
обладают довольно высокой кислотностью
-
N
CH2
N
-
CH2
N
CH2
N
CH2
19
20.
В присутствии оснований или в отдельных случаяхкислых катализаторов (ZnCl2, полифосфорная кислота)
происходит конденсация с альдегидами и кетонами
O
R
N
CH3
H
ZnCl2
HO
N
R
-HOH
H
N
CH=CH-R
Пиколиниевые соли и пиколин N-оксиды - еще более сильные СН-кислоты
+
+N
CH3 Cl
NOH
AmONO, H
OH
PhCHO
CH3
+N
CH3 Cl
пиперидин
+N
CH3 Cl
Ph
Конденсация с альдегидами и нитрозирование
протекает в более мягких условиях
20
21.
Таутомерные превращения гидроксипиридинов+
+
+H
-H
N
+
+H
OH
+
O-
N
N
H
-H
O-
OH
O
+
+
+H
-H
+
+H
N
O
+
N
N
H
-H
Гидрокси-формы могут быть обнаружены в значительных количествах
только в очень разбавленных растворах неполярных растворителей
типа петролейного эфира или в газовой фазе
Наличие в кольце гидроксильной группы придает пиридинам свойства,
близкие к фенолам.
OH
O-
+
-H
+
+H
N
OH
+
N
+
+H
N
+
H
-H
O-
+
-H
O-
+
+H
+
O
+
H
H
+H
-H
21
22.
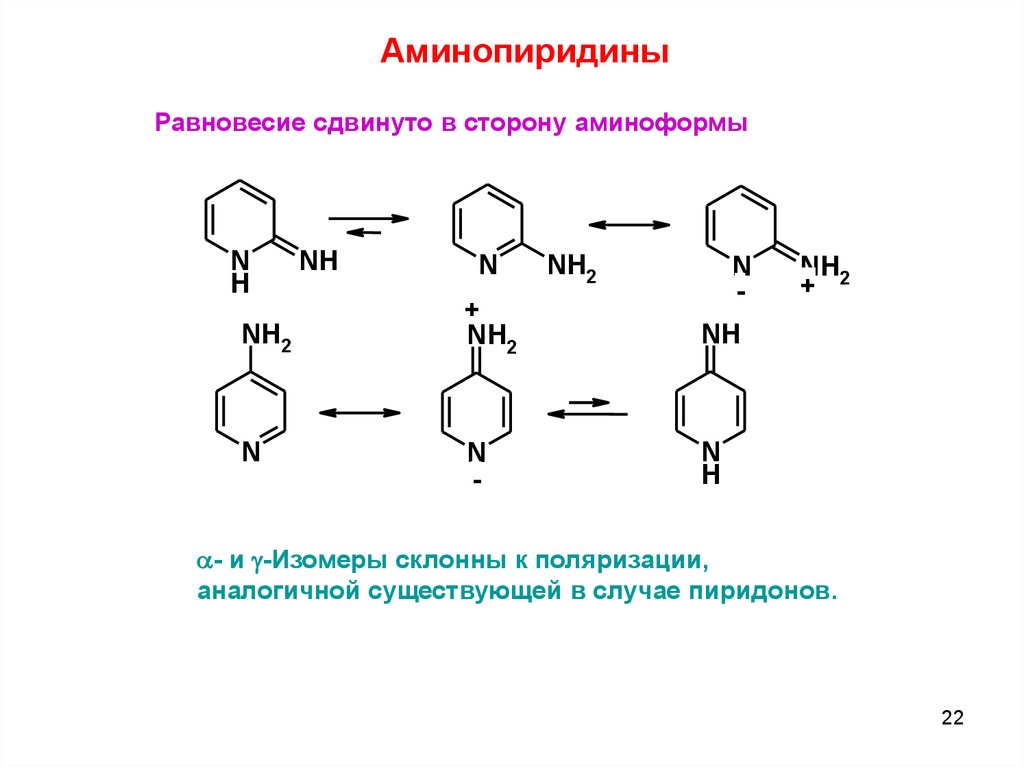
АминопиридиныРавновесие сдвинуто в сторону аминоформы
N
H
NH2
N
NH
N
NH2
N
-
+
NH2
NH
N
-
N
H
NH2
+
a- и g-Изомеры склонны к поляризации,
аналогичной существующей в случае пиридонов.
22
23.
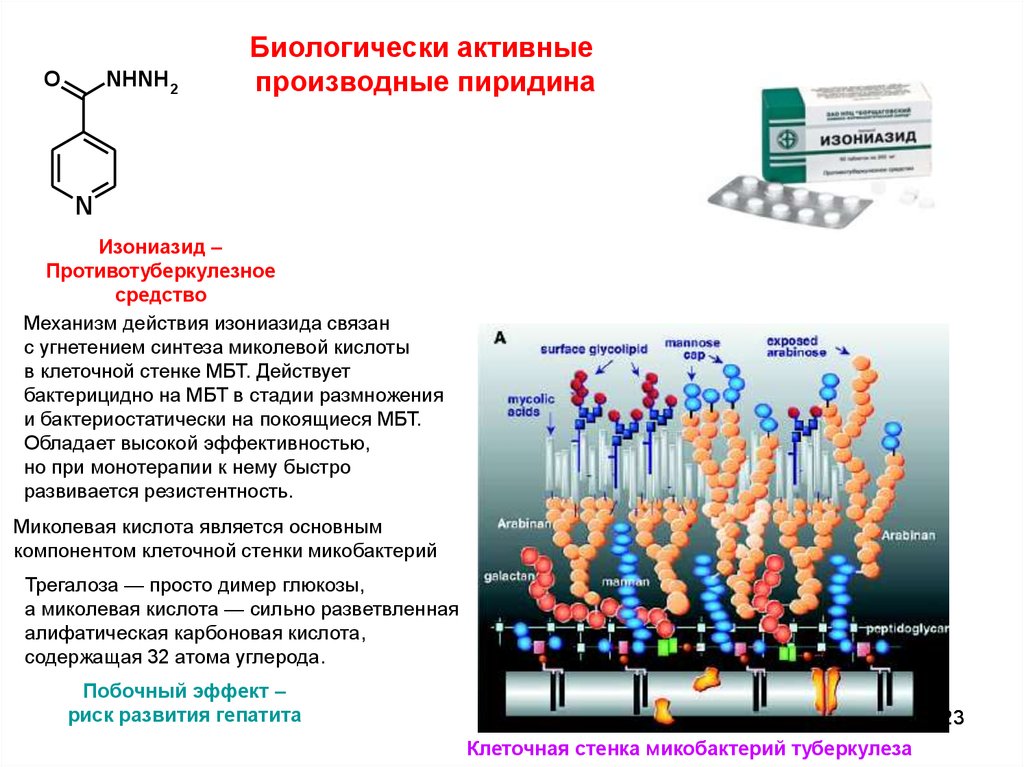
NHNH2O
Биологически активные
производные пиридина
N
Изониазид –
Противотуберкулезное
средство
Механизм действия изониазида связан
с угнетением синтеза миколевой кислоты
в клеточной стенке МБТ. Действует
бактерицидно на МБТ в стадии размножения
и бактериостатически на покоящиеся МБТ.
Обладает высокой эффективностью,
но при монотерапии к нему быстро
развивается резистентность.
Миколевая кислота является основным
компонентом клеточной стенки микобактерий
Трегалоза — просто димер глюкозы,
а миколевая кислота — сильно разветвленная
алифатическая карбоновая кислота,
содержащая 32 атома углерода.
Побочный эффект –
риск развития гепатита
23
Клеточная стенка микобактерий туберкулеза
24.
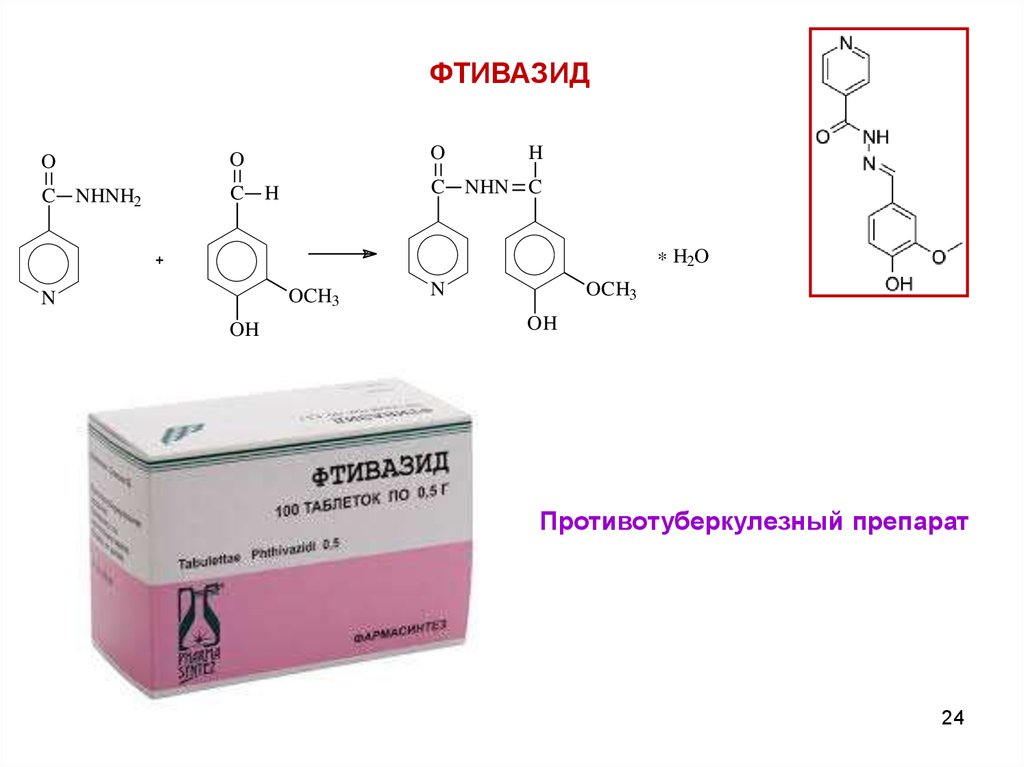
ФТИВАЗИДO
O
O
H
C NHNH2
C H
C NHN C
* H2O
OCH3
N
OH
N
OCH3
OH
Противотуберкулезный препарат
24
25.
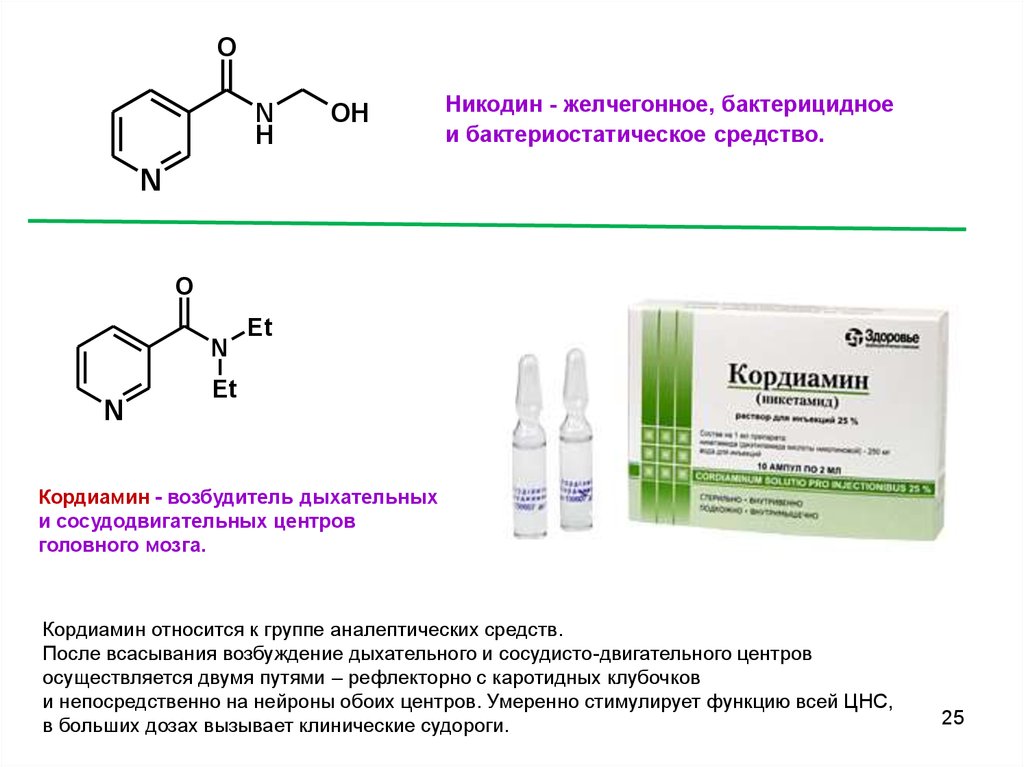
ON
H
OH
Никодин - желчегонное, бактерицидное
и бактериостатическое средство.
N
O
N
N
Et
Et
Кордиамин - возбудитель дыхательных
и сосудодвигательных центров
головного мозга.
Кордиамин относится к группе аналептических средств.
После всасывания возбуждение дыхательного и сосудисто-двигательного центров
осуществляется двумя путями – рефлекторно с каротидных клубочков
и непосредственно на нейроны обоих центров. Умеренно стимулирует функцию всей ЦНС,
в больших дозах вызывает клинические судороги.
25
26.
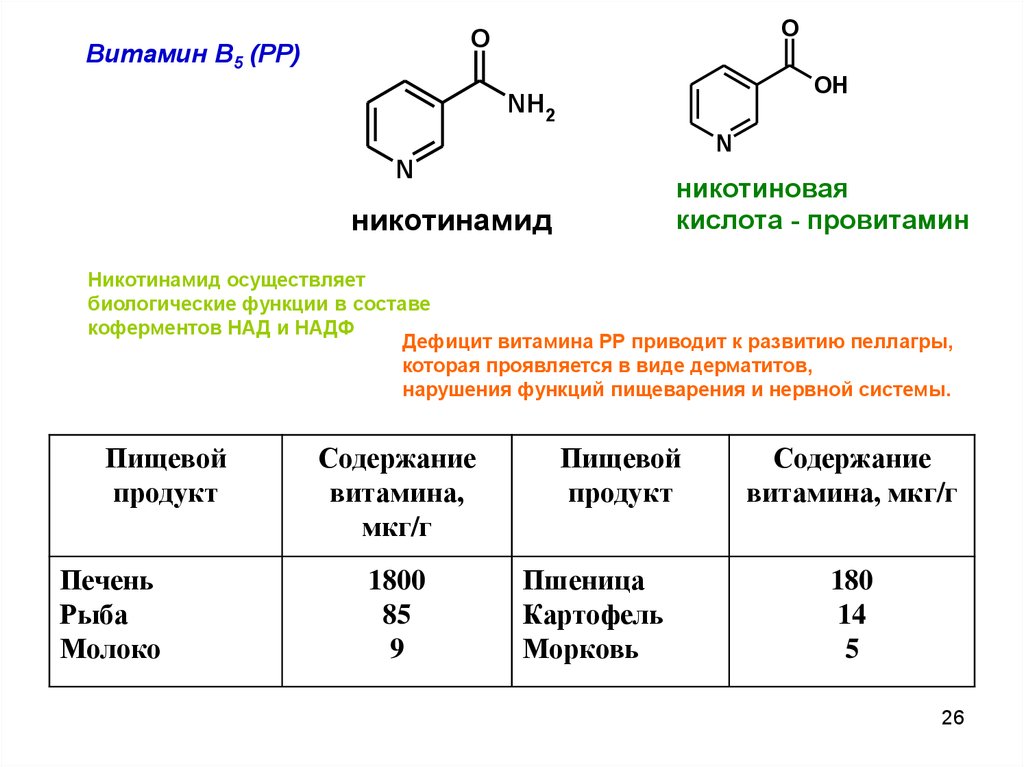
OO
Витамин В5 (РР)
OH
NH2
N
N
никотиновая
кислота - провитамин
никотинамид
Никотинамид осуществляет
биологические функции в составе
коферментов НАД и НАДФ
Дефицит витамина РР приводит к развитию пеллагры,
которая проявляется в виде дерматитов,
нарушения функций пищеварения и нервной системы.
Пищевой
продукт
Печень
Рыба
Молоко
Содержание
витамина,
мкг/г
1800
85
9
Пищевой
продукт
Пшеница
Картофель
Морковь
Содержание
витамина, мкг/г
180
14
5
26
27.
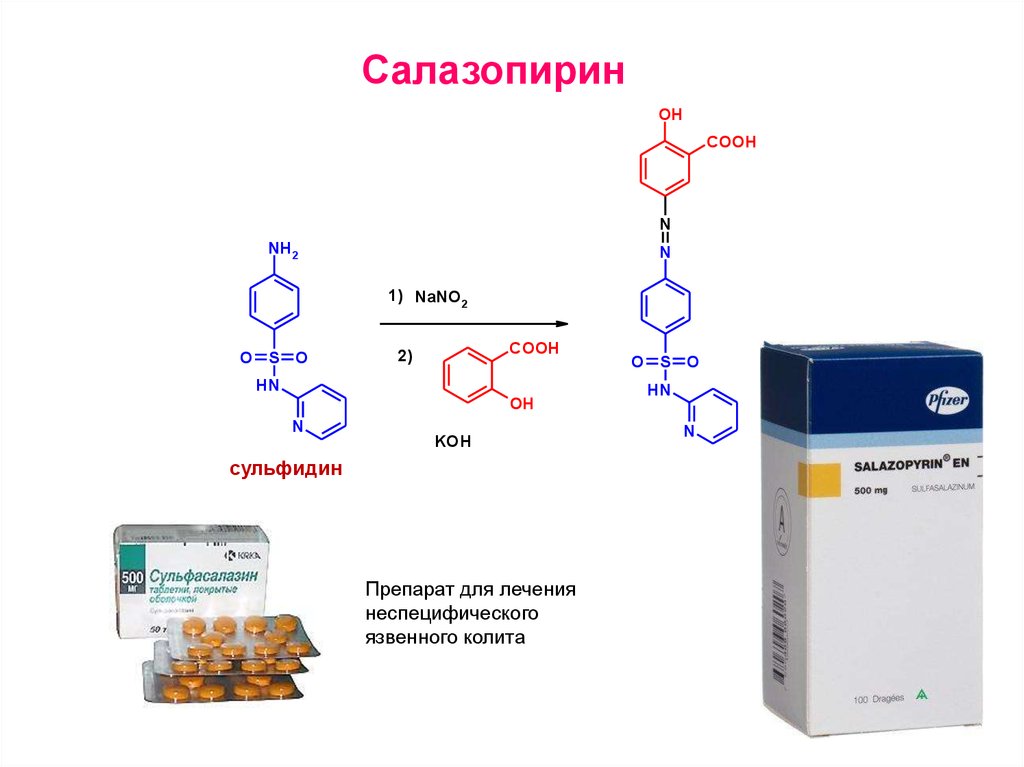
СалазопиринOH
COOH
N
NH2
N
1) NaNO2
O S O
COOH
2)
HN
OH
N
KOH
O S O
HN
N
сульфидин
Препарат для лечения
неспецифического
язвенного колита
27
28.
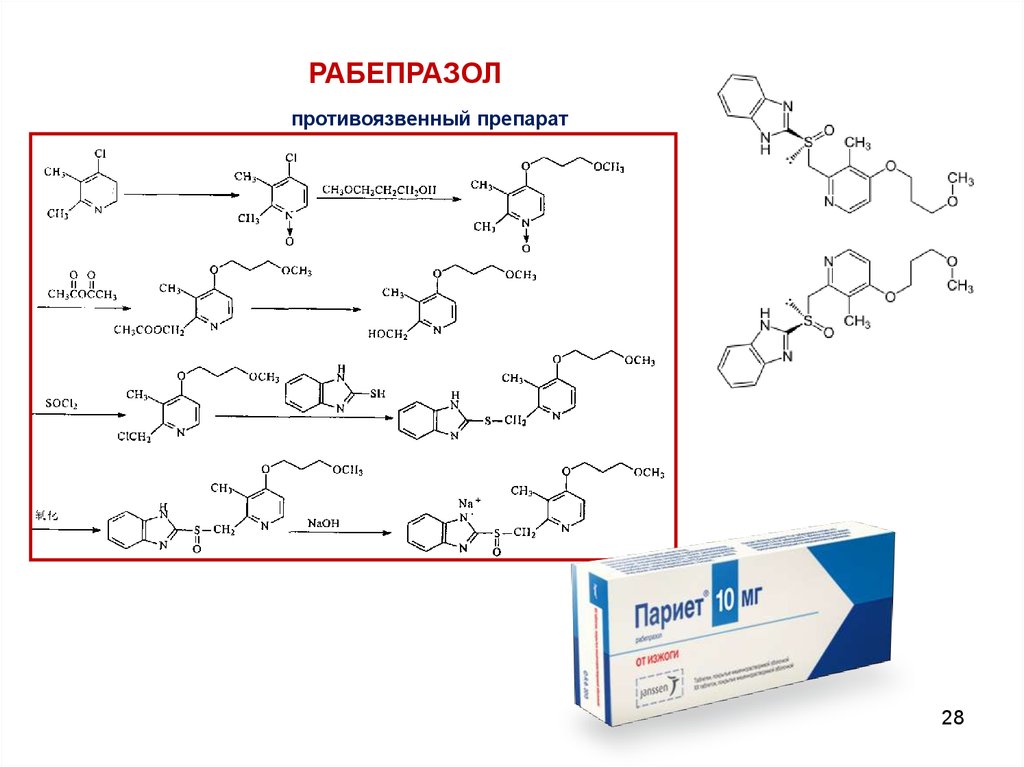
РАБЕПРАЗОЛпротивоязвенный препарат
28
29.
Курс лекций является частью учебно-методического комплекса«Химия биологически активных веществ»
автор:
Носова Эмилия Владимировна, д.х.н., доцент кафедры органической и биомолекулярной
химии УрФУ
Учебно-методический комплекс подготовлен на кафедре органической и
биомолекулярной химии
химико-технологического факультета УрФУ
Никакая часть презентации не может быть воспроизведена в
какой бы то ни было форме без письменного разрешения авторов
29 12









 Биология
Биология Химия
Химия








