Похожие презентации:
Альдегиды и кетоны
1. АЛЬДЕГИДЫ И КЕТОНЫ
2. ОПРЕДЕЛЕНИЕ
АЛЬДЕГИДЫ (СnH2n+1OН)– это органическиесоединения, молекулы которых содержат
карбонильную группу, связанную с атомом
водорода и углеводородным радикалом
С
O
H
АЛЬДЕГИДНАЯ ГРУППА
R С
O
H
ОБЩАЯ ФОРМУЛА
3. КЕТОНЫ
КЕТОНЫ – органические вещества, вмолекулах которых карбонильная группа
связана с двумя углеводородными
радикалами
R1 – C – R2
||
O
Общая формула
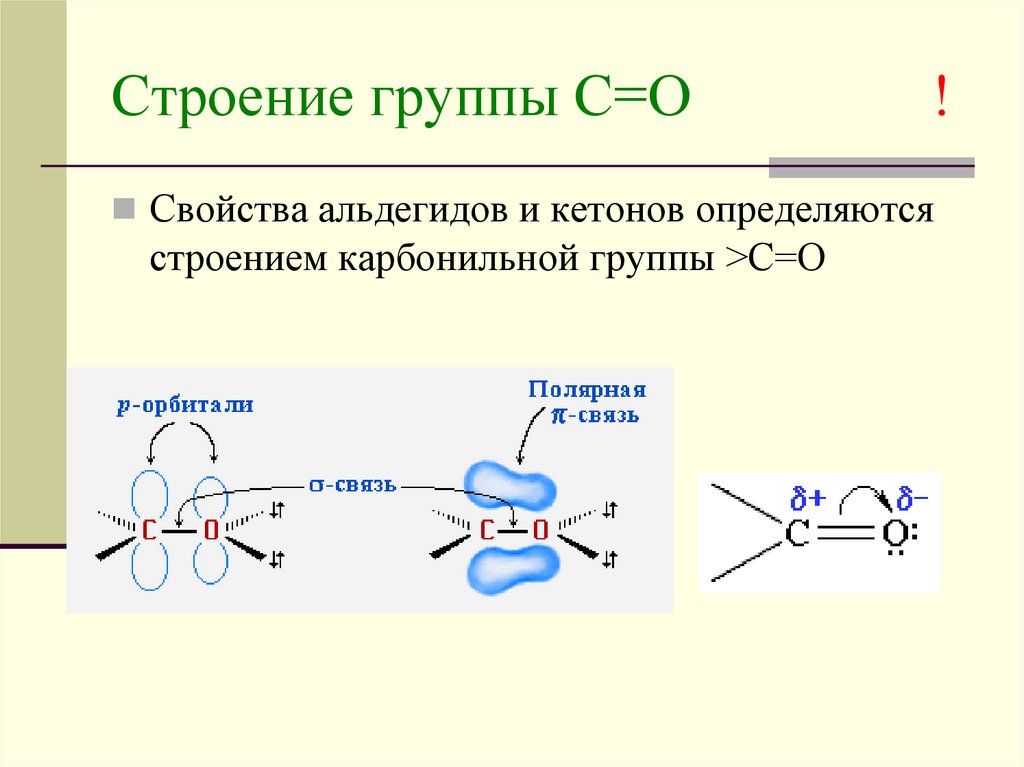
4. Строение группы С=О !
Свойства альдегидов и кетонов определяютсястроением карбонильной группы >C=O
5. НОМЕНКЛАТУРА И ИЗОМЕРИЯ
H CO
H
МЕТАНАЛЬ
(ФОРМАЛЬДЕГИД)
CH3 C
O
H
ЭТАНАЛЬ
(АЦЕТАЛЬДЕГИД)
CH3CH2 C
O
H
ПРОПАНАЛЬ
(ПРОПИОНОВЫЙ АЛЬДЕГИД)
5
6. ИЗОМЕРИЯ
Изомерияуглеродного
скелета
Межклассовая
изомерия
(с кетонами)
Межклассовая
изомерия
(с непредельными
спиртами и
простыми
эфирами)
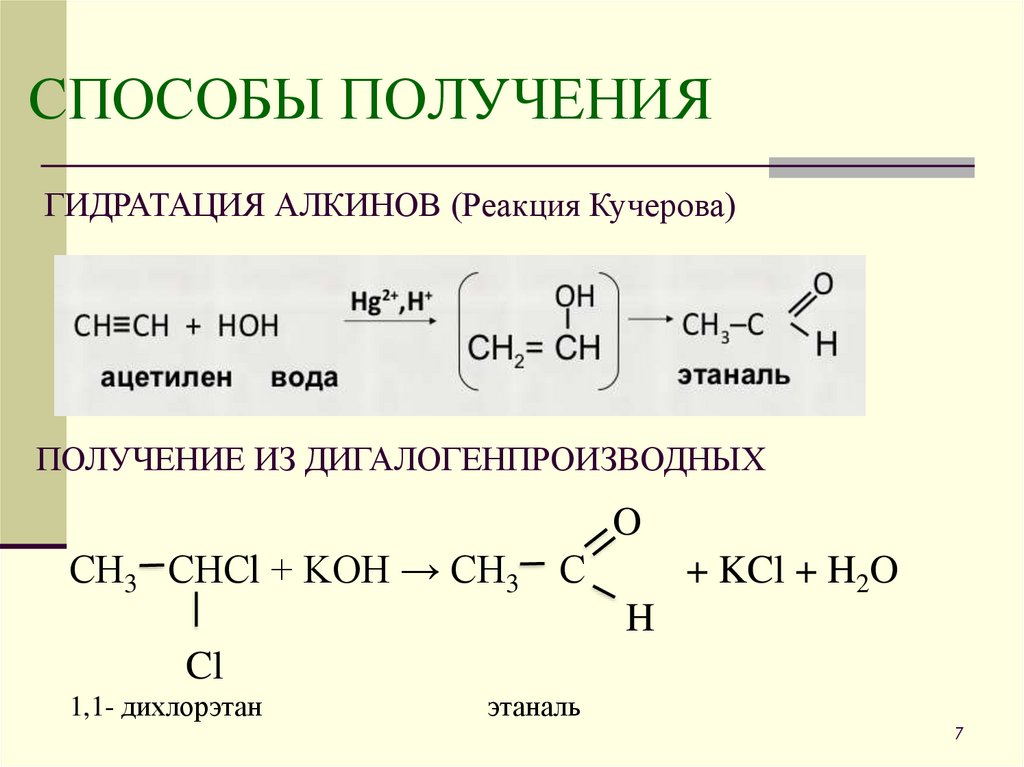
7. СПОСОБЫ ПОЛУЧЕНИЯ
ГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова)ПОЛУЧЕНИЕ ИЗ ДИГАЛОГЕНПРОИЗВОДНЫХ
O
СН3 СНСl + KOH → СН3
С
+ KCl + H2O
H
Cl
1,1- дихлорэтан
этаналь
7
8. СПОСОБЫ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ СПИРТОВO
Cu,t
//
CH3 – CH2 – CH2 – OH СH3 – CH2 – C + H2
\
H
Cu,t
СH3 – CH – CH3 CH3 – C – CH3 + H2
|
||
OH
O
пропанон - 2 (ацетон)
8
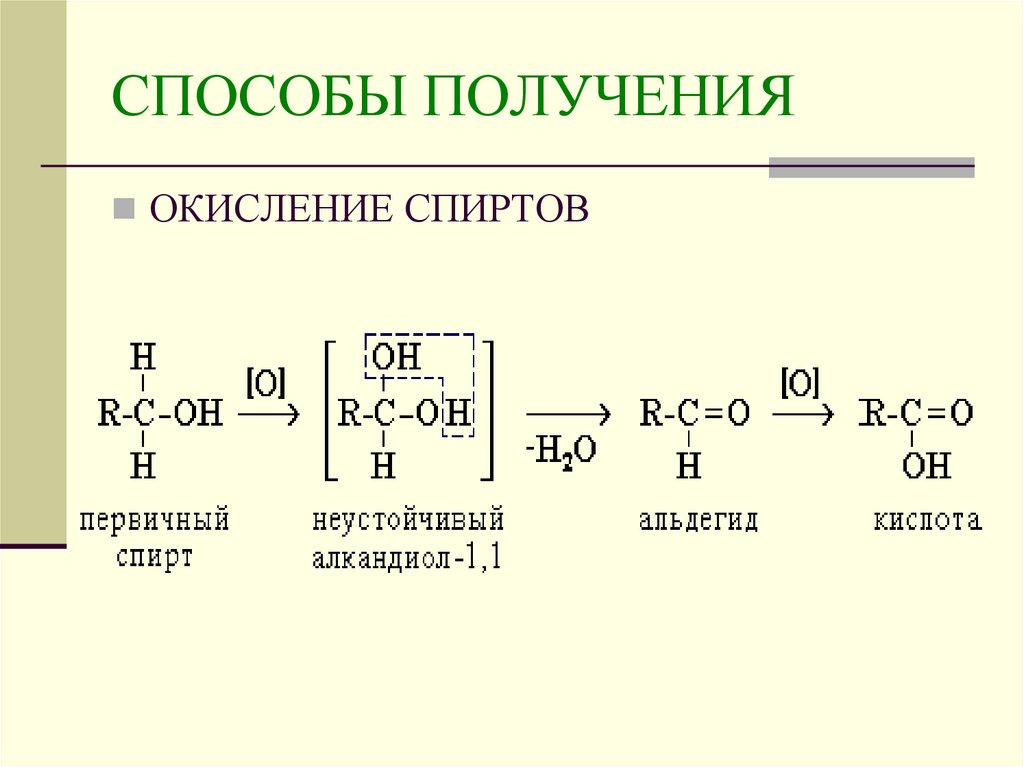
9. СПОСОБЫ ПОЛУЧЕНИЯ
ОКИСЛЕНИЕ СПИРТОВ10. СПОСОБЫ ПОЛУЧЕНИЯ
ОКИСЛЕНИЕ АЛКЕНОВКУМОЛЬНЫЙ СПОСОБ
11.
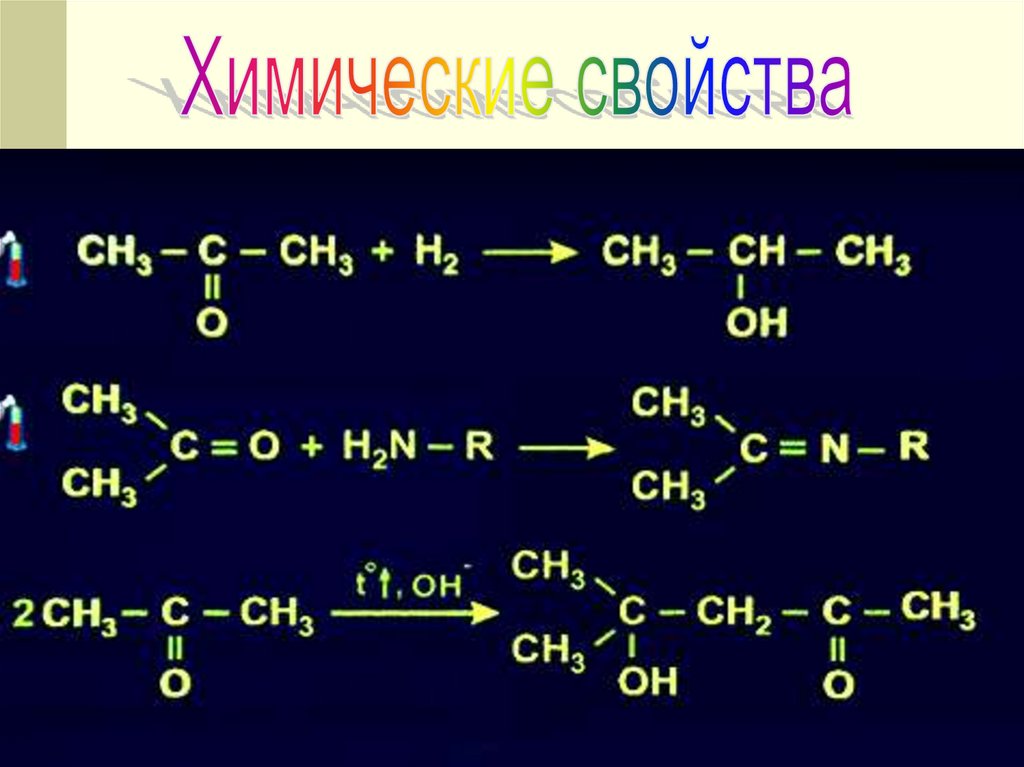
12. ХИМИЧЕСКИЕ СВОЙСТВА !
РЕАКЦИИ ОКИСЛЕНИЯРеакция серебряного зеркала
О
СН3 С
+ 2[Ag(NH3)2]OH → СН3
Н
О
С + Ag + 4NH3 + 2H2O
OН
12
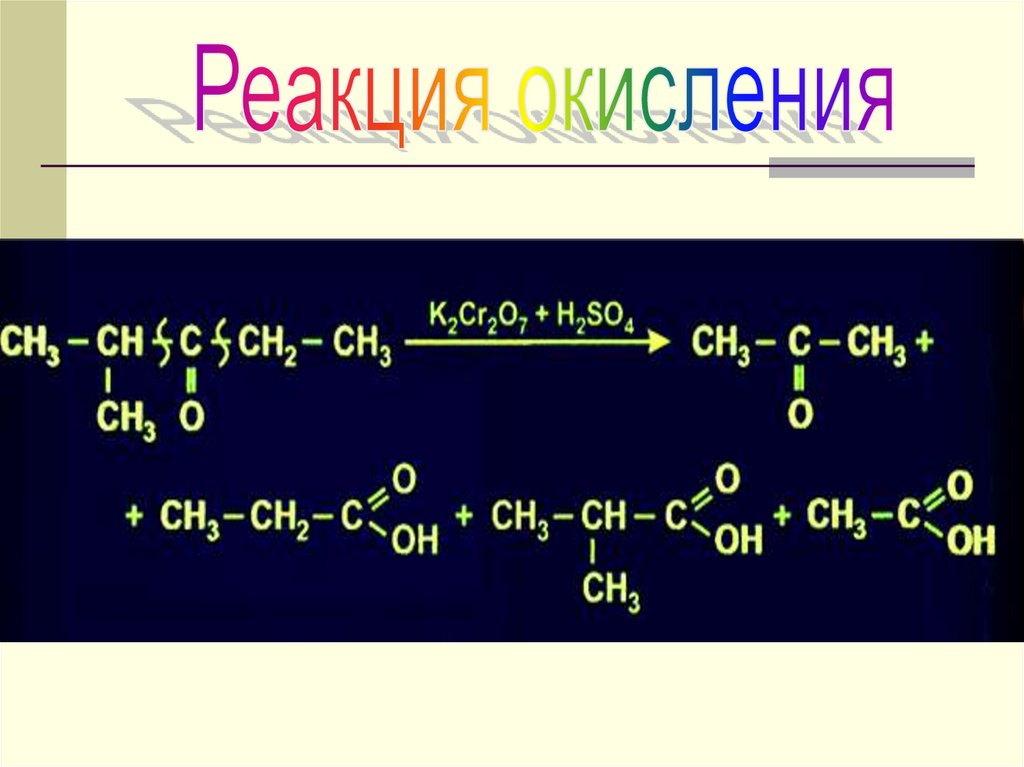
13. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИИ ОКИСЛЕНИЯРеакция с гидроксидом меди
О
О
СН3 С
+ 2Cu(OH)2 → СН3 С
этаналь
Н
+ 2H2O + Cu2O
OН
гидроксид
этановая кислота
меди (I)
(кирпично-красный)
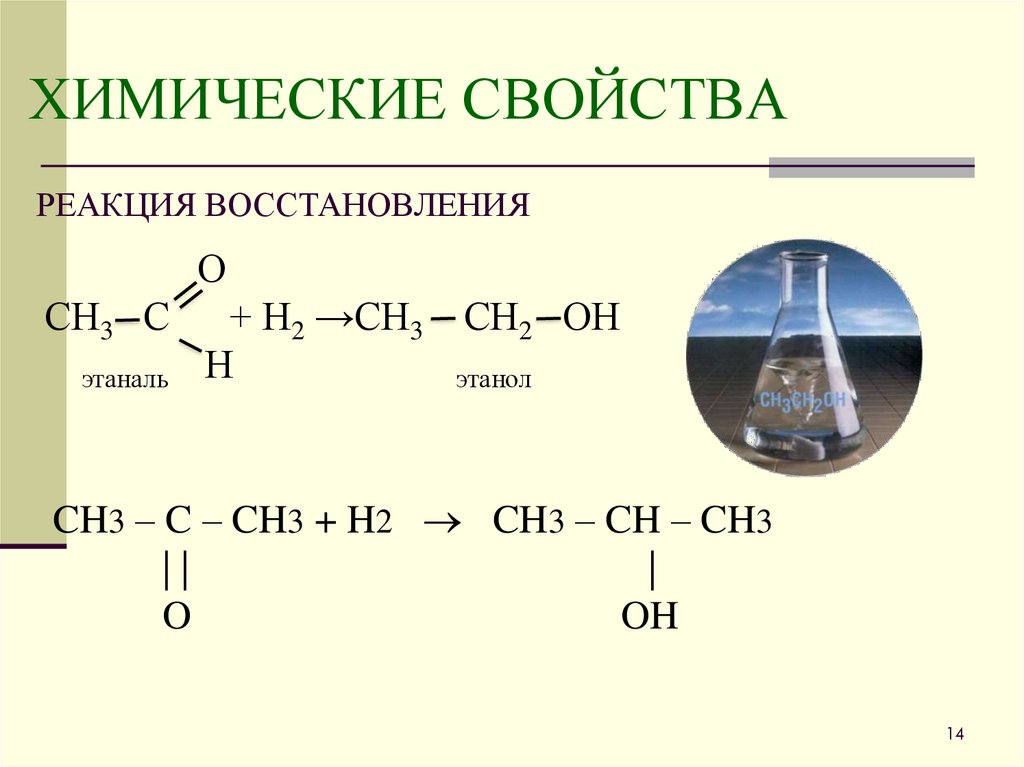
14. ХИМИЧЕСКИЕ СВОЙСТВА
РЕАКЦИЯ ВОССТАНОВЛЕНИЯО
СН3 С
этаналь
+ Н2 →СН3
Н
СН2 ОН
этанол
CH3 – C – CH3 + H2 CH3 – CH – CH3
||
|
O
OH
14
15.
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕПроцесс протекает ступенчато и начинается с
медленной атаки нуклеофила (:Nu ) по карбонильному углероду; образовавшийся анион быстро
присоединяет электрофил Е+ (например Н+):
:Nu─
δ+ δC = O медленно
.. ‒
H+
Nu– C –O.. :
быстро
альдегид или
кетон
промежуточный
продукт
Nu– C –OH
продукт
16.
ХИМИЯ АЛЬДЕГИДОВ И КЕТОНОВВ роли :Nu выступают: :CN , H2O:, R OH, :NH3
(:NH2R, :NHR2, :NR3) и др.
КИСЛОТНЫЙ КАТАЛИЗ
Нуклеофильное присоединение облегчается в
кислой среде:
δO
R–C
H
H+
δ+
R–C
+
OH
H
+
R–C
OH
H
17.
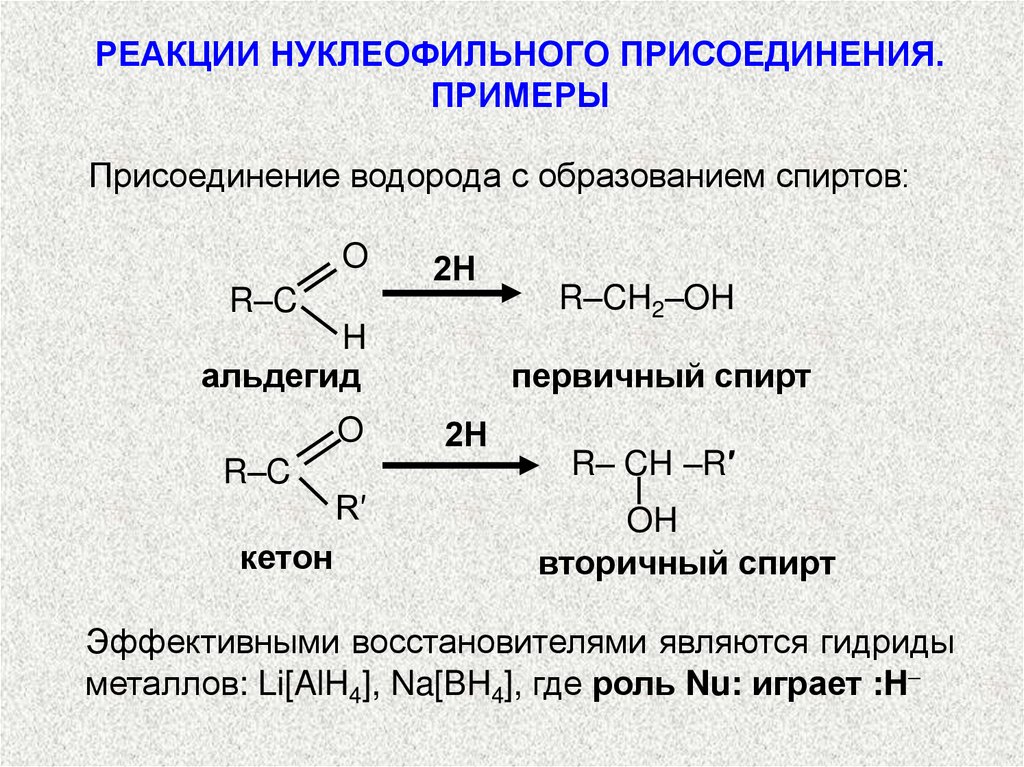
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ.ПРИМЕРЫ
Присоединение водорода с образованием спиртов:
O
2Н
R–C
R–CH2–OH
H
альдегид
первичный спирт
O
R–C
кетон
R′
2Н
R– CH –R′
OH
вторичный спирт
Эффективными восстановителями являются гидриды
металлов: Li[AlH4], Na[BH4], где роль Nu: играет :H
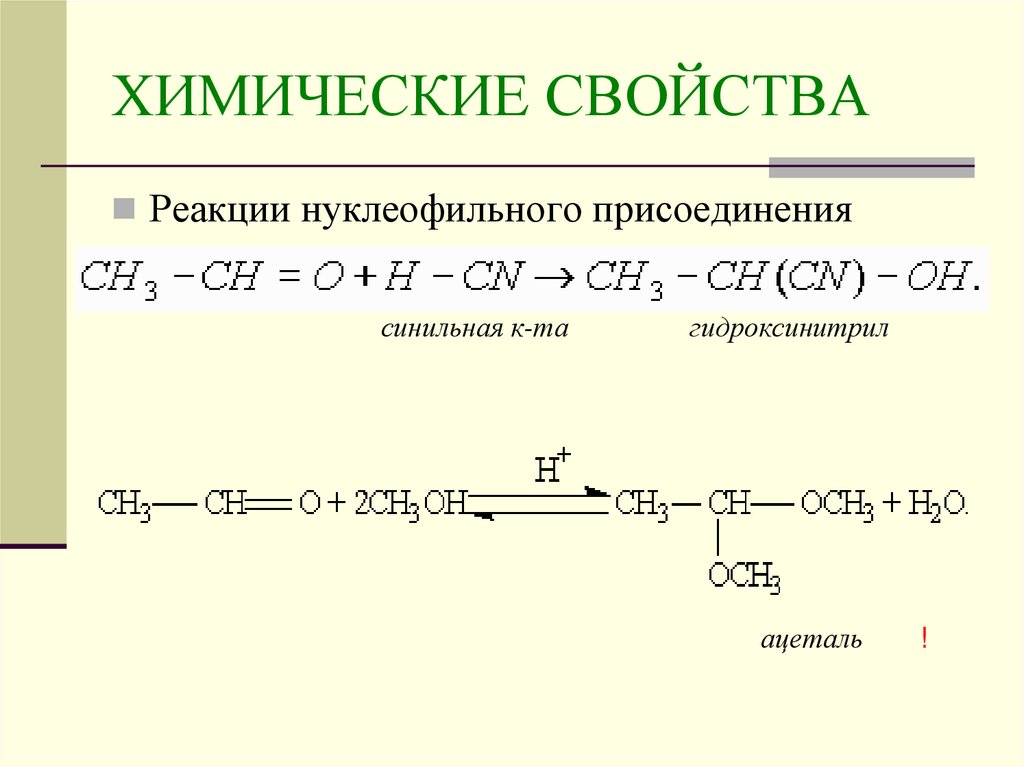
18. ХИМИЧЕСКИЕ СВОЙСТВА
Реакции нуклеофильного присоединениясинильная к-та
гидроксинитрил
ацеталь
!
19.
Присоединение гидросульфитов20.
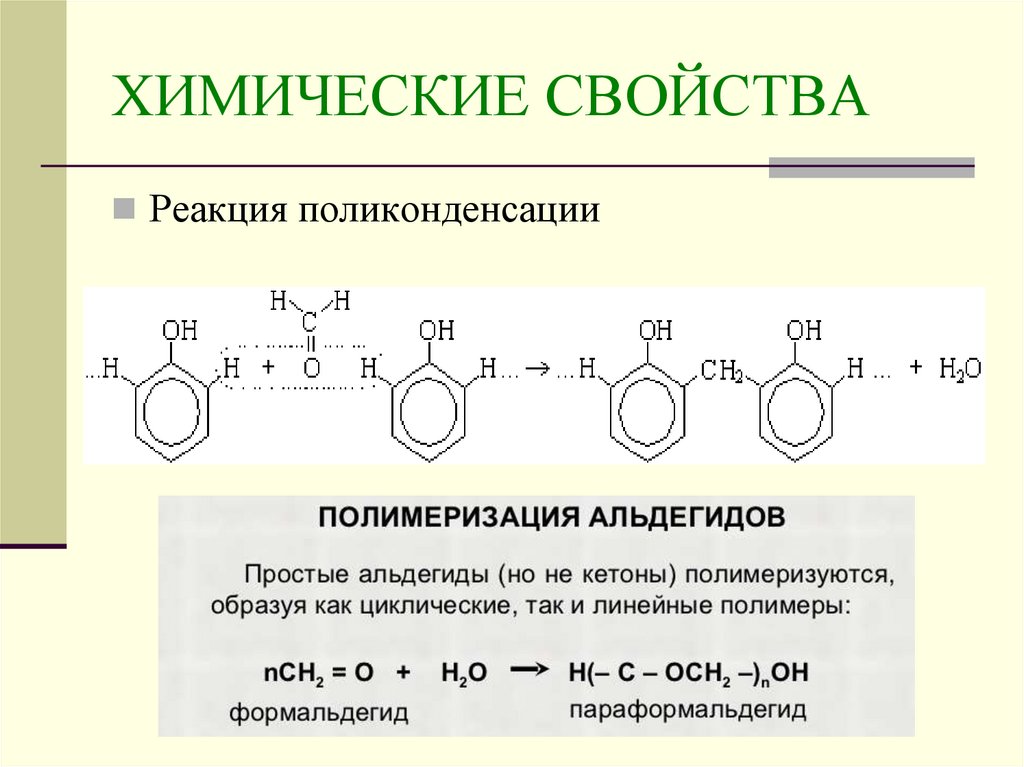
21. ХИМИЧЕСКИЕ СВОЙСТВА
Реакция поликонденсации22.
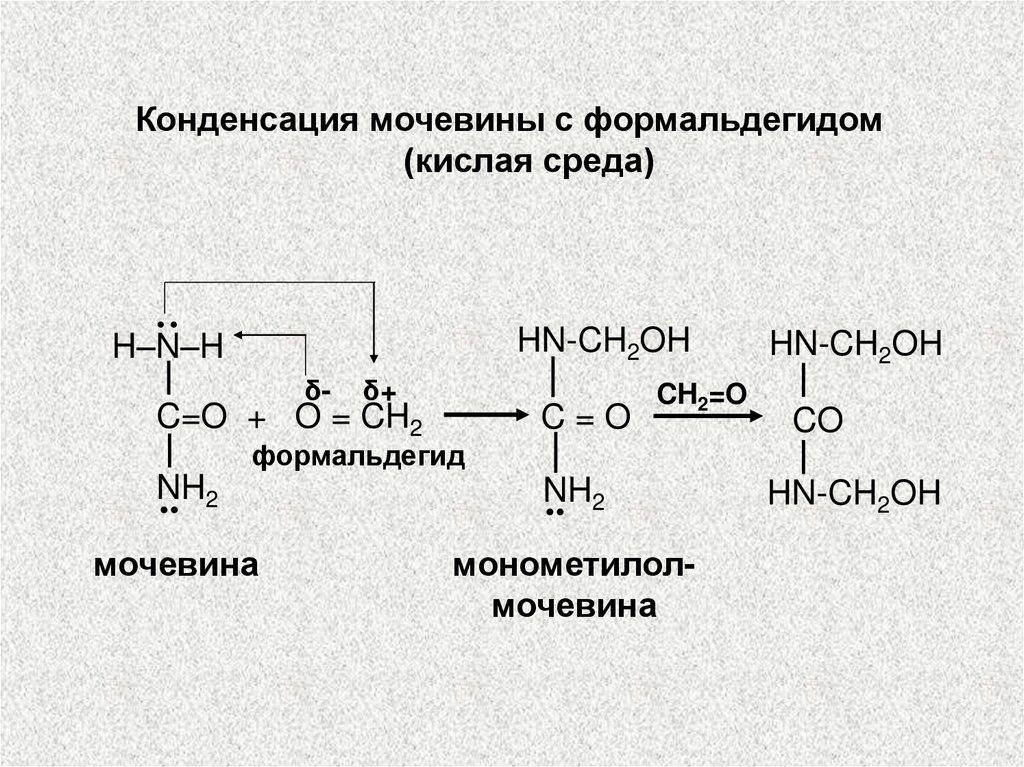
Конденсация мочевины с формальдегидом(кислая среда)
··
HN-CH2OH
H–N–H
δ-
δ+
CH2=O
C=O + O = CH2
C=O
NH
.. 2
NH
.. 2
мочевина
монометилолмочевина
HN-CH2OH
CO
формальдегид
HN-CH2OH
23.
24.
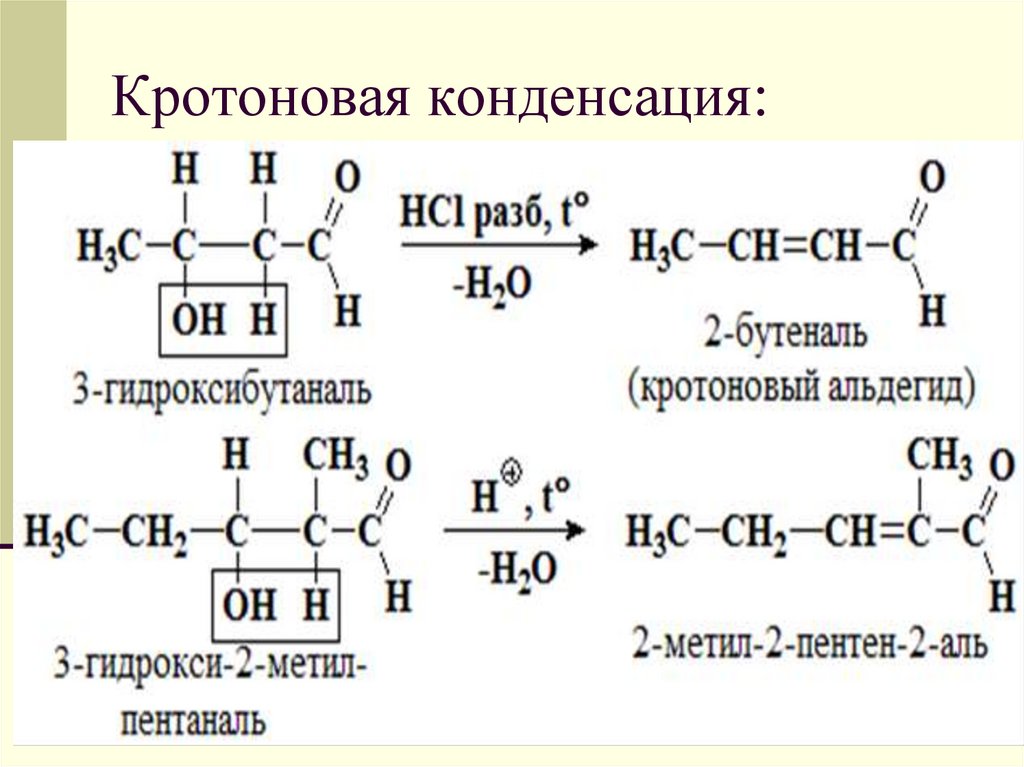
25. Кротоновая конденсация:
26. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПАРФЮМЕРИЯ• Альдегид анисовый, обепин
– жидкость с приятным
запахом мимозы
• Альдегид дециловый,
деканаль – при разбавлении
появляются нотки запаха
апельсиновой корки
27.
АЛЬДЕГИДЫ В ПРИРОДЕ28. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПОЛИМЕРНЫЕ МАТЕРИАЛЫФенолформальдегидные смолы
29. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ
ПРОИЗВОДСТВО ВЕЩЕСТВУксусная кислота
Этилацетат
Формалин
30.
31.
Физические свойстваНизшие представители – жидкость,
растворимые в воде со своеобразным
запахом.
Высшие - твердые вещества, без запаха,
не растворимые в воде.
Все
кетоны
растворяются
органических растворителях
в
32.
33.
34.
35.
Применение1. Растворители в лабораторной практике
2. Пищевой промышленности
3. Фармацевтической промышленности
4. Производство искусственного шелка
5. Бездымного пороха
6. Химической промышленности
7. Производстве кинопленки
8. Производстве лаков
36.
Лекция окончена.Спасибо за
внимание

























 Химия
Химия








