Похожие презентации:
Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10
1.
Атоми,молекули, йони,хімічні елементи,
їхні назви й символи
2. Мета
• Поглибити знання учнів про атоми імолекули як складні структурні частинки
речовини.
• Дати поняття про йони як заряджені
частинки речовини.
• На основі будови атома дати поняття про
хімічний елемент як певний тип атомів.
• Познайомити учнів із сучасною
науковою українською номенклатурою.
Дати уявлення про поширення хімічних
елементів у природі
3.
• Властивості речовин залежатьвід того, які частинки входять
до їх складу і як вони між
собою з’єднуються.
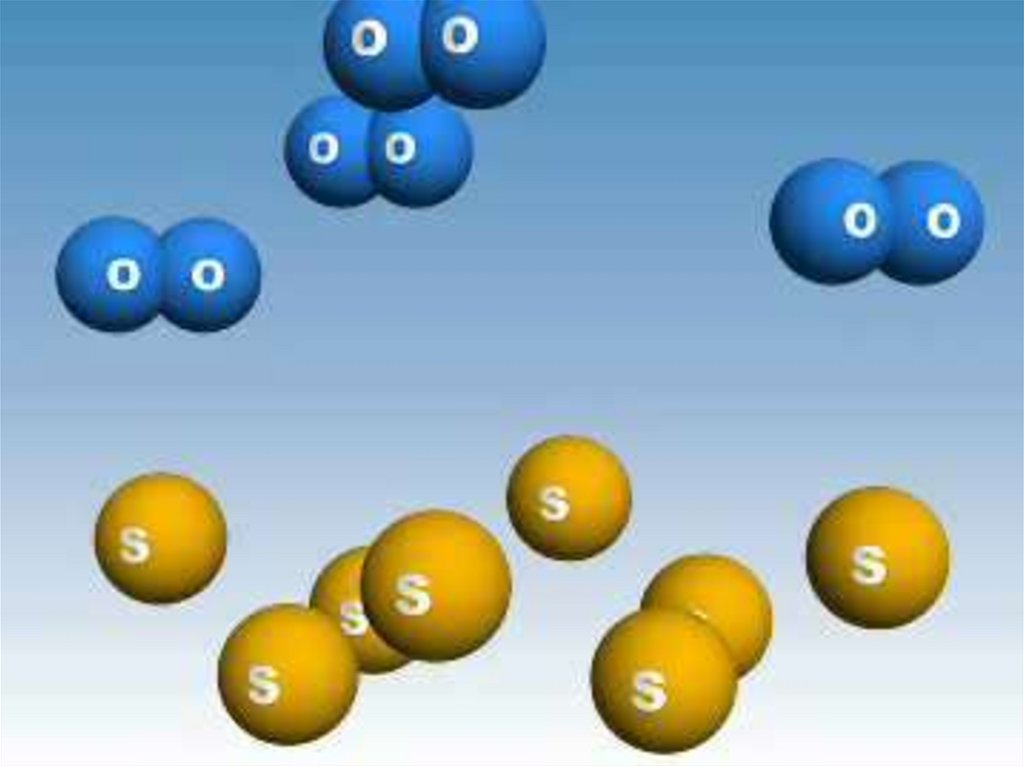
• Відомо, що багато які речовини
складаються з молекул.
4.
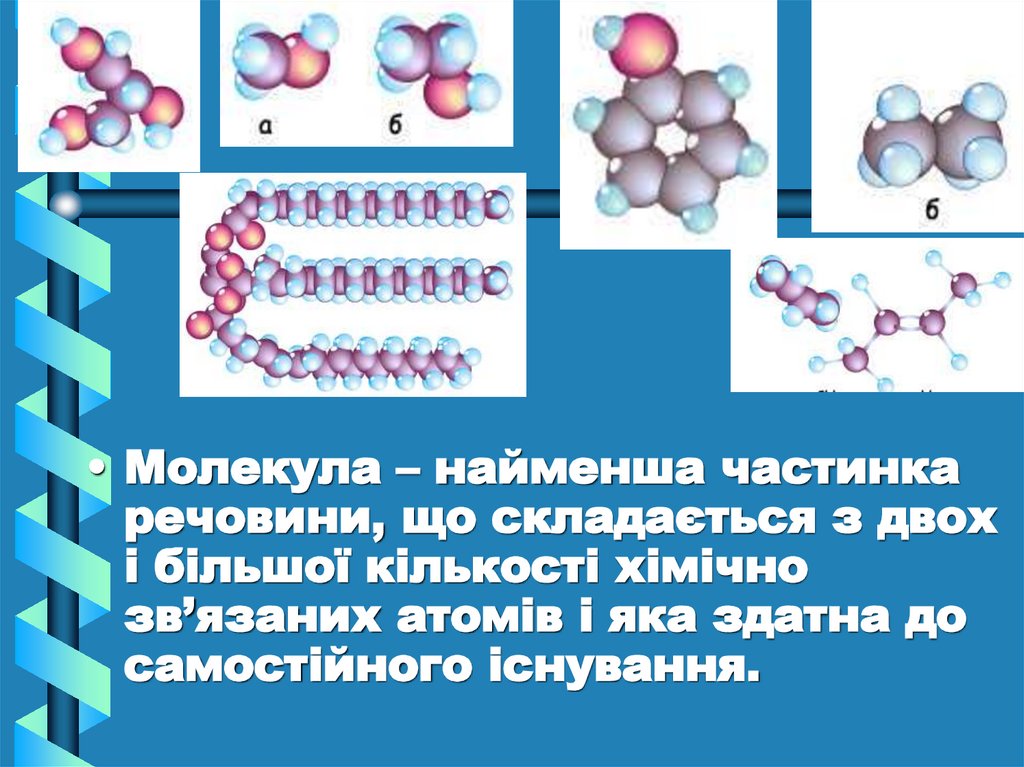
• Молекула – найменша частинкаречовини, що складається з двох
і більшої кількості хімічно
зв’язаних атомів і яка здатна до
самостійного існування.
5.
6.
7.
• Так, вода, вуглекислий газ,кисень, озон, спирт, крохмаль
– речовини молекулярної
будови.
• Молекули – це їхні структурні
частинки.
8.
• Інші речовини, наприкладалмаз, графіт, кремнезем
(річковий пісок), усі метали,
складаються з атомів.
• Атоми – це їхні структурні
частинки.
9.
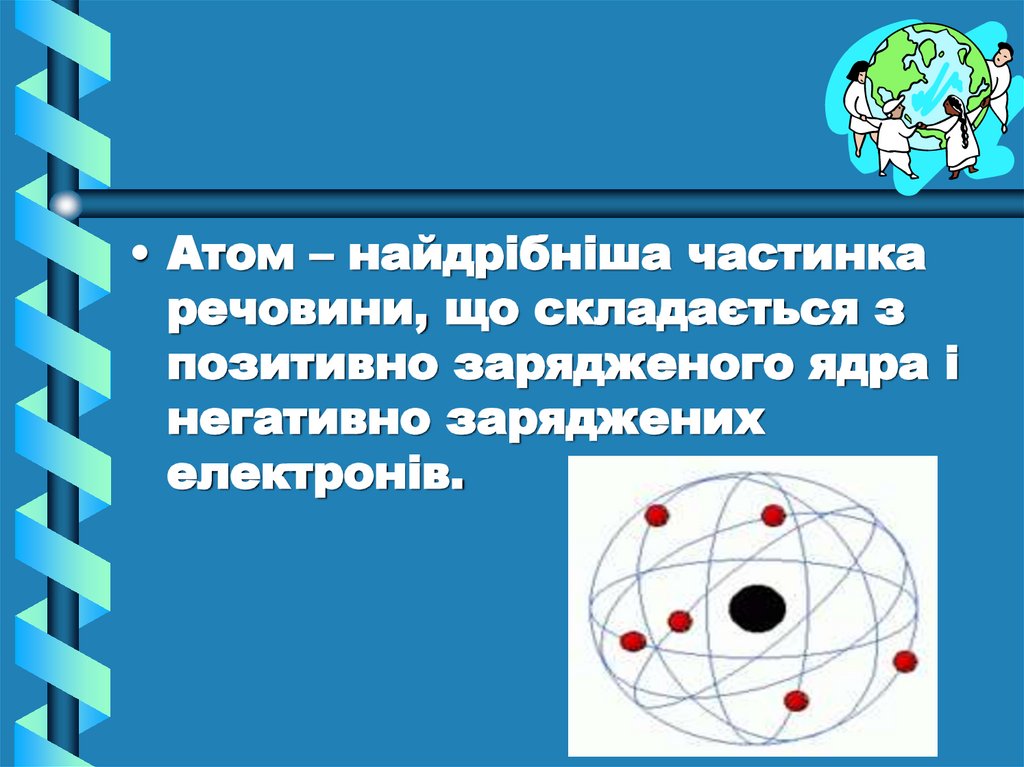
• Атом – найдрібніша частинкаречовини, що складається з
позитивно зарядженого ядра і
негативно заряджених
електронів.
10.
• Ядро атома містить елементарнічастинки – протони та нетрони.
• Протони мають заряд
+, тому ядро
завжди позитивно заряджене.
• Заряд електрона становить
–.
• В атомі сумарний заряд протонів
дорівнює сумарному заряду
електронів, тому атом
електронейтральний.
11.
12.
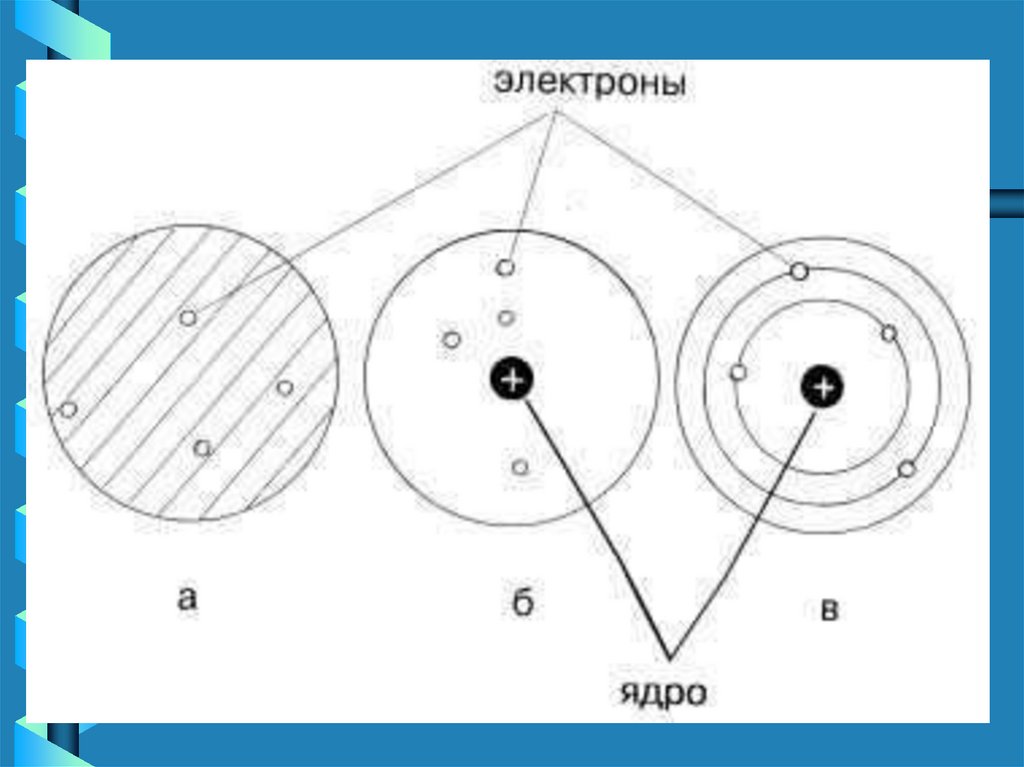
• Але в навколишньому світіелектронейтральних атомів
дуже мало,
• це, наприклад, атоми Гелію,
Неону, Аргону тощо.
Схематичне зображення
атома гелію з
електронною хмарою
навколо і складним за
будовою ядром
13.
• Частіше атоми або втрачають,або приєднують електрони і
стають зарядженими
частинками – йонами.
• Наприклад, натрій хлорид
(кухонна сіль) складається з
йонів Натрію і йонів Хлору.
14.
15.
• Основні положення Атомно-молекулярноговчення
• 1. Існують речовини з молекулярною і
немолекулярное будовою.
• 2. Між молекулами є проміжки, розміри
яких залежать від агрегатного стану
речовини. Найбільші відстані між молекулами
газів, найменші в твердих речовинах.
• 3. Атоми одного елемента відрізняються від
атомів інших елементів масою, розмірами і
властивостями.
• 4. Молекули і складаються з них атоми
знаходяться в безперервному русі.
Підтвердженням цього положення можуть
служити процеси розповсюдження запахів
(дифузія), випаровування рідин.
• 5. При фізичних явищах молекули
зберігаються, а при хімічних руйнуються,
атоми перегруповуються і утворюють нові
молекули.
16.
Нині відомо понад 110 видіврізних атомів, з них 90
зустрічаються в природі і 20 –
добуті штучно.
Вид атомів з певним зарядом
ядра називають хімічним
елементом.
17.
• Усі відомі нині речовини, а їх вже понад15 000 000, утворені з’єднанням атомів
різних хімічних елементів.
• У цій безлічі речовин неможливо було б
орієнтуватися, якби не було прекрасного
винаходу, що нагадує азбуку.
• За пропозицією шведського хіміка
Й. Берцеліуса хімічні елементи почали
позначати однією або двома літерами їх
латинської назви.
• Наприклад, Оксиген позначається літерою
О від Oxygenium (Оксігеніум), Сульфур S від
Sulfur, Ферум – Fe від Ferrum тощо.
18.
• Назви елементів мають різнепоходження:
за властивостями елементів
(водень - породжує воду);
на честь планет (селен - місяць);
з міфології (Тантал, Титан);
від географічних назв (рутеній латинська назва Росії);
на честь учених (Менделєвій Менделєєв).
19.
• Такою хімічною символікоюкористуються з 1814 р. й досі.
• Твоє завдання полягає в тім, щоб
поступово запам’ятати символи
найважливіших хімічних
елементів, навчитися їх писати,
вимовляти й розуміти, що вони
позначають.
• Зверни увагу: назви хімічних
елементів пишуться з великої
літери.
20.
Усі хімічні елементи завластивостями поділяють на метали
й неметали.
До елементів - металів належать
Алюміній Al, Натрій Na, Магній Mg
тощо,
до елементів-неметалів – Оксиген О,
Хлор Сl, Фосфор Р тощо.
Така класифікація дещо умовна,
оскільки між елементами-металами
і елементами-неметалами не
можна провести чіткої межі, проте
вона широко використовується.
21. Поширення хімічних елементів у природі
Всі хімічні елементи утворилисявнаслідок складних процесів
ядерного синтезу в зірках і в
космічному просторі.
Є багато теорій, що пояснюють
походження хімічних елементів та
особливості їх розповсюдження на
Землі і в Космосі (ми їх не
розглядаємо).
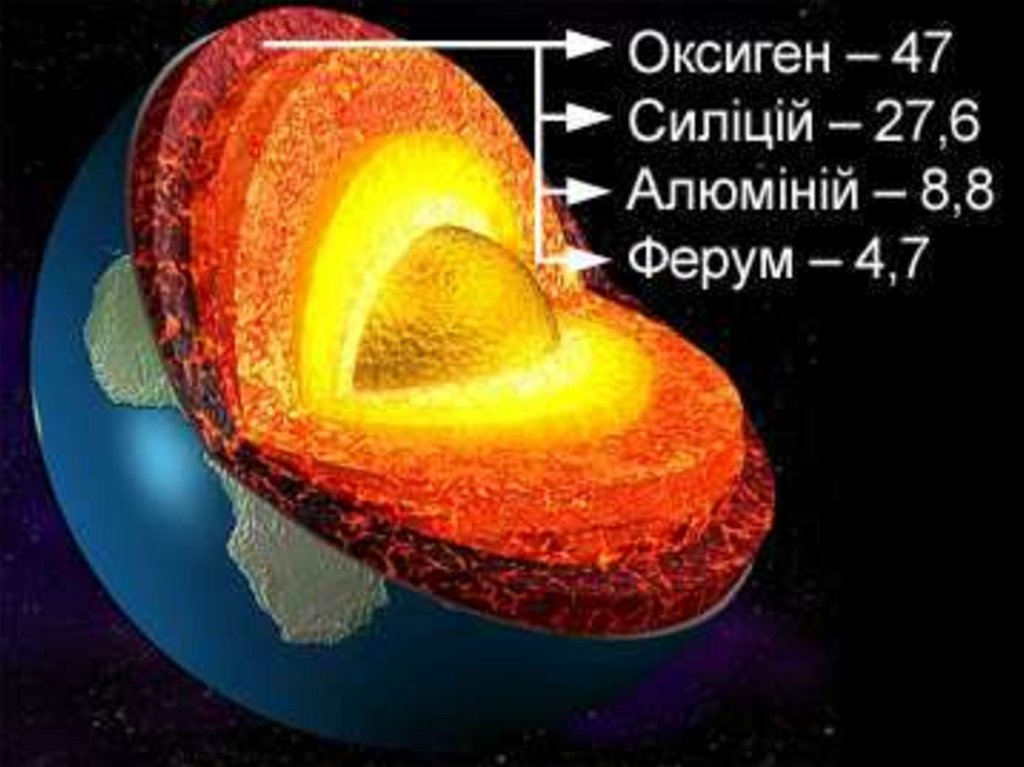
22.
• На Землі найпоширенішим єОксиген О (47% від маси
земної кори),
• за ним ідуть Силіцій Si (27,6%),
• Алюміній Al (8,8%),
• Ферум Fe (4,65%).
• Ці елементи разом із Кальцієм
Са, Натрієм Na, Калієм К і
Магнієм Mg складають понад
99% маси земної кори .
23.
24. Висновки
• Речовини бувають молекулярної інемолекулярної – атомної або
йонної – будови.
• Атоми певного виду з однаковим
зарядом ядра і є хімічним
елементом.
• Уся різноманітність речовин
утворилася внаслідок комбінації
хімічних елементів.




















 Химия
Химия








