Похожие презентации:
Свойства галогенводородных кислот
1.
Свойствагалогенводородных
кислот
2.
Строение и свойства галогеноводородов• В галогеноводородах и галогенидах галогены проявляют свою
низшую степень окисления – -1. Галогеноводороды – это бесцветные
соединения водорода с галогенами состава НГ (где «Г» – атом
галогена).
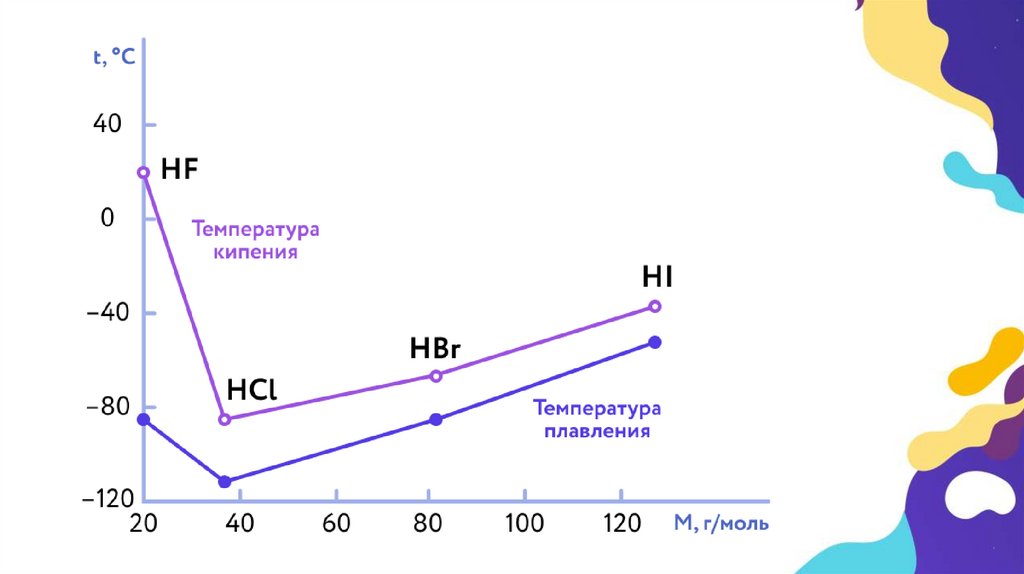
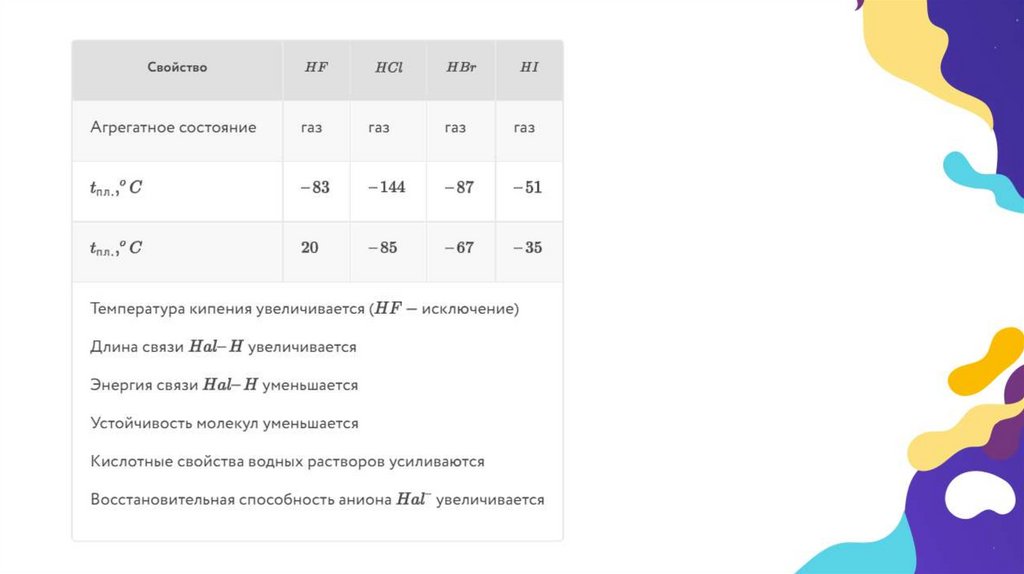
• При н. у. HCl, HBr и HI – газообразные вещества, HF – легколетучая
жидкость, температура кипения которой +19,5 °С. Все эти вещества
ядовиты и требуют очень осторожного обращения!
3.
• Галогеноводороды хорошо растворяются в воде, а фтороводородсмешивается с водой в любых соотношениях (т. е. неограниченно
растворим). Водные растворы галогеноводородов являются
кислотами. Сила этих кислот увеличивается сверху вниз, т. е.
самая сильная кислота – иодоводородная, а самая слабая –
фтороводородная.
4.
• Кислотные свойства галогеноводородных кислот будут тембольше, чем меньше прочность связи Н–Г. От HF к HI уменьшается
степень перекрывания электронных облаков атомов водорода и
галогена, а область перекрывания будет находиться на большем
расстоянии от ядер атомов. Кроме того, электроотрицательность
атомов галогенов сверху вниз по группе, т. е. от F к I,
уменьшается. Поэтому в молекуле HF электронное облако атома
водорода смещается в сторону атома галогена в большей
степени. Это приводит к усилению связи между атомами.
Запомним, фтороводородная кислота – слабая, остальные
галогеноводородные кислоты – сильные, причем их сила
увеличивается от HCl к HI.
5.
Плавиковая кислота• Фтороводородная кислота имеет еще одно название –
плавиковая кислота. Уникальным свойством плавиковой кислоты
является способность растворять стекло. Поэтому плавиковую
кислоту хранят не в стеклянной посуде, а в сосудах из пластика
или в стеклянной посуде, покрытой слоем парафина.
4 HF + SiO2 = SiF4↑ + 2H2O
6.
• Плавиковая кислота используется для нанесения на стеклянныеизделия рисунков, надписей, меток, а также для полировки
стекла.
2NaF + H2SO4 = Na2SO4 + 2HF↑
7.
Соляная кислота• В отличие от фтороводорода хлороводород ограниченно
растворим в воде, но его растворимость достаточно высока – в 1
объеме воды при комнатной температуре растворяется около 450
объемов хлороводорода. Раствор хлороводорода в воде
называется соляной, или хлороводородной кислотой.
• Концентрированная соляная кислота дымит на воздухе. Это
сильная кислота. Для нее характерны все общие свойства кислот:
изменение окраски индикаторов, взаимодействие с металлами,
основными и амфотерными оксидами, основаниями,
некоторыми солями.
8.
9.
10.
Химические свойства1) Взаимодействие с металлами, стоящими в ряду напряжения до
водорода
2HBr + Fe = FeBr2 + H2
HCl(разб) + Сu
2) Взаимодействие с основными и амфотерными оксидами
2HBr + CaO = H2O + CaBr2
ZnO + 2HCl = ZnCl2 + H2O
11.
3) Взаимодействие с основаниями и амфотерными гидроксидами2HBr + Ca(OH)2 = MgBr2 + 2H2O
3HCl + Al(OH)3 = AlCl3 + 3H2O
4) Реакция обмена с солями:
HCl + AgNO3 = AgCl + HNO3
2HBr + Na2CO3 = 2NaBr + CO2 + H2O









 Химия
Химия








