Похожие презентации:
Кислоты. Классификация. Химические свойства
1. Кислоты. Классификация. Химические свойства
2. Цель урока: Знать состав, классификацию, номенклатуру кислот. Задачи урока:
дать определение кислотам,ознакомиться с формулами и названиями
основных неорганических кислот.
уметь определять кислоты из ряда,
характеризовать физические свойства
кислот, составлять уравнения,
характеризующие свойства кислот,
экспериментально доказывать химические
свойства кислот, определять тип
химической реакции
3. ОРГАНИЧЕСКИЕ КИСЛОТЫ
ЛИМОННАЯ, ЯБЛОЧНАЯ, УКСУСНАЯ,ЩАВЕЛЕВАЯ, МУРАВЬИНАЯ, МОЛОЧНАЯ.
ОРГАНИЧЕСКИЕ
КИСЛОТЫ
4.
НЕОРГАНИЧЕСКИЕСЕРНАЯ, СОЛЯНАЯ,ПЛАВИКОВАЯ,
ФОСФОРНАЯ,
АЗОТНАЯ.
5. КИСЛОТЫ СОДЕРЖАТСЯ В ОРГАНИЗМАХ ЖИВОТНЫХ
Молочная кислотаобразуется в мышцах при
физической нагрузке.
Соляная кислота,
находящаяся в желудке,
помогает переваривать
пищу.
6. КИСЛОТЫ ПРИМЕНЯЮТСЯ В КУЛИНАРИИ .
Уксуснаяи лимонная
кислоты.
7. КИСЛОТЫ ПРИМЕНЯЮТСЯ В МЕДИЦИНЕ.
Аскорбиновая,фолиевая,
липоевая,
ацетилсалициловая
и другие
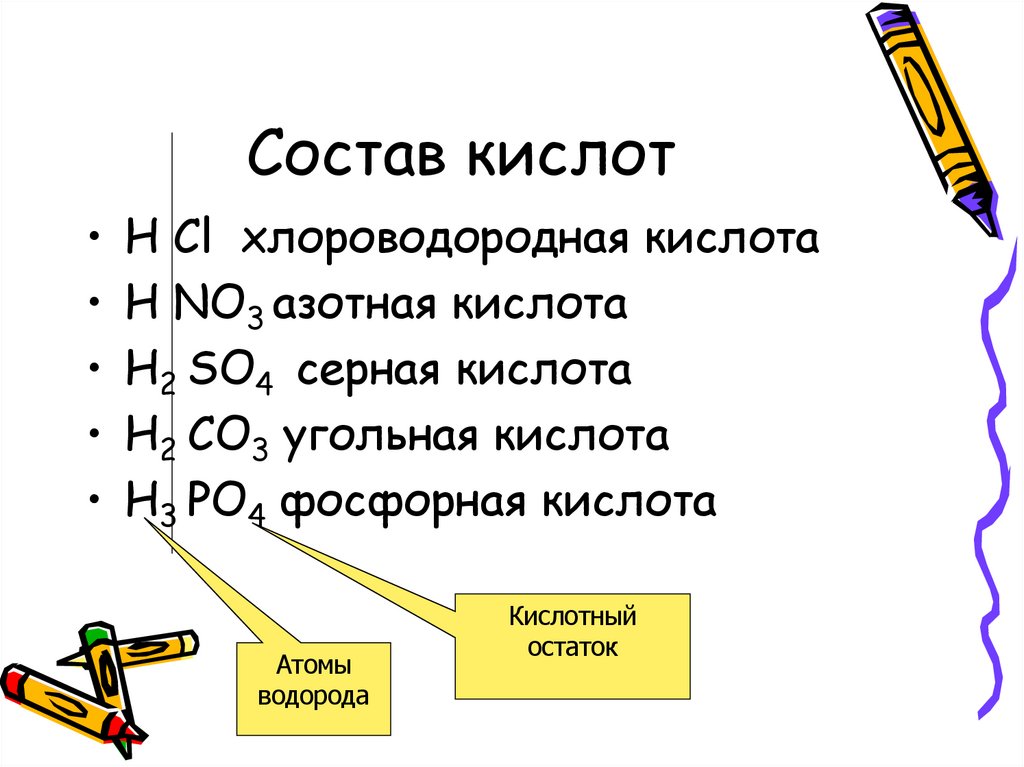
8. Состав кислот
• H Cl хлороводородная кислота• H NO3 азотная кислота
• H2 SO4 серная кислота
• H2 CO3 угольная кислота
• H3 PO4 фосфорная кислота
Атомы
водорода
Кислотный
остаток
9.
Кислоты – этосложные вещества,
состоящие из атомов
водорода и кислотных
остатков
10.
11.
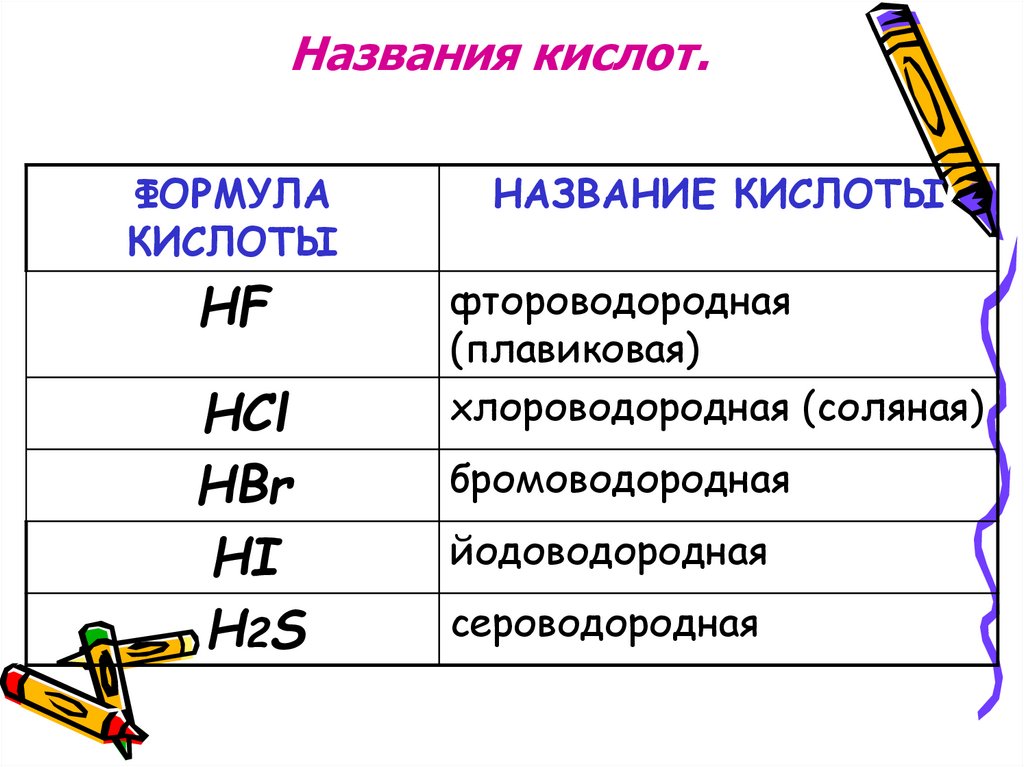
Названия кислот.ФОРМУЛА
КИСЛОТЫ
НАЗВАНИЕ КИСЛОТЫ
HF
фтороводородная
(плавиковая)
хлороводородная (соляная)
HCl
HBr
HI
H2S
бромоводородная
йодоводородная
сероводородная
12.
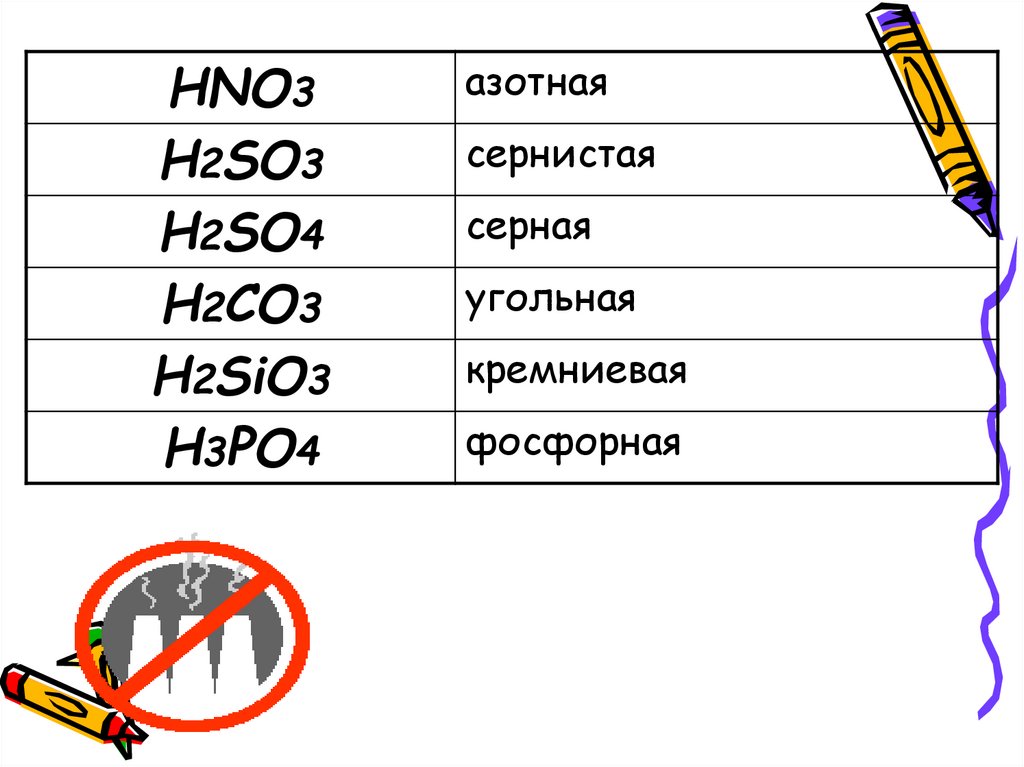
HNO3H2SO3
H2SO4
H2CO3
H2SiO3
H3PO4
азотная
сернистая
серная
угольная
кремниевая
фосфорная
13.
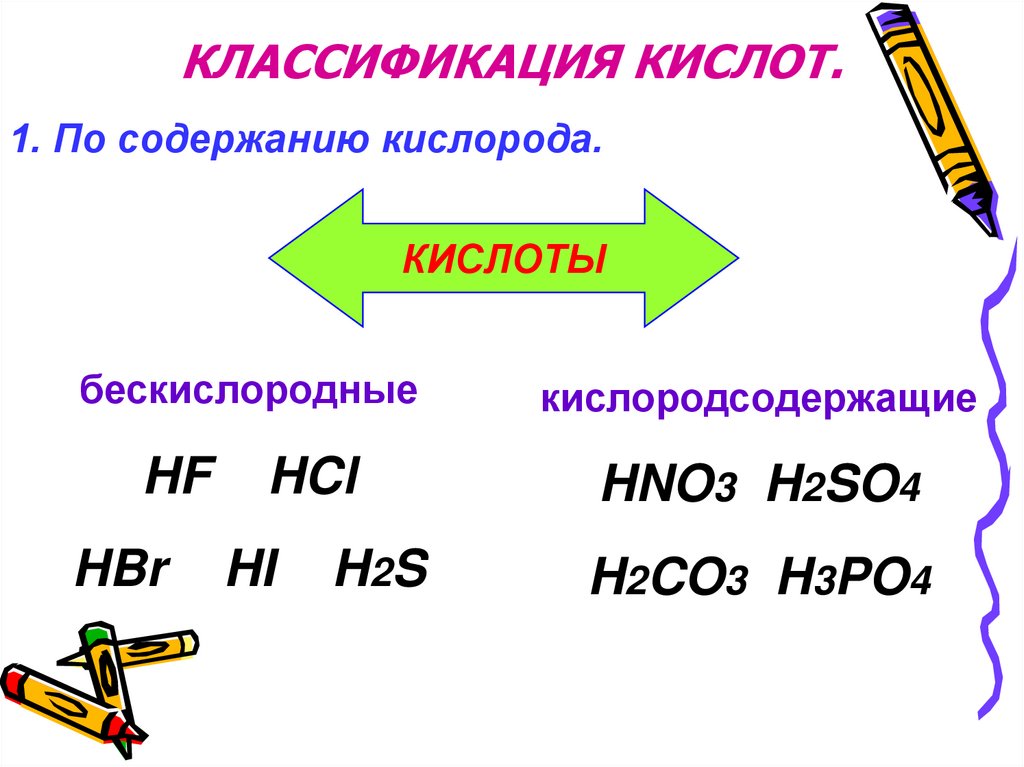
КЛАССИФИКАЦИЯ КИСЛОТ.1. По содержанию кислорода.
КИСЛОТЫ
бескислородные
HF
HBr
HCl
HI
H2 S
кислородсодержащие
HNO3 H2SO4
H2CO3 H3PO4
14.
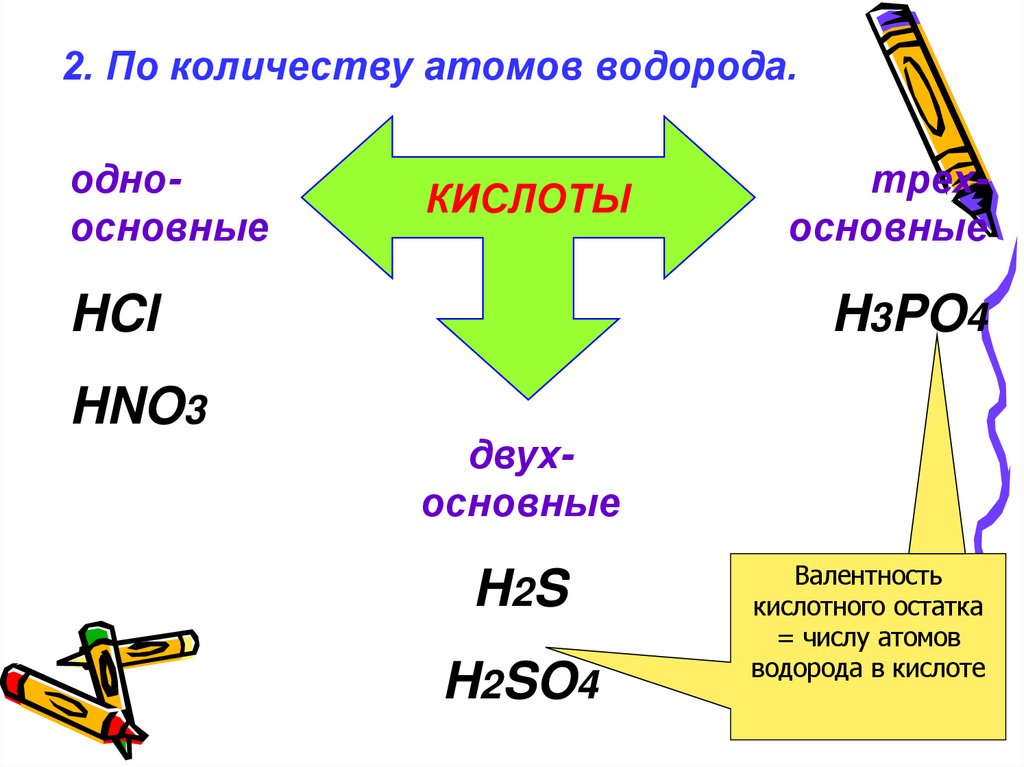
2. По количеству атомов водорода.одноосновные
КИСЛОТЫ
HCl
HNO3
трехосновные
H3PO4
двухосновные
H2 S
H2SO4
Валентность
кислотного остатка
= числу атомов
водорода в кислоте
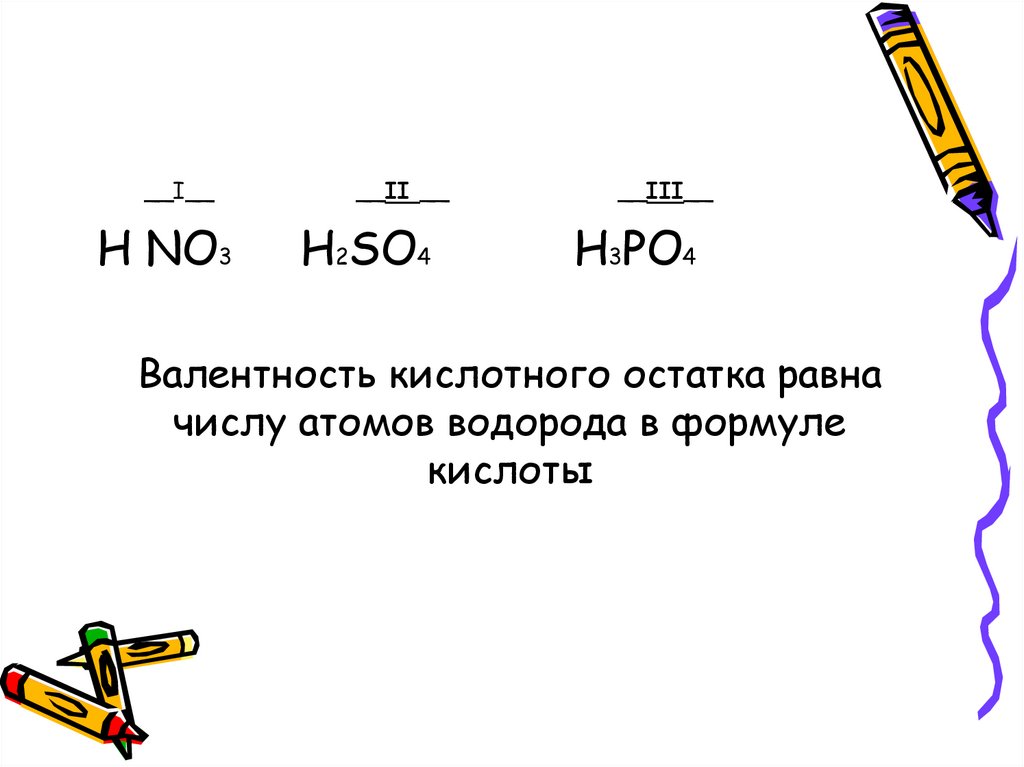
15. Валентность кислотного остатка равна числу атомов водорода в формуле кислоты
__I__Н NO3
__II __
H2SO4
__III__
H3PO4
Валентность кислотного остатка равна
числу атомов водорода в формуле
кислоты
16. Соблюдение ТБ при работе с кислотами
• Не нюхать• Не пробовать
• Что бы не попадала в глаза
Можно
получить
ожог
слизистой
оболочки
• Не разливать
О любых проблемах
сообщать учителю!!!!!!!!
Разъедает
кожу, ткань,
бумагу,
древесину,
изменяет цвет
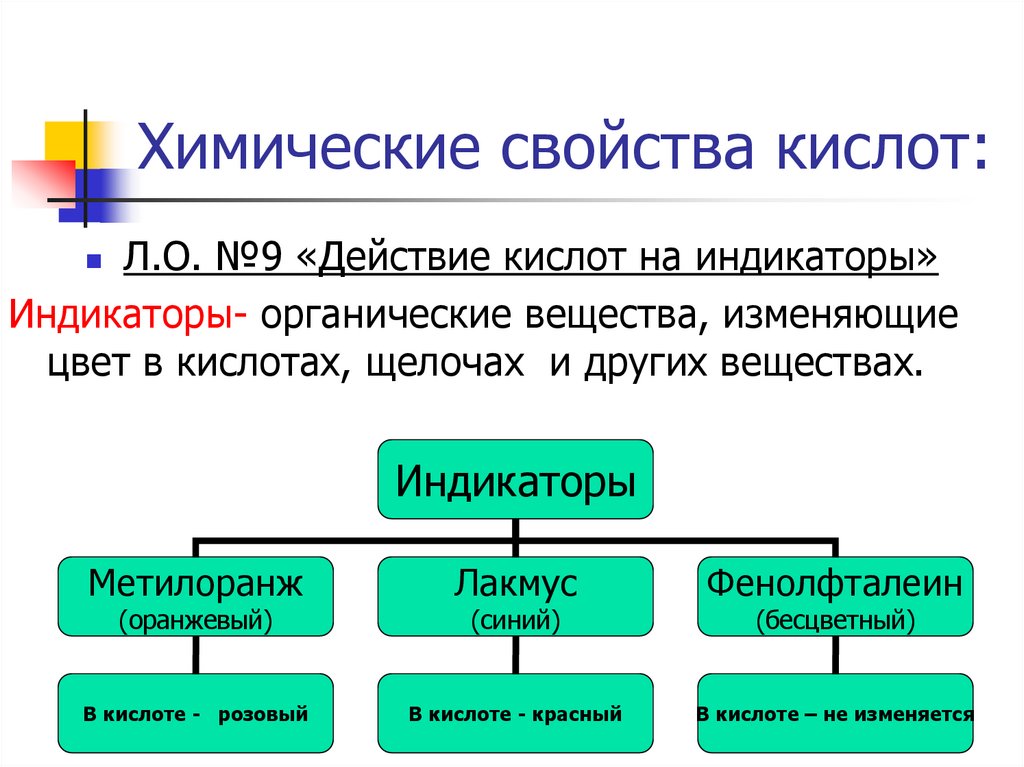
17. Химические свойства кислот:
Л.О. №9 «Действие кислот на индикаторы»Индикаторы- органические вещества, изменяющие
цвет в кислотах, щелочах и других веществах.
Индикаторы
Метилоранж
Лакмус
Фенолфталеин
В кислоте - розовый
В кислоте - красный
В кислоте – не изменяется
(оранжевый)
(синий)
(бесцветный)
18. Л.О. № 9 «Отношение кислот к металлам»
Некоторые металлы реагируют скислотами
Выделяется газ - водород
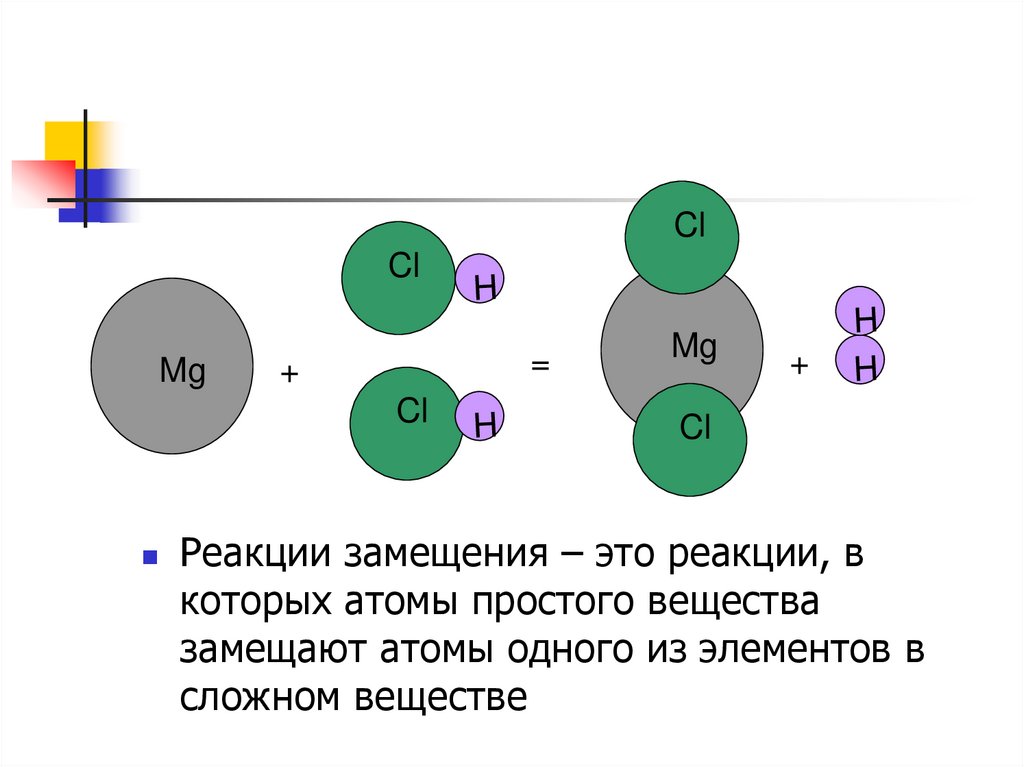
19.
ClCl
Mg
=
+
Cl
Mg
+
Cl
Реакции замещения – это реакции, в
которых атомы простого вещества
замещают атомы одного из элементов в
сложном веществе
20.
С кислотами реагируют металлы, находящиеся вряду активности или вытеснительном ряду до
водорода:
K Ca Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Au
2
Чем левее металл, тем активнее он вытесняет
водород
В результате реакции должна получиться
растворимая соль
Вступают только растворимые кислоты
21. Л.О. №11 « Взаимодействие кислот с оксидами металлов»
В данных случаях проходят реакцииобмена - в ходе которых сложные
вещества обмениваются составными
частями
В наших случаях образуется соль и вода
22.
Кислоты реагируют с основаниями(реакция нейтрализации – образуется соль и
вода)
H2SO4 + 2KOH
(метилоранж)
→ K2SO4 + 2H2O
23. Кислоты реагируют с солями:
Образуется соль и другая кислота:HNO3
H2SO4 HCl H2SO3 H2CO3 H2S H2SiO3
H3PO4
ZnCl2 + H2SO4→ZnSO4 + H2O
HCl + Na2SO4 →
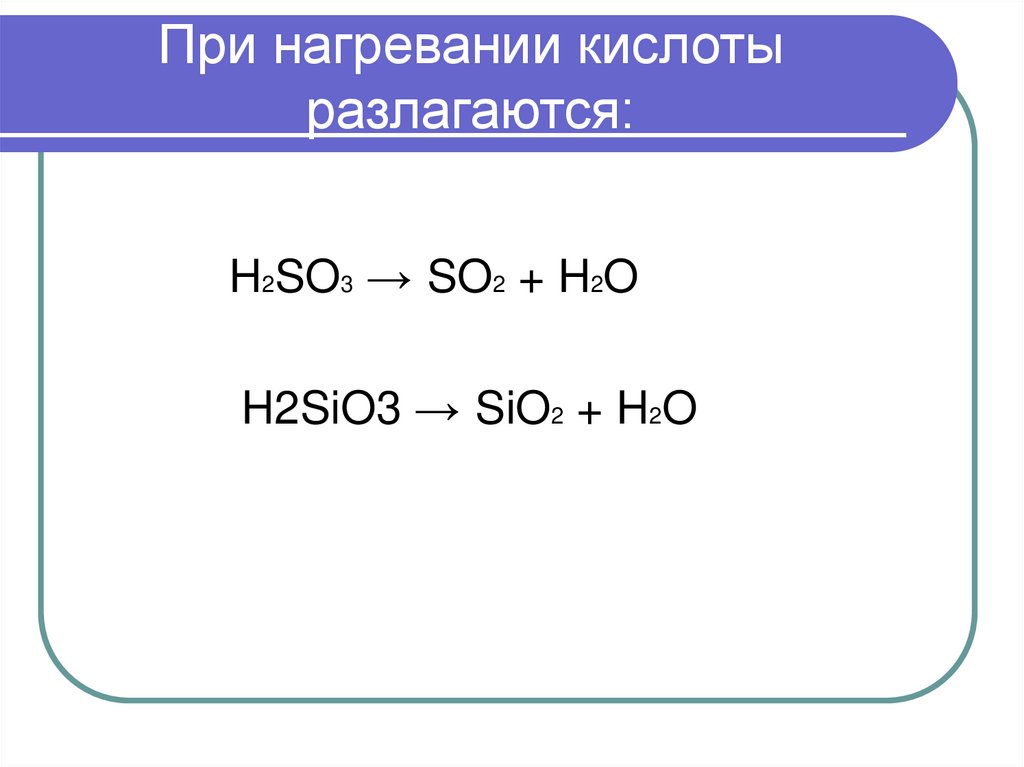
24. При нагревании кислоты разлагаются:
H2SO3 → SO2 + H2OH2SiO3 → SiO2 + H2O
25. Домашнее задание:
$ 32, упр. 8 стр.104,табл. 12 стр. 100 выучить















 Химия
Химия








