Похожие презентации:
Свойства галогенов
1.
Свойствагалогенов
2.
Физические свойства• Все галогены образуют двухатомные молекулы Hal2, наиболее
прочной из которых является молекула хлора Cl2. Все галогены
имеют очень резкий неприятный запах, вдыхание галогенов даже
в небольших количествах вызывает раздражение дыхательных
путей и раздражение слизистых оболочек. Галогены токсичны,
особенно опасен фтор.
• Галогены относительно плохо растворяются в воде. Так, при
комнатной температуре в 1 л воды растворяется 2,5 объёмов
хлора. Раствор хлора в воде называют хлорной водой, раствор
брома в воде — бромной водой. Растворимость брома в воде при
комнатной температуре составляет 3,5 г в 100 г воды, иода —
0,02 г.
3.
• Галогены хорошо растворяются в органических растворителях,таких как бензол (C6H6), четырёххлористый углерод (CCl4),
этанол(C2H5OH), диэтиловый эфир (C2H5 – O – C2H5),
сероуглерод(CS2).
4.
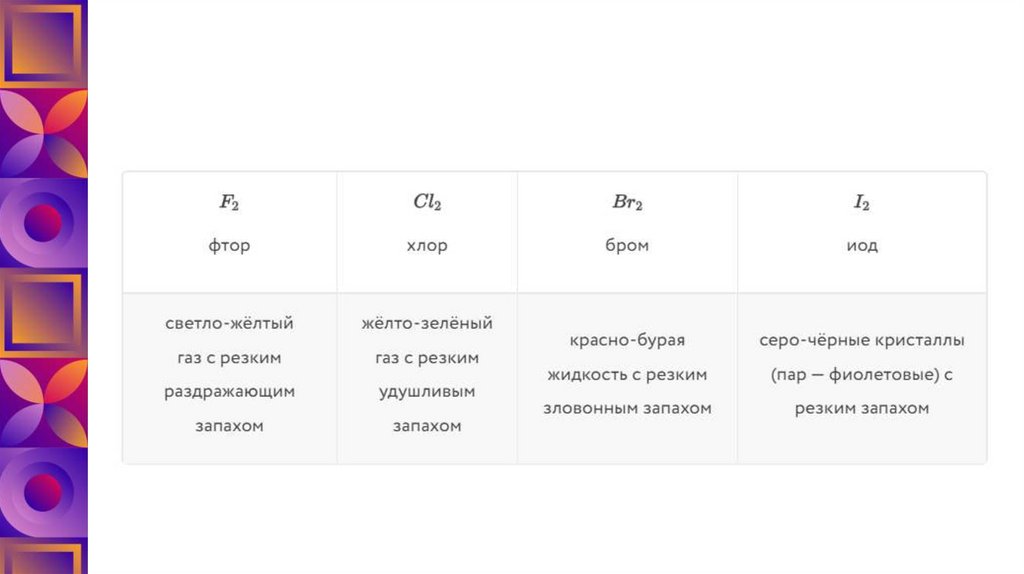
• От фтора к иоду увеличиваются температуры кипения иплавления галогенов, интенсивность их окраски. Так фтор —
светло-зелёный газ, хлор — газ жёлто-зелёного цвета, бром —
красно-бурая жидкость (бром — единственный жидкий
неметалл), иод образует серо-чёрные кристаллы, легко
возгоняется (переходит из твёрдого состояния в газообразное,
минуя жидкое), пары иода имеют фиолетовую окраску.
5.
6.
Химические свойства• Галогены относятся к химически активным веществам. В реакциях
с металлами и большинством неметаллов, а также со сложными
веществами галогены проявляют сильные окислительные
свойства. Наиболее активен в химических реакциях фтор. С
увеличением молекулярной массы активность галогенов
снижается.
7.
• Фтор при пропускании через воду бурно реагирует с ней:2F2 + 2H2O = 4HF + O2
8.
Взаимодействие с металлами• При взаимодействии галогенов с металлами образуются
соли: фториды, хлориды, бромиды, иодиды.
• Фтор реагирует со всеми металлами (даже с золотом и платиной),
с большинством — при обычных условиях:
Ca+F2=CaF2,
2Au+3F2=AuF3 (при нагревании)
9.
• Остальные галогены реагируют с металлами при нагревании:2Fe+3Cl2=FeCl3,
Cu+Br2=CuBr2,
2Al+3I2=AlI3.
10.
Вытеснение галогенов друг другом изсолей
• В реакциях галогенов с галогенидами проявляется следующая
закономерность: более активный галоген вытесняет менее
активный из его солей. Так, хлор взаимодействует с водными
растворами бромидов и иодидов, выступая в этих реакциях
окислителем:
2KBr+Cl2=Br2+2KCl,
2NaI+Cl2=I2+2NaCl
11.
• У иода способность вытеснять другие галогены отсутствует, таккак его окислительные свойства в ряду галогенов самые слабые.
• Реакции фтора с водными растворами солей невозможны по
причине его взаимодействия с водой.
12.
Br2 + H2S = 2HBr + S4Cl2 + H2S + 4H2O = H2SO4 + 8HCl
O2+F2=O2F2
13.
Взаимодействие с неметаллами2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
2P + 3Br2 = 2PBr3
14.
Взаимодействие с неметаллами3F2 + S = SF6
Cl2+ 2S = S2Cl2
Br2 + 2S = S2Br2
15.
Взаимодействие с щелочами16.
17.
Получение• Промышленное получение фтора и хлора основано на
электролизе: фтор получают исключительно электролизом
расплавов фторидов металлов, хлор – расплавов и растворов
хлоридов:
2KF = 2K + F2
2NaCl = 2Na + Cl2
2NaCl + 2H2O = 2NaOH + H2 + Cl2
18.
Лабораторный способ получения хлора4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
6KBr + K2Cr2O7 + 7H2SO4 = 3Br2 + Cr2(SO4)3 + H2O
6KI + K2Cr2O7 + 7H2SO4 = 3I2 + Cr2(SO4)3 + H2O










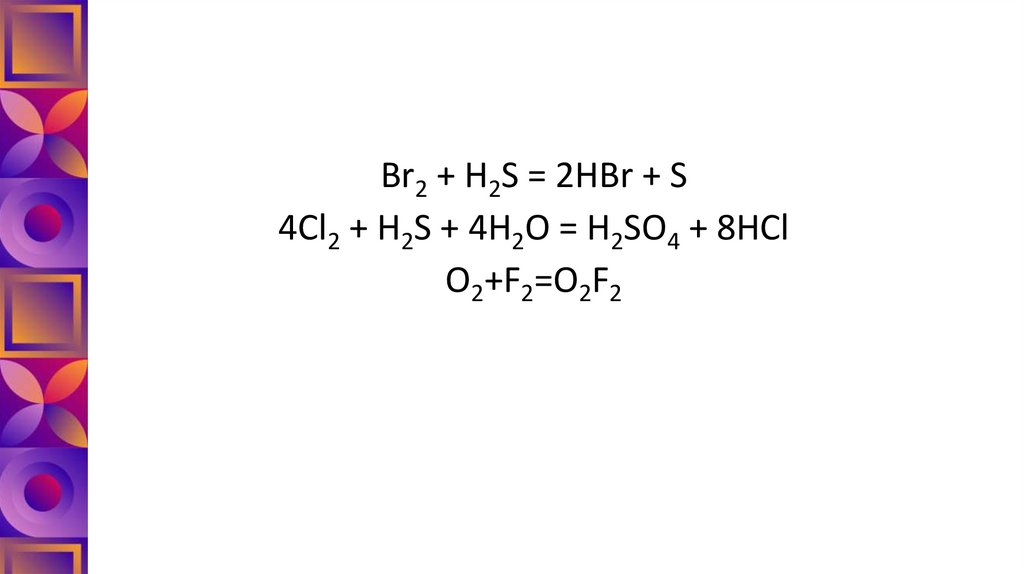






 Химия
Химия








