Похожие презентации:
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
1.
Электролиз растворовПрименение вытеснительного ряда металлов
для прогнозирования продуктов электролиза
2.
Цели обученияОбъяснять процессы, протекающие при
прохождении электрического тока через раствор,
содержащий заряженные ионы.
Прогнозировать продукты электролиза.
3.
Критерии оцениванияУчащийся достиг цели обучения, если:
Различает процессы электролиза растворов и расплавов
Определяет продукты электролиза водных растворов
Применяет правила конкуренции ионов в водных растворах
Называет катодные процессы, происходящие при электролизе
водных растворов электролитов
Называет анодные процессы, происходящие при электролизе
водных растворов электролитов
Записывает уравнение электролиза водных растворов
Определяет среду раствора
Записывает полуреакции окисления и восстановления
Проводит расчеты, связанные с электролизом
4.
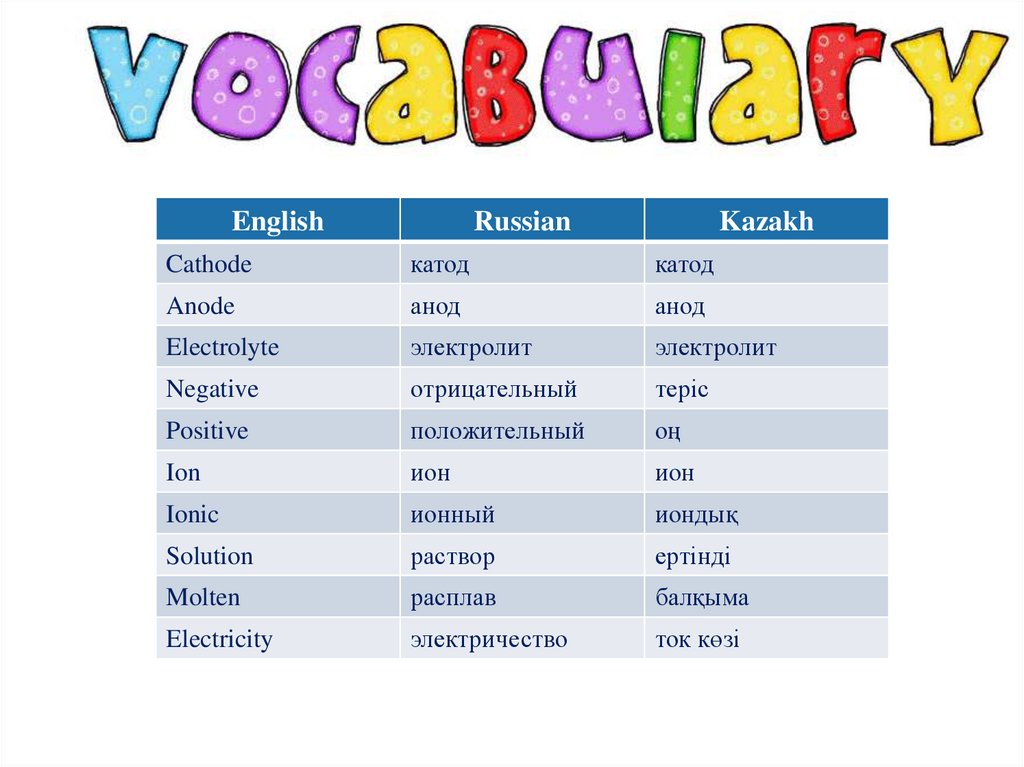
EnglishRussian
Kazakh
Cathode
катод
катод
Anode
анод
анод
Electrolyte
электролит
электролит
Negative
отрицательный
теріс
Positive
положительный
оң
Ion
ион
ион
Ionic
ионный
иондық
Solution
раствор
ертінді
Molten
расплав
балқыма
Electricity
электричество
ток көзі
5.
StarterКорзина идей
Подумай и ответь!
6.
StarterКорзина идей
1. Докажите, что электролиз – это окислительновосстановительный процесс
2.
Назовите
процесс,
идущий
на
катоде
при
электролизе
3. Назовите правила поведения катионов
4.Что такое анион? Назовите процесс, идущий на
аноде во время электролиза растворов
7.
Ответьте на вопросы, используя интерактивную доскуPadlet.com.
Назовите составные части
электролизера
Padlet.com.
https://padlet.com/uralbaeva_kar/w7bfuzvq1vmcfndz
8.
Ответьте на вопросы, используя интерактивную доскуPadlet.com.
What are the products of electrolysis?
Padlet.com.
https://padlet.com/uralbaeva_kar/rahaxowsxrpjfk9l
9.
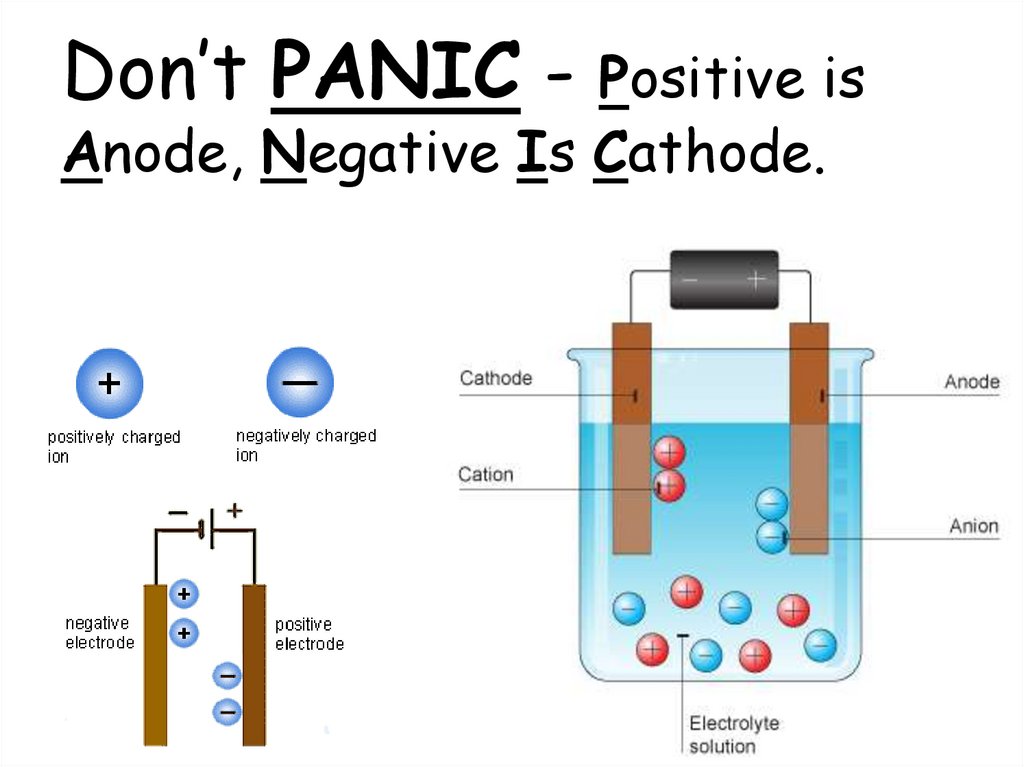
Don’t PANIC - Positive isAnode, Negative Is Cathode.
10.
Обучающее видео11.
Электролиз водного растворахлорида калия
KCl
(-)Катод
K+ + Cl-
Анод(+)
восстановление молекул воды: KOH окисление хлорид ионов
2H2O + 2e- = Н2↑ + 2ОН-
Cl- - e- = Cl0 ; 2Cl- = Cl02
Для нахождения коэффициентов используем электронно-ионный баланс
К(-) 2H2O + 2e- = Н2↑ + 2ОН- 1
А(+) 2Cl- - 2e- = Cl20 ;
1
2KCl + 2H2O электр. ток Н2↑ + Cl2 + 2KOH
12.
Электролиз водных растворов• Электролиз водных растворов солей сложнее
электролиза расплавленных солей, поскольку
ионы, образованные при диссоциации воды,
могут участвовать и в электродных реакциях.
Продукты электролиза водных растворов
электролитов часто сложно предугадать.
13.
Катодные процессыРазделим вытеснительный ряд металлов
на 3 части:
Правило №1.
Если металл в соли — неактивный (то есть стоит после
водорода в ряду стандартных электрохимических металлов),
то ион такого металла является более сильным окислителем,
чем ион водорода, и на катоде восстанавливается только
металл:
Men+ + nē → Me0
14.
Катодные процессыПравило №2.
Если металл в соли — активный (то есть расположен от Li+
до Al3+ включительно в ряду напряжений), то вместо
металла на катоде восстанавливается (разряжается) водород,
т.к. потенциал водорода намного больше. Протекает процесс
восстановления молекулярного водорода из воды, при этом
образуются ионы OH—, среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH—
15.
Катодные процессыПравило №3.
Если металл в соли – средней активности (между Al3+ и
Н+), то на катоде восстанавливается (разряжается) и
металл, и водород, так как потенциалы таких металлов
сравним с потенциалом водорода:
Men+ + nē → Me0
2H+2O +2ē → H20 + 2OH-
16.
Запомни правила на катоде!Вытеснительный ряд металлов
Li, K, Ca, Na, Mg, Mn, Zn, Fe, Ni, Sn,
Al
Pb
Men+ - не
Men+ +ne→Me0
восстанавливается
2H2O + 2e-→ H2 +2OH2H2O +2e-→H2+2OH-
H Cu, Hg, Ag, Pt,Au
2
Men+ +ne-→Me0
17.
Катодные процессы в растворах электролитовЭлектрохимический ряд напряжений металлов
Li, K, Ba, Ca, Na,
Mg, Al
Восстановление
молекул воды:
2H2O + 2e- = Н2↑
+ 2ОН-
Zn, Cr, Fe,
Cd, Co, Ni
1) Men+ + ne- =
Me0
2) 2H2O + 2e- = Н2↑
+ 2ОН-
Н Cu, Hg, Ag, Pt,
Au
восстановление
катионов
металлов:
Men+ + ne- =
Me0
18.
Анодные процессы• Процессы, происходящие на аноде, зависят от
природы анода. Аноды бывают растворимыми
(медь, серебро, цинк) и нерастворимыми
(платина и графит).
19.
Анодные процессыПравило №1.
Если на анод попадает бескислородный кислотный
остаток, то он окисляется до
свободного состояния (до степени окисления 0):
неМеn- – nē = неМе0
При электролизе растворов фторидов окисляться
будут именно молекулы воды, а не фторид-ионы!
2H2O-2 – 4ē → O02 + 4H+
20.
Анодные процессыПравило №2.
Если на анод попадает кислородсодержащий
кислотный остаток, либо фторид-ион, то окислению
подвергается вода с выделением молекулярного
кислорода:
2H2O-2 – 4ē → O02 + 4H+
21.
Анодные процессыПравило №3.
Если на анод попадает гидроксид-ион, то он
окисляется и происходит выделение молекулярного
кислорода:
4OH- – 4ē → O02 + 2H2O
22.
Это надо знать!Анод
Нерастворимый
Растворимый
Кислотный остаток Ac m-
Бескислородный
Кислородсодержащий
Окисление
4 OH- - 4e →O2 +
анионов (кроме
2H2O
фторидов)
Ac m- -me- → Ac0
Происходит окисление металлического
анода.
Men+ +ne- →Me0
23.
Анодные процессы в водных растворахАнионы кислотных остатков, АmБескислородные
- 2(Cl , Br , I , S и др., F
другие )
Окисление анионов
(кроме фтора)
Аm- - me- = А0
Кислородные
2( ОН , SO4 , NO3 ,
2CO3 др.) и F
В кислых и нейтральных
средах окисляются молекулы
воды:
2H2O – 4e- = O2↑ + 4H+
В щелочной среде:
4OH- - 4e- = O2↑ + 2H2O
24.
Изменение восстановительнойактивности анионов
Анионы по способности окисляться располагаются
в следующем порядке:
I-, Br-, S2-, Cl-, OH-, SO42-, NO3-, FВосстановительная активность анионов ослабевает.
25.
Электролиз водных растворов солейI. Активные металлы
А) металл и остаток бескислородных кислот
Б) металл и остаток кислородных кислот
C) гидроксид: активный металл и
гидроксид-ион
II. Металлы средней активности
А) металл (СА) и остаток бескислородных
кислот
Б) металл (СА) и остаток кислородных
кислот
C) гидроксид: металл (СА) и гидроксид-ион
26.
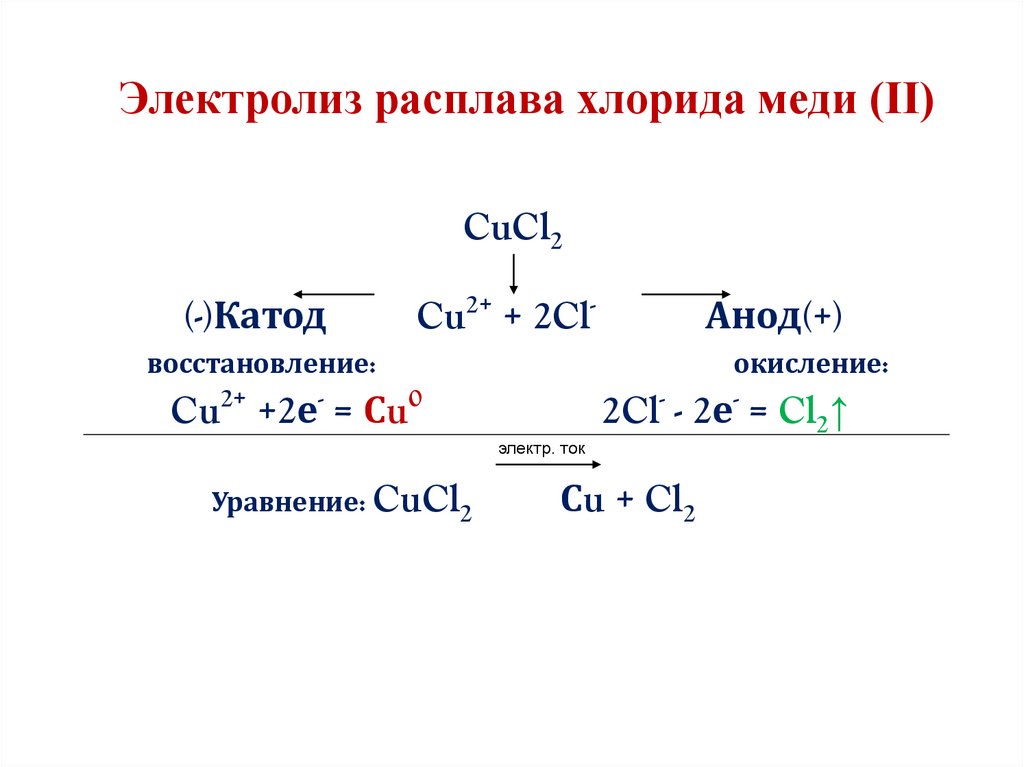
Электролиз расплава хлорида меди (ІІ)CuCl2
(-)Катод
Cu2+ + 2Cl-
Анод(+)
восстановление:
окисление:
Cu2+ +2е- = Сu0
электр. ток
Уравнение: CuCl2
2Cl- - 2е- = Cl2↑
Сu + Cl2
27.
Составьте 1вопрос к видео:28.
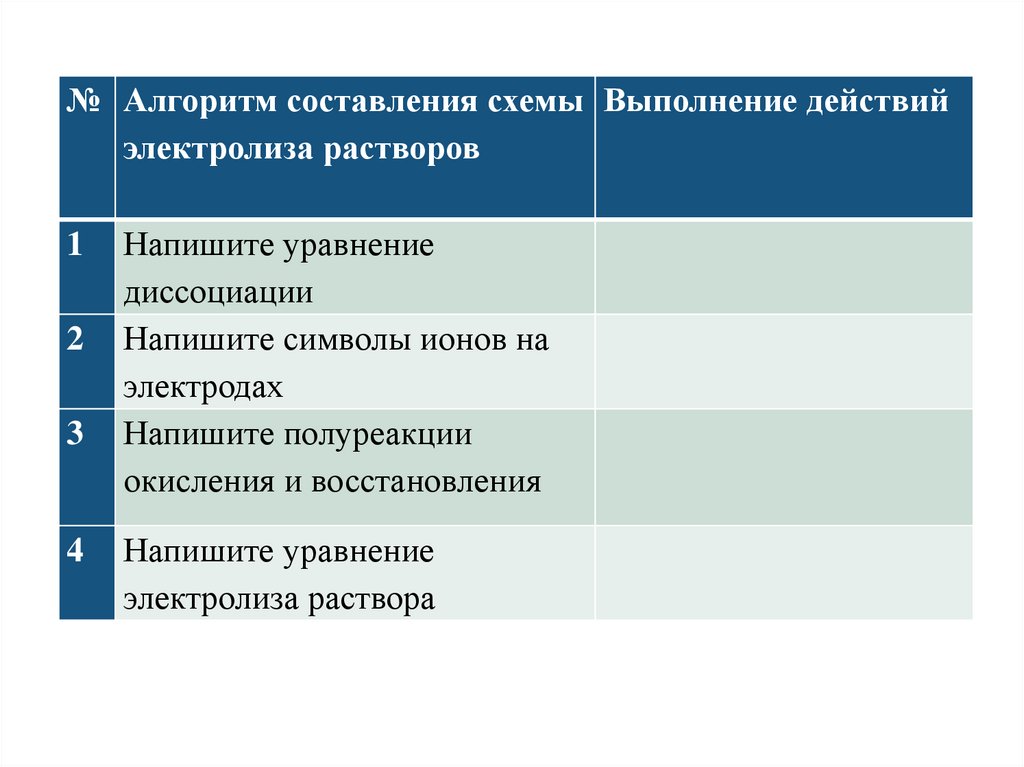
№ Алгоритм составления схемы Выполнение действийэлектролиза растворов
1
2
3
4
Напишите уравнение
диссоциации
Напишите символы ионов на
электродах
Напишите полуреакции
окисления и восстановления
Напишите уравнение
электролиза раствора
29.
Электролиз водного растворахлорида меди (ІІ)
CuSO4
Cu2+ + SO42-
(-)Катод
Анод(+)
H2SO4
Cu2+ + 2е- = Сu0
2H2O – 4e- = O2↑ + 4H+
К(-) Cu2+ + 2е- = Сu0
2
А(+) 2H2O – 4e- = O2↑ + 4H+ 1
электр. ток
2CuSO4 + 2H2O
2Cu + O2↑ + 2H2SO4
30.
• Электролиз водного раствора сульфата калия31.
Электролиз раствора сульфата калияК2SO4
(-)Катод
2К+ + SO42-
2H2O + 2e- = Н2↑ + 2ОНщелочная среда
электр. ток
2H2O
2H2↑ + O2↑
Анод(+)
2H2O – 4e- = O2↑ + 4H+
кислая среда
32.
Электролиз раствора хлорида натрия33.
Используя интерактивную доску Padlet.com. Выполнитезадания.
Напишите уравнения электролиза растворов
следующих солей:
Na2CO3, BaCl2, Li2SO4
Padlet.com.
https://padlet.com/uralbaeva_kar/rahaxowsxrpjfk9l
34.
Используя интерактивную доску Padlet.com.Решите задачу:
При электролизе водного раствора нитрата
серебра на аноде выделилось 5,6 л газа. Сколько
граммов металла образовалось на катоде?
Padlet.com.
https://padlet.com/uralbaeva_kar/rahaxowsxrpjfk9l
35.
Домашнее задание1. Напишите уравнение электролиза расплавов и
водных растворов: бромида меди, йодида калия,
сульфата ртути.
2. Рассчитайте массу серебра, выделившегося на
катоде, если известно, что в результате электролиза
водного раствора нитрата серебра на аноде
выделилось 6 г газообразного кислорода.
































 Химия
Химия








