Похожие презентации:
Характеристика кислорода и серы
1.
2.
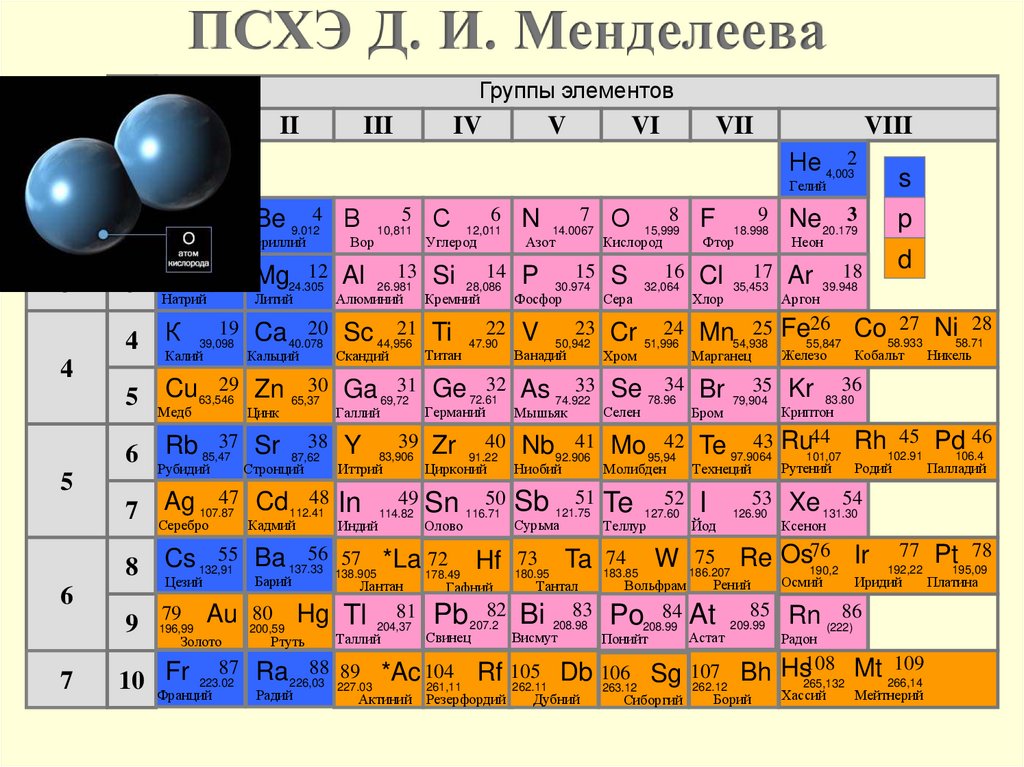
ПСХЭ Д. И. МенделееваГруппы элементов
I
1
1
2
2
3
3
4
4
5
6
5
7
III
IV
V
VI
VII
VIII
Не 4,0032
s
Li 6,9413 Be 9.0124 В 10,8115 С 12,0116 N 14.00677 О 15,9998 F 18.9989 Ne 20.1793
p
1
1,008
Водород
Литий
Гелий
Бериллий
Вор
Углерод
Азот
Кислород
Фтор
Неон
d
11 Mg 12 Al
13 Si
16 Cl 17 Ar 18
14 P
15 S
Na22,9898
24.305
26.981
32,064
39.948
28,086
30.974
35,453
Натрий
К
Литий
19
39,098
Калий
Алюминий
Кремний
Фосфор
Сера
Аргон
Хлор
22 V
23 Cr 24 Mn 25 Fe26 Co 27 Ni 28
20 Sc 21 Ti
Ca 40.078
58.933
58.71
47.90
50,942
55,847
44,956
51,996
54,938
Кальций
Скандий
Титан
Ванадий
Хром
Железо
Марганец
Кобальт
Никель
29 Zn 30 Ga 31 Ge 32 As 33 Se 34 Br 35 Kr 36
Cu 63,546
72.61
78.96
83.80
65,37
69,72
74.922
79,904
Медб
Цинк
Галлий
Германий
Мышьяк
Селен
Криптон
Бром
39 Zr 40 Nb 41 Mo 42 Te 43 Ru44 Rh 45 Pd 46
Rb 85,4737 Sr 87,6238 Y 83,906
102.91
106.4
101,07
97.9064
91.22
92.906
95,94
Рубидий
Стронций
Иттрий
Цирконий
Ниобий
Молибден
47 Cd 48 In
49 Sn 50 Sb 51 Te
52 I
Ag 107.87
112.41
121.75
114.82
116.71
127.60
Серебро
Кадмий
Индий
Олово
Сурьма
Теллур
Рутений
Технеций
53
Йод
126.90
Родий
Ксенон
8
9
196,99
Барий
Цезий
79
Лантан
Гафний
Тантал
Вольфрам
Рений
Палладий
54
Xe 131.30
55 Ba 56 57 *La 72 Hf 73 Ta 74 W 75 Re Os76 Ir
Cs 132,91
137.33 138.905
190,2
186.207
183.85
180.95
178.49
6
7
Н
II
Осмий
77
192,22
Иридий
82 Bi 83 Po 84 At
85 Rn 86
80 Hg Tl 81 Pb 207.2
Au 200,59
208.98
209.99
204,37
208.99
(222)
Золото
Ртуть
Таллий
Свинец
Висмут
Понийт
Астат
Радон
87 Ra 88 89 *Ac 104 Rf 105 Db 106 Sg 107 Bh Hs108 Mt 109
Fr 223.02
226,03 227.03
266,14
265,132
10 Франций
261,11
262.11
262.12
263.12
Радий
Хассий
Мейтнерий
Актиний
Резерфордий
Дубний
Сиборгий
Борий
78
Pt195,09
Платина
3.
Кислород как элемент1. Элемент кислород находится в VI группе, главной
подгруппе, II периоде, порядковый номер №8,
Ar = 16.
2. Строение атома:
+8О ) ) 1S2 2S2 2P4
26
валентность II, степень окисления -2
(редко +2; +1; -1).
3. Входит в состав оксидов, оснований, солей, кислот,
органических веществ, в том числе живых
организмов.
4.
ПСХЭ Д. И. МенделееваГруппы элементов
периоды ряды
I
1
1
2
2
3
3
II
32
III
IV
V
0
VI
VII
VIII
Характеристика
(16р+ + 16n0) 16e-
4
r (атома) – 0,104 нм
4
5
6
ЭО – 2,5
7
Неметалл
5
8
6
9
7
10
+16
Pd
5.
2HgOt
2 Hg + O2
6.
7.
Физические свойстваГаз - без цвета, вкуса и запаха;
в 100V H2O растворяется 3V O2 (н.у.);
t кип= -183 С;
t пл = -219 C;
При давлении 760 мм. рт.ст. и температуре
–183 С кислород сжижается
8.
9.
Получение кислорода2KMnO4 = K2MnO4 + MnO2 + O2
2H 2 O2
MnO2
2 H 2 O + O2
Кислород поддерживает горение
10.
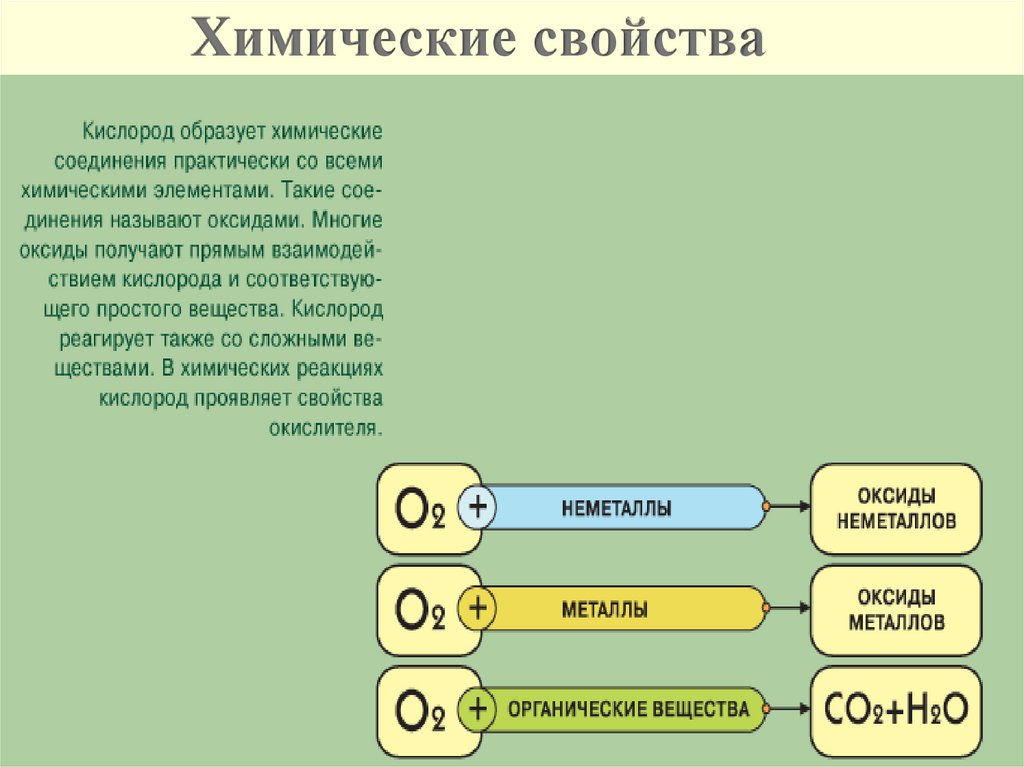
Химические свойства11.
Применение кислорода• Находит широкое применение в
медицине и промышленности.
• При высотных полётах лётчиков
снабжают специальными
приборами с кислородом.
• При многих лёгочных и
сердечных заболеваниях, а
также при операциях дают
вдыхать кислород из
кислородных подушек.
• Кислородом в баллонах
снабжают подводные лодки.
• Жидкий кислород применяют в
реактивных двигателях, в
автогенной сварке и резке
металлов, даже под водой.
12.
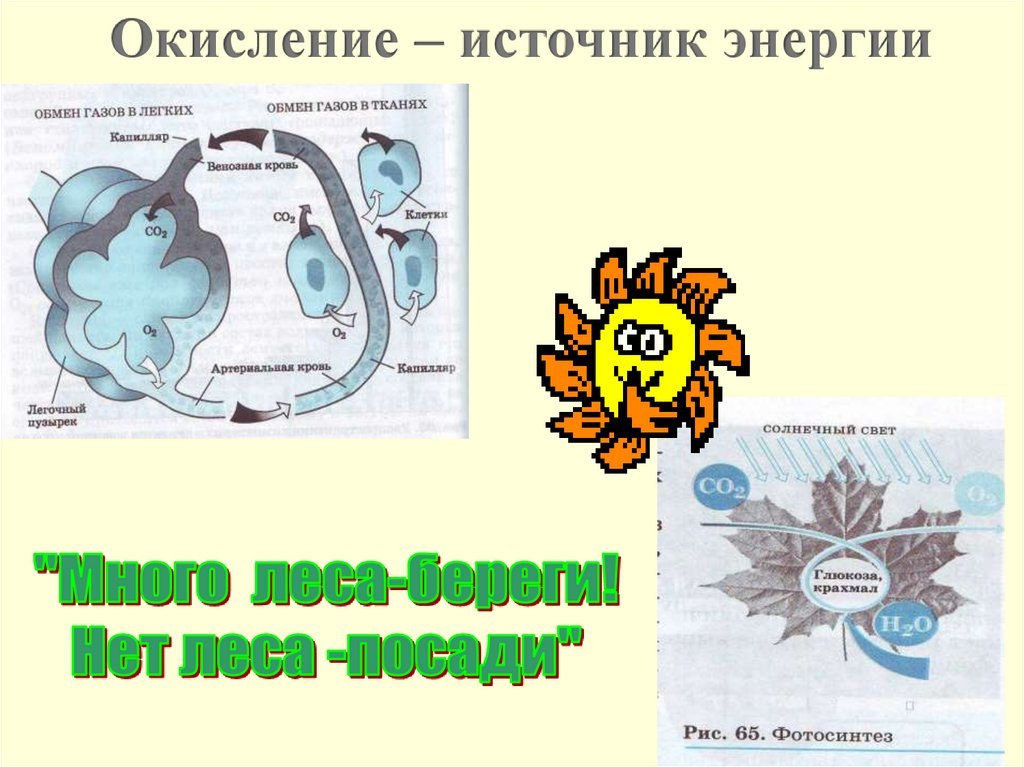
Окисление – источник энергии13.
газтяжелее
мало растворим
элементами
оксиды
14.
15.
Сера1. Электронное строение
32
0
+16
286
3d2
3p4
3S2
2p6
2S2
1S2
Проявляет степени
окисления: -2 +2 +4 +6
Краткая электронная
запись:
16.
Сера2. Аллотропия
Существует несколько аллотропных модификаций
серы.
пластическая
ромбическая моноклинная
Причина аллотропии в разном строении кристаллов.
Наиболее устойчивой модификацией является
ромбическая сера.
17.
Сера3. Физические свойства
Сера – твердое кристаллическое
вещество желтого цвета.
Не растворима в воде.
Мелкие кристаллы серы не
смачиваются водой, плавают на
поверхности (флотация).
Сера хорошо растворима в
сероуглероде
18.
Сера4. Нахождение в природе
Самородная
Сульфидная
Сульфатная
19.
Сера в организмеСера — один из биогенных элементов.
Сера входит в состав некоторых аминокислот
(цистеин, метионин), витаминов (биотин,
тиамин), ферментов. Сера участвует в
образовании третичной структуры белка
(формирование дисульфидных мостиков).
Человек содержит примерно 2 г серы на 1 кг
своего веса.
















 Химия
Химия