Похожие презентации:
Положение кислорода и серы в ПСХЭ. Строение. Свойства
1.
2.
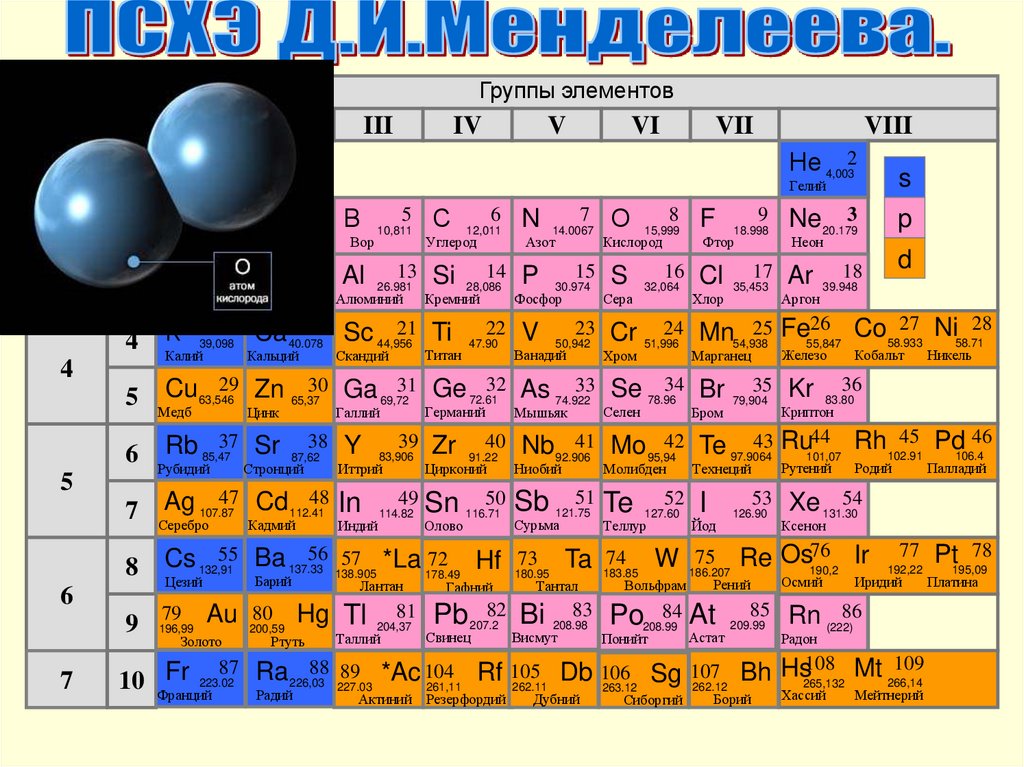
Группы элементовI
1
1
2
2
3
3
4
4
5
6
5
7
III
IV
V
VI
VII
VIII
Не 4,0032
s
Li 6,9413 Be 9.0124 В 10,8115 С 12,0116 N 14.00677 О 15,9998 F 18.9989 Ne 20.1793
p
1
1,008
Водород
Литий
Гелий
Бериллий
Вор
Углерод
Азот
Кислород
Фтор
Неон
d
11 Mg 12 Al
13 Si
16 Cl 17 Ar 18
14 P
15 S
Na22,9898
24.305
26.981
32,064
39.948
28,086
30.974
35,453
Натрий
К
Литий
19
39,098
Калий
Алюминий
Кремний
Фосфор
Сера
Аргон
Хлор
22 V
23 Cr 24 Mn 25 Fe26 Co 27 Ni 28
20 Sc 21 Ti
Ca 40.078
58.933
58.71
47.90
50,942
55,847
44,956
51,996
54,938
Кальций
Скандий
Титан
Ванадий
Хром
Железо
Марганец
Кобальт
Никель
29 Zn 30 Ga 31 Ge 32 As 33 Se 34 Br 35 Kr 36
Cu 63,546
72.61
78.96
83.80
65,37
69,72
74.922
79,904
Медб
Цинк
Галлий
Германий
Мышьяк
Селен
Криптон
Бром
39 Zr 40 Nb 41 Mo 42 Te 43 Ru44 Rh 45 Pd 46
Rb 85,4737 Sr 87,6238 Y 83,906
102.91
106.4
101,07
97.9064
91.22
92.906
95,94
Рубидий
Стронций
Иттрий
Цирконий
Ниобий
Молибден
47 Cd 48 In
49 Sn 50 Sb 51 Te
52 I
Ag 107.87
112.41
121.75
114.82
116.71
127.60
Серебро
Кадмий
Индий
Олово
Сурьма
Теллур
Рутений
Технеций
53
Йод
126.90
Родий
Ксенон
8
9
196,99
Барий
Цезий
79
Лантан
Гафний
Тантал
Вольфрам
Рений
Палладий
54
Xe 131.30
55 Ba 56 57 *La 72 Hf 73 Ta 74 W 75 Re Os76 Ir
Cs 132,91
137.33 138.905
190,2
186.207
183.85
180.95
178.49
6
7
Н
II
Осмий
77
192,22
Иридий
82 Bi 83 Po 84 At
85 Rn 86
80 Hg Tl 81 Pb 207.2
Au 200,59
208.98
209.99
204,37
208.99
(222)
Золото
Ртуть
Таллий
Свинец
Висмут
Понийт
Астат
Радон
87 Ra 88 89 *Ac 104 Rf 105 Db 106 Sg 107 Bh Hs108 Mt 109
Fr 223.02
226,03 227.03
266,14
265,132
10 Франций
261,11
262.11
262.12
263.12
Радий
Хассий
Мейтнерий
Актиний
Резерфордий
Дубний
Сиборгий
Борий
78
Pt195,09
Платина
3.
1. Элемент кислород находится в VI группе, главнойподгруппе, II периоде, порядковый номер №8,
Ar = 16.
2. Строение атома:
+8О ) ) 1S2 2S2 2P4
26
валентность II, степень окисления -2
(редко +2; +1; -1).
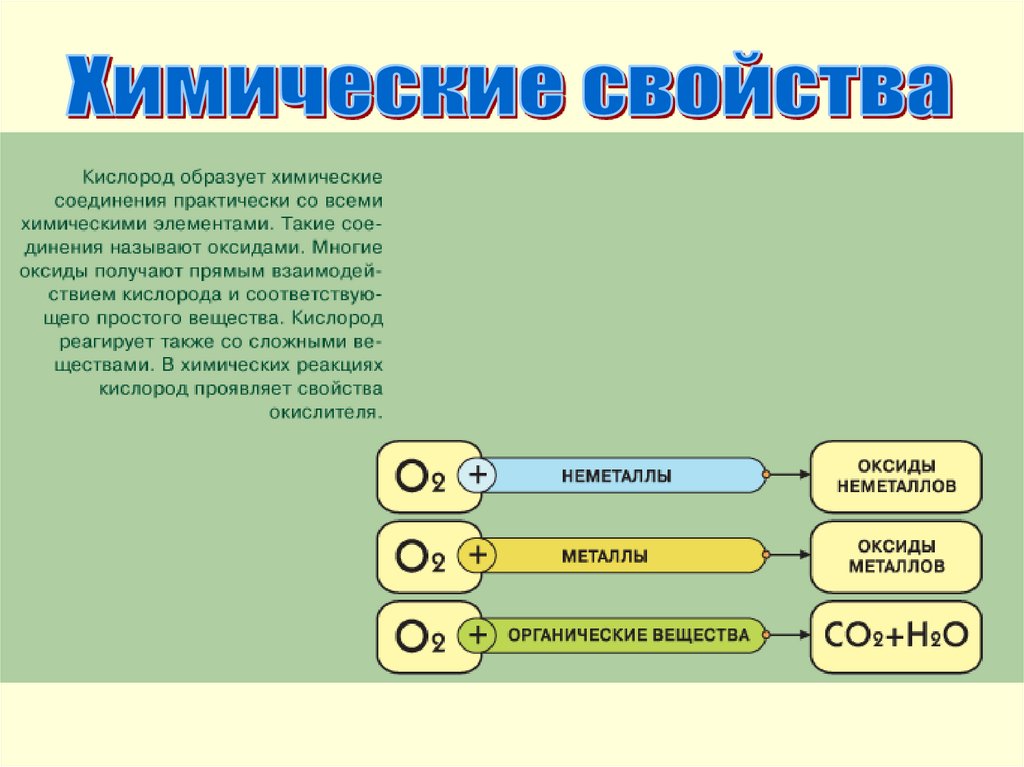
3. Входит в состав оксидов, оснований, солей, кислот,
органических веществ, в том числе живых организмов.
4.
Периодическая система химических элементов Д.И.МенделееваГруппы элементов
периоды ряды
I
1
1
2
2
3
3
II
32
III
IV
V
0
VI
VII
VIII
Характеристика
(16р+ + 16n0) 16e-
4
r (атома) – 0,104 нм
4
5
6
ЭО – 2,5
7
Неметалл
5
8
6
9
7
10
+16
Подробнее…
Pd
5.
Газ - без цвета, вкуса и запаха; в 100V H2O растворяется3V O2 (н.у.);
t кип= -183 С; t пл = -219 C; d по воздуху = 1,1.
При давлении 760 мм. рт.ст. и температуре
–183 С кислород сжижается
6.
2KMnO4 = K2MnO4 + MnO2 + O22H 2 O2
MnO2
2 H 2 O + O2
7.
8.
• Находит широкое применениев медицине и
промышленности.
• При высотных полётах
лётчиков снабжают
специальными приборами с
кислородом.
• При многих лёгочных и
сердечных заболеваниях, а
также при операциях дают
вдыхать кислород из
кислородных подушек.
• Кислородом в баллонах
снабжают подводные лодки.
• Жидкий кислород применяют
в реактивных двигателях, в
автогенной сварке и резке
металлов, даже под водой.
9.
газтяжелее
мало растворим
элементами
оксиды
10.
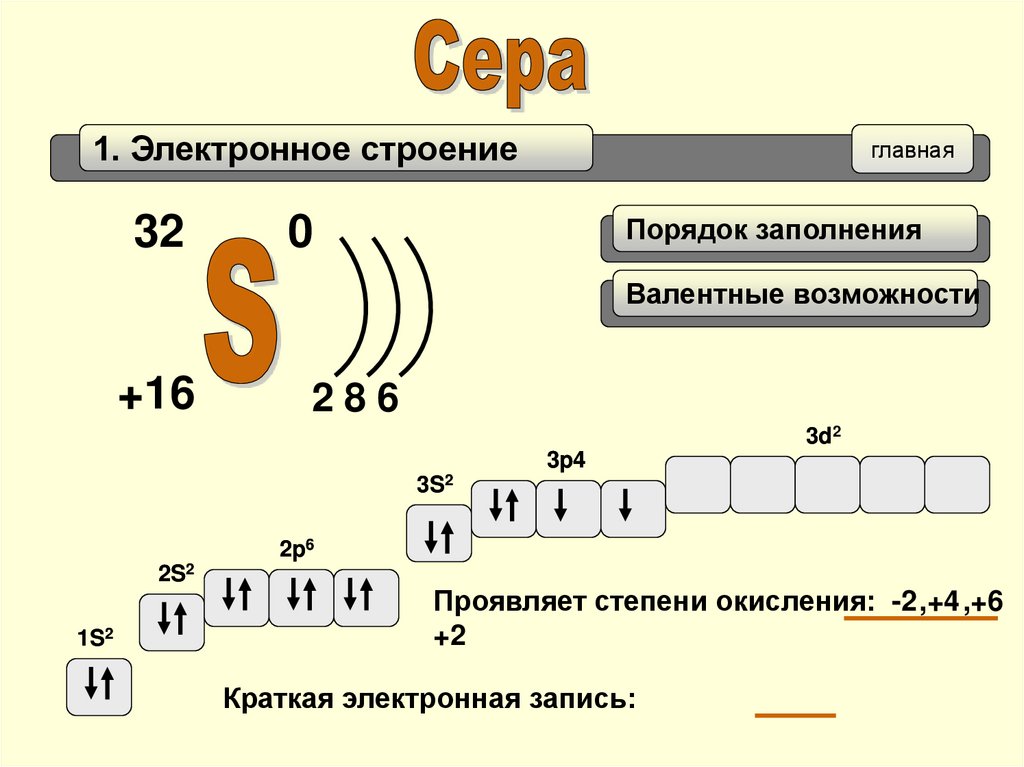
1. Электронное строение32
главная
Порядок заполнения
0
Валентные возможности
+16
286
3d2
3p4
3S2
2p6
2S2
1S2
Проявляет степени окисления: -2 ,+4 ,+6
+2
Краткая электронная запись:
11.
2. Аллотропияглавная
Существует несколько аллотропных
модификаций серы.
ромбическая моноклинна пластическа
я
я
Причина аллотропии в разном строении
кристаллов.
Наиболее устойчивой модификацией является
ромбическая сера.
12.
3. Физические свойстваСера – твердое
кристаллическое
вещество желтого цвета.
Не растворима в воде.
Мелкие кристаллы серы не
смачиваются водой, плавают
на поверхности (флотация).
Сера хорошо растворима в
сероуглероде.
главная
13.
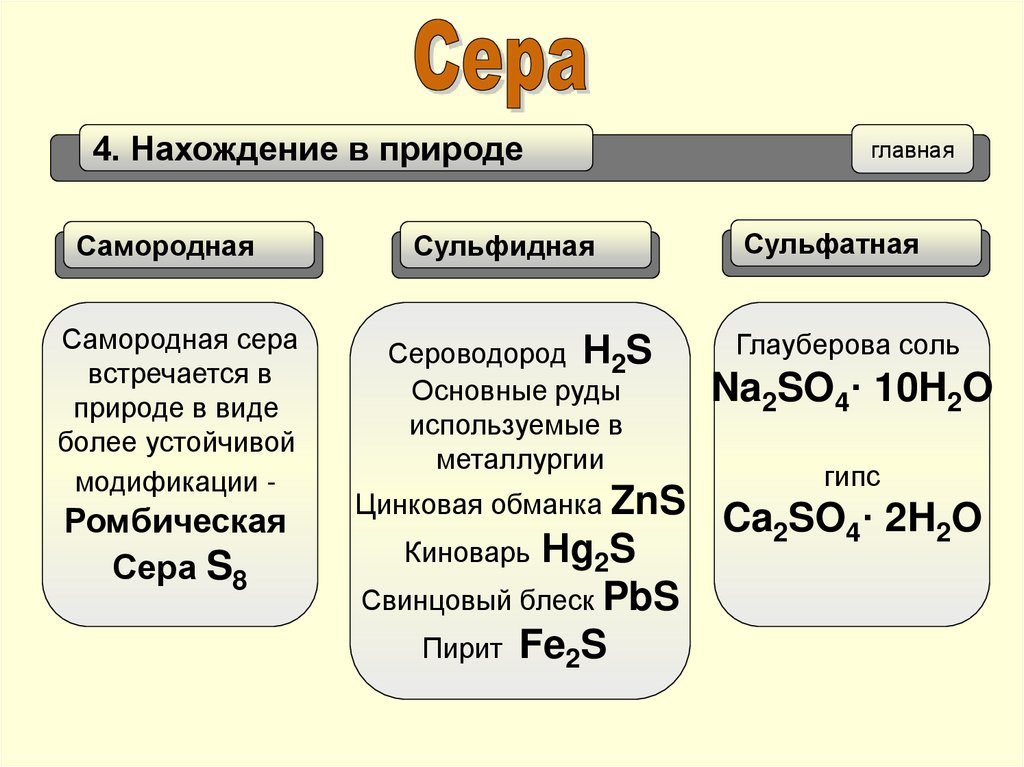
4. Нахождение в природеглавная
Самородная
Сульфидная
Сульфатная
Самородная сера
встречается в
природе в виде
более устойчивой
модификации -
Сероводород Н2S
Основные руды
используемые в
металлургии
Глауберова соль
Ромбическая
Сера S8
Цинковая обманка ZnS
Киноварь Нg2S
Свинцовый блеск PbS
Пирит Fe2S
Na2SO4· 10H2O
гипс
Ca2SO4· 2H2O
14.
Сера в организмеСера — один из биогенных элементов.
Сера входит в состав некоторых аминокислот
(цистеин, метионин), витаминов (биотин,
тиамин), ферментов. Сера участвует в
образовании третичной структуры белка
(формирование дисульфидных мостиков).
Человек содержит примерно 2 г серы на 1 кг
своего веса.










 Химия
Химия