Похожие презентации:
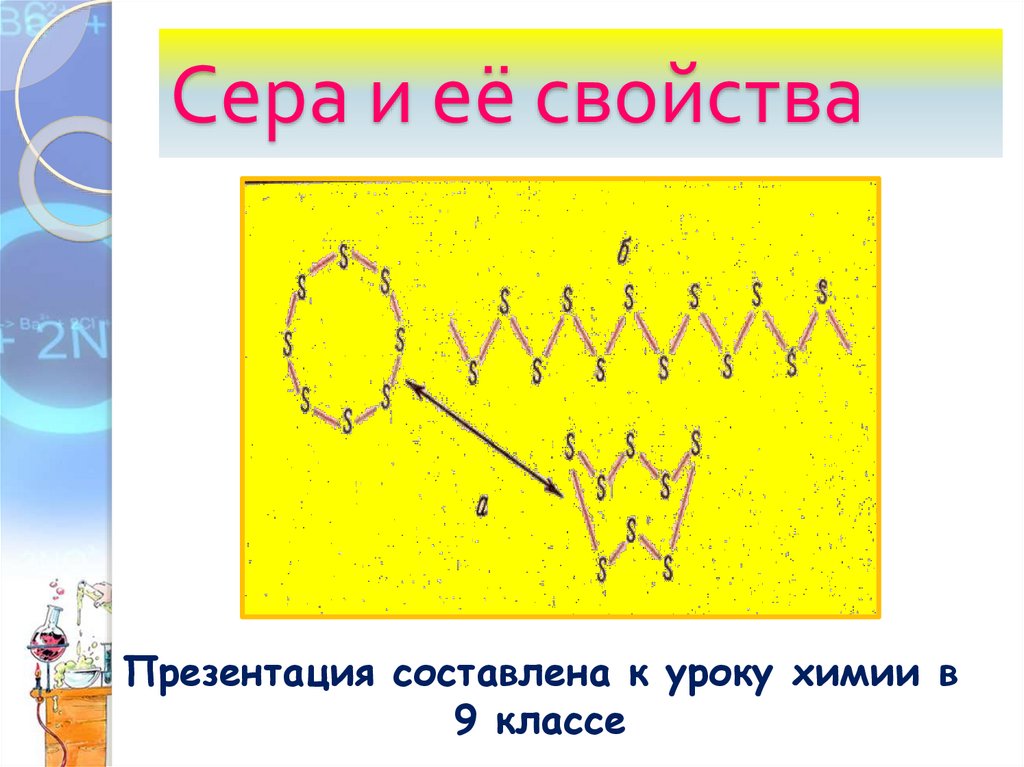
Сера и её свойства
1.
Сера и её свойстваПрезентация составлена к уроку химии в
9 классе
2.
Визитка химическогоэлемента.
Химический знак - S
Порядковый номер – 16
Аr - 32.066
Sulfur
Период - III
32.066
Группа – V I
3s23p4
Подгруппа – главная
Электронная формула атома –
S
1s22s22p63s23p4
Радиус атома – 0.104 нм.
Электроотрицательность – 2.58
16
2
8
6
3.
+8Телур
Te
+52
Поло
ний
Po
+84
2 8 6
))))
4s24p4
2 8 18 6
))))) 5s 5p
2
4
2 8 18 18 6
)))))) 6s 6p
2 8 18 32 18 6
2
4
Окислительные свойства
Se
+34
3s23p4
Электроотрицательность
)))
s
Селен
2s22р4
2 6
+16
Сера
))
Неметаллические свойства
О
Радиус атома
Кисло
род
4.
32+16
2 8 6
1s2
2s2
2p6
3s2
3p4
3d0
Валентные возможности- II (примеры
соединений: SCl2 H2S)
IV (SO2)
VI (SO3)
5.
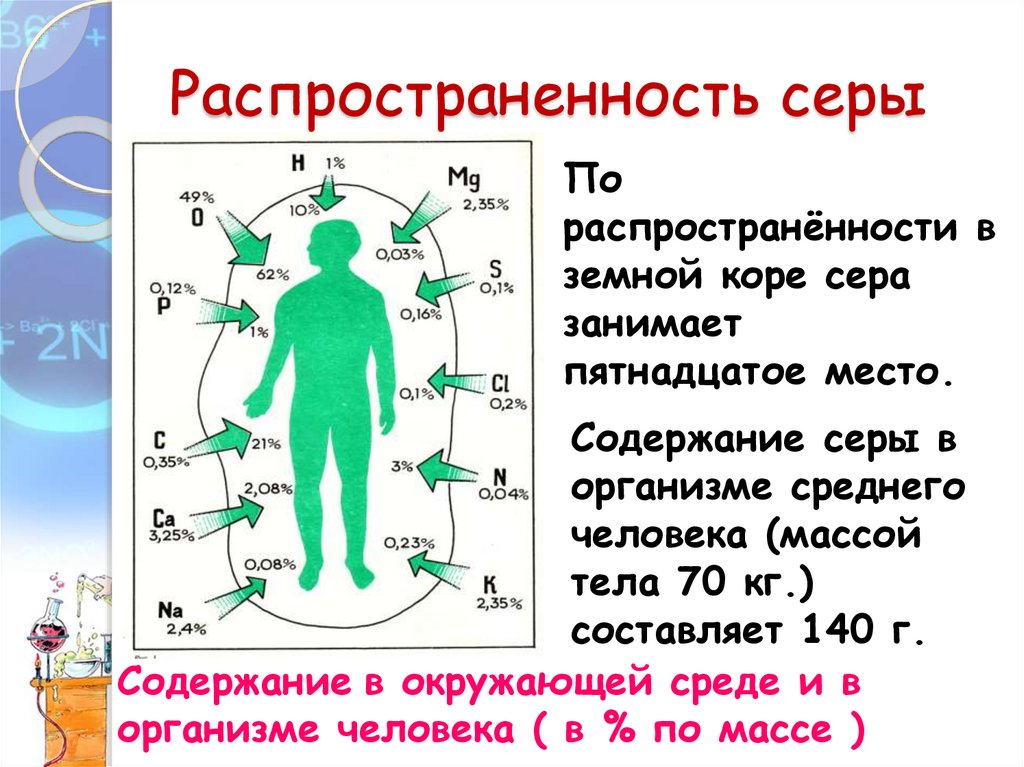
Распространенность серыПо
распространённости в
земной коре сера
занимает
пятнадцатое место.
Содержание серы в
организме среднего
человека (массой
тела 70 кг.)
составляет 140 г.
Содержание в окружающей среде и в
организме человека ( в % по массе )
6.
Нахождение серы в природе.Сера в природе
Самородная
сера -S
Киноварь
HgS
Сульфиды
Пирит –FeS2
Сульфаты
ГипсСаSO4*2H2O
Мирабилит –
Na2SO4*10H2O
Горькая сольMgSO4*7H2O
Халькопирит
CuFeS2
7.
Аллотропные модификации серы.1. Ромбическая сера устойчива
при комнатной
температуре
2. Моноклинная сера –
образуется при
медленном охлаждении
расплава
ромбической серы.
3. Пластическая сера –
резиноподобная масса,
состоящая из полимерных
цепочек, образуется при
быстром охлаждении
расплава ромбической серы.
8.
9.
— твердое агрегатноесостояние
— желтого цвета
— не растворима в воде
— не смачивается водой
(
ация)
— растворяется в
органических
растворителях
10.
Химические свойства серыS – окислитель
S + 2е- = S-2
1.Взаимодействие с
металлами
Сu + S = CuS
2Al + 3S = Al2S3
2.Взаимодействие с
водородом
H2 + S = H2S
11.
Химические свойства серы.S – восстановитель
S – 2e- = S+2
1.Взаимодействие
с кислородом
S + O2= SO2
S - 4e- = S+4
S - 6e- = S+6
2.Взаимодействие
с галогенами
3.Взаимодействие с
кислотами –
окислителями
S+ Cl2= SCl2
S + 3F2= SF6
S+ 2Н2SО4=3SO2+2H2O
Концентрированная.
12.
13.
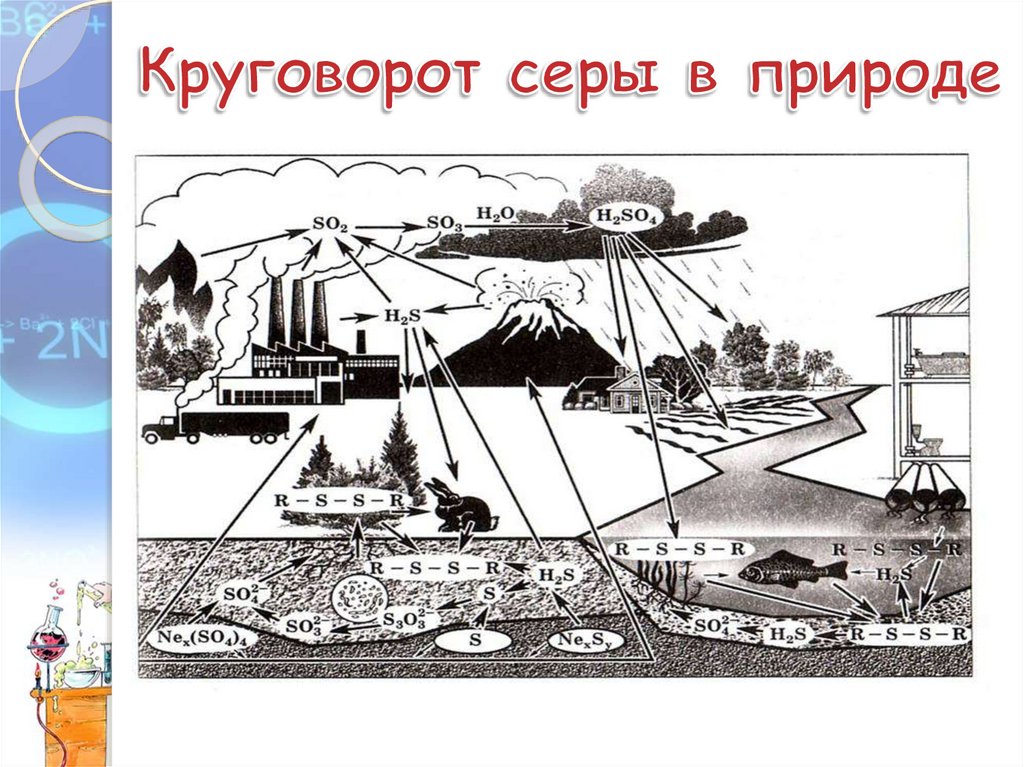
Кто есть кто на данномсемейном портрете?
14.
15.
п.26 прочитатьНаписать уравнения реакций для
перехода.
Реакции № 1, 2, 5 разобрать как
окислительно-восстановительные:
1
S
MgS
2
SO2
3
4
H2S
5











 Химия
Химия