Похожие презентации:
Химическая термодинамика. Растворы. Законы Рауля, Генри, Коновалова
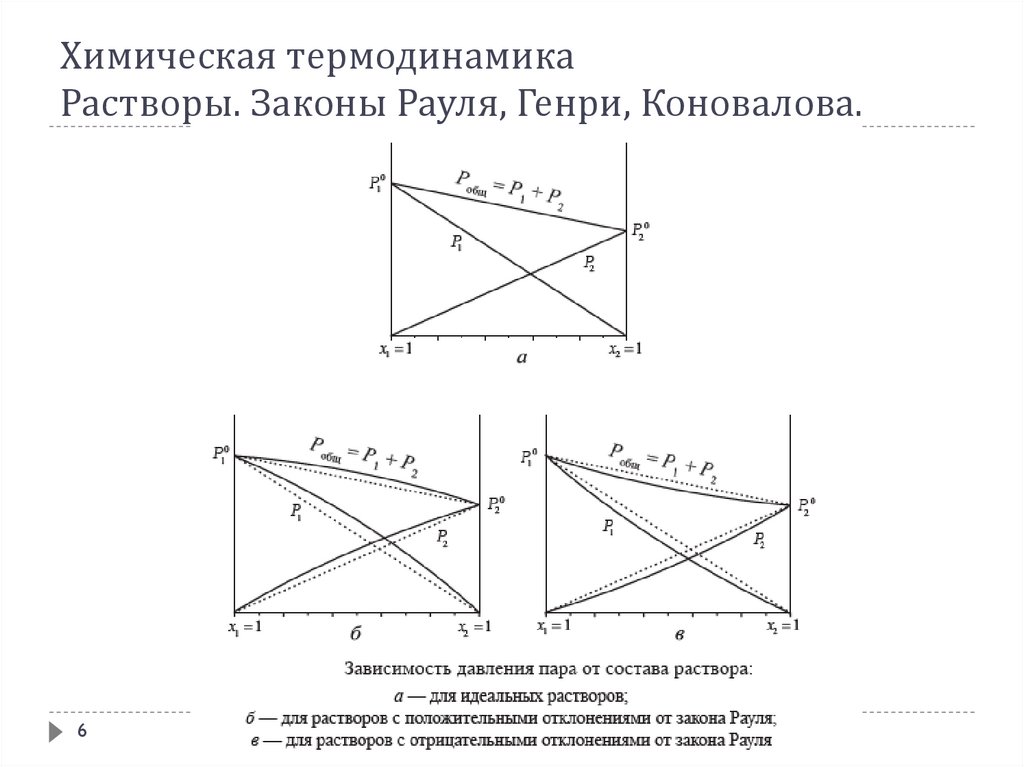
1. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
12. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
23. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
34. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
45. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
56. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
67. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
78. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
89. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
910. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
1011. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
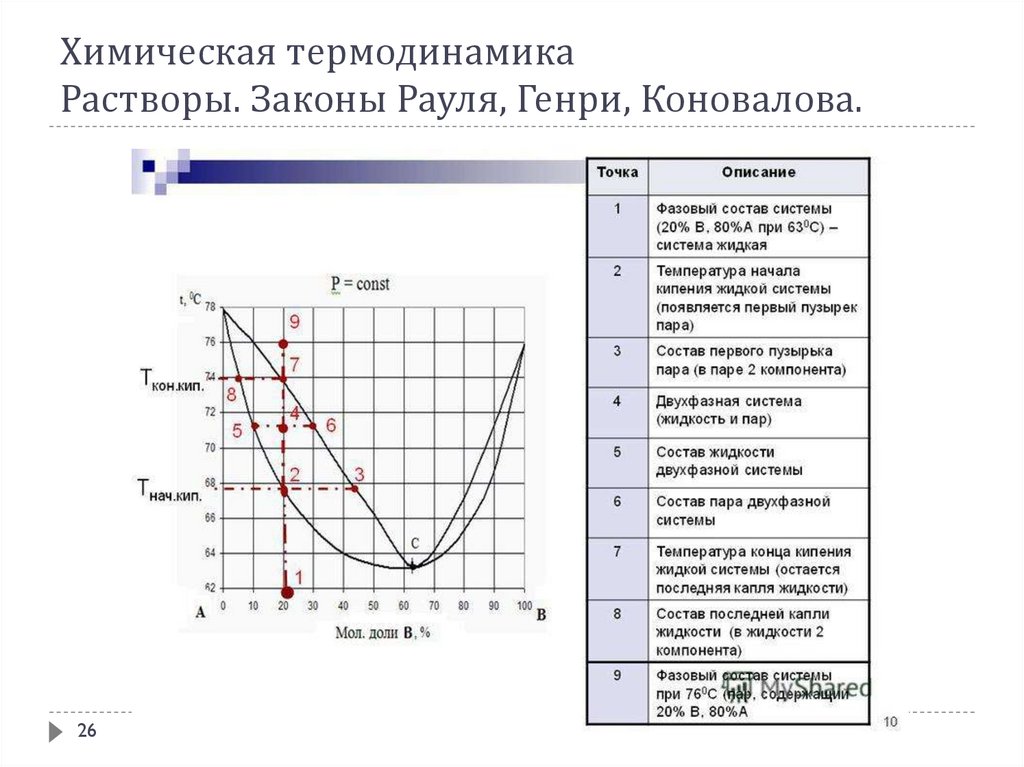
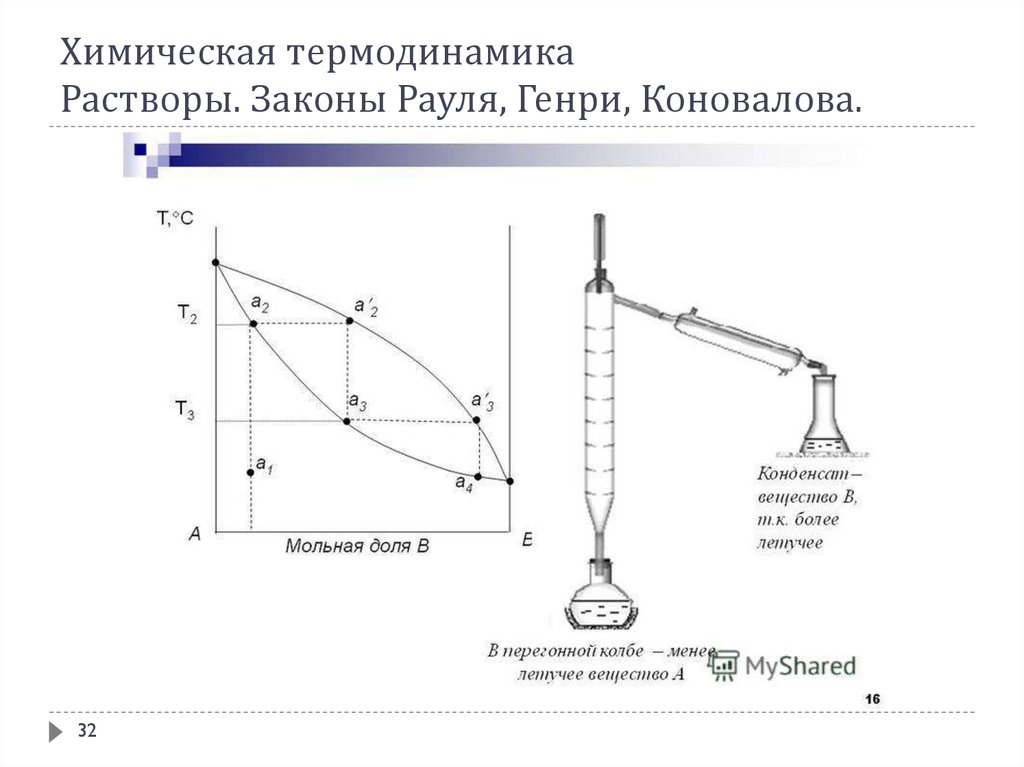
Любые жидкости, как чистые, так и смеси, закипают тогда, когда давлениепара над ними становится равным атмосферному давлению. Чистые
жидкости кипят при постоянной температуре, являющейся характерной
константой при каждом данном давлении – при своей температуре кипения
Ткип. Это обусловлено тем, что пар над кипящей чистой жидкостью имеет тот
же состав и теплота испарения жидкости равна теплоте конденсации пара.
Если температура кипения измерена при стандартных условиях, т. е. при
нормальном атмосферном давлении, то она называется нормальной
температурой кипенияданного вещества Токип.
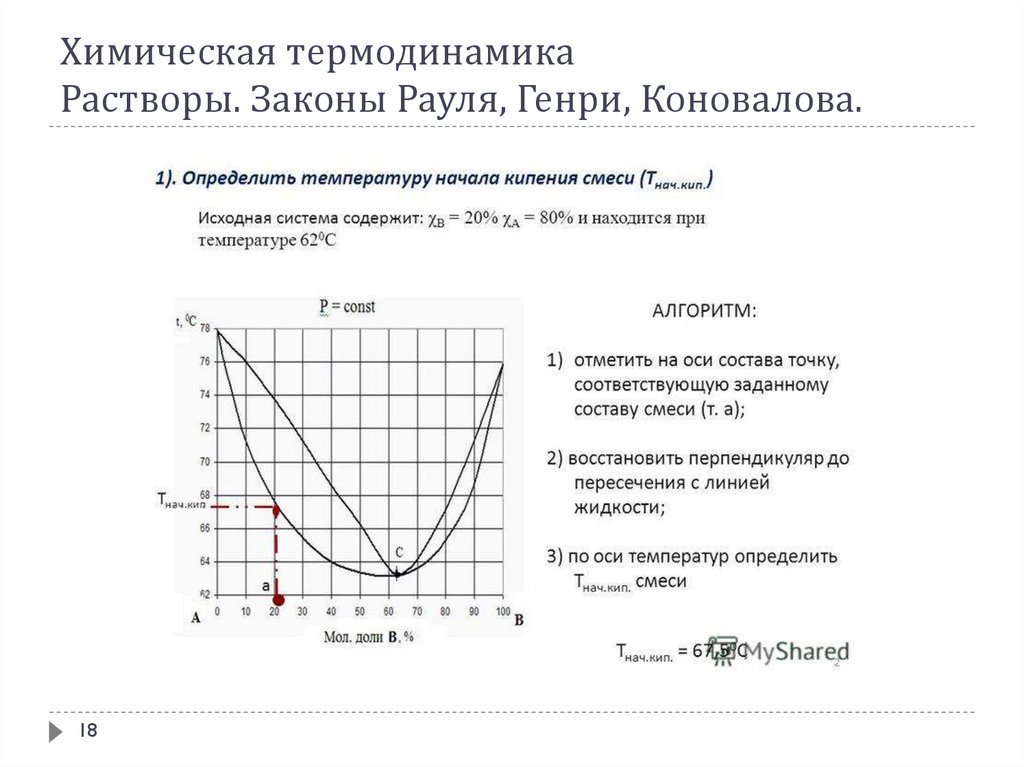
Растворы же в большинстве случаев при кипении ведут себя иначе. Так как
состав пара над раствором отличается от состава жидкости и к тому же
непрерывно изменяется при выкипании жидкой фазы, то кипение происходит
не при фиксированной температуре, а в некотором интервале температуры.
11
12. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
1213. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
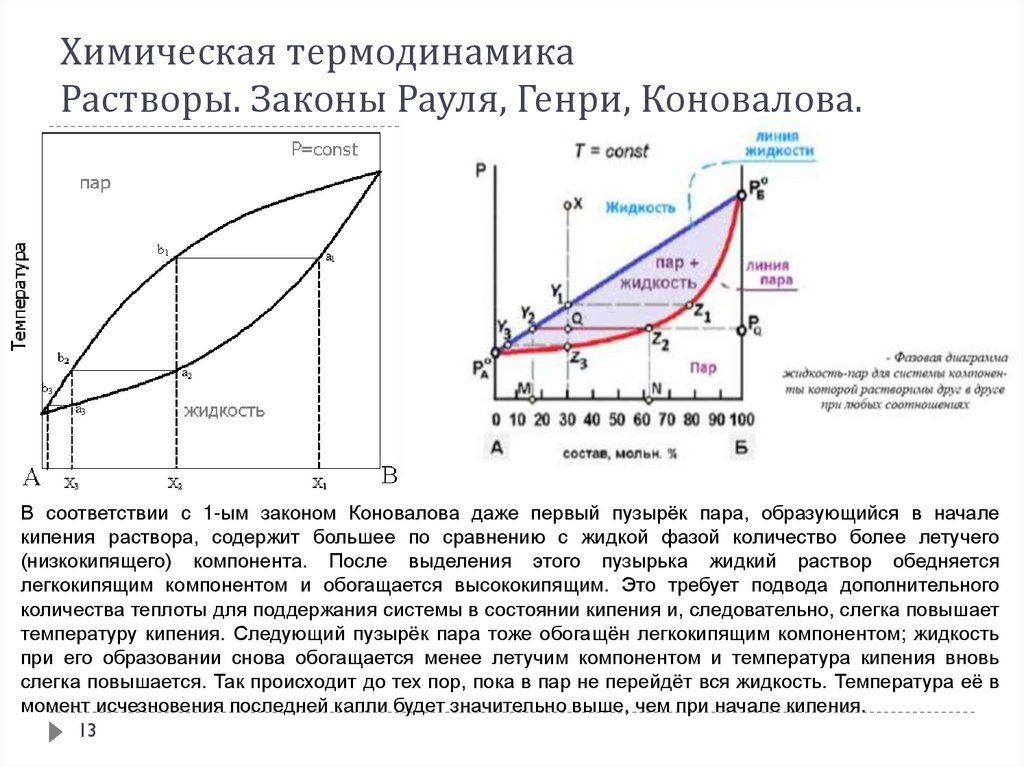
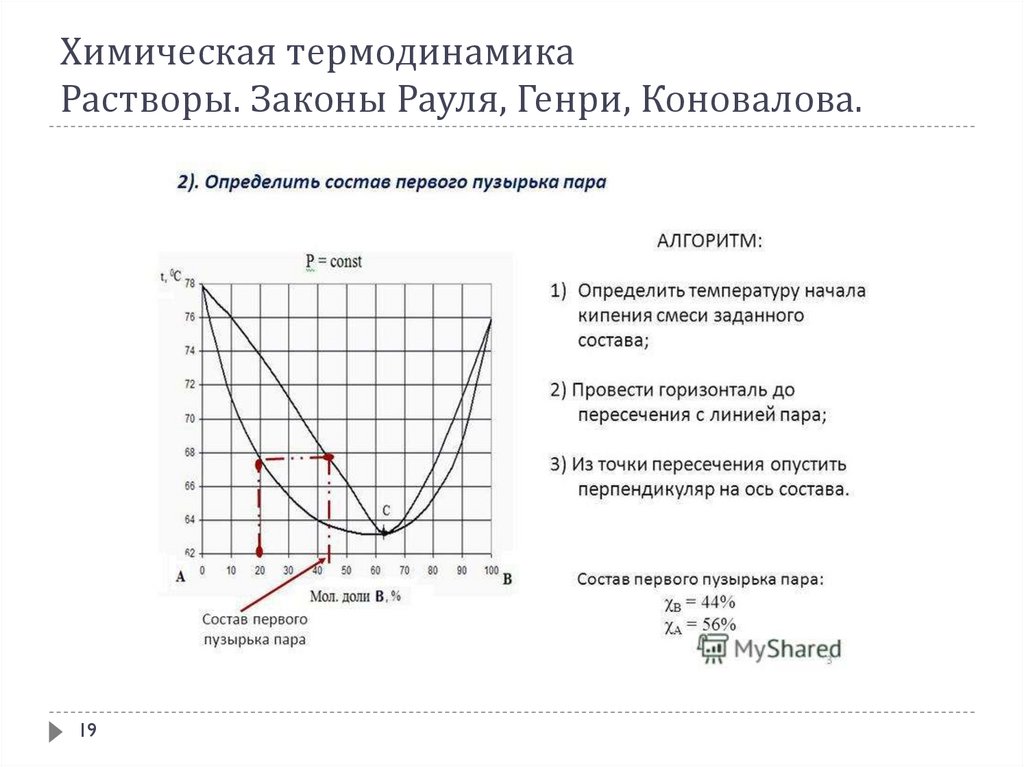
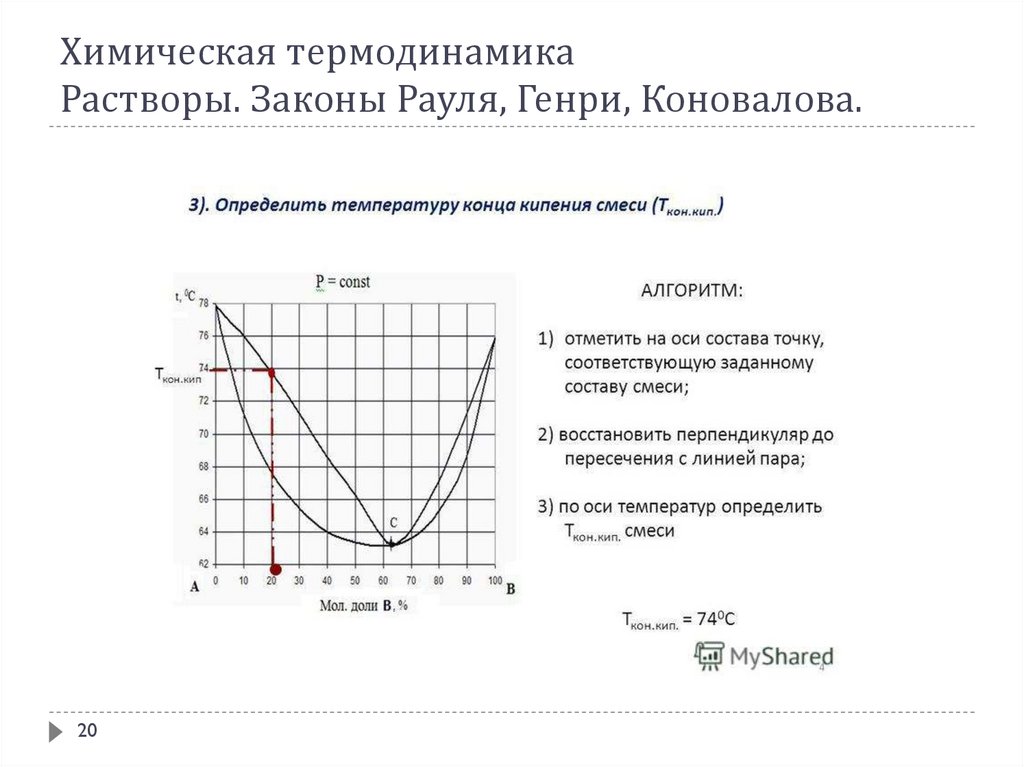
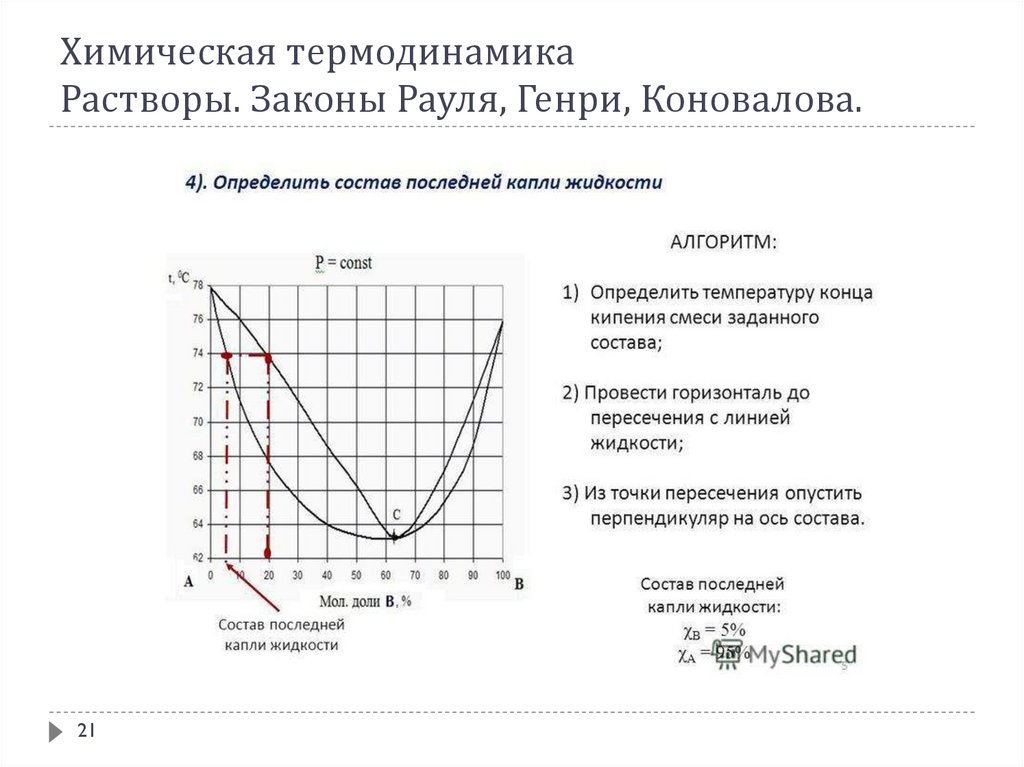
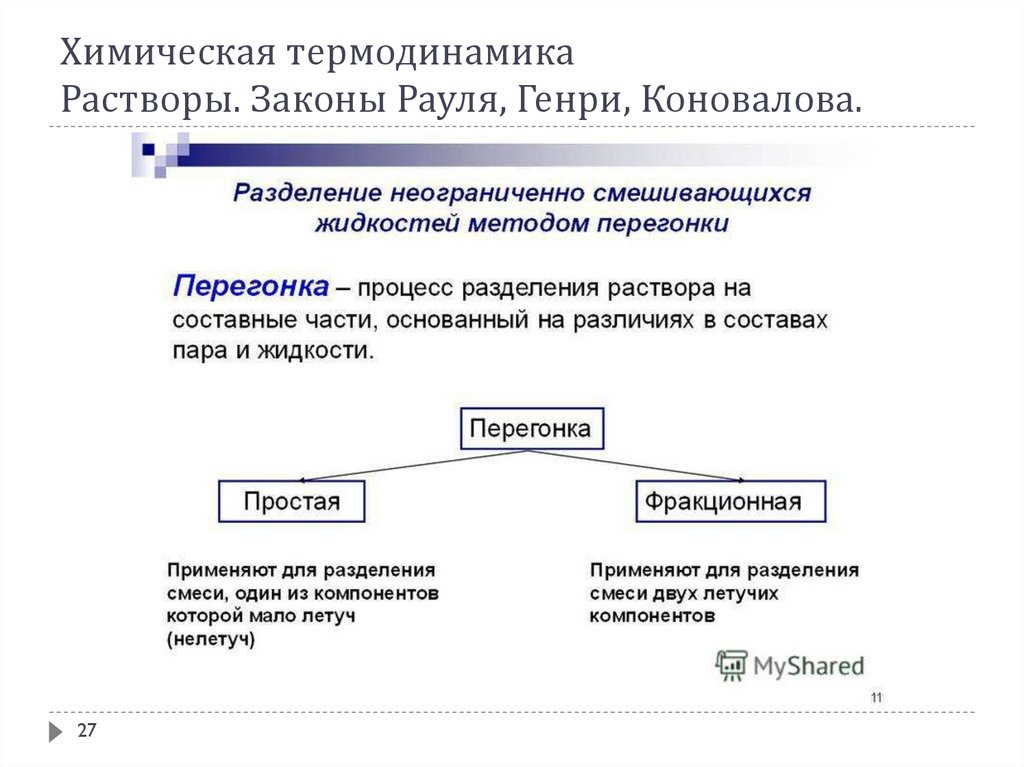
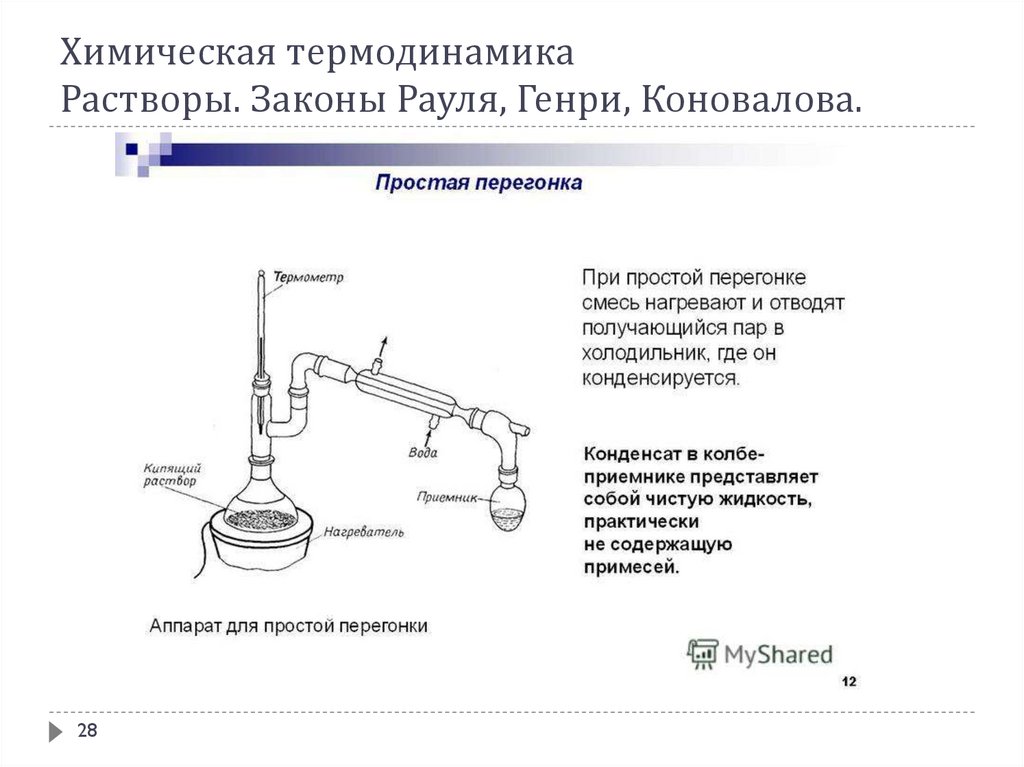
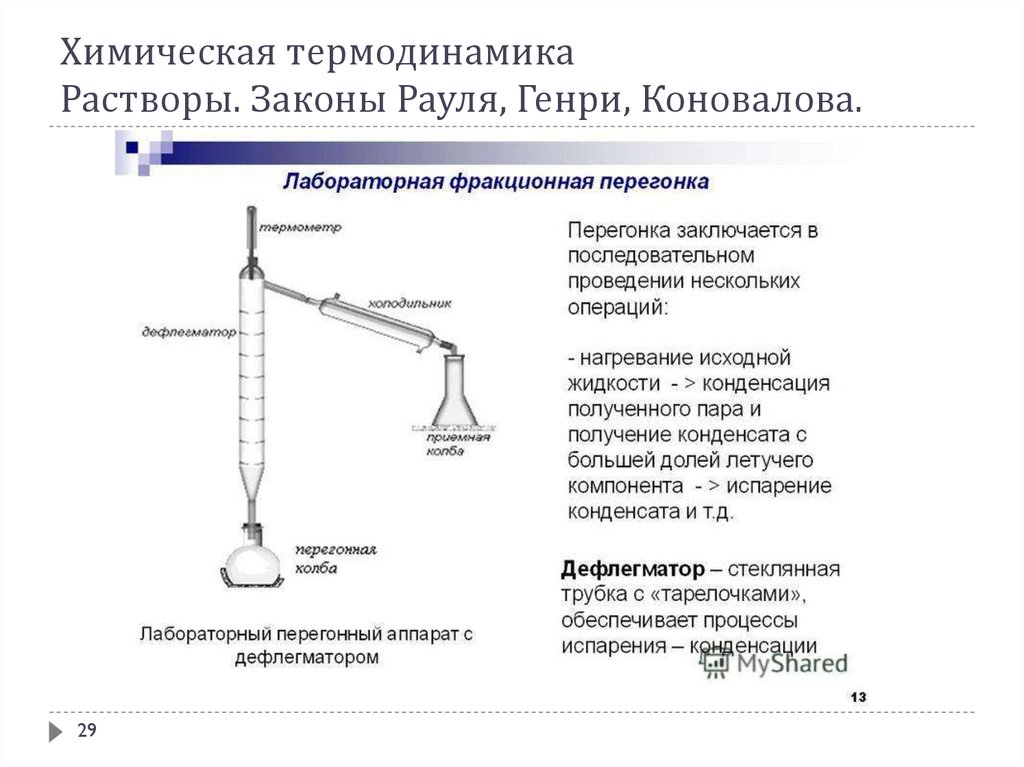
В соответствии с 1-ым законом Коновалова даже первый пузырёк пара, образующийся в началекипения раствора, содержит большее по сравнению с жидкой фазой количество более летучего
(низкокипящего) компонента. После выделения этого пузырька жидкий раствор обедняется
легкокипящим компонентом и обогащается высококипящим. Это требует подвода дополнительного
количества теплоты для поддержания системы в состоянии кипения и, следовательно, слегка повышает
температуру кипения. Следующий пузырёк пара тоже обогащён легкокипящим компонентом; жидкость
при его образовании снова обогащается менее летучим компонентом и температура кипения вновь
слегка повышается. Так происходит до тех пор, пока в пар не перейдёт вся жидкость. Температура её в
момент исчезновения последней капли будет значительно выше, чем при начале кипения.
13
14. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
1415. Химическая термодинамика Растворы. Законы Рауля, Генри, Коновалова.
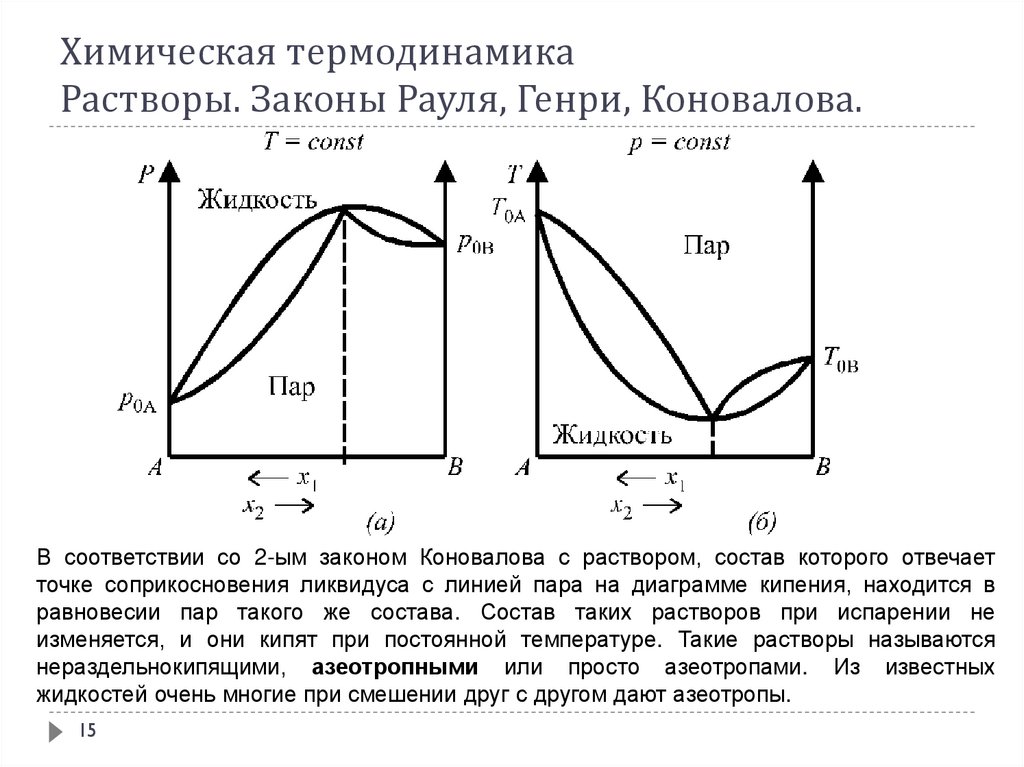
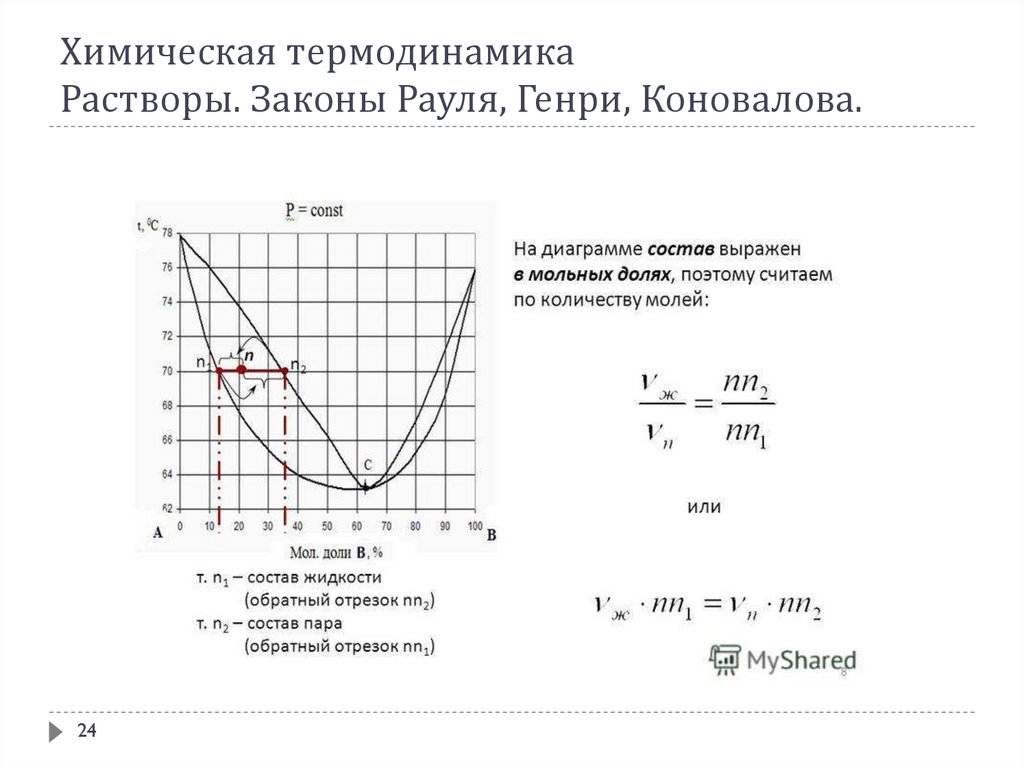
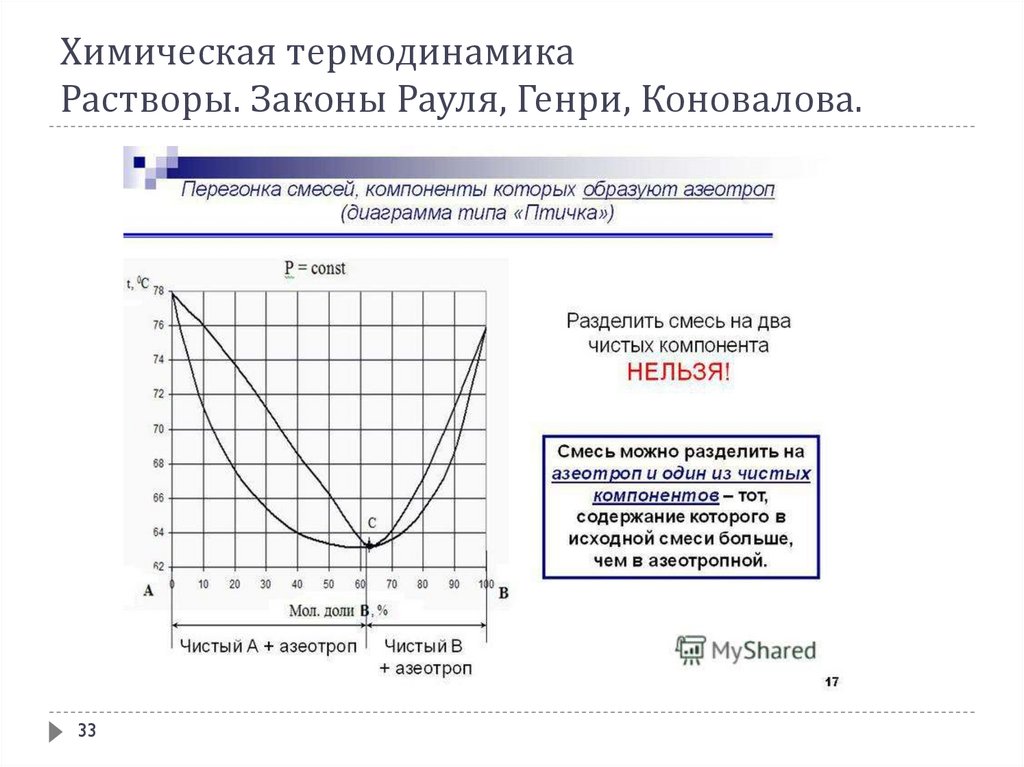
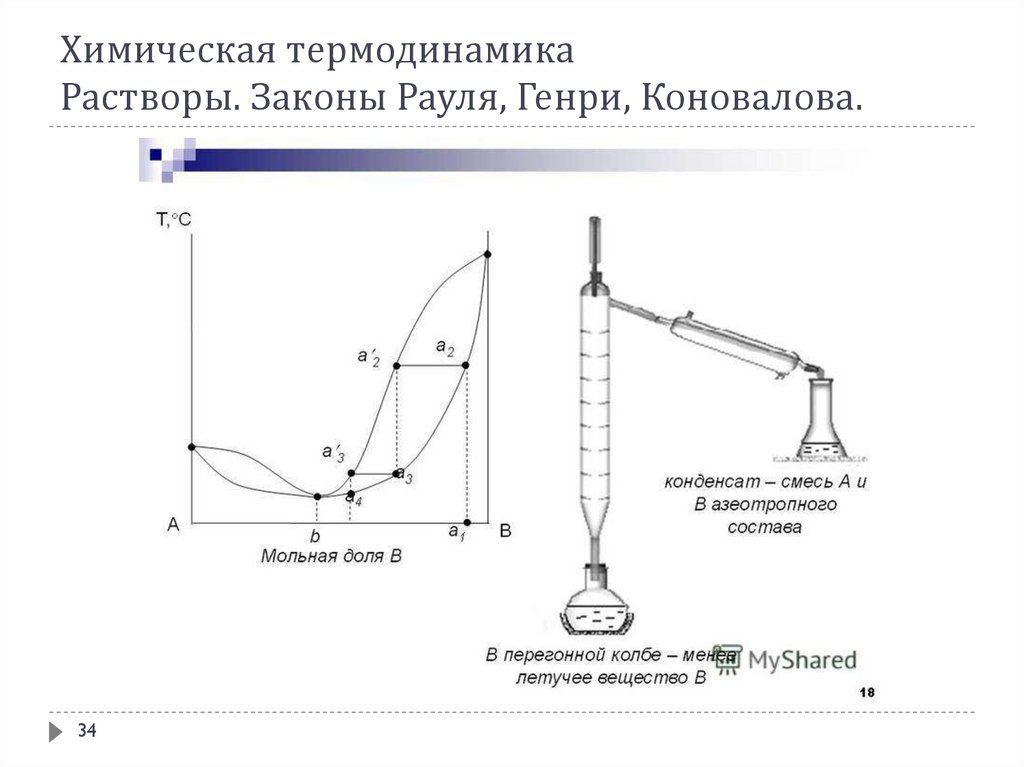
В соответствии со 2-ым законом Коновалова с раствором, состав которого отвечаетточке соприкосновения ликвидуса с линией пара на диаграмме кипения, находится в
равновесии пар такого же состава. Состав таких растворов при испарении не
изменяется, и они кипят при постоянной температуре. Такие растворы называются
нераздельнокипящими, азеотропными или просто азеотропами. Из известных
жидкостей очень многие при смешении друг с другом дают азеотропы.
15























 Химия
Химия








