Похожие презентации:
Кислоти. Фізичні властивості кислот
1.
Кислоти.Фізичні
властивості
кислот
2.
Приклади органічних кислотУ щавлі є щавлева кислота
У лимонах міститься лимонна і
аскорбінова кислоти (вітамін С)
Кисле молоко містить
молочну кислоту
у яблуках – яблучна
При
бродінні
виноградного
соку
Мурахи виприскують крапельки
утворюється оцтова кислота
їдкої мурашиної кислоти
3.
Що таке кріпатураhttps://www.youtube.com/wat
ch?v=WPzi2UqOe34&ab_chan
nel=%D0%9D%D0%B0%D1%83
%D1%87%D0%BF%D0%BE%D0
%BA
4.
Кислоти – це складні речовини, до складу яких входятьодин або декілька атомів Гідрогену і кислотний залишок
ІІ
Н2 SO4
атоми
Гідрогену
кислотний
залишок
Валентність кислотного залишку дорівнює
кількості атомів Гідрогену!
5.
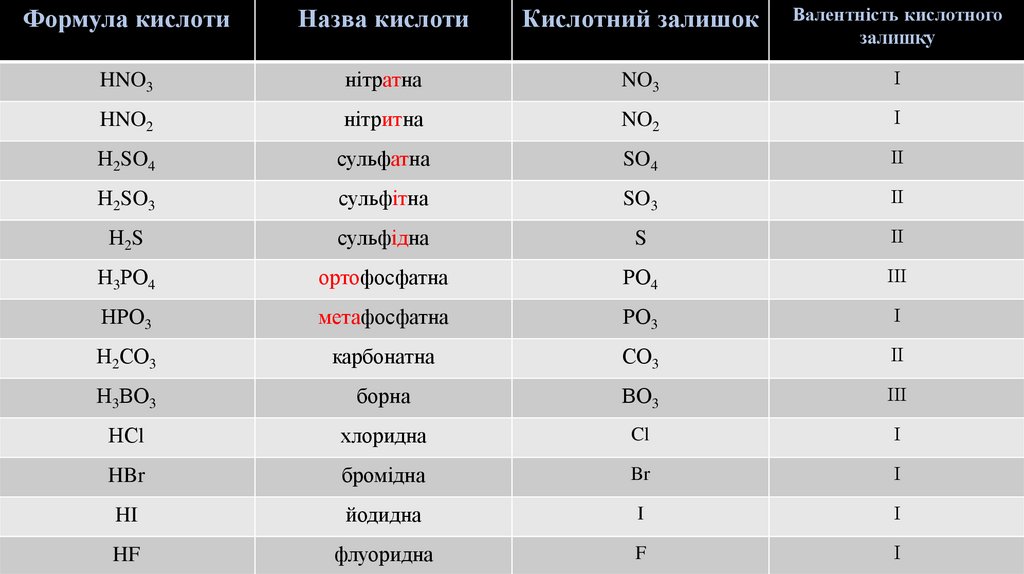
Формула кислотиНазва кислоти
Кислотний залишок
Валентність кислотного
залишку
HNO3
нітратна
NO3
І
HNO2
нітритна
NO2
І
Н2SO4
сульфатна
SO4
ІІ
Н2SO3
сульфітна
SO3
ІІ
Н2S
сульфідна
S
ІІ
Н3РО4
ортофосфатна
РО4
ІІІ
НРО3
метафосфатна
РО3
І
Н2СО3
карбонатна
СО3
ІІ
Н3ВО3
борна
ВО3
ІІІ
НСl
хлоридна
Cl
І
HBr
бромідна
Br
І
HI
йодидна
I
І
HF
флуоридна
F
І
6.
Як визначити валентність центрального атома?1. Знаходимо число одиниць
валентності атомів Гідрогену,
помноживши валентність Гідрогену
на число атомів Гідрогену.
2. Аналогічно находимо число одиниць
валентності атомів Оксигену.
3.Знайдемо різницю числа одиниць
валентності атомів.
7.
Структурна формула - формула, що схематично показуєпорядок сполучення атомів у молекулі
Як написати структурну формулу кислоти?
1.Записуємо символ центрального атома.
2. Приєднати до нього атоми Гідрогену
через атоми Оксигену.
3. Інші атоми Оксигену
з’єднати із центральним
атомом подвійними зв’язками.
Н2 SO4
8.
Класифікація кислотЗа вмістом атомів Оксигену кислоти бувають:
безоксигенові
оксигеновмісні
(розчини деяких газів у воді)
(продукти взаємодії
кислотного оксиду з водою)
HCl
HF
Н2S
Н2SO4
Н3РО4
Н2СО3
9.
Класифікація кислотЗа кількістю атомів Гідрогену кислоти бувають:
одноосновні двохосновні трьохосновні
HNO3
НРО3
НСl
HBr
HI
HF
Н2SO4
Н2SO3
Н2СO3
Н2S
Н3РО4
10.
Фізичні властивості кислот1. Кислоти бувають рідинами і
твердими речовинами
HNO3
Н2SO4
Н3РО4
Н2SiО3
Н3ВО3
11.
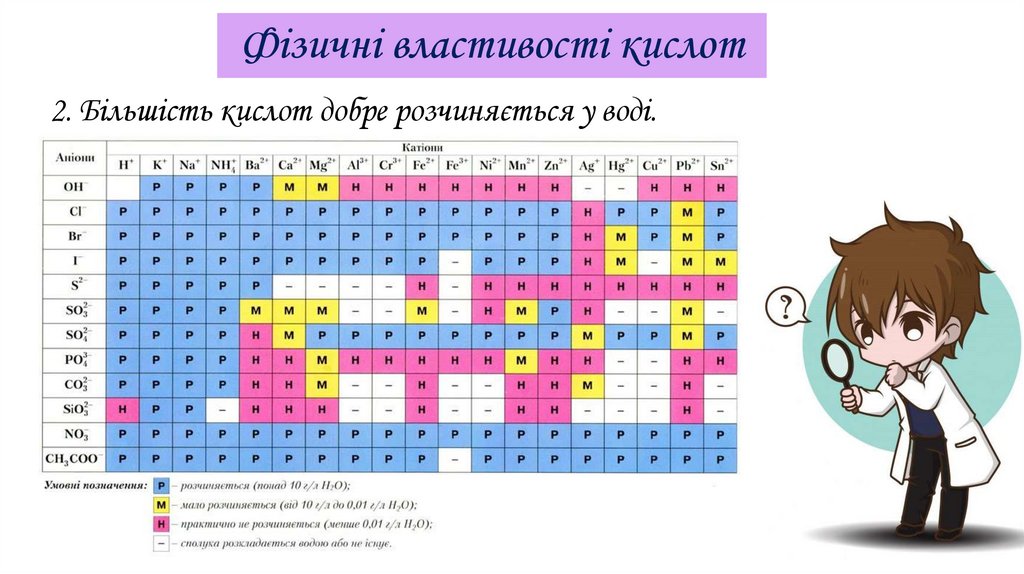
Фізичні властивості кислот2. Більшість кислот добре розчиняється у воді.
12.
Фізичні властивості кислот3. Водні розчини кислот відзначаються кислим
смаком, руйнують рослинні і тваринні тканини.
4. Кислоти кислі нас смак.
Індикатори – складні речовини, що змінюють
своє забарвлення у присутності кислот
лакмус
кислота
метилоранж
У присутності
кислоти лакмус і
метиловий
оранжевий стають
червоними
При потраплянні на шкіру або
слизові оболонки з’являються
хімічні опіки
13.
Властивості кислот зумовленінаявністю у їхньому складі атомів Гідрогену!
За силою відщеплення від молекули позитивно
заряджених йонів Гідрогену розрізняють типи кислот:
14.
15.
Поширення і значення неорганічних кислотКислоти входять до
складу засобів для
чищення сантехніки
Газована вода утворюється
завдяки розчиненню в ній
вуглекислого газу – це розчин
карбонатної кислоти
У шлунку міститься розчин
хлоридної кислоти
Кока-кола містить розчин
ортофосфатної кислоти
16.
Поширення і значення неорганічних кислотУ результаті виверження вулканів і викидів
промислових підприємств у повітря надходять
оксиди, які спричинюють утворення
кислотних дощів
17.
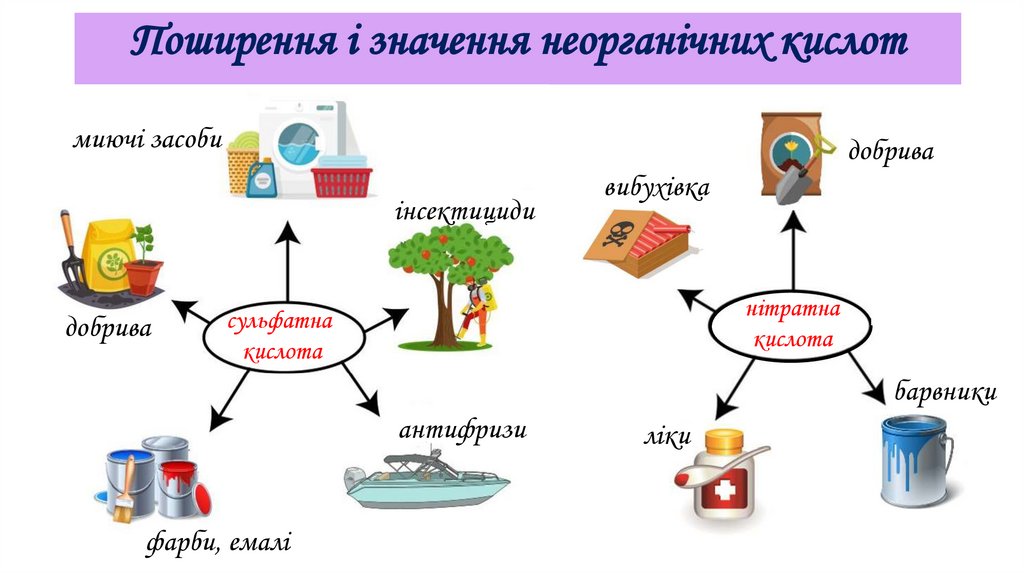
Поширення і значення неорганічних кислотмиючі засоби
добрива
інсектициди
добрива
вибухівка
нітратна
кислота
сульфатна
кислота
барвники
антифризи
фарби, емалі
ліки
18.
Робота з кислотами потребує обережності!Якщо кислота випадково попала на шкіру,
її треба негайно змити
великою кількістю проточної води,
а тоді ушкоджену ділянку
змочити слабким розчином соди!
19.
Завжди додавай кислоту до води, а не навпаки!20.
УзагальненняКислоти – це складні речовини, до складу яких входять один або декілька
атомів Гідрогену і кислотний залишок.
Валентність кислотного залишку дорівнює кількості атомів Гідрогену
кислоти.
За наявністю атомів Оксигену кислоти поділяються на безоксигенові
та оксигеновмісні.
Залежно від кількості атомів Гідрогену молекули кислот
поділяються на одноосновні, двоосновні, триосновні.
Індикатори змінюють своє забарвлення у присутності кислот: лакмус і
метиловий оранжевий змінюють колір на червоний.
За силою відщеплення від молекули позитивно заряджених йонів Гідрогену
розрізняють три типи кислот: сильні, середньої сили і слабкі.
При розбавленні концентрованої кислоти потрібно наливати кислоту у
склянку з водою, а не навпаки.

















 Химия
Химия








