Похожие презентации:
Кислоти. Фізичні властивості кислот
1.
Кислоти.Фізичні
властивості
кислот
2.
Неорганічні сполуки – це сполуки, які утворюються всіма хімічнимиелементами (крім більшості органічних сполук Карбону),
хімічні речовини не рослинного і не тваринного походження
Складні речовини утворені атомами різних хімічних елементів:
оксиди
основи
силіцій (ІV) оксид
SiO2
кислоти
oртофосфатна
H3PO4
натрій гідроксид NaOH
кальцій карбонат СаСО3
ферум (ІІІ) гідроксид
Fe(OH)3
ферум (ІІІ) оксид Fe2O3
солі
натрій хлорид
NaCl
хлоридна HCl
3.
Приклади органічних кислотУ щавлі є щавлева кислота
У лимонах міститься лимонна і
аскорбінова кислоти (вітамін С)
Кисле молоко містить
молочну кислоту
у яблуках – яблучна
Мурахи виприскують крапельки
їдкої мурашиної кислоти
При бродінні виноградного соку
утворюється оцтова кислота
4.
Кислоти – це складні речовини, до складу яких входятьодин або декілька атомів Гідрогену і кислотний залишок
ІІ
Н2 SO4
атоми
Гідрогену
кислотний
залишок
Валентність кислотного залишку дорівнює
кількості атомів Гідрогену!
5.
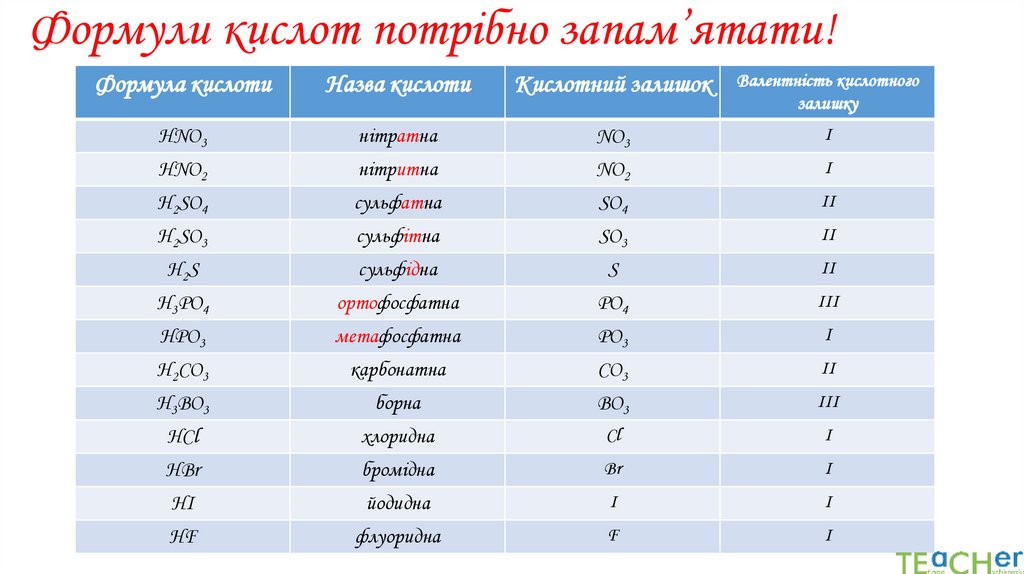
Формули кислот потрібно запам’ятати!Формула кислоти
Назва кислоти
Кислотний залишок
Валентність кислотного
залишку
HNO3
нітратна
NO3
І
HNO2
нітритна
NO2
І
Н2SO4
сульфатна
SO4
ІІ
Н2SO3
сульфітна
SO3
ІІ
Н 2S
сульфідна
S
ІІ
Н3РО4
ортофосфатна
РО4
ІІІ
НРО3
метафосфатна
РО3
І
Н2СО3
карбонатна
СО3
ІІ
Н3ВО3
борна
ВО3
ІІІ
НСl
хлоридна
Cl
І
HBr
бромідна
Br
І
HI
йодидна
I
І
HF
флуоридна
F
І
6.
Як визначити валентність центрального атома?1. Знаходимо число одиниць
валентності атомів Гідрогену,
помноживши валентність Гідрогену
на число атомів Гідрогену.
2. Аналогічно находимо число одиниць
валентності атомів Оксигену.
3.Знайдемо різницю числа одиниць
валентності атомів.
І
V ІІ
1⋅3=3
2⋅4=8
Н3 РO4
8–3=5
7.
Структурна формула - формула, що схематично показуєпорядок сполучення атомів у молекулі
Як написати структурну формулу кислоти?
1.Записуємо символ центрального атома.
2. Приєднати до нього атоми Гідрогену
через атоми Оксигену.
3. Інші атоми Оксигену
з’єднати із центральним
атомом подвійними зв’язками.
Н2 SO4
Н O S O
Н O O
8.
Класифікація кислотЗа вмістом атомів Оксигену кислоти бувають:
безоксигенові
оксигеновмісні
(розчини деяких газів у воді)
(продукти взаємодії
кислотного оксиду з водою)
HCl
HF
Н2S
Н2SO4
Н3РО4
Н2СО3
9.
Класифікація кислотЗа кількістю атомів Гідрогену кислоти бувають:
одноосновні
HNO3
НРО3
НСl
HBr
HI
HF
двохосновні
Н2SO4
Н2SO3
Н2СO3
Н2S
трьохосновні
Н3РО4
10.
Фізичні властивості кислот1. Кислоти бувають рідинами і
твердими речовинами
HNO3
Н2SO4
Н3РО4
Н2SiО3
Н3ВО3
11.
Фізичні властивості кислот2. Більшість кислот добре розчиняється у воді.
12.
Фізичні властивості кислот3. Водні розчини кислот відзначаються кислим
смаком, руйнують рослинні і тваринні тканини.
4. Кислоти кислі нас смак.
Індикатори – складні речовини, що змінюють
своє забарвлення у присутності кислот
лакмус
кислота
метилоранж
У присутності
кислоти лакмус і
метиловий
оранжевий стають
червоними
При потраплянні на шкіру або
слизові оболонки з’являються
хімічні опіки
13.
Властивості кислот зумовленінаявністю у їхньому складі атомів Гідрогену!
За силою відщеплення від молекули позитивно
заряджених йонів Гідрогену розрізняють типи кислот:
сильні
HCl
HNO3
Н2SO4
HBr
HI
НClО4
середньої сили
Н2SO3
Н3РО4
слабкі
H2S
H2СO3
H2SіO3
14.
Поширення і значення неорганічних кислотКислоти входять до
складу засобів для
чищення сантехніки
Газована вода утворюється
завдяки розчиненню в ній
вуглекислого газу – це розчин
карбонатної кислоти
У шлунку міститься розчин
хлоридної кислоти
Кока-кола містить розчин
ортофосфатної кислоти
15.
Поширення і значення неорганічних кислотУ результаті виверження вулканів і викидів
промислових підприємств у повітря надходять
оксиди, які спричинюють утворення
кислотних дощів
16.
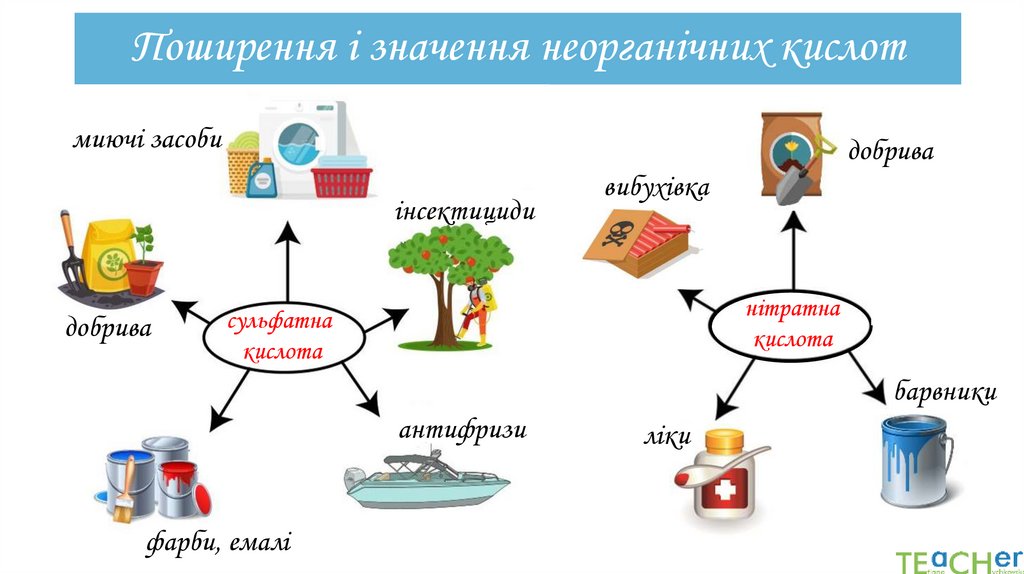
Поширення і значення неорганічних кислотмиючі засоби
добрива
інсектициди
добрива
вибухівка
нітратна
кислота
сульфатна
кислота
барвники
антифризи
фарби, емалі
ліки
17.
Робота з кислотами потребує обережності!Якщо кислота випадково попала на шкіру,
її треба негайно змити
великою кількістю проточної води,
а тоді ушкоджену ділянку
змочити слабким розчином соди!
18.
Робота з кислотами потребує обережності!Завжди додавай кислоту до води, а не навпаки!
19.
Підведемо підсумки!Кислоти – це складні речовини, до складу яких входять один або декілька
атомів Гідрогену і кислотний залишок.
Валентність кислотного залишку дорівнює кількості атомів Гідрогену кислоти.
За наявністю атомів Оксигену кислоти поділяються на безоксигенові та
оксигеновмісні.
Залежно від кількості атомів Гідрогену молекули кислот поділяються на
одноосновні, двоосновні, триосновні.
Індикатори змінюють своє забарвлення у присутності кислот: лакмус і
метиловий оранжевий змінюють колір на червоний.
За силою відщеплення від молекули позитивно заряджених йонів Гідрогену
розрізняють три типи кислот: сильні, середньої сили і слабкі.
При розбавленні концентрованої кислоти потрібно наливати кислоту у
склянку з водою, а не навпаки.
20.
нітратнаHNO3
21.
нітритнаHNO2
22.
сульфатнаН2SO4
23.
сульфітнаН2SO3
24.
сульфіднаН2S
25.
ортофосфатнаН3РО4
26.
метафосфатнаНРО3
27.
карбонатнаН2СО3
28.
борнаН3ВО3
29.
хлориднаНСl
30.
броміднаНBr
31.
йодиднаНІ
32.
флуориднаНF
33.
Чизалишились
запитання?
34.
Відеоурок ви можете переглянути за посиланням:https://www.youtube.com/watch?v=u6rC3jJzg2w
































 Химия
Химия








