Похожие презентации:
Сульфатна кислота. Фізичні та хімічні властивості сульфатної кислоти
1.
2.
SSO2
Н2S
SO3
Н2SO3
Натисніть на кружок –
отримаєте формулу
речовини. Опишіть
фізичні властивості даної
речовини.
3.
Здогадайтеся, яку речовину ми будемо сьогодні вивчати.Без цієї речовини не
обходиться жодна галузь
хімічної промисловості. Тому
дану речовину називають
“хлібом хімічної
промисловості”
4.
Цю кислоту можнапридбати в магазині під
назвою «акумуляторна»
Н2SO4
5.
Тема уроку:6.
Мета уроку: познайомитися зфізичними і хімічними
властивостями сульфатної
кислоти.
7.
молекулярна формуластруктурна формула
Характеристика:
-двохосновна;
- оксигеновмісна;
- сильний електроліт;
-H2SO4 роз. - слабкий окисник;
- H2SO4 конц. - сильний окисник.
8.
Робота з підручником с. 1281. Безбарвна оліїста рідина. (H2SO4 конц)
2.Важка ρ = 1,84 г/см3
3.Нелетка, без запаху
4.Гігроскопічна (поясніть, чому маса стакана з
H2SO4 з часом зростає?)
5.При розчинені у воді виділяє багато теплоти.
9.
При розведенні треба лити кислоту у воду, а не навпаки.Н2SO4
Н2O
При попаданні Н2SO4 на шкіру, її потрібно змити
великою кількістю води і нейтралізувати розчином
питної соди.
10.
H2SO4 роз— сильний електроліт, виявляє типовіхімічні властивості кислот.
Дослідіть хімічні властивості розведеної
сульфатної кислоти, виконавши
лабораторний дослід №3
11.
1. H2SO4 конц. – дуже гігроскопічна. Вона здатнавідбирати воду навіть з органічних речовин, до
складу яких входять хімічні елементи Оксиген і
Гідроген, й обвуглювати (виділяти вуглець)
речовини.
Натисніть на малюнок для перегляду
відео досліду “Гігроскопічність
сульфатної кислоти”
12.
2. H2SO4 конц. – сильний окисник, тому взаємодіє зметалами незалежно від їх положення в ряді
напруг. При цьому Н2 не утворюється, а
відновлюється S+6 → SO2, S, H2S
Натисніть на малюнок для
перегляду відео досліду
“взаємодія сульфатної кислоти
з металами”.
13.
При н.у не реагуютьне реагують зовсім
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pt Au
H2S
S, H2S, SO2
SO2
Допишіть рівняння реакції. Урівняйте методом
електронного балансу.
H2SO4 конц + Na →
H2SO4 конц + Zn →
H2SO4 конц + Cu →
14.
15.
Сировина:FeS2 – залізний колчедан, пірит
S – сірка
Сu2S, ZnS, PbS – сульфіди кольорових металів
СаSO4 ∙ 2H2O – гіпс
Н2S – сірководень
Процеси:
FeS2
S
SO2 → SO3 → H2SO4
Н2S
16.
ІІ етап –каталітичне окиснення.ІІІ етап – гідратація.
V2O5
SO
=
SO32++HO22O→
І етап – некаталітичне окиснення.
FeS2 + O2 →
17.
Аерозолі сірчаної ісірчистої кислот
конденсуються у
водяній парі
атмосфери і стають
причиною кислотних
опадів. Вони складають
близько 2/3 кислотних
опадів.
18.
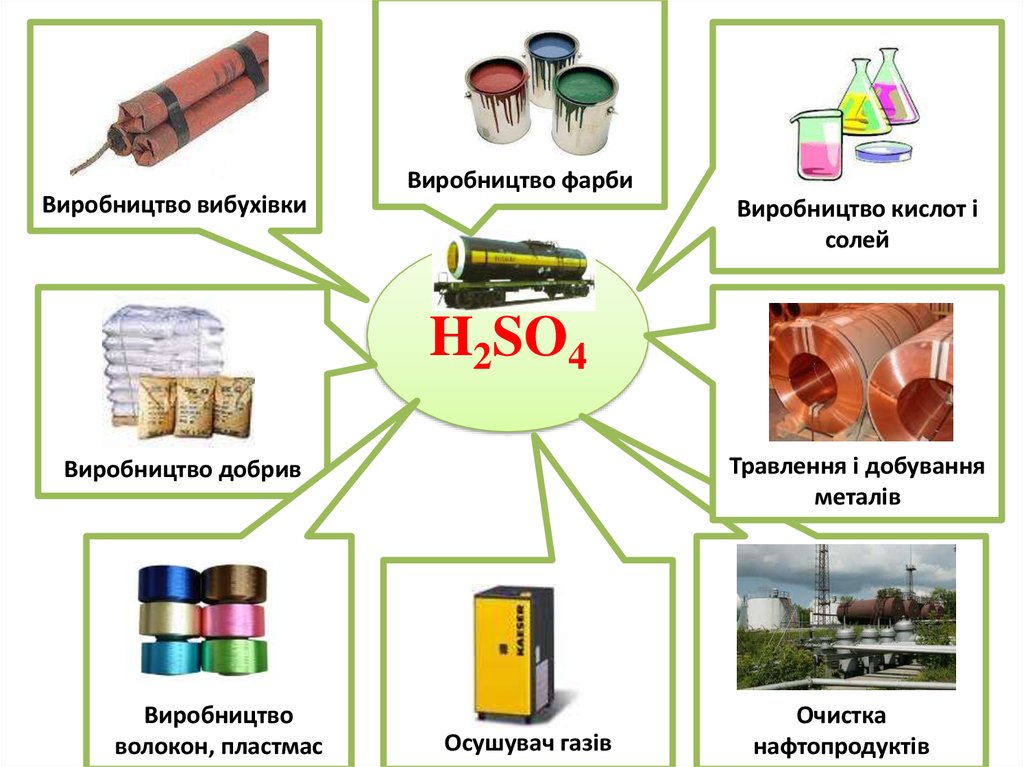
Виробництво вибухівкиВиробництво фарби
Виробництво кислот і
солей
H2SO4
Травлення і добування
металів
Виробництво добрив
Виробництво
волокон, пластмас
Осушувач газів
Очистка
нафтопродуктів
19. З якими із запропонованих речовин: Na , Cu, Na2O, Cu(OH)2, Na2CO3, NaCl, BaCl2 буде реагувати а) H2SO4 роз б) H2SO4 конц Напишіть відповідні рівняння реакцій
20.
§ 30Впр. 4, 8 с.135


















 Химия
Химия








