Похожие презентации:
Белки. Уровни организации белковой молекулы
1. Белки
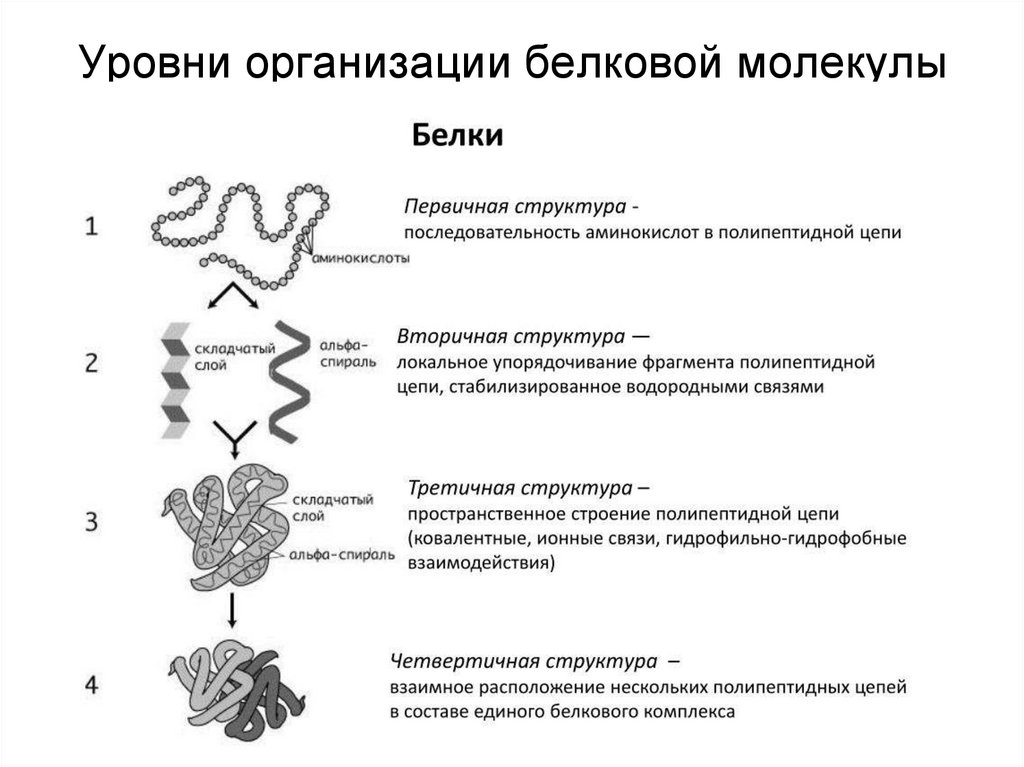
2. Уровни организации белковой молекулы
3. Как аминокислоты соединяются с друг другом в рибосомальном аппарате?
Реакцияполиконденсации.
Огромное
количество
эндогенной воды
в клетке
образуется при
синтезе белка
4.
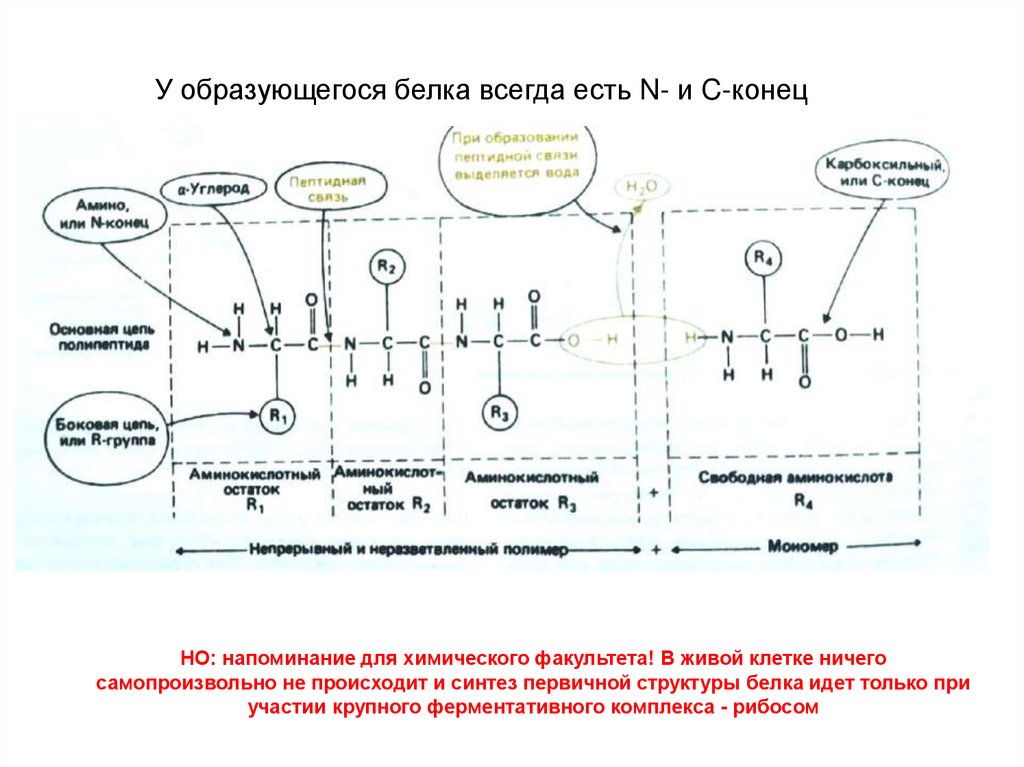
У образующегося белка всегда есть N- и C-конецНО: напоминание для химического факультета! В живой клетке ничего
самопроизвольно не происходит и синтез первичной структуры белка идет только при
участии крупного ферментативного комплекса - рибосом
5. Как это выглядит (упрощенно) на рибосоме
Функциональный белок – это не просто набор аминокислот. Они должнырасполагаться в строго запрограммированном в генетическом коде порядке
6.
7. Еще раз в виде анимации
Синтез любого белка в клетке начинается всегда сметионина. Кодон, который кодирует эту аминокислоту
называется «старт-кодон»
8. Метионин на данный момент находится в центре внимания молекулярной геронтологии Давно известно, что ограничение калорийности
рациона продляет срокжизни, но в 2014 году обнаружили интересный феномен
50 дней
жизни
70 дней жизни
и высокая
плодовитость
Ограничение по метионину способствует долгой жизни и
высокой плодовитости (для Drosophila срок жизни увеличился на
30%)
9. Дальнейшие исследования показали
Сокращение в рационе питания аминокислоты L метионин снижает ожирение
примерно на 20-30%, увеличивая расход энергии!!!
Сокращение в рационе питания аминокислоты L метионин снижает системное
воспаление. А ведь рост с возрастом системного воспаления (которое каждый
может проверить, сдав анализ на С-реактивный белок) - это один из
биомаркеров наступления старости организма.
В экспериментах на крысах сокращали в питании только одну аминокислоту L
метионин на 83% (пожизненно), и добивались продления жизни животных на
30-40% - даже без ограничения калорийности питания. И наоборот оптимально-калорийное питание с добавлением в рацион аминокислоты L
метионин не приводило к продлению жизни. То есть ограничение метионина это один из главных факторов продления жизни при оптимально-калорийном
питании.
Эксперименты показали, что ограничение аминокислоты L метионин в
питании сокращает смертность от всех причин, а также увеличивает
именно максимальную продолжительность жизни. А это значит, что сокращение
метионина тормозит именно процессы старения, а не просто предупреждает
преждевременную смерть от какого-либо заболевания.
Вероятная причина: дефицит метионина снижает активность киназы mTOR, что
стимулирует аутофагию.
10.
Эти исследования лишь подтвердили на молекулярном уровнеизвестный факт: умеренное потребление животных продуктов полезно
11.
Привет, это снова я.В 1930х годах Лайнус
полинг, отец
структурной химии и
теории
электромагнитного
резонанса, обосновал
особенности
пептидной связи в
белках.
1) Пептидная связь плоскостная, все атомы
находятся в одной плоскости и находятся в
транс-состоянии.
2) Пептидная связь, практически единственная
в химии, находящаяся в промежуточном
состоянии между одинарной и двойной, что
делает ее неподвижной вокруг своей оси.
12.
Как он это заметил? Смотрите на формулы: связь между αатомом углерода и азотом аминогруппы больше, чем связьмежду тем же азотом и углеродом карбоксильной группы
Наблюдательный Лайнус
Полинг и Роберт Кори,
измерявшие связи
нанолинейкой
13.
14. Особенная аминокислота - цистеин, единственная, которая участвует в создании дополнительной ковалентной дисульфидной связи в
белках15.
16.
17.
Белок – это последовательность аминокислот, связанных друг с другом пептиднымисвязями. Если количество аминокислот не превышает 10, то новое соединение
называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40
аминокислот – белок. Линейная молекула белка, образующаяся при соединении
аминокислот в цепь, является первичной структурой. Образно ее можно сравнить с
обычной нитью, на которую навешено до нескольких сотен бусинок двадцати
различных цветов (по числу аминокислот). Последовательность и соотношение
аминокислот в первичной структуре определяет дальнейшее поведение молекулы: ее
способность изгибаться, сворачиваться, формировать те или иные связи внутри себя.
18.
Вторичная структура определяется:1) устойчивостью пептидной связи,
2) подвижностью С-С связи,
3) размером аминокислотного радикала.
Все это вкупе с аминокислотной
последовательностью приводит к строго
определенной конфигурации белка.
Можно выделить два возможных варианта
вторичной структуры: α-спираль и β-структура (β-складчатый слой). В
одном белке, как правило, присутствуют обе структуры. В глобулярных
(шаровидных) белках преобладает α-спираль, в фибриллярных
(линейных) – β-структура.
19.
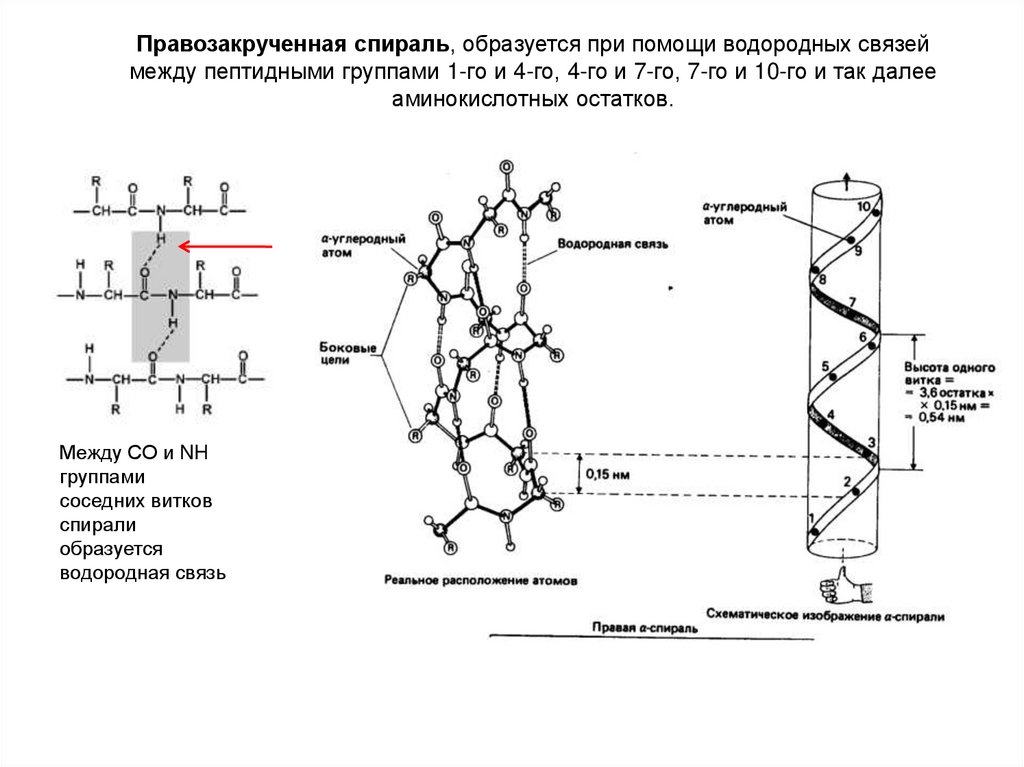
Правозакрученная спираль, образуется при помощи водородных связеймежду пептидными группами 1-го и 4-го, 4-го и 7-го, 7-го и 10-го и так далее
аминокислотных остатков.
Между СО и NH
группами
соседних витков
спирали
образуется
водородная связь
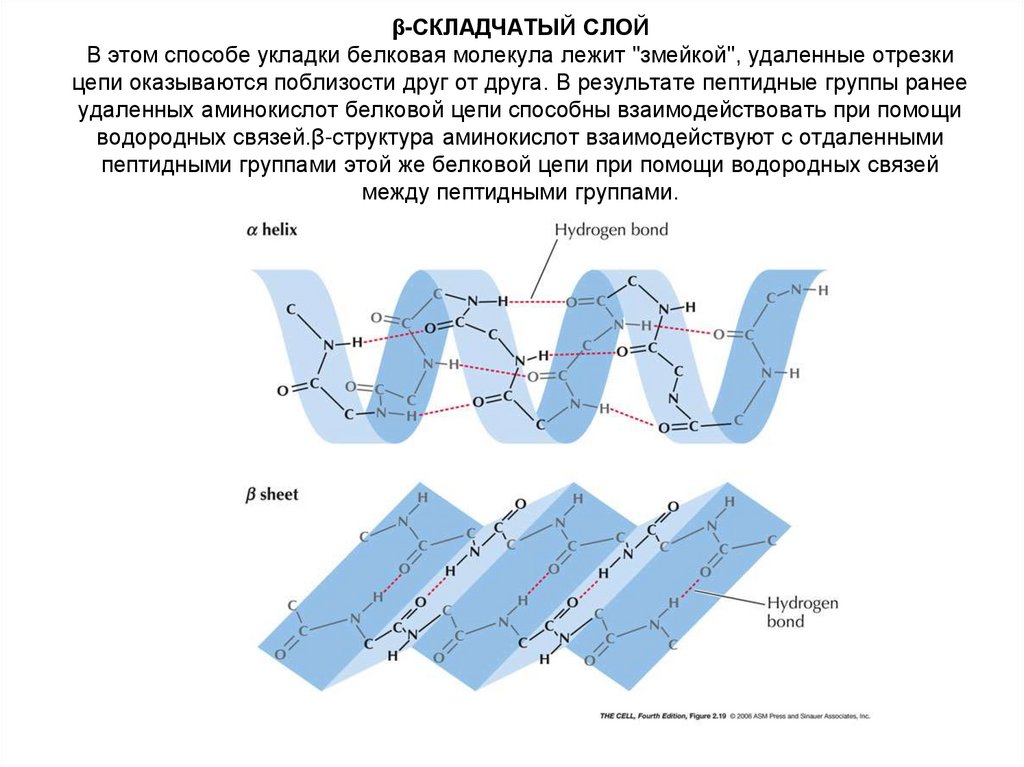
20. β-СКЛАДЧАТЫЙ СЛОЙ В этом способе укладки белковая молекула лежит "змейкой", удаленные отрезки цепи оказываются поблизости друг
β-СКЛАДЧАТЫЙ СЛОЙВ этом способе укладки белковая молекула лежит "змейкой", удаленные отрезки
цепи оказываются поблизости друг от друга. В результате пептидные группы ранее
удаленных аминокислот белковой цепи способны взаимодействовать при помощи
водородных связей.β-структура аминокислот взаимодействуют с отдаленными
пептидными группами этой же белковой цепи при помощи водородных связей
между пептидными группами.
21.
Пролин обеспечиваетповороты молекулы белка
22. Третичная структура
Наряду с α-спиралью и β-структурой в третичной структуре обнаруживается так называемаянеупорядоченная конформация, которая может занимать значительную часть молекулы. В
разных белках наблюдается разное соотношение типов структур. Например, инсулин
содержит 52% α-спирали и 6% β-структуры, трипсин – 14% α-спирали и 45% β-структуры.
23.
24.
25.
ВодорастворимыеНаходятся в гидрофобном
окружении
26.
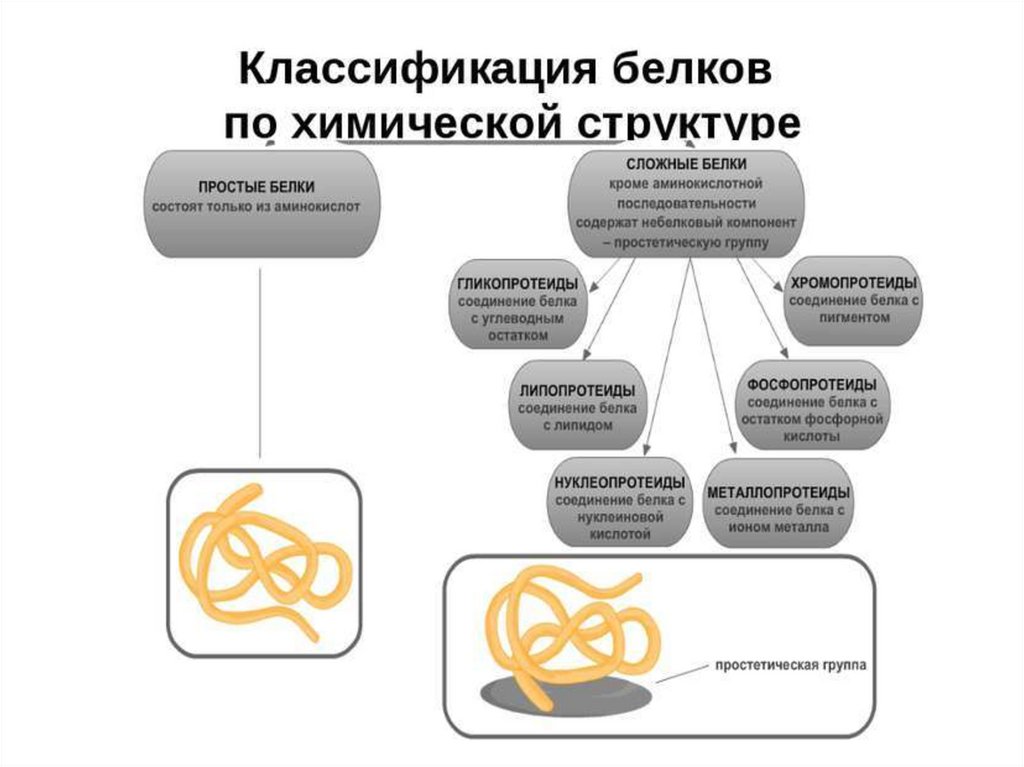
Структура простых белков представлена только полипептидной цепью (альбумин). Однаконеобходимо понимать, что многие простые белки (например, альбумин) не существуют в
„чистом" виде, они всегда связаны с какими-либо небелковыми веществами. Их относят к
простым белкам, т.к. связи с небелковой группой слабые.
АЛЬБУМИНЫ
Группа белков плазмы крови с молекулярной массой около 40 кДа, имеют кислые свойства и
отрицательный заряд при физиологических рН, т.к. содержат много глутаминовой кислоты.
Легко адсорбируют полярные и неполярные молекулы, являются в крови переносчиком
многих веществ, в первую очередь билирубина и жирных кислот.
ГЛОБУЛИНЫ
Группа разнообразных белков плазмы крови с молекулярной массой до 100 кДа, слабокислые
или нейтральные. Часто содержат углеводные компоненты. При обычном электрофорезе
разделяются, как минимум, на 4 фракции – α1, α2, β и γ.
27.
Что такое электрофорез: белки сыворотки крови заряженыотрицательно. Если поместить их на ацетилцеллюлозную пленку и
поместить в систему катод/анод, то белки пойдут к аноду в силу
электростатического притяжения. Самые маленькие молекулы за
определенное время продвинутся дальше, остальные разбегутся
на пленке в зависимости от их массы и размера
28.
Альбумины – лучший пример транспортной функции белковСинтезируется в печени
Составляет 55%
белков крови
Благодаря своей химической
структуре транспортирует
билирубин, жирные кислоты,
лекарства, металлы, гормоны,
антибиотики
29.
30.
А почему вещества самостоятельно не могут транспортироваться вкрови?
31.
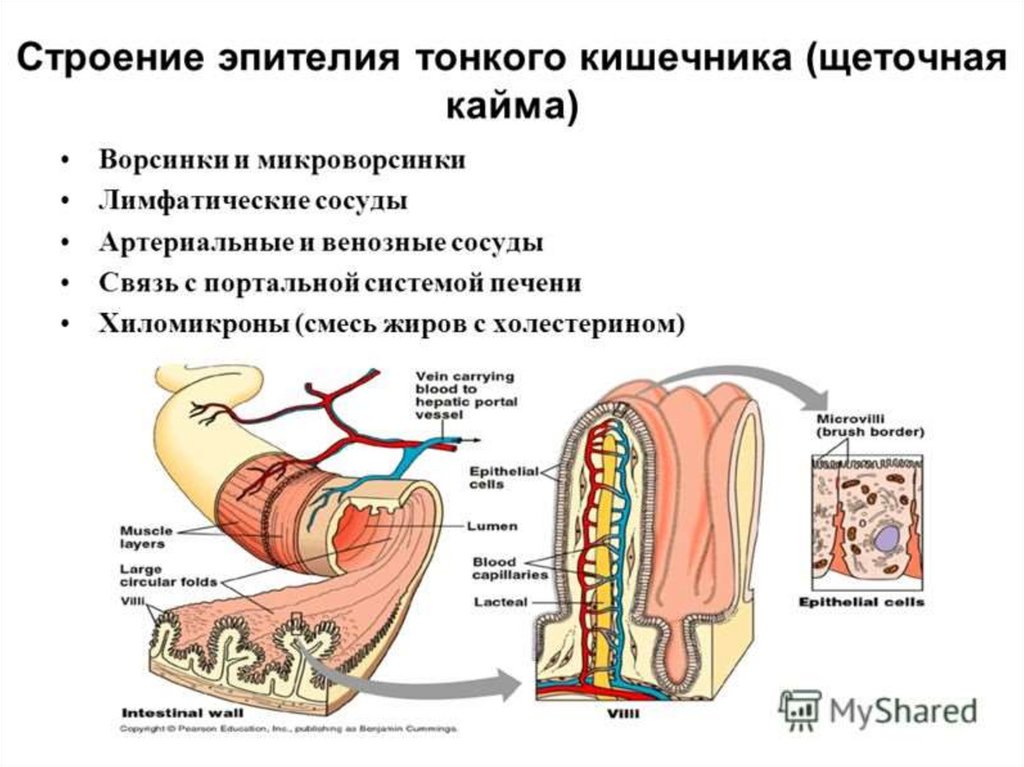
Как происходит всасывание веществ в кишечнике.32.
33.
34.
И все бы ничего, если бы не одно:Вместе с естественными
нутриентами с пищей поступает
огромное количество других
веществ. Как организму разобраться,
что «свое», а что «чужое»?
35. На страже в кишечнике стоит иммунная система - лимфоциты и тучные клетки, которые ответственны за безопасность поступающих в
На страже вкишечнике стоит
иммунная
система лимфоциты и
тучные клетки,
которые
ответственны за
безопасность
поступающих в
кровь веществ
36.
Если вещество, поступившее в кровь соединилосьс альбумином, то для иммунной системы – это
«зеленый свет», поэтому практически все
лекарственные вещества, поступающие в кровь,
проверяются на связывание с альбуминами
Альбумин
Вещество
Лимфоцит
37.
Альбумин ответственен за то, чтобы соединенное сним вещество на любом «блокпосте» иммунной
системы не проходило длительную проверку. Если
вещество не связалось с альбумином, то оно либо
инактивируется иммунным ответом
(высокомолекулярные вещества), либо немедленно
выводится через фильтрационную систему почек
(низкомолекулярные).
38.
Гипопротеинемия – снижение концентрации белка вкрови.
Возникает при снижении белка в рационе
При заболевании печени и почек
При такой патологии витамины, стероидные гормоны,
лекарства не транспортируются в крови, а выводятся
с мочой.
Особенную опасность представляет сочетание
гипопротеинемии с высоким уровнем
холестерина и липидов в крови
39.
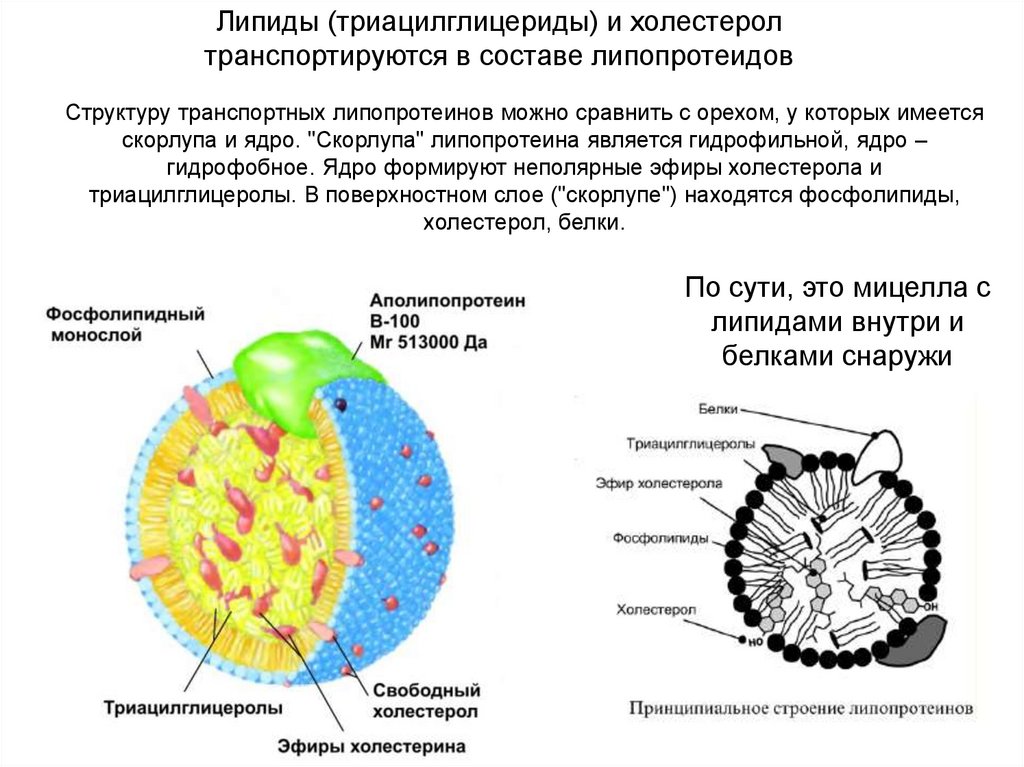
Липиды (триацилглицериды) и холестеролтранспортируются в составе липопротеидов
Структуру транспортных липопротеинов можно сравнить с орехом, у которых имеется
скорлупа и ядро. "Скорлупа" липопротеина является гидрофильной, ядро –
гидрофобное. Ядро формируют неполярные эфиры холестерола и
триацилглицеролы. В поверхностном слое ("скорлупе") находятся фосфолипиды,
холестерол, белки.
По сути, это мицелла с
липидами внутри и
белками снаружи
40.
41.
42.
Холестерин – это хорошо, он жизненно необходим для синтезастероидных гормонов и стабилизации мембраны каждой клетки.
Но: если белков –переносчиков крови мало, то липиды и
холестерин начинают выходить в кровеносное русло
самостоятельно, откладываются на стенках сосудов, что приводит
к атеросклерозу.
Атеросклеротическая
бляшка
Поэтому в крови должно быть достаточное количество белкапереносчика, который формирует ЛПВП, в таком состоянии липиды
и холестерин будет доставлен в нужный орган и не «потеряется» в
процессе доставки
43.
Лучший источник альбумина – молочные продукты и яица.При любых патологических состояниях (ожоги, истощение, анемия,
астенический синдром, воспаление и пр.) назначают альбумин
внутривенно, и лишь потом лекарственное вещество, потому что
без первого второе просто не дойдет до пункта назначения.




































 Биология
Биология








