Похожие презентации:
Белки. Структуры белковой молекулы
1.
Лекция 4Белки
Структура
2.
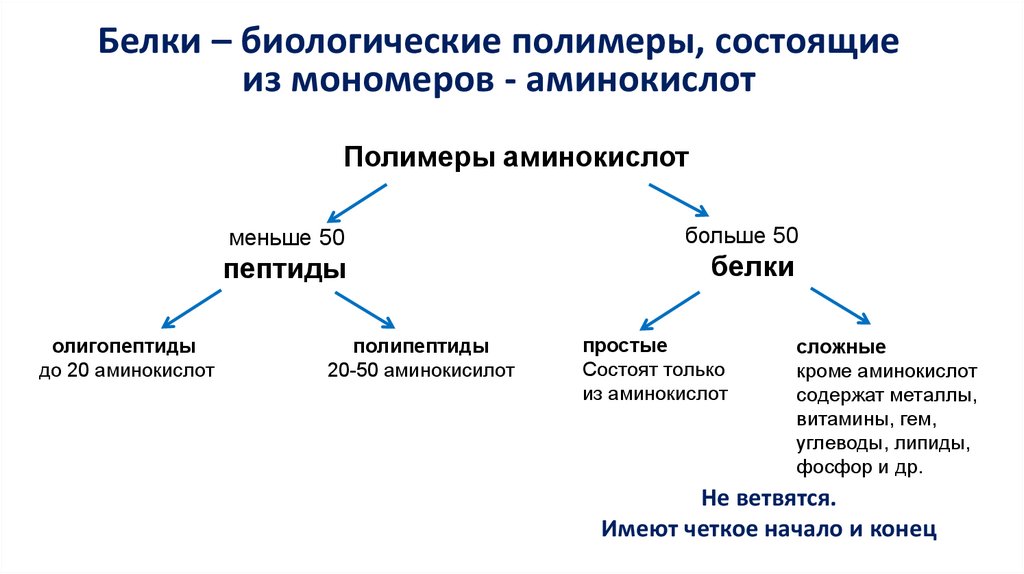
Белки – биологические полимеры, состоящиеиз мономеров - аминокислот
Полимеры аминокислот
меньше 50
пептиды
олигопептиды
до 20 аминокислот
полипептиды
20-50 аминокисилот
больше 50
белки
простые
Состоят только
из аминокислот
сложные
кроме аминокислот
содержат металлы,
витамины, гем,
углеводы, липиды,
фосфор и др.
Не ветвятся.
Имеют четкое начало и конец
3.
Инсулин(гормон поджелудочной железы)
состоит из 51 аминокислоты
4.
Биологические функции белков и пептидов1)
Структурная
(коллаген, фиброин шелка, белки паутины)
2) Каталитическая
(ферменты)
3) Регуляторная
(белковые факторы транскрипции
и трансляции, гормоны (инсулин))
4) Рецепторная
(родопсин, рецепторы гормонов)
5) Двигательная (сократительная)
(актин, миозин)
6) Функция защиты и нападения
(иммуноглобулины, пептидные антибиотики, яды
и токсины)
7) Транспортная
(гемоглобин, альбумины крови, кинезин, динеин)
8) Запасная
(казеин молока, овальбумин, зеин кукурузы)
5.
Структурыбелковой
молекулы
6.
Первичная структура белка –порядок чередования аминокислот в полипептидной цепи, начиная с N-конца
Определяет особенности всех остальных структур белка.
+ 2 Н2О
Связи – пептидные
между СООН-группой n-ой аминокислоты и NH2-группой (n+1)-ой аминокислоты
7.
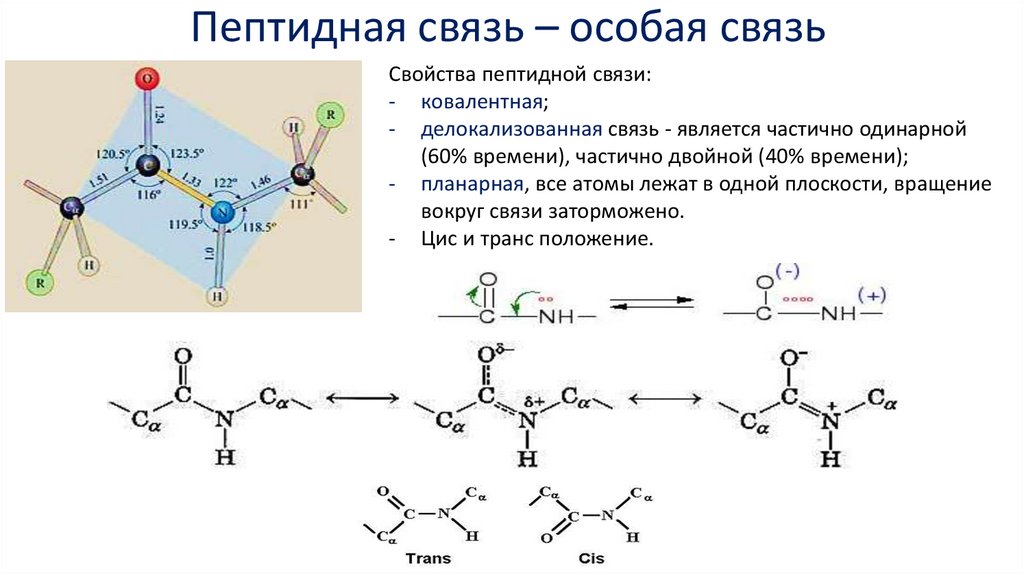
Пептидная связь – особая связьСвойства пептидной связи:
- ковалентная;
- делокализованная связь - является частично одинарной
(60% времени), частично двойной (40% времени);
- планарная, все атомы лежат в одной плоскости, вращение
вокруг связи заторможено.
- Цис и транс положение.
8.
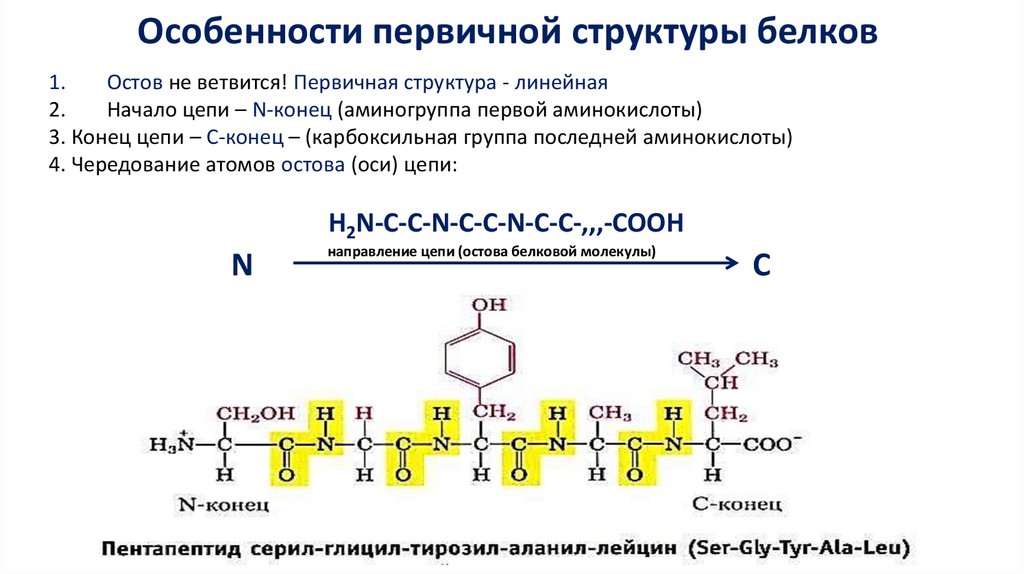
Особенности первичной структуры белков1.
Остов не ветвится! Первичная структура - линейная
2.
Начало цепи – N-конец (аминогруппа первой аминокислоты)
3. Конец цепи – С-конец – (карбоксильная группа последней аминокислоты)
4. Чередование атомов остова (оси) цепи:
Н2N-C-C-N-C-C-N-C-C-,,,-COOH
N
направление цепи (остова белковой молекулы)
C
9.
Расшифровка первичной структуры белкаБелковый секвенатор – прибор для автоматического
определения первичной последовательности белка
Последовательность = sequence (англ.)
Первичная последовательность инсулина
10.
Protein Data Bank www.rcsb.org11.
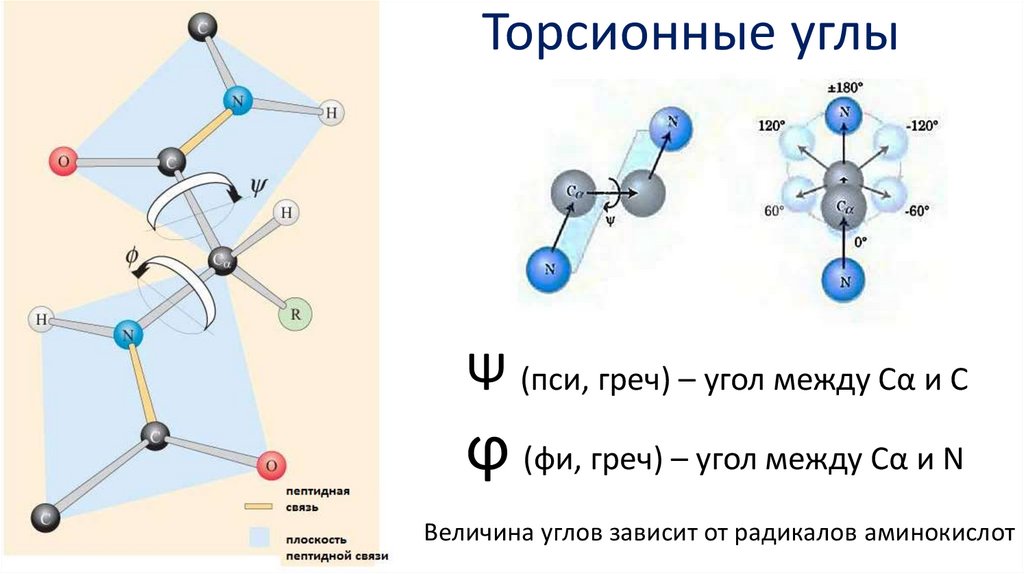
Торсионные углыΨ (пси, греч) – угол между Сα и С
ϕ (фи, греч) – угол между Сα и N
Величина углов зависит от радикалов аминокислот
12.
13.
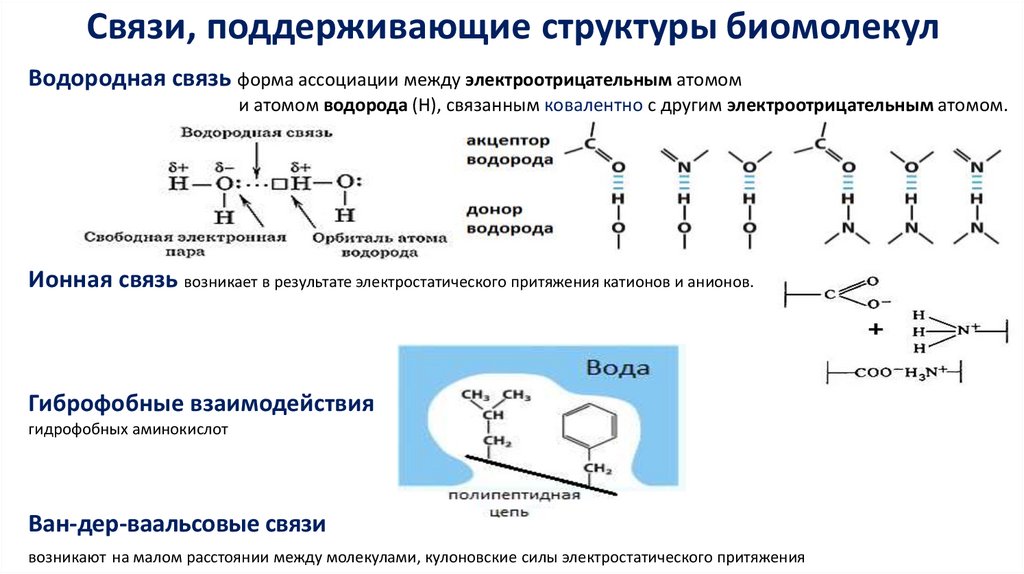
Связи, поддерживающие структуры биомолекулВодородная связь форма ассоциации между электроотрицательным атомом
и атомом водорода (H), связанным ковалентно с другим электроотрицательным атомом.
Ионная связь возникает в результате электростатического притяжения катионов и анионов.
Гиброфобные взаимодействия
гидрофобных аминокислот
Ван-дер-ваальсовые связи
возникают на малом расстоянии между молекулами, кулоновские силы электростатического притяжения
14.
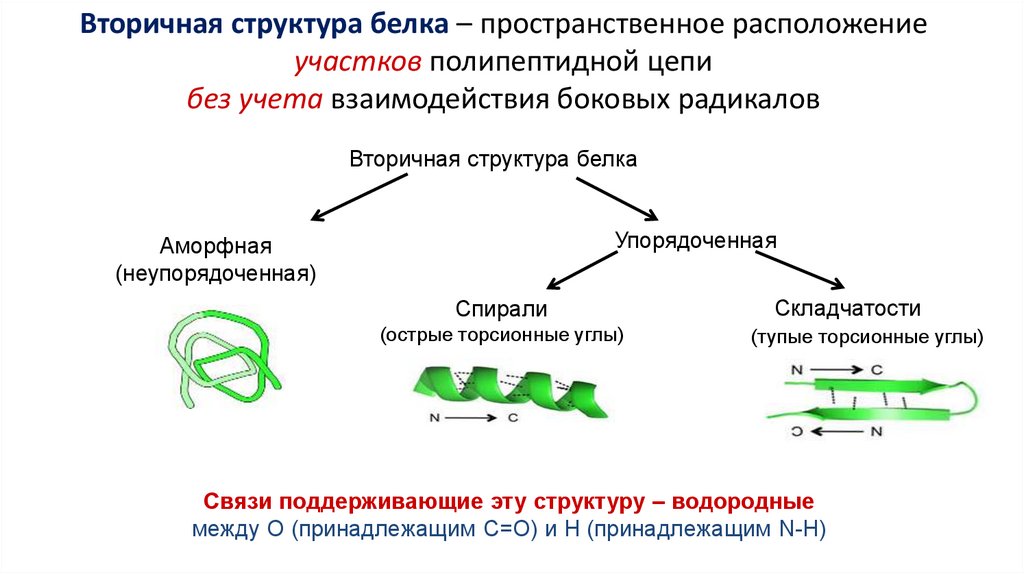
Вторичная структура белка – пространственное расположениеучастков полипептидной цепи
без учета взаимодействия боковых радикалов
Вторичная структура белка
Упорядоченная
Аморфная
(неупорядоченная)
Спирали
(острые торсионные углы)
Складчатости
(тупые торсионные углы)
Связи поддерживающие эту структуру – водородные
между О (принадлежащим С=О) и Н (принадлежащим N-Н)
15.
Американский физик и химик.Лайнус Полинг В 1951г. совместно с Р.Кори
сформулировал теорию о вторичной структуре белков и описал α-спираль.
Лауреат двух Нобелевских премий – премии по химии и премии мира.
16.
Спиралиα-спираль наиболее распространенная форма
спиралей в белках
Правозакрученная
Формула α-спирали:
Все углы Ψ = - 45о
Все углы ϕ = - 60о
Водородные связи
- параллельны оси спирали
- замыкаются от первой к
четвертой пептидной связи
17.
β-складчатая структураВсе углы Ψ = + 135о
Все углы ϕ = - 120о
Водородные связи
- перпендикулярны оси спирали
или располагаются под углом
- замыкаются между атомами
образующими пептидную связь на
разных участках молекулы
18.
Антипараллельная β-структураβ –изгиб (часто присутствует пролин)
Параллельная β-структура
19.
Сверхвторичная структура –ансамбли из вторичных структур
На схемах спирали - цилиндры
складчатости объемные стрелки
Поддерживается за счет
взаимодействия боковых радикалов
20.
Примеры мотивов – структурных образованийсверхвторичной структуры
ДНК
лейциновая молния
мотив не является независимо стабильным
(если его отделить от белка, он не будет работать отдельно)
21.
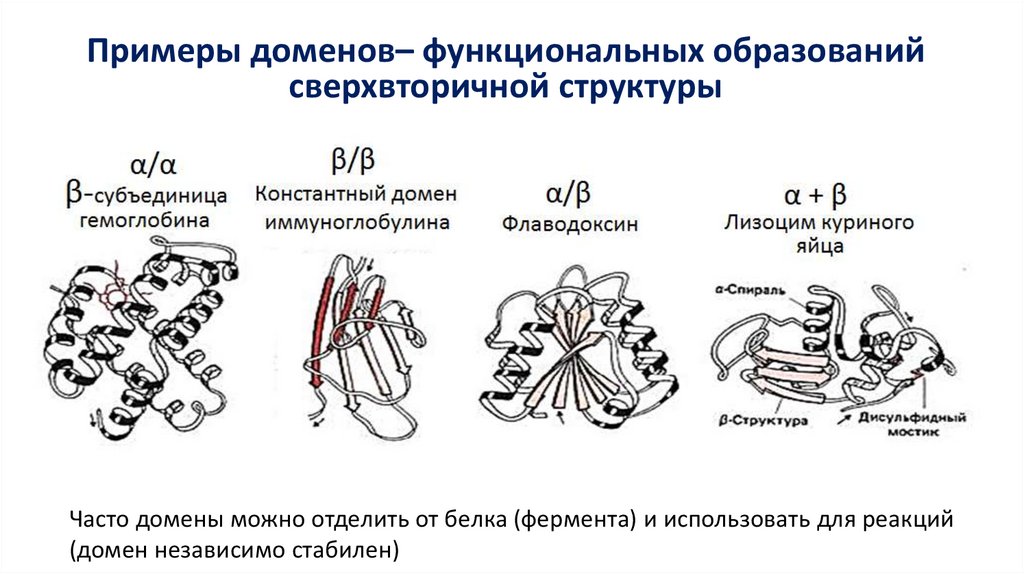
Примеры доменов– функциональных образованийсверхвторичной структуры
Часто домены можно отделить от белка (фермента) и использовать для реакций
(домен независимо стабилен)
22.
Суперспирали сверхвторичная структура структурных белков23.
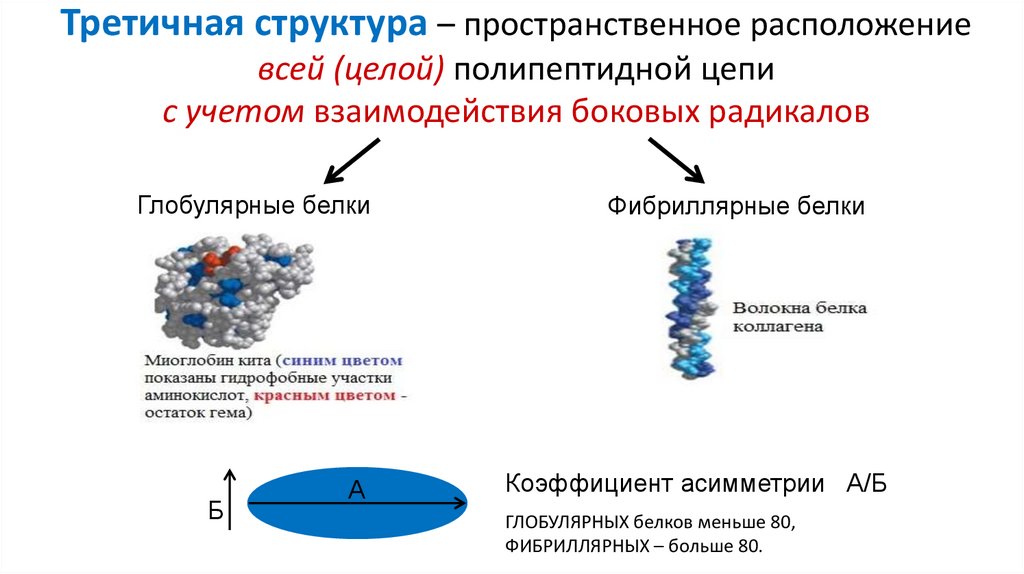
Третичная структура – пространственное расположениевсей (целой) полипептидной цепи
с учетом взаимодействия боковых радикалов
Глобулярные белки
Б
А
Фибриллярные белки
Коэффициент асимметрии А/Б
ГЛОБУЛЯРНЫХ белков меньше 80,
ФИБРИЛЛЯРНЫХ – больше 80.
24.
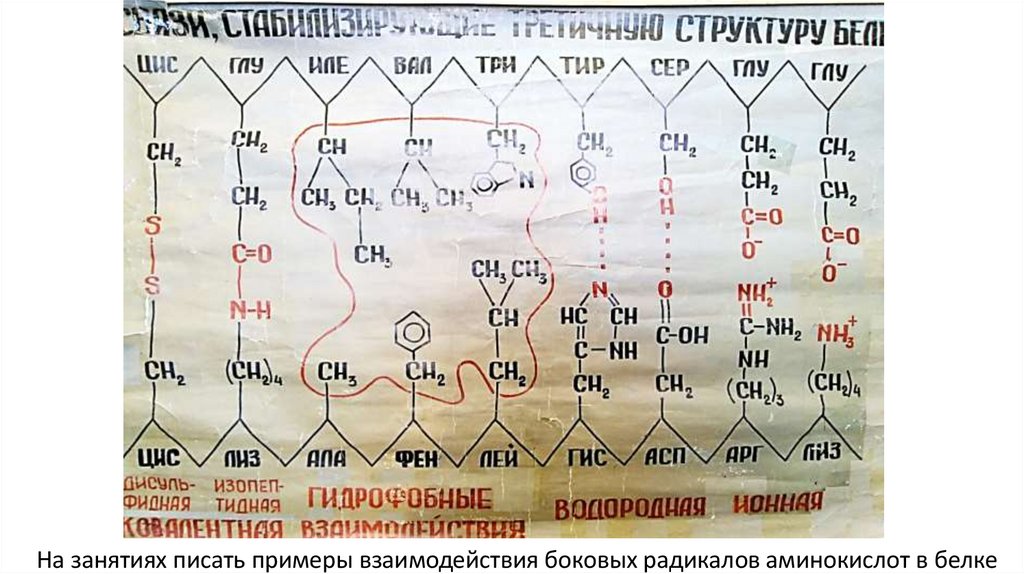
Третичная структура поддерживается связями,возникающими между радикалами аминокислот
1) ионные (“+” c “-”)
2) водородные
3) гидрофобные взаимодействия
4) ковалентные (чаще всего S-S)
25.
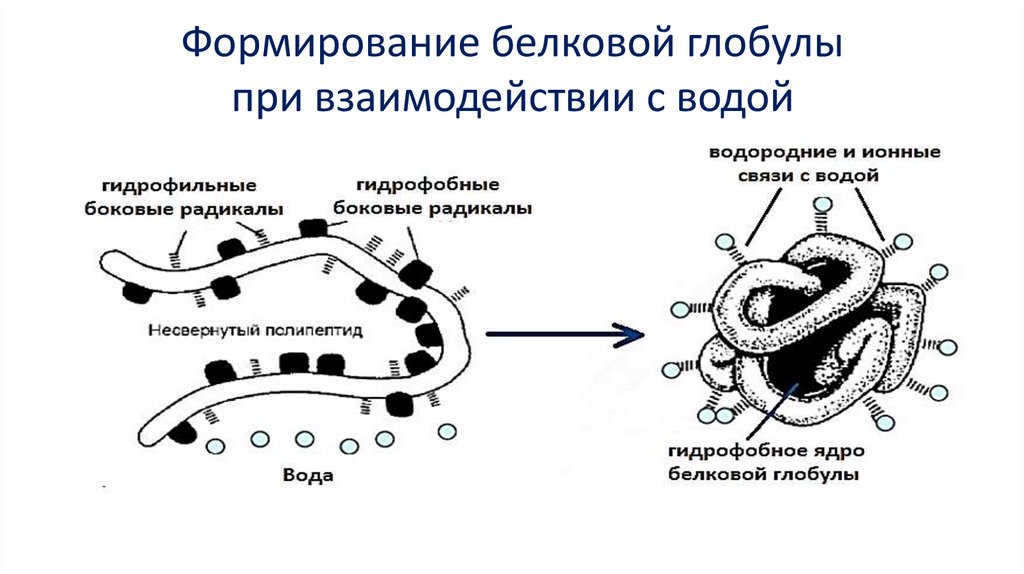
Формирование белковой глобулыпри взаимодействии с водой
26.
На занятиях писать примеры взаимодействия боковых радикалов аминокислот в белке27.
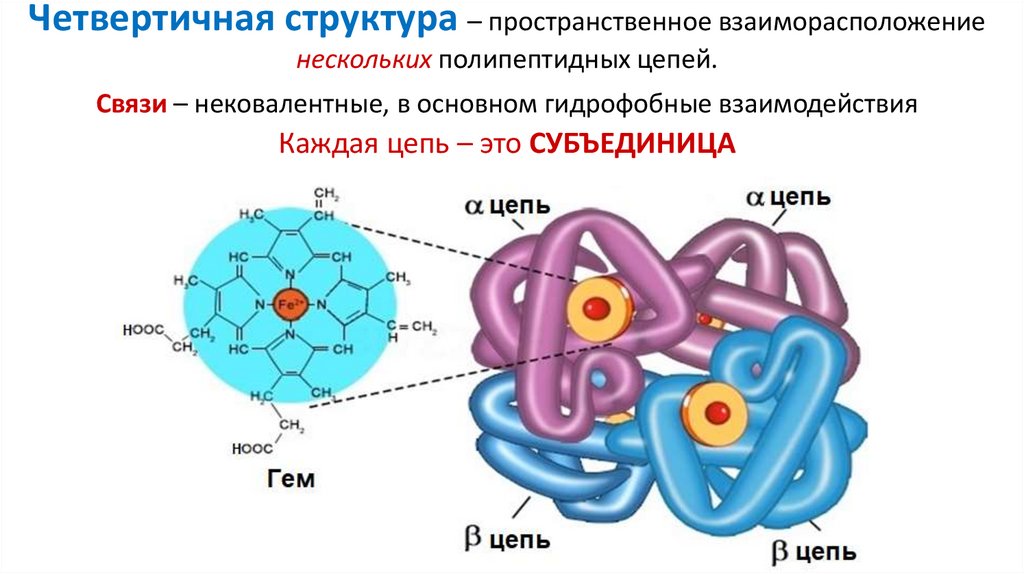
Четвертичная структура – пространственное взаиморасположениенескольких полипептидных цепей.
Связи – нековалентные, в основном гидрофобные взаимодействия
Каждая цепь – это СУБЪЕДИНИЦА
28.
29.
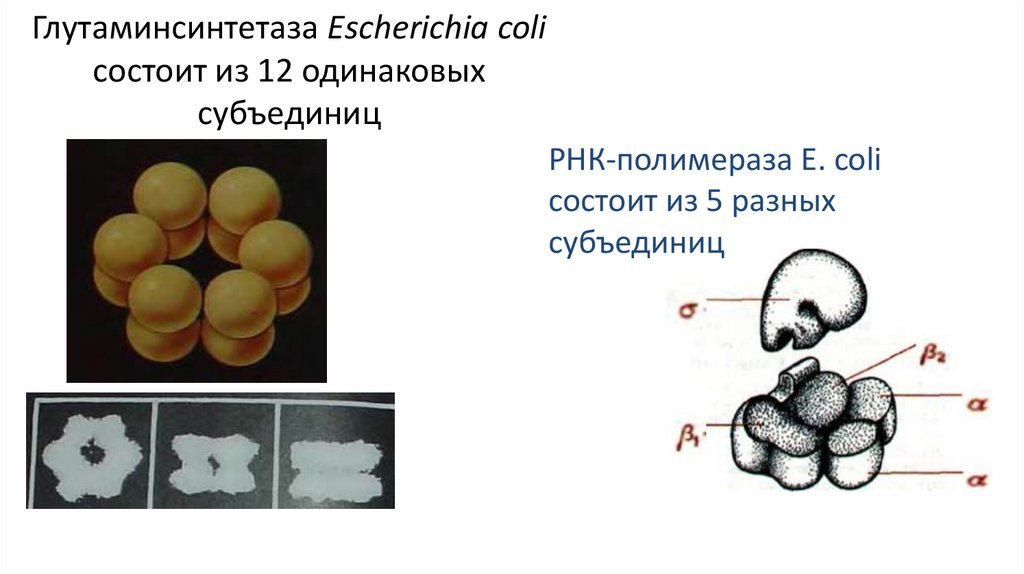
Глутаминсинтетаза Escherichia coliсостоит из 12 одинаковых
субъединиц
РНК-полимераза E. coli
состоит из 5 разных
субъединиц
30.
Подготовка к семинару1.
2.
3.
4.
Тема «Структуры белковой молекулы»
Первичная структура, особенности пептидной связи.
Торсионные углы
Методы расшифровки первичной структуры белков
(самостоятельно, см. учебник Анисимова)
Вторичная структура белка. Уметь рисовать структуры,
расставлять атомы и водородные связи.
Третичная структура белка. Приводить примеры
взаимодействия радикалов аминокислот


















 Биология
Биология