Похожие презентации:
Белки (или белковые вещества)
1. Белки
12.
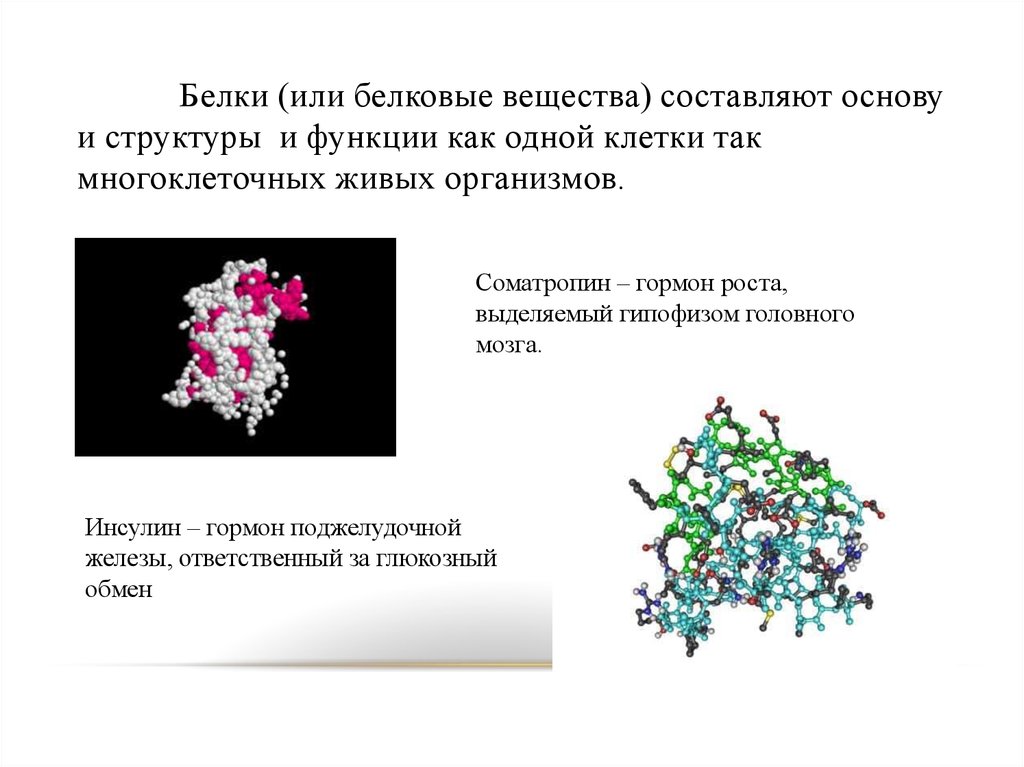
Белки (или белковые вещества) составляют основуи структуры и функции как одной клетки так
многоклеточных живых организмов.
Соматропин – гормон роста,
выделяемый гипофизом головного
мозга.
Инсулин – гормон поджелудочной
железы, ответственный за глюкозный
обмен
2
3. Функции белков
это разносторонние роли белков в живом организме,решающей из которых являются их способность строго
избирательно, специфически соединяться с широким
кругом разнообразных веществ. Реализуется зта
способность через «биоспецифическое узнавание»,
приводит к связыванию молекулы субстрата с белком и в
итоге обеспечивает протекание химической реакции.
Высокой специфичностью обладают также белки,
которые участвуют в таких процессах, как деление,
дифференцировка клеток и развитие живых организмов,
определяя их биологическую индивидуальность.
4. Функции белков
К главным, и в некотором смысле уникальнымбиологическим функциям белков, несвойственным или лишь
частично присущим другим классам биополимеров относятся
следующие функции.
Структурная (опорная) функция
Ферментативная (каталитическая) функция
Рецепторная и гормональная функция
Транспортная функция
Резервная (питательная) функция
Сократительная функция
Защитная функция
Функции белков крови
5. Функции белков Структурная (опорная) функция
Белки, выполняющие структурную функцию, преобладаютсреди других белков тела человека. Фибриллярные белки
формируют вещество соединительной ткани — коллаген, эластин (в
сосудистой стенке сосудов эластического типа), кератин (в коже и её
производных элементах), протеогликаны.
Большое значение имеют комплексы белков
с углеводородами в формировании ряда секретов: мукоидов, муцина
и т.д. В комплексе с липидами (в частности, с фосфолипидами)
белки участвуют в образовании биомембран клеток.
Непосредственно участвуют в построении мембран и цитоскелета
(интегральные, полуинтегральные и поверхностные белки) —
спектрин (поверхностный, основной белок цитоскелета
эритроцитов), гликофорин A (интегральный, фиксирует спектрин на
поверхности). Также к данной функции можно отнести участие
белка в создании таких органелл, как рибосомы.
6. Функции белков Ферментативная (каталитическая) функция
Все ферментыявляются белками, которые определяет
скорость химических реакций в биологических системах.
Но вместе с тем, имеются экспериментальные данные о
существовании рибозимов, то есть рибонуклеиновой
кислоты, обладающей каталитической активностью, и
абзимов — и моно- и поликлональных антител.
7. Функции белков Рецепторная и гормональная функция
Эта функция заключается в избирательномсвязывании гормонов, биологически активных веществ и
медиаторов на поверхности мембран или внутри клеток.
Регуляцию и согласование обмена веществ в разных
клетках организма осуществляют гормоны. Часть из них
являются белками или полипептидами,
например, инсулин и глюкагон. Однако, некоторые
гормоны являются производными аминокислот.
8. Функции белков Транспортная функция
Только белки осуществляют перенос веществ вкрови, например, липопротеины (перенос
жира), гемоглобин (транспорт
кислорода), трансферрин (транспорт железа). Белки
транспортируют в крови катионы кальция,
магния, железа, меди и другие ионы.
Транспорт веществ через мембраны осуществляют
белки — Na+,К+-АТФаза (антинаправленный
трансмембранный перенос ионов натрия и калия), Са 2+АТФаза (выкачивание ионов кальция из клетки),
глюкозные транспортеры.
9. Функции белков Резервная (питательная) функция
Эту функцию выполняют так называемыерезервные протеины. В качестве примера
депонированного белка можно привести производство и
накопление в яйце яичного альбумина (овальбумина). У
животных и человека таких специализированных депо
нет, но при длительном голодании используются белки
мышц, лимфоидных органов, эпителиальных тканей и
печени. Основной белок молока (казеин) также
выполняет главным образом питательную функцию.
10. Функции белков Сократительная функция
Существует ряд внутриклеточных белков,предназначенных для изменения формы клетки и
движения самой клетки или ее органелл. Главную роль в
процессах движения играют актин и миозин —
специфические белки мышечной ткани, и белок
цитоскелета тубулин, что обеспечивает тончайшие
процессы жизнедеятельности клеток — расхождение
хромосом в процессе митоза.
11. Функции белков Защитная функция
Защитную функцию, предупреждаяинфекционный процесс и сохраняя устойчивость
организма, выполняют иммуноглобулины крови, факторы
системы комплемента, пропердин, при повреждении
тканей работают белки свертывающей системы крови —
например, фибриноген, протромбин, антигемофильный
глобулин. В результате свертывания образуется сгусток
крови, предохраняющий от потери крови при ранениях.
Механическую защиту и поддержку клеток
осуществляют протеогликаны.
12. Функции белков Функции белков крови
Плазма крови человека в норме содержит более100 видов белков. Примерно 90% общего белка
составляют альбумины,
иммуноглобулины, липопротеины, фибриноген,
трансферрин; другие белки присутствуют в плазме в
небольших количествах.
В регуляции содержания белков плазмы на
определенном уровне большое значение имеет печень,
которая полностью синтезирует фибриноген и
альбумины крови, большую часть α- и β-глобулинов,
клетки ретикулоэндотелиальной системы костного мозга
и лимфатических узлов.
13. Функции белков Функции белков крови
Белки плазмы крови выполняют несколько важныхфункций:
• поддерживают постоянство коллоидно-осмотического
давления крови, интерстиция и внутриклеточных
пространств — в первую очередь, альбумины;
• Белковая буферная система участвует в поддержании
кислотно-основного состояния — альбумины, гемоглобин;
• удерживают в связанном состоянии и транспортируют
ионы кальция, магния, железа, меди и другие ионы,
препятствуя их потере с мочой — альбумины и
специфические транспортные белки;
• связывают и транспортируют органические вещества
(углеводы, липиды, гормоны, лекарства, витамины,
токсины) — альбумины и другие белки;
14. Функции белков Функции белков крови
• определяют вязкость крови и сохраняют устойчивостьэритроцитов и лейкоцитов в кровотоке, обеспечивают
нормальный кровоток в капиллярах (реологические свойства
крови) — белки свертывающей системы;
• являются резервом аминокислот;
• специализированные белки, участвующие в свертывании
крови (фибриноген, протромбин, антигемофильный глобулин
и др.);
• обеспечивают иммунную защиту организма —
иммуноглобулины, факторы системы комплемента,
трансферрин и пропердин;
• обеспечивают неспецифическую защиту организма при
повреждении тканей — белки острой фазы.
15. Функции белков нарисовать схему Структурная (опорная) функция Ферментативная (каталитическая) функция Рецепторная и
Функции белковСтруктурная (опорная) функция Ферментативная (каталитическая) функция Рецепторная и
гормональная функция Транспортная функция Резервная (питательная) функция Сократительная функция
Защитная функция Функции белков крови
нарисовать схему
16. БЕЛКИ
Белками, или белковыми веществами, называютвысокомолекулярные органические соединения,
молекулы которых построены из остатков α-аминокислот,
связанных между собой пептидными связями.
Природные белки формируются исходя из 21
аминокислоты. В состав молекул большинства белков
входит по 300 – 500 аминокислотных остатков, может
достигать иногда и нескольких тысяч.
Белки можно рассматривать как биополимеры. Эти
полимеры не регулярны по своему составу.
16
17.
α-аминокислоты участвуют в синтезебелка.
В состав белковых тел входят и такие
аминокислоты, которые кроме аминогрупп содержат и
другие функциональные группы.
По своей значимости для организма все
аминокислоты делятся на:
Заменимые (синтезируются в организме)
Не заменимые (запас пополняется только с
пищей)
17
18.
НазваниеФормула
H2N
CH 2
H2N
CH
C
C
O
OH
O
OH
CH 3
H3C
CH
CH
C
O
OH
CH 3 NH2
H3C
H3C
CH
CH 2
CH
CH 3
NH 2
CH 2 CH
CH
CH 3
NH 2
C
C
O
OH
O
OH
По номенклатуре
тривиальное
Усл. Об.
α-аминоуксусная
Глицин
гли
α-аминопропионовая
Аланин
Ала
α-аминоизовалериановая
Валин
вал
α-аминоизокапроновая
Лейцин
лей
Втор.бутил –αаминоуксусная
Изолейцин
иле
18
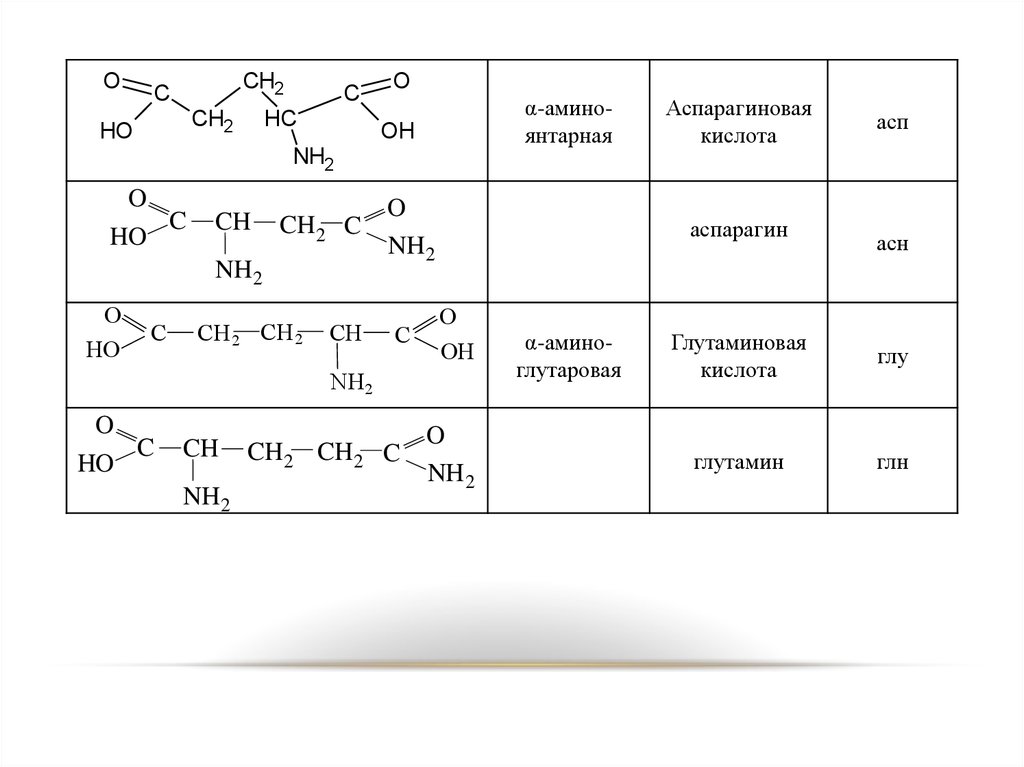
19.
OCH2
C
CH2
HO
C
HC
O
α-аминоянтарная
OH
Аспарагиновая
кислота
асп
NH2
O
C
HO
CH
CH2 C
NH 2
O
HO
C
CH 2 CH 2
CH
O
NH 2
C
аспарагин
O
OH
NH 2
O
C
HO
CH
NH 2
CH2 CH2 C
O
NH 2
α-аминоглутаровая
асн
Глутаминовая
кислота
глу
глутамин
глн
19
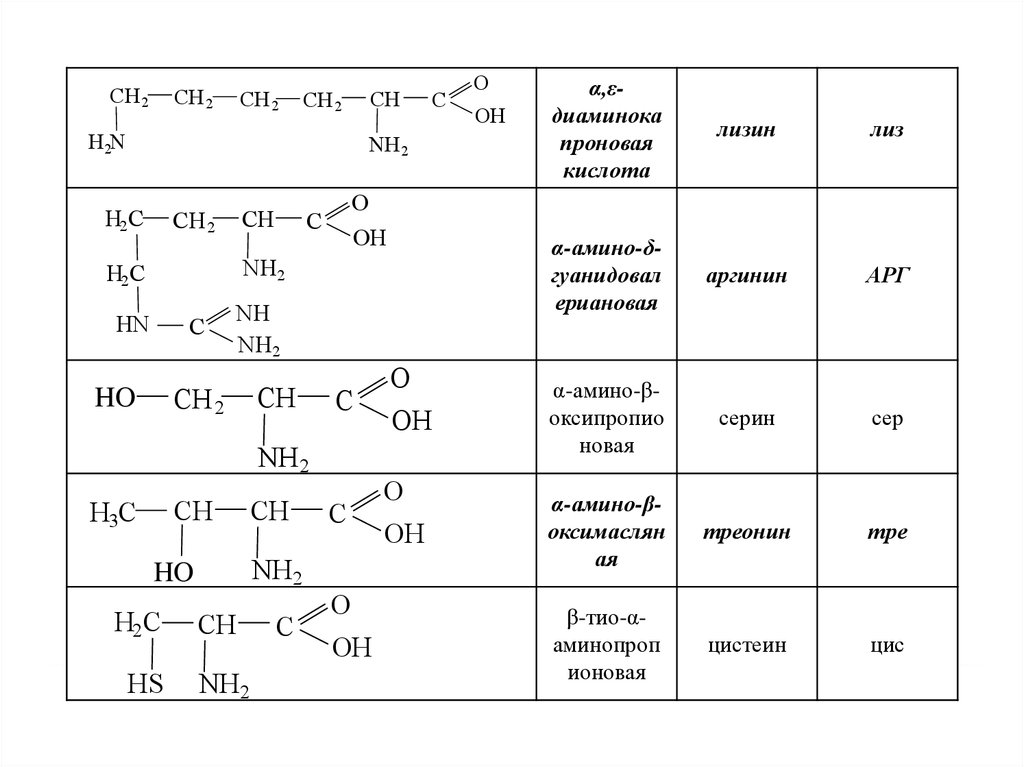
20.
CH 2CH 2
CH 2
CH
CH 2
H2N
C
NH 2
H2 C
CH
CH 2
O
OH
C
NH 2
H2 C
HN
C
NH
NH 2
CH 2
HO
CH
C
O
OH
C
O
OH
NH2
CH
H3C
CH
NH2
HO
H2 C
CH
HS
NH2
C
O
OH
O
OH
α,εдиаминока
проновая
кислота
лизин
лиз
α-амино-δгуанидовал
ериановая
аргинин
АРГ
α-амино-βоксипропио
новая
серин
сер
α-амино-βоксимаслян
ая
треонин
тре
β-тио-αаминопроп
ионовая
цистеин
цис
20
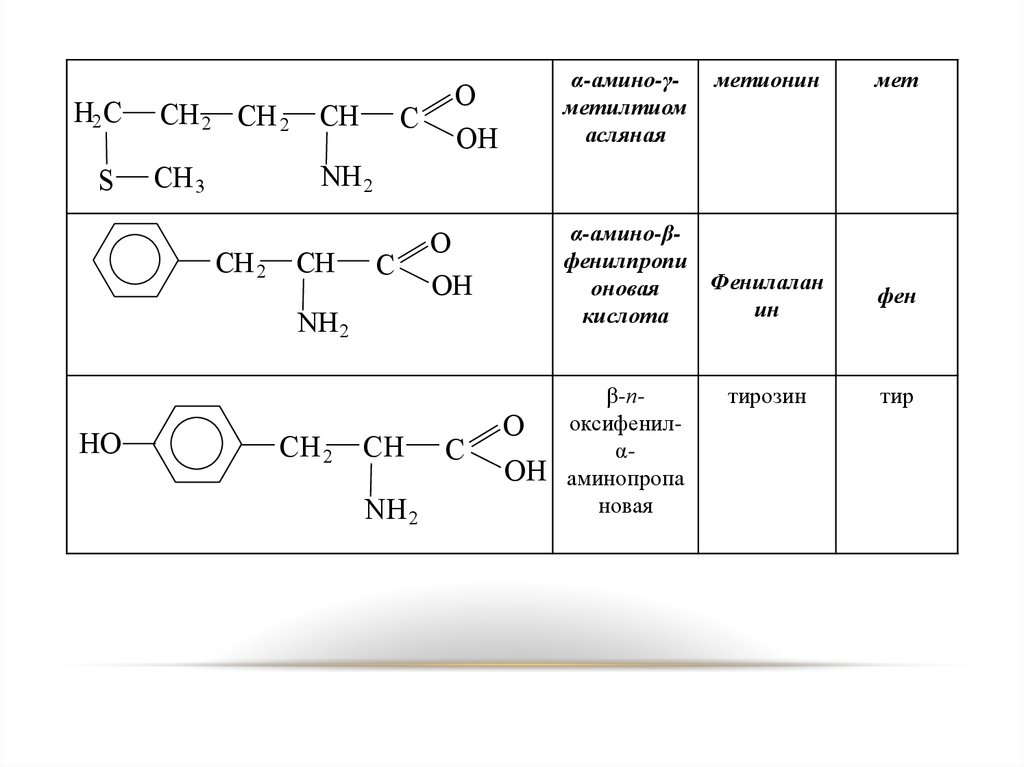
21.
H2 CS
CH 2 CH 2
CH
CH 3
NH2
CH 2
CH
C
C
α-амино-γметилтиом
асляная
O
OH
α-амино-βфенилпропи
Фенилалан
оновая
ин
кислота
O
OH
NH 2
HO
CH 2
CH
NH2
C
метионин
O
OH
β-поксифенилαаминопропа
новая
тирозин
мет
фен
тир
21
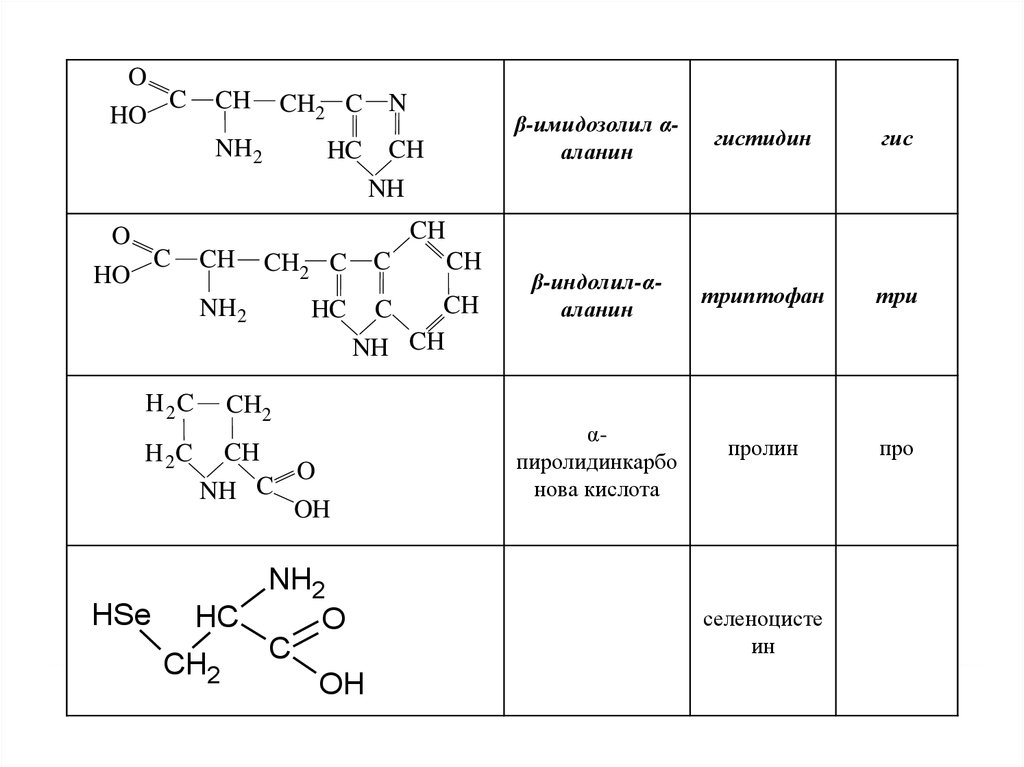
22.
OC
HO
CH
CH2 C
NH 2
HC
N
CH
β-имидозолил αаланин
гистидин
гис
β-индолил-αаланин
триптофан
три
пролин
про
NH
O
C
HO
CH
CH
NH 2
H 2C
C
CH2 C
HC
CH
CH
C
NH CH
CH2
H 2 C CH
O
NH C
OH
NH2
HSe HC
O
C
CH2
OH
αпиролидинкарбо
нова кислота
селеноцисте
ин
22
23.
Помимо наличия в большинстве природныхбелков двадцати аминокислот, в некоторых белках
обнаружены производные аминокислот:
- Оксипролин и оксилизин содержатся в белке
соединительной ткани коллагене;
-Дийодтирозин является основой структуры гормонов
щетовидной железы:
- Фосфосерин и фосфотреонин входят в состав сложных
белков – фосфопротеинов;
- ε-N-метиллизин обнаружен в составе мышечного белка
– миозина.
Кроме того в состав некоторых белков типа
кератина входит цистин.
24.
H2 CH2N
S
CH
S
CH 2
O
OH
C
C
NH 2
O
OH
цистин
цин
O
H
N
H2C
CH
C
CH
оксипролин
OH
CH CH2
HO
HO
H2N
O
CH
CH2
C
CH2
CH2
CH
OH
оксилизин
H2N
I
HO
H2N
CH
C
C
C
CH
C
CH
CH2
O
C
OH
3,5дийодтирозин
I
24
25.
NH2HO
O
P
O
OH
HC
O
CH2
C
OH
фосфосерин
NH2
HO
O
P
O
HC
HC
OH
O
фосфотреонин
C
CH3
OH
NH2
H3C
CH2
CH2 HC
CH2
NH
CH2
O
C
ε-N-метиллизин
OH
25
26. БЕЛКИ
Структура белков очень сложная. Аминокислотные остатки вмолекуле белка связаны пептидными связями и образуют пептидные
цепи.
26
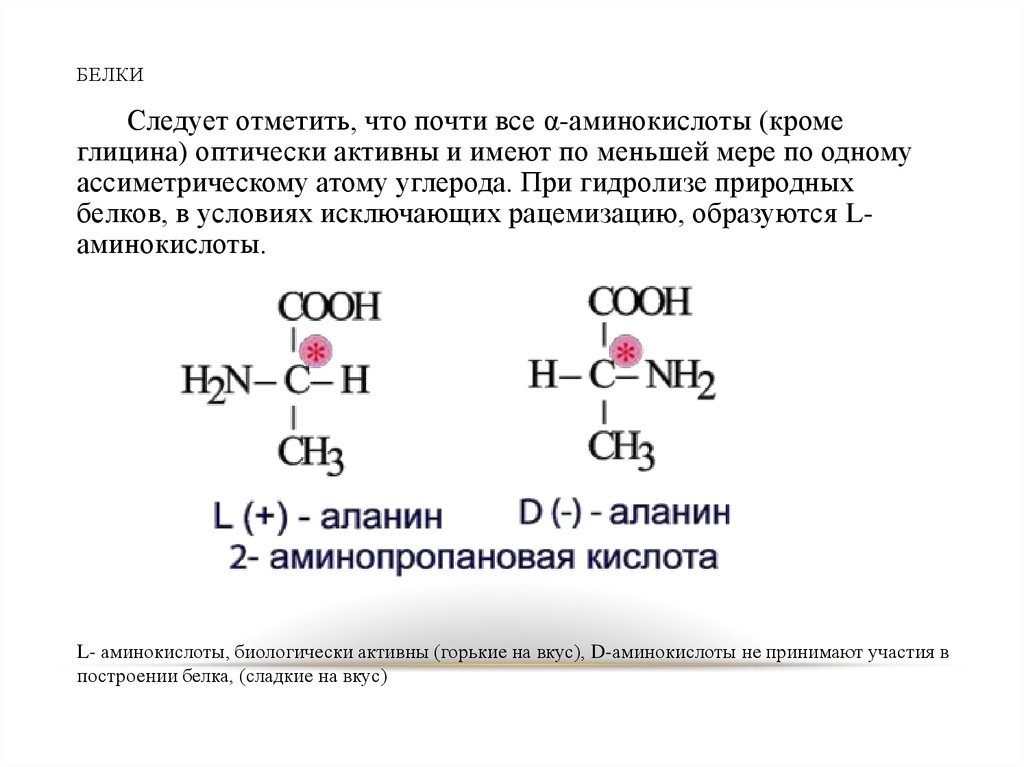
27. БЕЛКИ
Следует отметить, что почти все α-аминокислоты (кромеглицина) оптически активны и имеют по меньшей мере по одному
ассиметрическому атому углерода. При гидролизе природных
белков, в условиях исключающих рацемизацию, образуются Lаминокислоты.
L- аминокислоты, биологически активны (горькие на вкус), D-аминокислоты не принимают участия в
построении белка, (сладкие на вкус)
27
28. БЕЛКИ
Отдельные пептидные цепи или их участки могут быть связанымежду собой дисульфидными , солевыми или водородными связями.
Солевые связи образуются между свободными аминогруппами
(например, концевая аминогруппа, расположенная на одном конце
полипептидной цепи или ε-аминогруппа лизина) и свободными
карбоксильными группами (концевая карбоксильная группа цепи
или свободные карбоксильные группы двухосновных аминокислот);
Водородные связи могут возникать между атомом кислорода
карбонильной группы и атомом водорода аминогруппы, а также за
счет гидроксогрупп оксиаминокислот и кислорода пептидных групп.
28
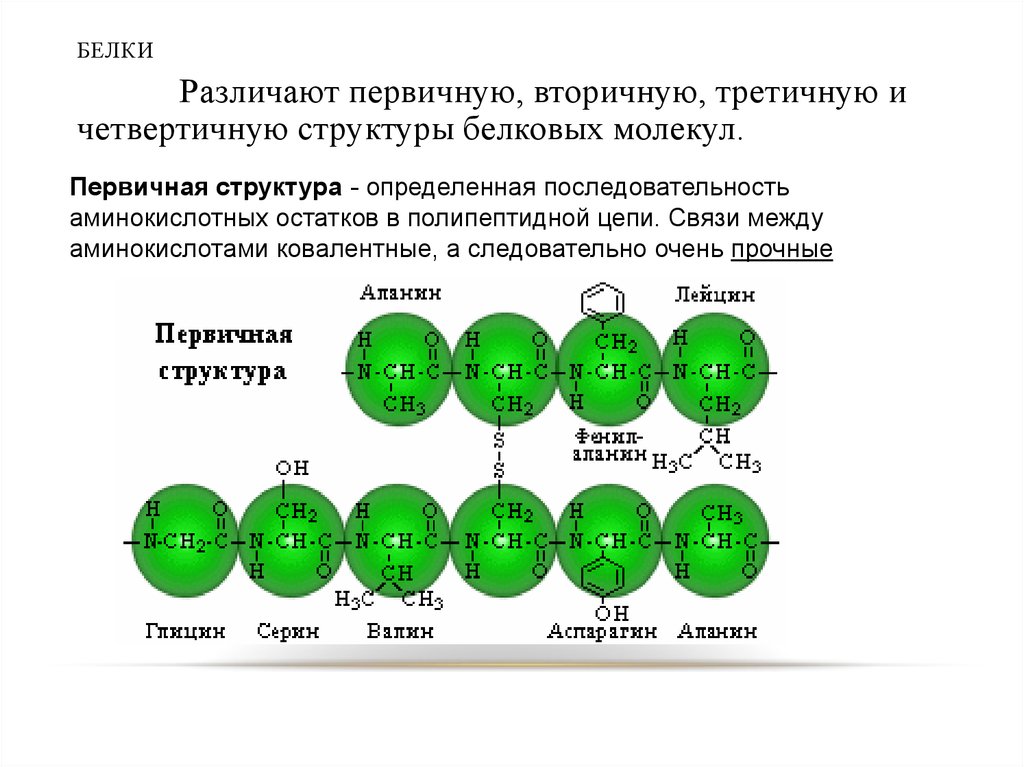
29. БЕЛКИ
Различают первичную, вторичную, третичную ичетвертичную структуры белковых молекул.
Первичная структура - определенная последовательность
аминокислотных остатков в полипептидной цепи. Связи между
аминокислотами ковалентные, а следовательно очень прочные
29
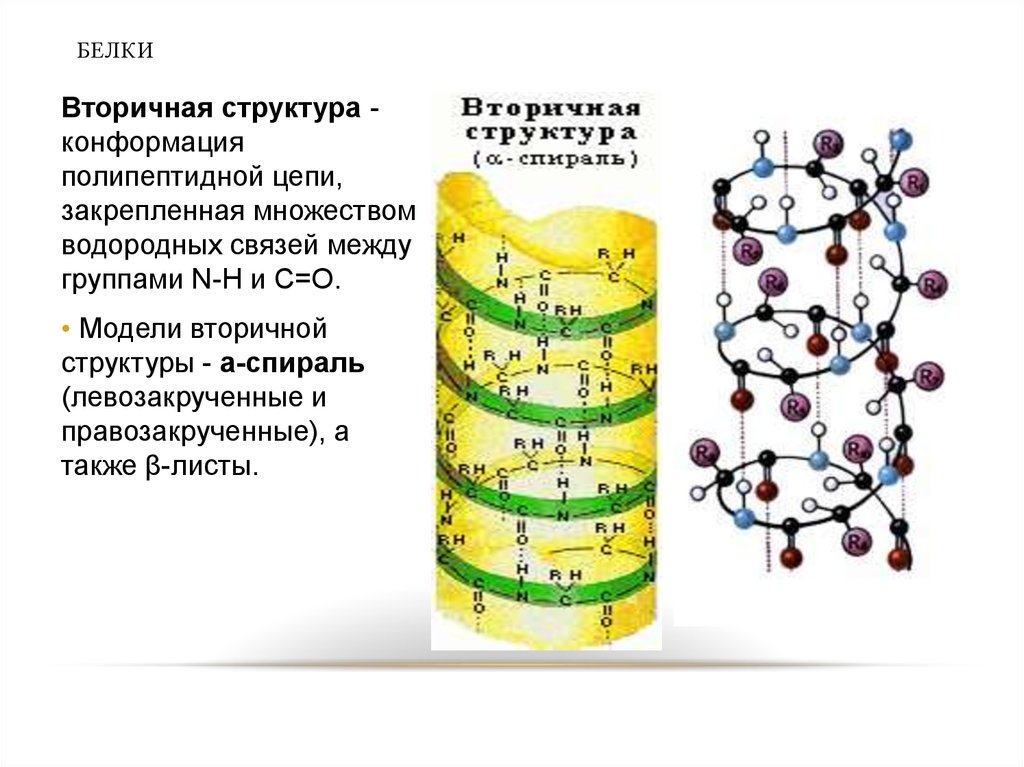
30. БЕЛКИ
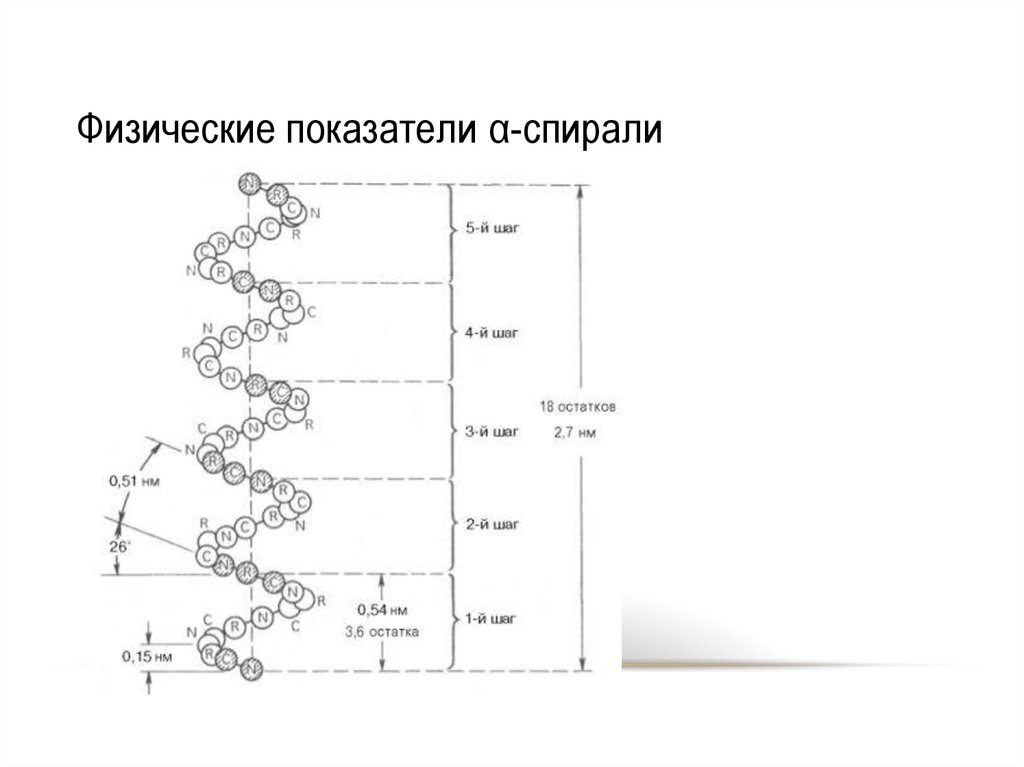
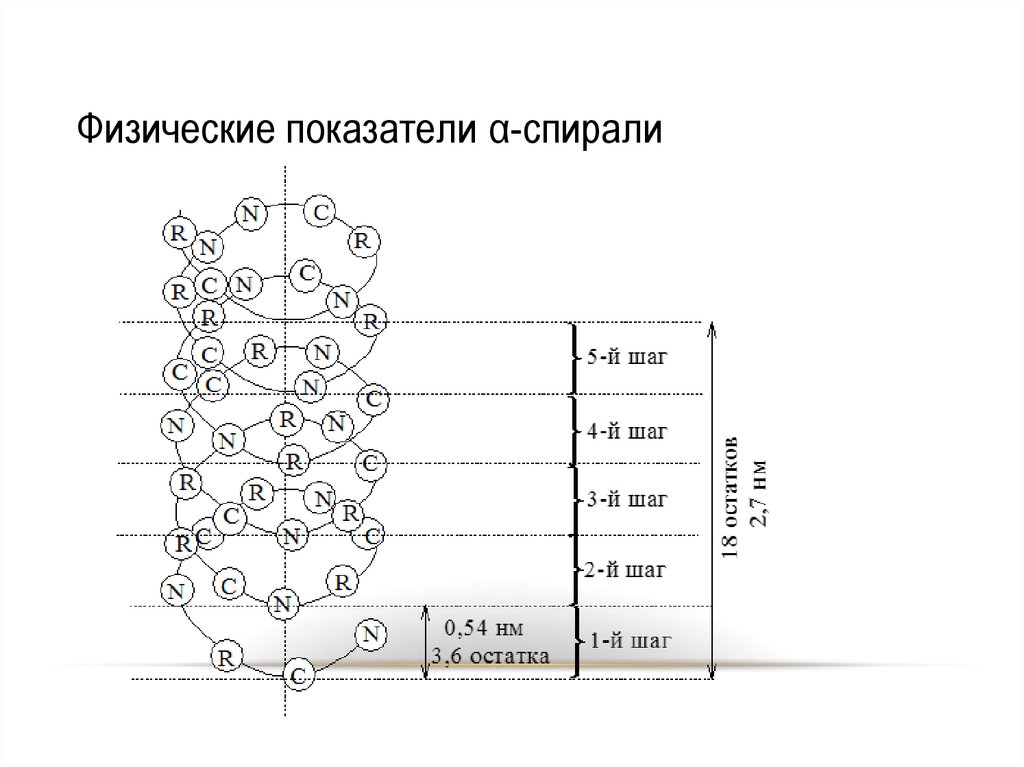
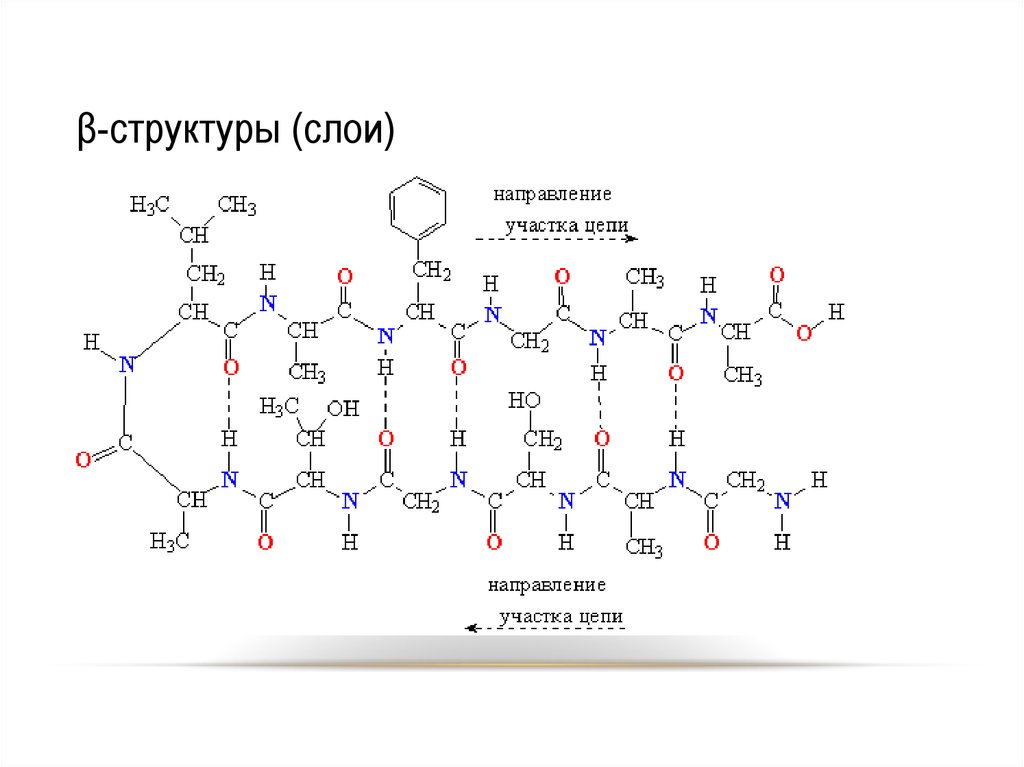
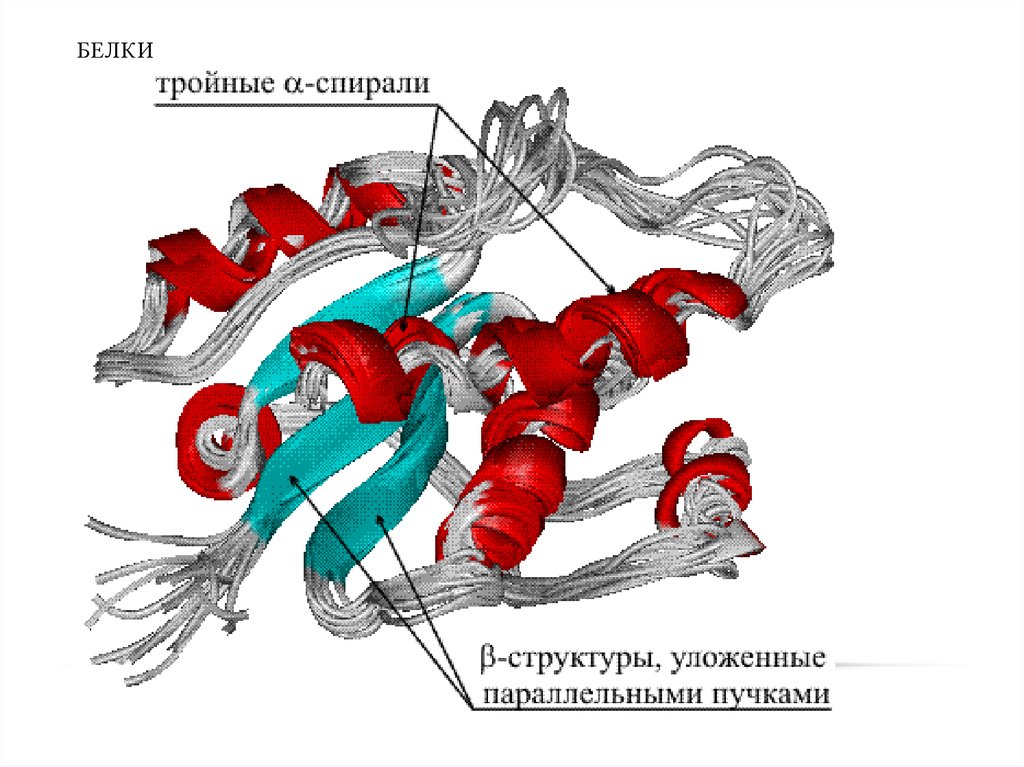
Вторичная структура конформацияполипептидной цепи,
закрепленная множеством
водородных связей между
группами N-H и С=О.
• Модели вторичной
структуры - a-спираль
(левозакрученные и
правозакрученные), а
также β-листы.
30
31. Физические показатели α-спирали
32. Физические показатели α-спирали
33. β-структуры (слои)
34. β-структуры (слои)
35. БЕЛКИ
Третичная структура –это пространственное
строение, включая
конформацию, всей
молекулы белка,
состоящей из единой цепи.
Особое свернутое
состояние молекулы белка.
35
36. БЕЛКИ
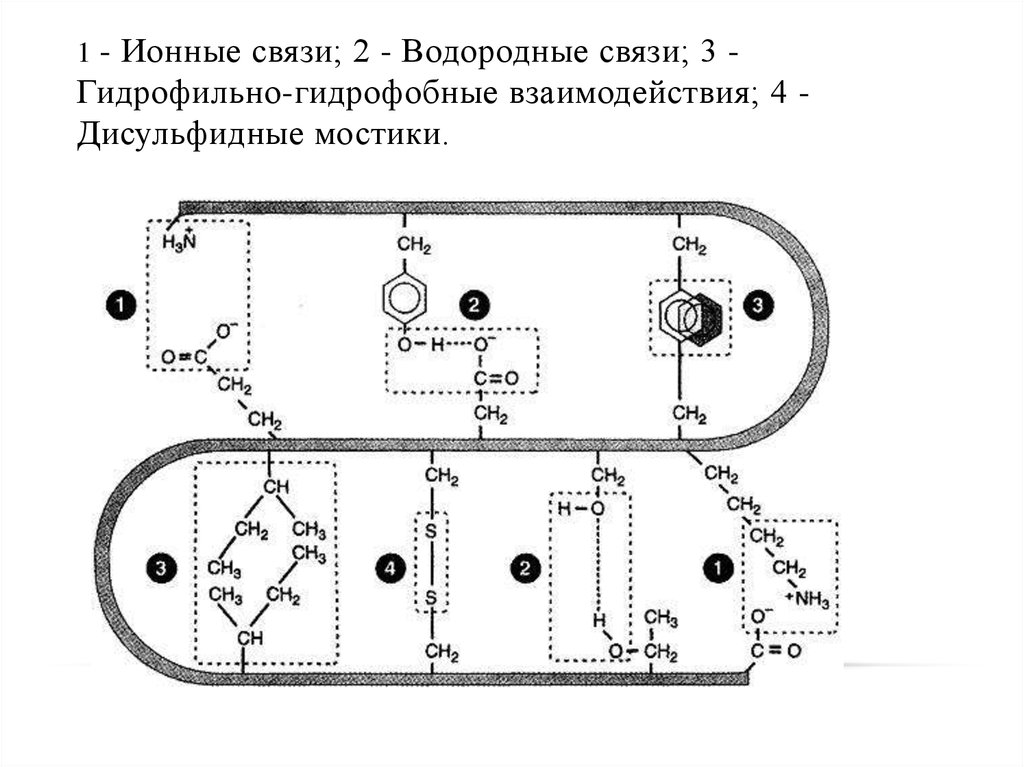
3637. Связи, поддерживающие третичную структуру белковой молекулы
• Ковалентные связи между двумя остатками цистеина –дисульфидные мостики;
• Ионные связи между противоположно заряженными боковыми
группами аминокислотных остатков;
• Водородные связи;
• Гидрофильно-гидрофобные взаимодействия. При
взаимодействии с окружающими молекулами воды белковая
молекула «стремится» свернуться так, чтобы неполярные
боковые группы аминокислот оказались изолированными от
водного раствора; на поверхности молекулы оказываются
полярные гидрофильные боковые группы.
38. 1 - Ионные связи; 2 - Водородные связи; 3 - Гидрофильно-гидрофобные взаимодействия; 4 - Дисульфидные мостики.
1 - Ионные связи; 2 - Водородные связи; 3 -Гидрофильно-гидрофобные взаимодействия; 4 Дисульфидные мостики.
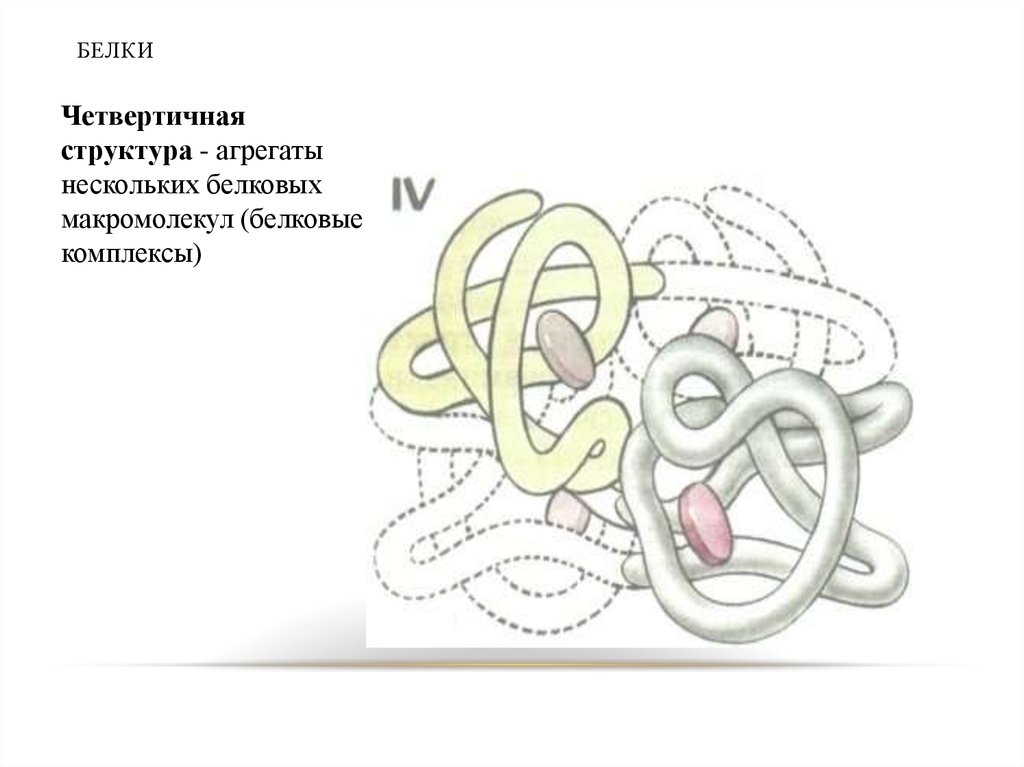
39. БЕЛКИ
Четвертичнаяструктура - агрегаты
нескольких белковых
макромолекул (белковые
комплексы)
39
40. БЕЛКИ
Все белки, независимо от того к какойгруппе они относятся и какие функции выполняют,
построены из относительно небольшого набора (обычно
20 (21)) аминокислот, которые расположены в различной,
но всегда строго определенной для данного вида белка
последовательности.
Белки подразделяют на протеины и протеиды.
Протеины – простые белки, состоящие только из
остатков аминокислот.
Альбумины – обладают сравнительно небольшой
молекулярной массой, хорошо растворимы в воде, при
нагревании свертываются.
40
41. БЕЛКИ
Глобулины – не растворимы в чистой воде, норастворимы в теплом 10%-ном растворе NaCl.
Проламины – незначительно растворимы в воде, но
растворимы в 60÷80%-ном водном этиловом спирте.
Глютелины – растворимы только в 0,2%-ной
щелочи.
Протамины – совершенно не содержат серы.
Пртеиноиды – нерастворимые белки.
Фосфопротеины – содержат фосфорную кислоту
(козеин).
41
42. БЕЛКИ
Пртеиды – сложные белки, в состав которых наряду саминокислотами входят углеводы, липиды,
гетероциклические соединения, нуклеиновые кислоты,
фосфорная кислота.
Липопротеиды – гидролизуются на простой белок и
липиды. (зерна хлорофила, протоплазма клеток).
Гликопротеиды – гидролизуются на простые белки и
высокомолекулярные углеводы. (слизистые выделения
животных).
Хромопротеиды – гидролизуются на простые белки и
красящие вещества (гемоглобин)
Нуклеопротеиды – гидролизуются на простые белки
(обычно протамины) и нуклеиновые кислоты
42
43. ГОМОЛОГИЧЕСКИЙ РЯД
H2NC
O
OH
C
O
OH
CH 2 C
O
OH
CH 2
H3C
CH
NH2
CH 2
H2N
CH
CH 2
NH2
H3C
H2N
C
O
OH
CH
CH 2
C
O
OH
C
O
OH
H3C
CH 2
H2N
(CH 2 )2
2-аминоэтановая
α-аминоуксусная
глицин
2-аминопропановая
α-аминопропионовая
α-аланин
3-аминопропановая
β-аминопропионовая
β-аланин
2-аминобутановая
α-аминомасляная
3-аминобутановая
β-аминомасляная
4-аминобутановая
γ-аминомасляная
43
44.
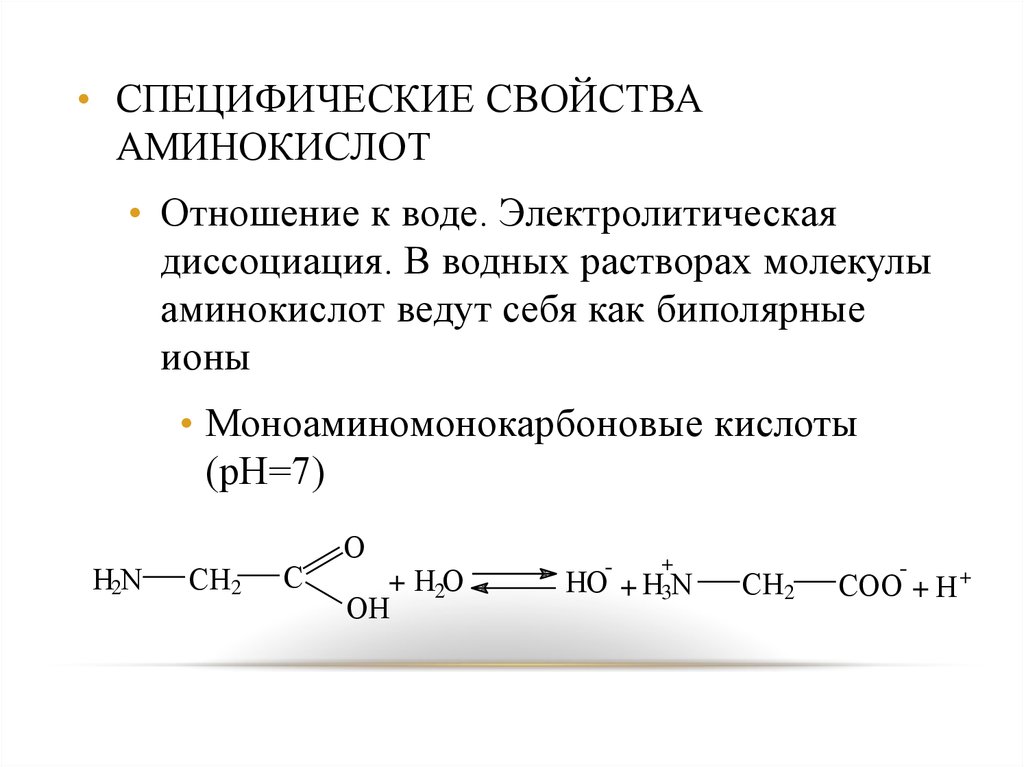
• СПЕЦИФИЧЕСКИЕ СВОЙСТВААМИНОКИСЛОТ
• Отношение к воде. Электролитическая
диссоциация. В водных растворах молекулы
аминокислот ведут себя как биполярные
ионы
• Моноаминомонокарбоновые кислоты
(рН=7)
H2N
CH2
C
O
+ H2O
OH
-
HO
+
+ H3N
CH2
-
COO + H +
44
45.
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Отношение к воде.
• Диаминомонокарбоновые кислоты (рН>7)
C
O
-
+
H3N
CH
CH2
H2N
CH
H2C
CH2
H2C
CH2
H2C
H2C
NH2
+ 2 H2O
OH
HO +
CH2
-
COO + H +
+
NH3 + OH
-
45
46.
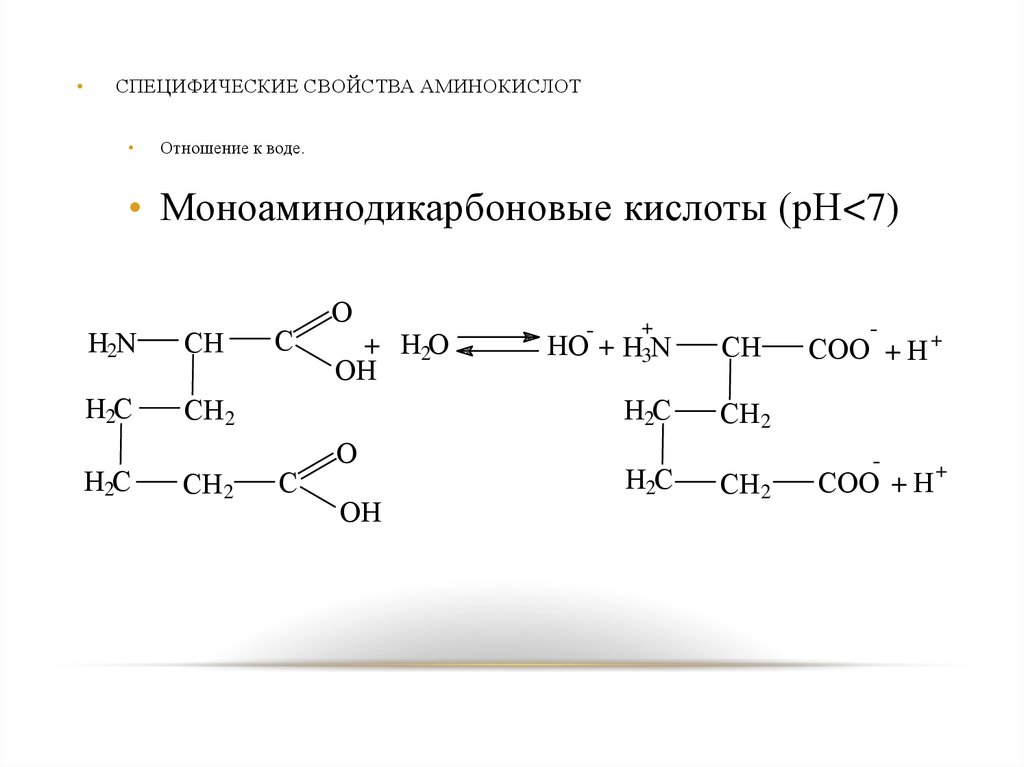
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Отношение к воде.
• Моноаминодикарбоновые кислоты (рН<7)
H2N
CH
H2C
CH2
H2C
CH2
C
C
O
+ H2O
OH
O
OH
-
HO +
+
H3N
CH
H2C
CH2
H2C
CH2
-
COO + H +
-
COO + H
+
46
47.
В кристаллическом виде α-аминокислотыприбывают в состоянии цвиттериона
47
48.
Белок можно создать искусственно.Чтобы соединить две аминокислоты
пептидной связью, необходимо: а) защитить
карбоксильную группу одной кислоты
(например: превратив её в эфирную) и
аминогруппу другой кислоты (ацелированием);
б) образовать пептидную связь; в) снять
защитные группы, обычно реакцией гидролиза,
но в таких условиях, что бы не пострадала
пептидная связь.
48
































 Биология
Биология








