Похожие презентации:
Дизайн дослідження IMpower010
1.
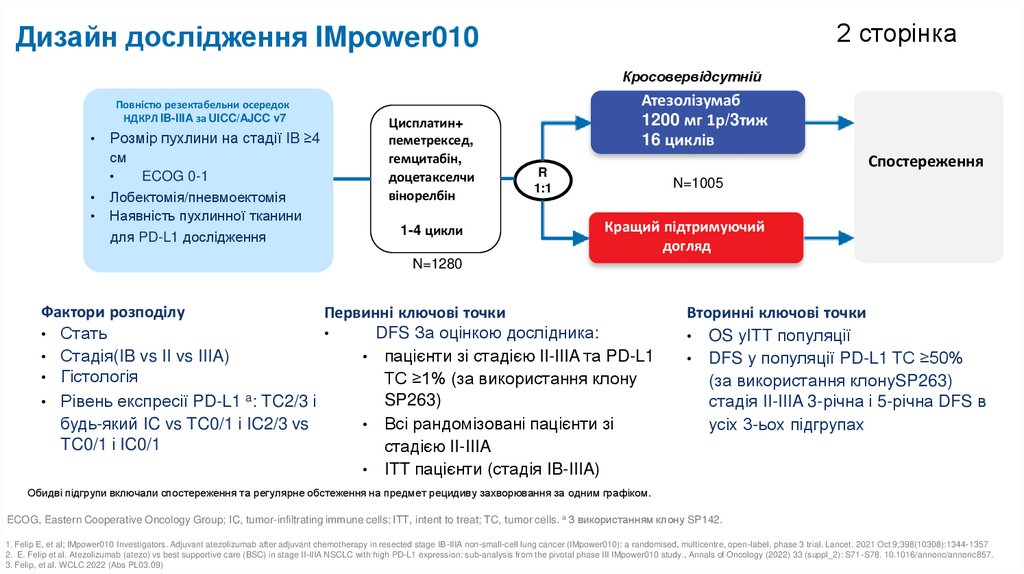
2 сторінкаДизайн дослідження IMpower010
Кросовервідсутній
Повністю резектабельни осередок
НДКРЛ IB-IIIA за UICC/AJCC v7
Розмір пухлини на стадії IB ≥4
см
ECOG 0-1
Лобектомія/пневмоектомія
Наявність пухлинної тканини
для PD-L1 дослідження
Цисплатин+
пеметрексед,
гемцитабін,
доцетакселчи
вінорелбін
1-4 цикли
Атезолізумаб
1200 мг 1р/3тиж
16 циклів
Спостереження
R
1:1
N=1005
Кращий підтримуючий
догляд
N=1280
Фактори розподілу
Первинні ключові точки
DFS За оцінкою дослідника:
• Стать
• Стадія(IB vs II vs IIIA)
• пацієнти зі стадією II-IIIA та PD-L1
• Гістологія
TC ≥1% (за використання клону
a
SP263)
• Рівень експресії PD-L1 : TC2/3 і
будь-який IC vs TC0/1 і IC2/3 vs
• Всі рандомізовані пацієнти зі
TC0/1 і IC0/1
стадією II-IIIA
• ITT пацієнти (стадія IB-IIIA)
Вторинні ключові точки
• OS уITT популяції
• DFS у популяції PD-L1 TC ≥50%
(за використання клонуSP263)
стадія II-IIIA 3-річна і 5-річна DFS в
усіх 3-ьох підгрупах
Обидві підгрупи включали спостереження та регулярне обстеження на предмет рецидиву захворювання за одним графіком.
ECOG, Eastern Cooperative Oncology Group; IC, tumor-infiltrating immune cells; ITT, intent to treat; TC, tumor cells. a З використанням клону SP142.
1. Felip E, et al; IMpower010 Investigators. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021 Oct 9;398(10308):1344-1357
2. E. Felip et al. Atezolizumab (atezo) vs best supportive care (BSC) in stage II-IIIA NSCLC with high PD-L1 expression: sub-analysis from the pivotal phase III IMpower010 study., Annals of Oncology (2022) 33 (suppl_2): S71-S78. 10.1016/annonc/annonc857.
3. Felip, et al. WCLC 2022 (Abs PL03.09)
2.
DFS у ключових підгрупах пацієнтів з рівнем експресії PD-L1 TC ≥50%Стадії II-IIIA
5 сторінка
Підгрупа
n
HR (95% CI)
Підгрупа
n
HR (95% CI)
Всі пацієнти
229
0.43 (0.27, 0.68)
Всі пацієнти
229
0.43 (0.27, 0.68)
<65 yроків
138
0.44 (0.24, 0.80)
≥65 років
91
0.43 (0.21, 0.87)
II
119
0.51 (0.26, 1.00)
IIIA
110
0.38 (0.20, 0.72)
N0
51
1.09 (0.39, 3.07)
N1
95
0.29 (0.12, 0.72)
N2
83
0.35 (0.18, 0.68)
Вік
Стать
Стадії
Регіонарні л/вузли (pN)
Чоловіки
167
0.50 (0.28, 0.89)
Жінки
62
0.34 (0.15, 0.76)
Європеоїдна
161
0.37 (0.21, 0.67)
Азіатська
62
0.52 (0.22, 1.22)
0
131
0.34 (0.18, 0.65)
Позитивний
14
0.33 (0.06, 1.75)
1
97
0.60 (0.31, 1.19)
Негативний
124
0.39 (0.20, 0.76)
Невідомий
91
0.48 (0.24, 0.98)
Відсутній
31
0.46 (0.17, 1.25)
В минулому/поточний
198
0.40 (0.24, 0.68)
Раса
ECOG PS
Анамнез куріння
Гістологічний підтип
Плоскоклітинний
92
0.60 (0.29, 1.26)
Неплоскоклітинний
137
0.36 (0.20, 0.65)
HR
Атезолізумаб краще КПТ краще
Статус мутацій EGFR
ALK статус
Позитивний
6
0.00 (0.00, NE)
Негативний
124
0.45 (0.24, 0.84)
Невідомий
99
0.43 (0.21, 0.87)
HR
Атезолізумаб краще КПТ краще
1. Felip E, et al; IMpower010 Investigators. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021 Oct 9;398(10308):1344-1357
2. E. Felip et al. Atezolizumab (atezo) vs best supportive care (BSC) in stage II-IIIA NSCLC with high PD-L1 expression: sub-analysis from the pivotal phase III IMpower010 study., Annals of Oncology (2022) 33 (suppl_2): S71-S78. 10.1016/annonc/annonc857.
3. Felip, et al. WCLC 2022 (Abs PL03.09)
3.
Частота та характер рецидивів захворювання в популяціїпацієнтів з рівнем експресії PD-L1 TC ≥50% стадії II-IIIA
Зменшення загального ризику рецидиву спостерігалося при застосуванні атезолізумабу (22%
пацієнтів) порівняно з кращою підтримуючою терапією (44% пацієнтів), з деякими відмінностями у
характері рецидиву залежно від локалізації
Пацієнти з рецидивом захворювання
6 сторінка
Рецидив, n (%)
Atezo (n=115)
BSC (n=114)
Лише місцевийb
15 (13)
17 (15)
Відділений
10 (9)
30 (26)
Лише віддаленийc,d
6 (5)
21 (18)
Лише ЦНС
1 (1)
7 (6)
Місцевий + віддалений
4 (4)
9 (8)
Друга легеня (первинний)
0
3 (3)
ЦНС, центральна нервова система. Дані про рецидиви були подібними в популяції PD-L1 TC ≥50%, за винятком пацієнтів з EGFR/ALK+. b Включає пацієнтів лише з «локальним»
та/або «регіональним» рецидивом. c Включає пацієнтів лише з віддаленими локалізаціями; у пацієнтів може бути >1 віддалена ділянка. d Рецидиви були у кістки/кістковий мозок,
ЦНС, контралатеральну легеню, іпсилатеральну легеню, печінку, лімфатичний вузол та інше.
1. Felip E, et al; IMpower010 Investigators. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021 Oct 9;398(10308):1344-1357
2. E. Felip et al. Atezolizumab (atezo) vs best supportive care (BSC) in stage II-IIIA NSCLC with high PD-L1 expression: sub-analysis from the pivotal phase III IMpower010 study., Annals of Oncology (2022) 33 (suppl_2): S71-S78. 10.1016/annonc/annonc857.
3. Felip, et al. WCLC 2022 (Abs PL03.09)
4. Спостерігається тенденція щодо збільшення загальної виживаності (ЗВ) при першому проміжному аналізі в популяції PD-L1 TC ≥1%
стадії II–IIIA82.1%
76.8%
78.9%
Загальна виживаність
67.5%
Атезолізумаб
(n=248)
КПТ
(n=228)
52 (21.0%)
64 (28.1%)
Медіана ЗВ (95%
CI), міс
НД
НД
HR (95% CI)*
0.71 (0.49, 1.03)
Події, n (%)
Медіана спостереження : 46 місяців
Місяці
Зріз даних: 18 квітня 2022
*Стратифіковано
НД, Не досягнуто, КПТ – краща підтримуюча терапія
7 сторінка
1. Felip E, et al; IMpower010 Investigators. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021 Oct 9;398(10308):1344-1357 2.
E. Felip et al. Atezolizumab (atezo) vs best supportive care (BSC) in stage II-IIIA NSCLC with high PD-L1 expression: sub-analysis from the pivotal phase III IMpower010 study., Annals of Oncology (2022) 33 (suppl_2): S71-S78. 10.1016/annonc/annonc857. 3.
Felip, et al. WCLC 2022 (Abs PL03.09)
5.
Профіль безпеки Тецентрика був керованим і відповідав відомомупрофілю монотерапії Тецентриком2
Найпоширеніші побічні реакції при застосуванні Тецентрику загалом були низького ступеня тяжкості2
Побічні ефекти, що виникають
у ≥10% усіх пацієнтів
Тецентрик*
*
Краща підтримуюча терапія
Ступені 3-4*
(%)
Усі ступені *
(%)
Ступені 3-4*
(%)
22
71
12
Кашель
93+
13
0
9
0
Дихоманка
13
1
2
<1
Гіпотериоз
11
0
1
0
Підвищення рівня АЛТ
11
2
3
<1
Підвищення рівня АСТ
Артралгія
11
11
1
<1
3
5
0
0
Свербіж
Назофарингіт
10
7
0
0
1
10
0
0
Пацієнти
Будь-які побічні ефекти
Усі ступені
(%)
* The most frequent serious ARs (>1%) were pneumonia (1.8%), pneumonitis (1.6%), and pyrexia (1.2%). The most common ARs ( 1%) leading to TECENTRIQ discontinuation were pneumonitis (1.4%),
hypothyroidism (1.4%), AST increased (1.4%), and ALT increased (1.0%).† Grade 5 TECENTRIQ-related adverse events occurred in 1% of patients (myocarditis, interstitial lung disease, multiple organ
dysfunction syndrome, and acute myeloid leukaemia). ALT=alanine aminotransferase; AR=adverse reaction; AST=aspartate aminotransferase. The safety population comprised all randomized patients
who received ≥1 TECENTRIQ dose or who for BSC had ≥1 post-baseline assessment.
• Cерйозні побічні реакції, пов’язані з лікуванням, виникли у 7% пацієнтів, які отримували Тецентрик2
• Менше ніж 1 з 5 пацієнтів (18%) припинили лікування Тецентриком через побічні реакції2
• 65% пацієнтів пройшли повний курс лікування Тецентриком2
AR = Побічні реакції
6.
UNMET NEEDSAFETY
EFFICACY
PRACTICALITIES
SUMMARY
REFERENCES
PI
Імуноопосередковані побічні реакції були низького
ступеня важкості2
Імуноопосередковані побічні реакції, які спостерігаються у ≥1% пацієнтів2
ТЕЦЕНТРИК*
Краще підтримуюче лікування
All grades*
(%)
Grades 3-4*
(%)
All grades*
(%)
Grades 3-4*
(%)
Будь-які побічні реакції
52†
8
10
<1
Висип
18
2
0
Patients
Гепатит (діагноз та лабораторні аномалії)
17
1
4
4
<1
Гепатит (лабораторні аномалії)
16
3
4
<1
Гепатит (діагноз)
1
<1
<1
0
Гіпотериоз
17
0
<1
0
Гіпертиреоз
7
<1
<1
0
Пневмоніти
4‡
<1
<1
0
Інфузійні реакції
Недостатність наднирникових залоз
1
1
<1
<1
0
0
0
0
• Більшість побічних реакцій 3-4 важкості виникали у <1% пацієнтів, за винятком висипу та печінкових аномалій2
AR = Побічні реакції. † Includes two (<1%) Grade 5 events. ‡ Includes one (<1%) Grade 5 event.
Most common ARs
Immune related ARs
7.
Застосування препарату Тецентрик затверджено у якості ад’ювантної монотерапіїпісля резекції пухлини та хіміотерапії на основі препаратів платини дорослим
пацієнтам із НДКРЛ стадії II – IIIA з експресією PD-L1 ≥1 %
Дослідження IMpower010 (NCT02486718) продемонструвало значне покращення виживаності без
ознак захворювання при застосування препарату Тецентрик у ад’ювантному режимі після
хіміотерапії на основі препаратів платини
ТЕЦЕНТРИК дозволяє знизити ризик виникнення рецидиву на 34% в порівнянні з кращим
підтримуючим лікуванням у популяції пацієнтів з рівнем експресії PD-L1 TC ≥1% та стадії II-IIIA
НДКРЛ (HR, 0,66; 95% ДІ: 0,50, 0,88)
• У підгрупі пацієнтів з рівнем експресії PD-L1 ≥50% ризик рецидиву знижується на 57% на
фоні терапії препаратом ТЕЦЕНТРИК в порівнянні з кращим підтримуючим лікуванням
(HR, 0,43; 95% ДІ: 0,27, 0,68)
1. Felip E, et al; IMpower010 Investigators. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021 Oct 9;398(10308):1344-1357
2. E. Felip et al. Atezolizumab (atezo) vs best supportive care (BSC) in stage II-IIIA NSCLC with high PD-L1 expression: sub-analysis from the pivotal phase III IMpower010 study., Annals of Oncology (2022) 33 (suppl_2): S71-S78. 10.1016/annonc/annonc857.
3. Felip, et al. WCLC 2022 (Abs PL03.09
8.
IMpower010: Висновки• IMpower010 – дослідження III фази НДКРЛ, що продемонструвало збільшення DFS при застосуванні
атезолізумабу після ад’ювантної хіміотерапії на основі платини
• Застосування атезолізумабу в ад’ювантному режимі після повної резекції та ад’ювантної хіміотерапії
продемонструвало статистично значущу перевагу у DFS у пацієнтів з PD-L1 TC ≥1% та стадією II-IIIA (HR, 0.66;
95% CI: 0.50, 0.88) та всіх рандомізованих пацієнтів зі стадією II-IIIA (HR, 0.79; 95% CI: 0.64, 0.96) з найбільшою
перевагою для пацієнтів з високим рівнем PD-L1
• Тенденція щодо загальної виживаності на користь атезолізумабу спостерігалася в популяції PD-L1
TC ≥1% стадії II-IIIA (ОВ HR, 0,71 [95% ДІ: 0,49, 1,03]) під час першого аналізу 18 квітня 2022.
• У субпопуляції PD-L1 TC ≥50% стадії II-IIIA спостерігалася клінічно значуща тенденція збільшення загальної
виживаності на користь атезолізумабу (OS HR, 0,43 [95% ДІ: 0,24, 0,78])
• Профіль безпеки атезолізумабу був порівнянним з попереднім досвідом монотерапії
атезолізумабом згідно діючих показань та напрямків терапії
• Атезолізумаб можна вважати варіантом ад'ювантного лікування, що змінює нинішню практику, для
пацієнтів з НДКРЛ на стадії II-IIIA з рівнем PD-L1 експресії ≥1%
1. Felip E, et al; IMpower010 Investigators. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021 Oct 9;398(10308):1344-1357
2. E. Felip et al. Atezolizumab (atezo) vs best supportive care (BSC) in stage II-IIIA NSCLC with high PD-L1 expression: sub-analysis from the pivotal phase III IMpower010 study., Annals of Oncology (2022) 33 (suppl_2): S71-S78. 10.1016/annonc/annonc857.
3. Felip, et al. WCLC 2022 (Abs PL03.09
9.
Коротка інструкція для медичного застосування лікарського засобу Тецентрик®Склад: Діюча речовина: atezolizumab; 1 флакон (20 мл концентрату для розчину для інфузій) містить 1200 мг атезолізумабу: Лікарська форма. Концентрат для розчину для інфузій. Meханізм дії.
Aтезолізумаб є моноклональним антитілом, що блокує ліганд 1 програмованої смерті клітин (PD-L1) та блокує його взаємодію з рецепторами PD-1 і B7.1, наслідком чого є усунення опосередкованого PDL1/PD-1 пригнічення імунної відповіді, включаючи активацію протипухлинної імунної відповіді без індукування антитілозалежної клітинної цитотоксичності. Показання. Уротеліальна карцинома: Лікування
дорослих пацієнтів з місцево поширеною або метастатичною уротеліальною карциномою:яким не підходить цисплатинвмісна хіміотерапія та у яких пухлина експресує PD-L1 (PD-L1-пофарбовані імунні
клітини, що інфільтрують пухлину, покривають ≥ 5 % площі пухлини) або яким не підходить жодна платиновмісна хіміотерапія незалежно від рівня експресії PD-L1 пухлиною. Недрібноклітинний рак легень:
Ад’ювантне лікування у режимі монотерапії після резекції та хіміотерапії на основі препаратів платини дорослим пацієнтам із НДКРЛ II – IIIA стадії з експресією PD-L1 на ≥ 1 % пухлинних клітин. Лікування
першої лінії у режимі монотерапії дорослих пацієнтів із метастатичним недрібноклітинним раком легень (НДКРЛ) із високою експресією PD-L1 (PD-L1-забарвлені пухлинні клітини ≥ 50 % або PD-L1забарвлені імунні клітини, що інфільтрують пухлину, покривають ≥ 10 % площі пухлини) та без геномних пухлинних аберацій EGFR або ALK. Лікування першої лінії у комбінації з бевацизумабом,
паклітакселом та карбоплатином дорослих пацієнтів з метастатичним неплоскоклітинним НДКРЛ без геномних пухлинних аберацій EGFR або ALK. Лікування першої лінії у комбінації з паклітакселом,
зв’язаним з білком, та карбоплатином дорослих пацієнтів з метастатичним неплоскоклітинним НДКРЛ без геномних пухлинних аберацій EGFR або ALK. Лікування дорослих пацієнтів з метастатичним
НДКРЛ, у яких спостерігається прогресування захворювання під час або після хіміотерапії, що включає препарати платини, у пацієнтів з EGFR- або ALK-геномними пухлинними абераціями до отримання
препарату Тецентрик® повинно спостерігатися прогресування захворювання на фоні терапії, що схвалена для НДКРЛ з такими абераціями. Дрібноклітинний рак легені: Лікування першої лінії у комбінації з
карбоплатином та етопозидом дорослих пацієнтів з дрібноклітинним раком легені на поширеній стадії (ПС-ДКРЛ). Гепатоцелюлярна карциномa: Лікування у комбінації бевацизумабом пацієнтів із
неоперабельною або метастатичною гепатоцелюлярною карциномою, які не отримували попередню системну терапію. Протипоказання. Підвищена чутливість до атезолізумабу або будь-якої допоміжної
речовини лікарського засобу. Рекомендоване дозування препарату Тецентрик® як монотерапії при уротеліальній карциномі, НДКРЛ: 1200 мг кожні 3 тижні до прогресування захворювання або виникнення
неприйнятної токсичності. Ад’ювантне лікування НДКРЛ : рекомендована доза препарату Тецентрик® становить 1200 мг кожні 3 тижні до одного року, якщо немає рецидиву захворювання або неприйнятної
токсичності. Рекомендації щодо дозування препарату Тецентрик® у разі застосування в комбінації з іншими лікарськими засобами: при НДКРЛ 1200 мг кожні 3 тижні Тецентрик® слід вводити до хіміотерапії
та бевацизумабу за умови застосування в той самий день, при ДКРЛ 1200 мг кожні 3 тижні Тецентрик® слід вводити до хіміотерапії за умови застосування в той самий день, при ГЦК 1200 мг кожні 3 тижні
Тецентрик® слід вводити до бевацизумабу за умови застосування в той самий день, бевацизумаб застосовується у дозі 15 мг/кг кожні 3 тижні, Тецентрик® застосовують до прогресування захворювання або
виникнення неприйнятної токсичності. Побічні реакції. Для пацієнтів, які отримували препарат Тецентрик® як монотерапію, найбільш поширеними побічними реакціями (≥ 20%) пацієнтів були
слабкість/aстенія (48%), зниження апетиту (25%), нудота (24%), кашель (22%) та задишка (22%) та інші. У пацієнтів з НДКРЛ та ДКРЛ, які отримували препарат Тецентрик® у комбінації з іншими
протипухлинними засобами, найбільш поширеними побічними реакціями (≥20%) пацієнтів були слабкість/aстенія (49%), нудота (38%), aлопеція (35%), запор (29%), діарея (28%) та зниження апетиту (27%) та
інші. При ГЦК найбільш поширеними побічними реакціями, що призвели до відміни препарату Тецентрик® були кровотеча (1,2 %), підвищення рівня трансаміназ або білірубіну (1,2 %); інфузійні
реакції/синдром вивільнення цитокінів (0,9 %), аутоімунний гепатит (0,6 %) та інші. При ад’ювантному лікування НДКРЛ найбільш поширеними побічними реакціями (≥ 1 %), які призвели до передчасної
відміни препарату Тецентрик®, були пневмоніт (2,2 %), гіпотиреоз (1,6 %) та інші. Термін придатності. 3 роки. Категорія відпуску. За рецептом. Виробник Ф.Хоффманн-Ля Рош Лтд, Вурмісвег, 4303
Кайсераугст, Швейцарія. Інформацію наведено у скороченому вигляді. Більш детальна інформація щодо лікарського засобу Teцентрик® міститься у інструкції для медичного застосування, що затверджена
наказом МОЗ України від від 16.12.2021 № 2797 реєстраційне посвідчення №UA/15872/01/01. Зміни внесені Наказом МОЗ України від 18.07.2022 № 1246
У разі виникнення побічних явищ під час лікування лікарським засобом ТОВ «Рош Україна» або при наявності скарги на якість лікарського засобу звертайтеся на електронну адресу: ukraine.safety@roche.com
Запит медичної інформації про лікарські засоби ТОВ «Рош Україна» ви можете надіслати на електронну адресу: ukraine.medinfo@roche.com
ТОВ «Рош Україна»,
м.Київ, 03150,вул. Велика Васильківська,139, 5-й поверх
www.roche.ua








 Медицина
Медицина








