Похожие презентации:
Железо(Fe) и его свойства
1.
Железо(Fe) и его св-ваРабота Конников Р. и Осиповой
2.
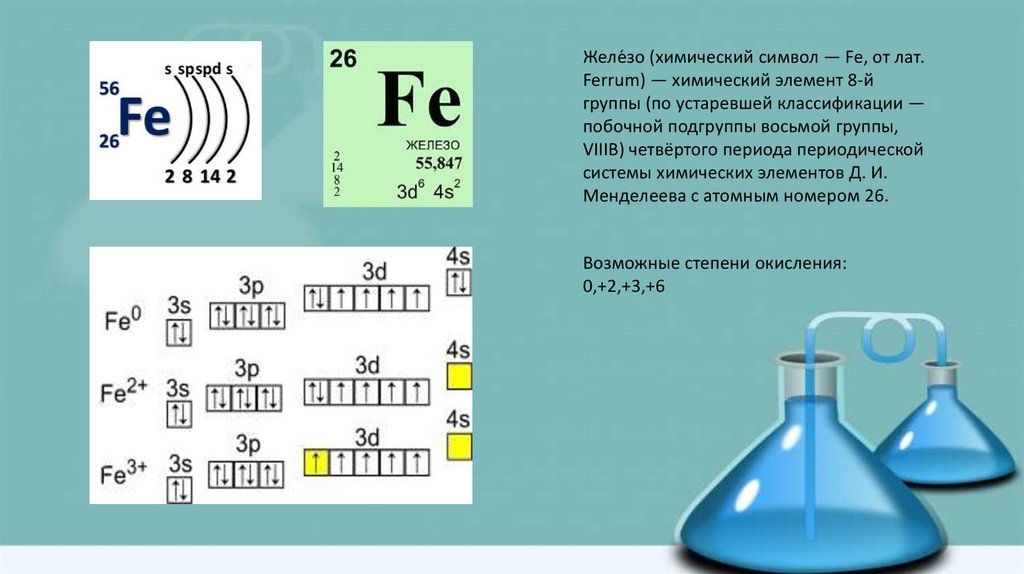
Желе́зо (химический символ — Fe, от лат.Ferrum) — химический элемент 8-й
группы (по устаревшей классификации —
побочной подгруппы восьмой группы,
VIIIB) четвёртого периода периодической
системы химических элементов Д. И.
Менделеева с атомным номером 26.
Возможные степени окисления:
0,+2,+3,+6
3.
Наиболее распространены следующиесоединения железа:
• оксиды Fe2O3 (гематит, красный железняк),
Fe3O4 (магнетит, магнитный железняк).
• гидратированный оксид Fe2O3 * nH2O
(лимонит, бурый железняк).
• карбонат FeCO3 (сидерит).
• дисульфид FeS2 (пирит).
4.
Физические св-ва:1. серебристо-белый металл;
2. весьма пластичный;
3. тяжёлый;
4. тугоплавкий (1579С);
5. обладает магнитными свойствами.
5.
Получение железа:Fe2O3 + 3CO = 2Fe + 3CO2
Важнейшие сплавы железа: сталь и чугун
6.
7.
Соединения железа IIFeSO4 + 2NaOH = Na2SO4 + Fe(OH)2 - зелёный осадок
↓ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 - бурый осадок
1) Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
2) FeO + H2SO4 = FeSO4 + H2O
8.
Соединения железа IIIFe(OH)3 + H2SO4 = Fe2(SO4)3 + 6H2O
Fe2O3 + CaO = CaFe2O4(сплавление)
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 6NaCl
2FeCl3 + Cu = 2FeCl2 + CuCl2
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
2Fe(OH)3 + 3Br2 + 10KOH + 2K2FeO4 + 6KBr + 8H2O
9.
Качественные реакции• FeCl3 + 3KSCN = 3KCl + Fe(SCN)3 - кроваво-красный раствор
• K4[Fe(CN)6] + FeCl3 = 3KCl + KFe[Fe(CN)6] - синий раствор и осадок
«берлинской лазури»
• K3[Fe(CN)6] + FeCl2 = 2KCl + KFe[Fe(CN)6]









 Химия
Химия








