Похожие презентации:
Железо, медь
1.
Железо, медь24.10.2020
1
2.
Железо. Общая информация.• Положение в Периодической системе: VIIIB группа, 4-й период
• Электронная конфигурация: [Ar]4s23d6
• Основные степени окисления: +2, +3. Менее устойчивая: +6.
• Известно с глубокой древности. Название "ghelgh" было в праиндоевропейском
языке и, по всей видимости, не имеет слов-предшественников.
• Лат. "ferrum" - нет общепринятой версии происхождения.
• Англ. "iron" - во многих древних языках (напр. кельтском, греческом, санскрите)
этот корень имел смысл "крепкий"/"сильный".
2
3.
Железо. Применение• Конструкционные материалы (сталь, чугун и другие сплавы; железобетон).
>90% от всей выплавки металлов в мире приходится на железо.
• Магнитные материалы (в т.ч. элементы памяти)
• Катализаторы:
Fe - производство аммиака по Габеру-Бошу; синтез алканов по ФишеруТропшу;
FeCl3 - алкилирование и ацилирование ароматических соединений по
Фриделю-Крафтсу)
• Аккумуляторы (напр. железо-никелевые) - невысокая эффективность, но
высокая химическая стабильность и долговечность работы.
3
4.
Железо. Получение• 4-й по распространенности в земной коре (после O, Si и Al)
• Основные добывающие страны: Китай, Бразилия, Австралия, Индия.
• Производство стали: Китай - больше 50% от мирового.
• Добывают из минералов: Fe2O3 (гематит), Fe3O4 (магнетит), FeO(OH)
(лимонит), FeCO3 (сидерит). Из FeS2 (пирит) получают серную кислоту.
• Основной путь выделения железа:
1). 2С + O2 →(t°C) 2CO↑
2). Fe2O3 + 3CO →(t°C) 2Fe + 3CO2↑
• Другие пути:
Fe2O3 + 3C →(t°C) 3CO↑ + Fe (загрязнено углеродом, серой и т.д.)
Fe2O3 + 3H2 →(t°C) 2Fe + 3H2O↑
4
5.
Хим. свойства0
Fe
• Левее водорода в ряду напряжений. Похоже по свойствам на Mn.
• Fe + 2HCl → FeCl2 (светло-зеленая окраска) + H2↑
На воздухе: FeCl2 + O2 + H2O → Fe(OH)Cl2 (постепенно)
• Fe + NaOH(р-р) = не идёт ( т.к. Fe(OH)2 - основный гидроксид )
• Железо пассивируется H2SO4(конц.) и HNO3(конц.) на холоду.
• 2Fe + 3H2O(пар) →(t°C) Fe2O3 + 3H2↑
• 4Fe + 6H2O + 3O2 →(tкомн) 4"Fe(OH)3" (медленная коррозия).
"Fe(OH)3" → Fe2O3*xH2O (непостоянный состав). "Ржавчина"
Реакции с простыми веществами:
• 3Fe + 2O2 →(t°C) Fe3O4 ("Железная окалина")
• 2Fe + 3Cl2 →(t°C) 2FeCl3 (Cl2 - сильный окислитель)
• Fe + S →(t°C) FeS (S - слабый окислитель)
5
6.
http://files.school-collection.edu.ru/dlrstore/deb6e939-f8c8fea7-fe24-7b2c80013fd7/index.htmhttp://chemnet.ru/rus/teaching/zagorskii2/lesson0/v011.html
6
7.
Хим. свойства+2
Fe
Fe(OH)2 – основный гидроксид, в воде нерастворим
С растворами кислот реагирует, с р-рами щелочей – нет.
Fe(OH)2 + H2SO4(разб.) → FeSO4 + 2H2O
Fe(OH)2 + NaOH(изб.) = не идёт
Fe(OH)2
Но! Идёт 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 (В щелочной среде - очень быстро)
• Осаждение Fe(OH)2 :
FeSO4 + 2NaOH(изб.) → Fe(OH)2↓ (грязно-зеленый) + Na2SO4
FeSO4 + 2NH3∙H2O(изб.) → Fe(OH)2↓ + (NH4)2SO4
• Пример комплекса Fe2+:
FeSO4 + 6KCN → K4[Fe(CN)6] (гексацианоферрат(II) калия,
"желтая кровяная соль")
K4[Fe(CN)6]
7
8.
Хим. свойства+2
Fe
Осадки с катионом Fe2+:
• 1. FeSO4 + (NH4)2S → FeS↓ (черный) + (NH4)2SO4
• Сульфид железа(II) растворяется в сильнокислой среде:
FeS + 2HCl(20% р-р) → FeCl2 + H2S↑
• 2. FeCl2 + 2NaHCO3 → FeCO3↓ (зеленый) + 2NaCl + CO2↑ + H2O
FeCO3
Примеры восстановительных свойств Fe+2:
• FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
• Fe(OH)2 + HNO3(разб.) → Fe(NO3)3 + NO + H2O
• FeCl2 + Br2(водн.) → FeBr3 + FeCl3
Задание на дом: самостоятельно уравнять реакции!
8
9.
Хим. свойства+3
Fe
• Fe2O3 и Fe(OH)3 – считаются амфотерными, но на деле ни оксид, ни
гидроксид в щелочах не растворяются.
• Fe2O3 инертен из-за прочной кристаллической решетки (как Cr2O3)
• Fe(OH)3 – из-за быстрого "старения" (его реальная формула - Fe2O3*xH2O).
• Старение осадка – постепенная потеря осадком кристаллизационной воды.
Обычно сопровождается снижением реакционной способности.
Очень характерно для гидроксидов переходных металлов.
• Fe2O3 + 6HCl → 2FeCl3 (желтая окраска) + 3H2O
• 2Fe(OH)3 + 3H2SO4(разб.) → Fe2(SO4)3 + 6H2O
• Осаждение гидроксида:
Fe2(SO4)3 + 6KOH → 2Fe(OH)3↓ + 3K2SO4
Fe2(SO4)3 + 6NH3*H2O → 2Fe(OH)3↓ + 3(NH4)2SO4
• Fe3+ тоже не образует аммиачных комплексов!
Fe2O3*xH2O
9
10.
Хим. свойства+3
Fe
• Железо(+3) может быть окислителем:
2FeCl3 + 2NaI → 2FeCl2 + I2↓ + 2NaCl
Fe2(SO4)3 + SO2 + 2H2O → 2FeSO4 + 2H2SO4
• Может быть восстановителем (только в щелочной среде!):
2Fe(OH)3 + 10KOH + 3Cl2 → 2K2FeO4 (фиолетовая окраска) + 6KCl + 8H2O
• Пример комплекса Fe3+:
FeCl3 + 6KCN → K3[Fe(CN)6] (гексацианоферрат(III) калия, "красная
кровяная соль")
K3[Fe(CN)6]
10
11.
Хим. свойства Fe+6• H2FeO4 ("железная кислота") и оксид FeO3 не существуют.
Соли FeO42- (ферраты) устойчивы в сильнощелочных растворах, могут
быть выделены в твердом виде
• Получение:
Fe2O3 + 3KNO3 + 4KOH →(t°C) 2K2FeO4 + 3KNO2 + 2H2O↑
Окислительная щелочная плавка!
Очень сильный окислитель:
2K2FeO4 + 16HCl(разб.) → 2FeCl3 + 3Cl2↑ + 4KCl + 8H2O
2K2FeO4 + 2NH3(разб.) + 2H2O → 2Fe(OH)3↓ + N2↑ + 4KOH
4K2FeO4 + 10H2O → 4Fe(OH)3↓ + 8KOH + 3O2↑ (при стоянии)
K2FeO4
11
12.
Качественные реакции на Fe3+:• Самая неспецифичная:
Fe3+ (желтый р-р) + 3OH- → Fe(OH)3↓ (бурый осадок)
• С роданидом (тиоцианатом)
Fe3+ + 3SCN- → Fe(SCN)3↓ (кроваво-красное окрашивание)
Fe(SCN)3
• С желтой кровяной солью:
FeCl3 + K4[Fe(CN)6] → K[FeFe(CN)6]↓ (синий осадок) + 3KCl
"Берлинская лазурь"
Берлинская лазурь
12
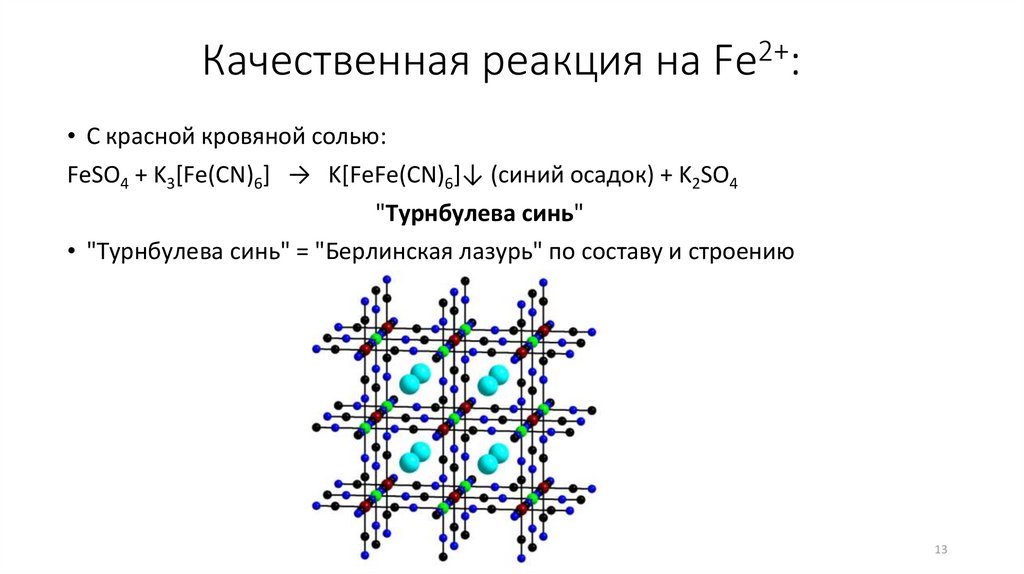
13.
Качественная реакция на Fe2+:• С красной кровяной солью:
FeSO4 + K3[Fe(CN)6] → K[FeFe(CN)6]↓ (синий осадок) + K2SO4
"Турнбулева синь"
• "Турнбулева синь" = "Берлинская лазурь" по составу и строению
13
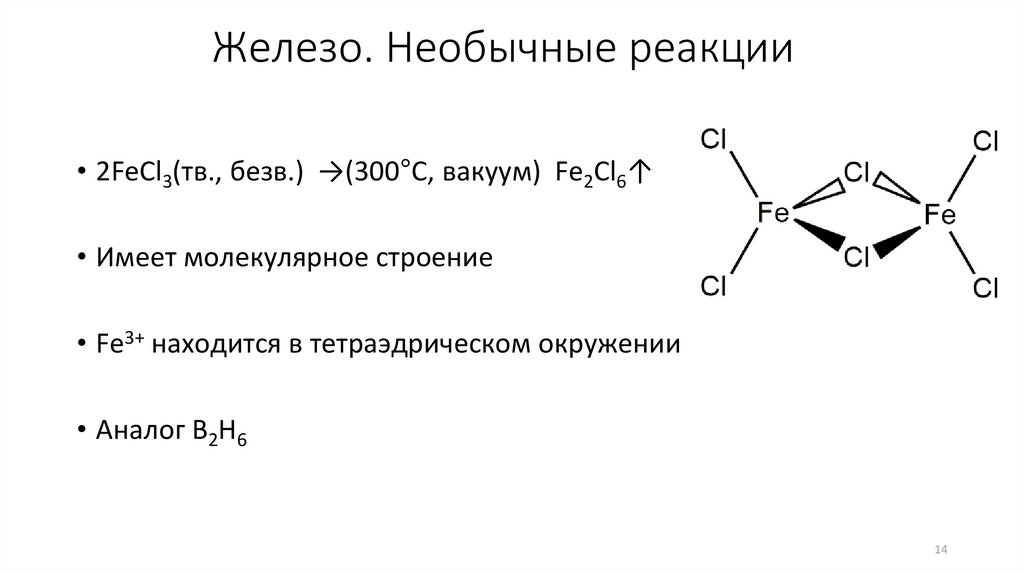
14.
Железо. Необычные реакции• 2FeCl3(тв., безв.) →(300°C, вакуум) Fe2Cl6↑
• Имеет молекулярное строение
• Fe3+ находится в тетраэдрическом окружении
• Аналог B2H6
14
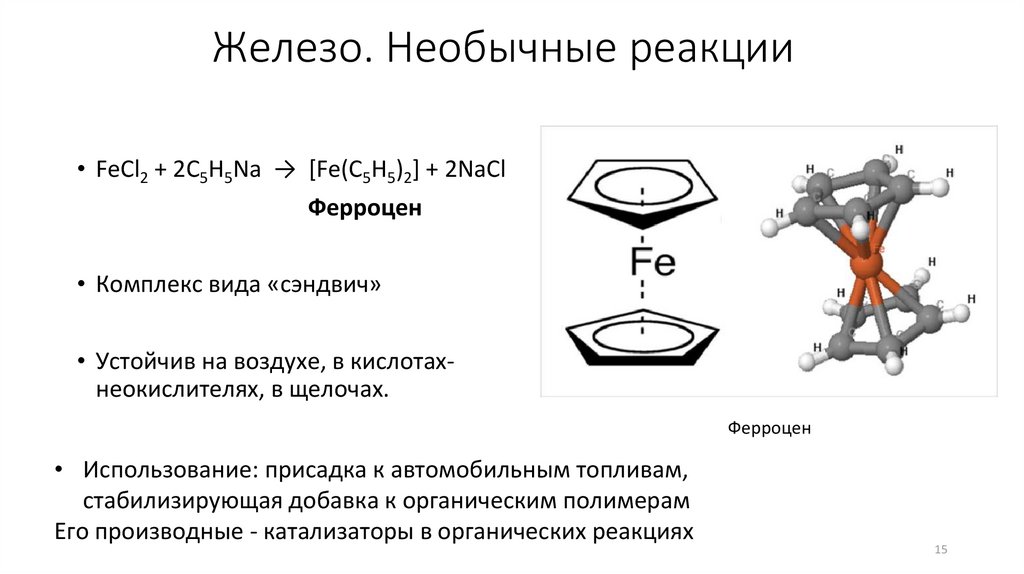
15.
Железо. Необычные реакции• FeCl2 + 2C5H5Na → [Fe(C5H5)2] + 2NaCl
Ферроцен
• Комплекс вида «сэндвич»
• Устойчив на воздухе, в кислотахнеокислителях, в щелочах.
Ферроцен
• Использование: присадка к автомобильным топливам,
стабилизирующая добавка к органическим полимерам
Его производные - катализаторы в органических реакциях
15
16.
Медь. Общая информация.• Положение в Периодической системе: IB группа, 4-й период
• Электронная конфигурация: [Ar]4s13d10 ("проскок" электрона!)
• Основные степени окисления: +1, +2. Очень неустойчива +3.
• Происхождение названия: лат. "Cuprum" произошло от названия
острова Кипр. Происхождение славянского "Медь" неизвестно.
16
17.
Медь. Применение• Электропровода и электротехника; припои (латунь - сплав меди с цинком)
• Конструкционные материалы - водопроводные трубы; покрытие крыш и
фасадов зданий; изделия из бронзы (бронза - сплав меди с оловом)
• Чеканка монет (медь, медно-никелевые сплавы)
• Катализаторы: CuCl+NH4Cl - димеризация ацетилена в винилацетилен;
порошок Cu - синтез полиацетилена (проводящий полимер).
Есть перспектива замены платины и палладия медью в каталитических
процессах.
17
18.
Медь. Получение• 25-я по распространенности в земной коре
• Основные добывающие страны: Чили, Китай, Перу, США.
• Добывают из сульфидных минералов: CuFeS2 (халькопирит), Cu2S (халькозин),
Cu5FeS4 (борнит).
• Другие известные минералы: Cu2(OH)2CO3 (малахит), Cu3(OH)2(CO3)2 (азурит).
• Основной путь выделения:
1). 2Cu2S + 3O2 →(t°C) 2Cu2O + 2SO2↑
2). Cu2S + 2Cu2O →(t°C) 6Cu + 2SO2↑ ("томление" в безвоздушной среде)
3). Электролитическое рафинирование - очистка меди:
2Cu + 2H2SO4(р-р) + O2
2CuSO4(р-р) + 2H2O
18
19.
Хим. свойства0
Cu
• Медь находится правее водорода в ряду напряжений металлов.
• Не растворяется в щелочах и кислотах-неокислителях, кроме HClконц:
2Cu + 2HCl(конц.) → 2H[CuCl2] (бесцв. раствор) + H2↑
• С водой не реагирует даже при нагревании
• Cu + 2H2SO4(конц.) → CuSO4 + SO2↑ + H2O
• Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2↑ + H2O
• 3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO↑ + H2O
Реакции с простыми веществами:
• 2Cu + O2 →(t°C) CuO (до 1000°С. Выше - Cu2O)
• Cu + Cl2 →(t°C) CuCl2 (В недостатке - CuCl)
• 2Cu + S →(t°C) Cu2S (идёт медленно и плохо)
19
20.
Хим. свойства+1
Cu
• Аквакомплекс Cu+ в водном растворе неустойчив, диспропорционирует:
Cu2O(тв.) + H2SO4(разб.) → Cu↓ + CuSO4 (голубой раствор) + H2O
• В растворе устойчив аммиачный комплекс:
4Cu + 8NH3 + 2H2O + O2 → 4[Cu(NH3)2]OH (бесцветный раствор, может
окисляться дальше до меди(+2) )
CuCl(тв.) + 2NH3(водн.) → [Cu(NH3)2]Cl (бесцветный р-р)
• Медь (+1) проявляет свойства восстановителя:
Cu2O + 3H2SO4(конц.) → 2CuSO4 + SO2↑ + 3H2O
4[Cu(NH3)2]OH + O2 + 8NH3 + 2H2O → 4[Cu(NH3)4](OH)2
20
21.
Хим. свойства+2
Cu
• Cu(OH)2 - голубой "объемный" осадок, растворяется в кислотах,
не растворяется в щелочах:
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
CuO + H2SO4 → CuSO4 + H2O
Cu(OH)2 + NaOH(изб) = не идёт (с CuO тоже)
• При долгом стоянии или кипячении разлагается до оксида:
Cu(OH)2 →(t°C) CuO + H2O
• Cu(OH)2 осаждается щелочами:
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Cu(OH)2
CuO
• Образует прочный аммиачный комплекс [Cu(NH3)4]2+ :
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (темно-синий раствор)
21
22.
Хим. свойства+2
Cu
Осадки с катионом Cu2+:
• 1. CuSO4 + H2S → CuS↓ (черный) + H2SO4
Выпадает даже из H2S и не растворяется даже в конц. HCl !
Cu2(OH)2CO3
• 2. 2CuCl2 + 4NaHCO3 → Cu2(OH)2CO3↓ (голубовато-зеленый) + 4NaCl + 3CO2↑ + H2O
Средний карбонат CuCO3 из водного раствора выпасть не может (гидролиз).
Окислительные свойства меди (+2) :
• 2CuSO4 + 4KI → 2CuI↓ ("телесный") + I2↓ (бурый) + 2K2SO4
• CuSO4 + Fe → FeSO4 + Cu↓
• CuO - окислитель при нагревании:
3CuO + 2NH3 →(t°C) 3Cu + N2 + 3H2O
CuI
22
23.
Медь. Необычные реакцииH
O
H
OH
H
HO
H
H
OH
H
OH
C H 2O H
C u (O H )2
OH-
O
-
C
C
C
H
O
2-
O
H
OH
HO
H
t° C
H
O
-C u 2O
HO
OH
H
H
OH
H
OH
Cu
H
H O H 2C
O
2
C H 2O H
• Голубой осадок → синий раствор →(t°C) красный осадок
• Идёт через стадию образования хелатного комплекса!
• C6H12O6(р-р) + 2Cu(OH)2 + NaOH(р-р) →(t°C) C6H11O7Na(р-р)+ Cu2O + 3H2O
23
24.
Медь. Необычные реакции• 3CuCl2 + 5Na2SO3 + 3H2O → Cu2SO3*CuSO3*2H2O↓ (темно-красный) + Na2SO4 +
6NaCl + 2NaHSO3
Соль Шевреля
2Cu+2 + 2e- = 2Cu+1
S+4 - 2 e- = S+6
• 2Cu(OH)2 (голубой) + Na2S2O8 (р-р) + 2NaOH(р-р) →(t°C)
→ 2Cu(OH)3↓ (черный) + 2Na2SO4
Соль Шевреля
• Конц. раствор CuCl2 - зеленый
Разб. раствор CuCl2 - голубой
[CuCl2] + 4H2O → [Cu(H2O)4]Cl2
(замещение Cl- на воду при разбавлении)
CuCl2 (конц.)
24
25.
Успехов!25






















 Химия
Химия








