Похожие презентации:
Дезинфекция, дезинсекция, дератизация
1. Деинфекция, Дезинсекция, Дератизация
Проворова В. В.2.
• Дезинфекция медицинская — уничтожение возбудителяинфекционных (паразитарных) болезней в (на) абиотических
объектах окружающей среды, т.е. на путях его передачи от
источника инфекции к восприимчивым людям.
3.
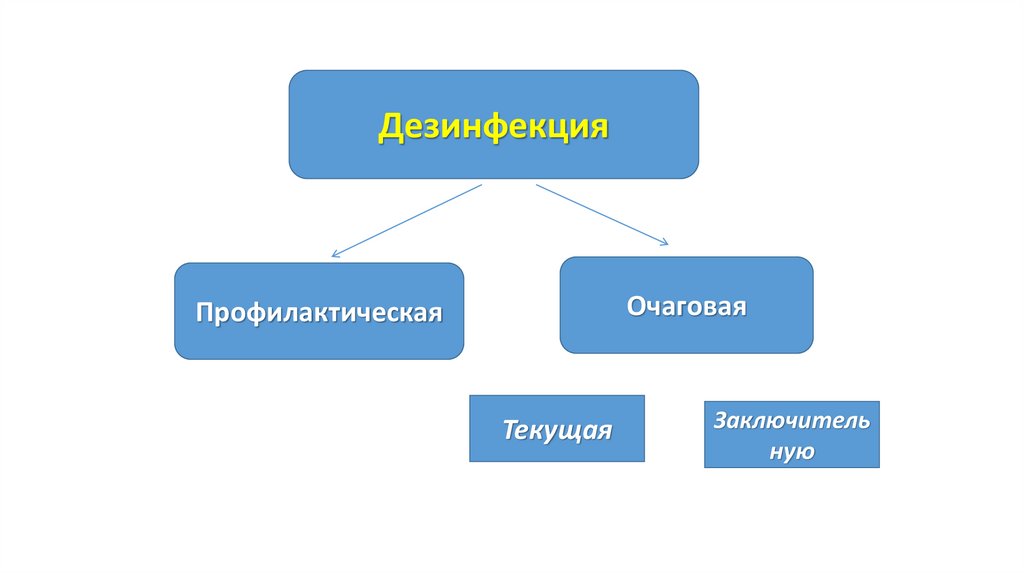
ДезинфекцияОчаговая
Профилактическая
Текущая
Заключитель
ную
4. Текущую дезинфекцию
• в очаге инфекционной болезни организует участковый врач илиинфекционист.
• Цель текущей дезинфекции — уничтожение возбудителя на
объектах в окружении больного или носителя.
• Обработке подвергают: экскременты, рвотные массы, мокрота,
патологическое отделяемое больного или носителя,
перевязочный материал, нательное и постельное белье, посуду и
другие предметы быта и обстановки.
5.
• Текущую дезинфекцию в зависимости от места нахожденияисточника инфекции осуществляют проинструктированные
люди, ухаживающие за ним, или медицинские работники
6. Заключительную дезинфекцию
• в эпидемическом очаге проводят после госпитализации,выздоровления или смерти больного,
• при перепрофилировании отделений лечебного учреждения.
Цель заключительной дезинфекции — уничтожение патогенных и
условно-патогенных микроорганизмов, оставшихся в
жизнеспособном состоянии на различных объектах после
удаления источника инфекции.
7.
• В эпидемических очагах: вирусных гепатитов А и Е, полиомиелитаи других энтеровирусных инфекций, шигеллезов, кишечного
иерсинио- за, острых кишечных инфекций (ОКИ), вызванных
неустановленными возбудителями, заключительная
дезинфекция может быть проведена силами медицинского
персонала лечебно-профилактических организаций (ЛПО),
детских и подростковых учреждений, а также населением.
8.
• При выявлении больного или при подозрении на чуму, холеру,возвратный тиф, эпидемический сыпной тиф, болезнь Брилла,
легочную форму Ку-лихорадки, сибирскую язву,
высококонтагиозные вирусные геморрагические лихорадки,
брюшной тиф, паратифы, туберкулез, проказу, орнитоз
(пситтакоз), дифтерию, грибковые болезни волос, кожи и ногтей
(микроспория, трихофития, руброфития, фавус), чесотку,
платяной педикулез заключительную дезинфекцию проводят
работники дезотделов государственных унитарных
предприятий дезинфекционного профиля.
9.
• Заявку на проведение заключительной дезинфекции подают втечение 1 ч после госпитализации или смерти больного в
учреждения, занимающиеся дезинфекционной деятельностью.
• Заключительную дезинфекцию проводят в сроки от 3 до 12 ч от
момента удаления источника из эпидемического очага.
10.
• Объем и сроки ее проведения, выбор обеззараживающихсредств и режима их применения, а также перечень предметов и
объектов, подлежащих обработке, зависят от нозоформы
инфекционной (паразитарной) болезни, санитарного состояния
очага и регламентируются соответствующими нормативными
документами.
• Работу организуют и выполняют врачи-дезинфекционисты.
11.
• В случае выявления больного инфекционной болезнью или приподозрении на нее и изоляции больного дома, а также при
возникновении внутрибольничной инфекции (ВБИ) в ЛПО
обязанностью врача является определение показаний к
назначению дезинфекции.
12. Методы дезинфекции делятся на три группы:
Методы дезинфекции делятся на тригруппы:
• ► механические (мытье, фильтрование);
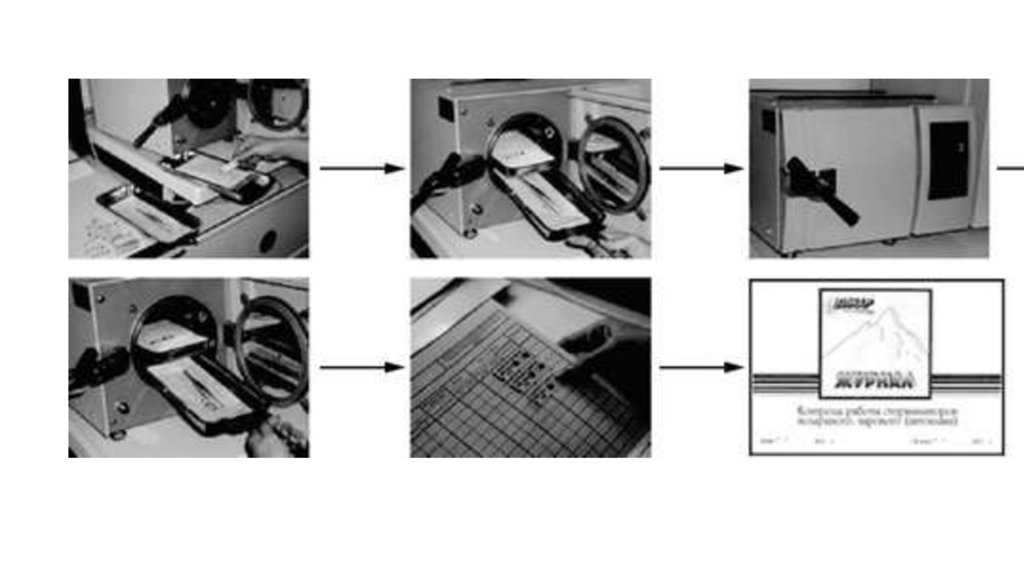
• ► физические (горячий воздух, сжигание, кипячение,
ультрафиолетовое излучение, пар);
• ► химические (соединения из различных групп).
13.
• Физические методы заключаются в использовании механическихспособов удаления возбудителя (влажная уборка, стирка, чистка
пылесосом, проветривание, фильтрация), температурного
воздействия (кипячение, пастеризация, сжигание, сухой и
влажный горячий воздух, водяной пар), лучистой энергии
(ультрафиолетовое излучение), радиоактивного излучения,
ультразвука.
• Частный пример физического воздействия на патогенные
микроорганизмы — камерная дезинфекция паровым,
паровоздушным и пароформалиновым методами.
14.
• Дезинфицирующие средства должны обладать вирулицидным,бактерицидным, спороцидным, фунгицидным действием.
• Не следует применять для дезинфекции средства с только
бактериостатическим действием.
15. Дезинфицирующие средства должны обладать вирулицидным, бактерицидным, спороцидным, фунгицидным действием. Не следует применять
для дезинфекции средства с толькобактериостатическим действием.
Химические дезинфицирующие средства должны удовлетворять
следующим требованиям:
• ► обладать высокой эффективностью;
• ► иметь широкий спектр действия;
• ► не должны обладать коррозионной активностью;
• ► обладать остаточным антимикробным действием;
• ► желательно наличие положительных свойств, например
дезодорирующих, моющих, чистящих, отбеливающих.
16.
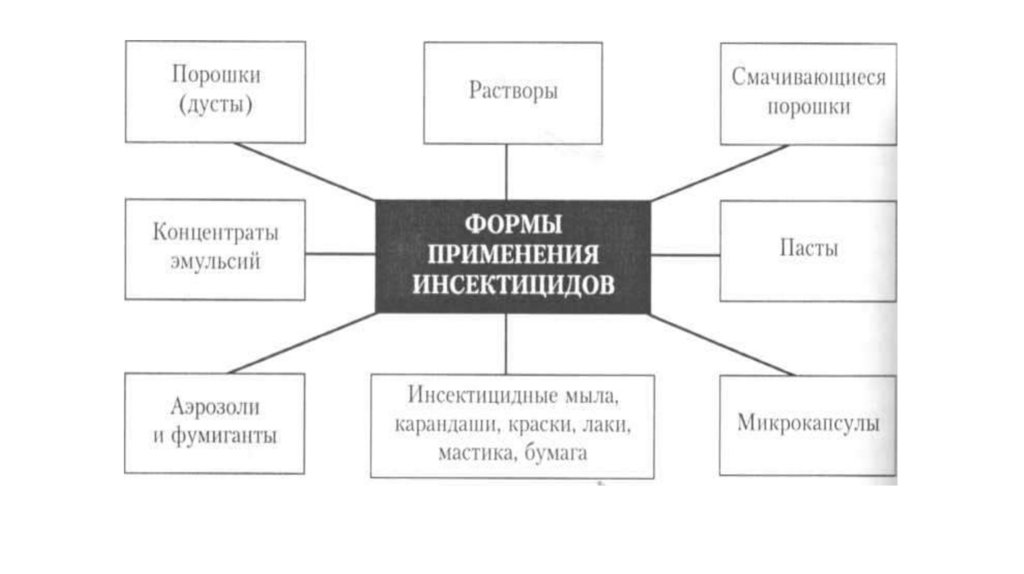
• Выпускаются в виде гранул, таблеток, порошков, жидкихконцентратов (растворы, пасты, кремы, эмульсии), газов, готовых
форм (лаки, салфетки, аэрозольные баллоны, краски).
17.
• К химическим дезинфицирующим средствам относят:• ► галоидсодержащие соединения;
• ► кислородсодержащие соединения;
• ► альдегидсодержащие соединения;
• ► поверхностно-активные вещества;
• ► гуанидинсодержащие соединения;
• ► спиртосодержащие;
• ► фенолсодержащие;
• ► на основе кислот.
18.
• Эти вещества имеют разную степень активности, неодинаковыеспектры антимикробного действия, токсичность и влияние на
обрабатываемые объекты и др. Знание свойств и особенностей
дезинфицирующих средств необходимо для их правильного
выбора и эффективного применения в соответствии с
поставленной целью.
19.
• Γалоидсодержащие дезинфицирующие средства содержат вкачестве активно действующих веществ йод, хлор, бром. Они
имеют широкий спектр действия, но раздражают слизистые
оболочки глаз и дыхательные пути, коррозионно-активны, имеют
запах.
• Ассортимент: кальция гипо-хлорит, натрия гипохлорит, хлорамин
Б, ДП-2Т, ДП-2.
20.
• Традиционными средствами дезинфекции являютсяхлорактивные препараты органической (тозилхлорамид натрия,
хлорпроизвод-ные циануровой кислоты) и неорганической
(гипохлориты) природы.
• Многие хлорактивные препараты наряду с достоинствами имеют
и ряд недостатков:
• недостаточная растворимость,
• низкая стабильность,
• резкий запах,
• способность раздражать слизистые оболочки глаз и верхних
дыхательных путей,
• вызывать коррозию металлических поверхностей,
• разрушать и обесцвечивать ткани.
21.
• Из неорганических соединений хлора крайне низкойстабильностью отличается гипохлорит натрия (NaOCl). Повысить
стабильность его растворов удается добавлением силиката
натрия и сульфонола, силиката натрия и уксусной кислоты или ее
солей, цитраля и других веществ.
• Ряд зарубежных фирм предлагает твердые формы гипохлорита
натрия, наиболее стабильным из которых является пентагидрат
гипохлорита натрия.
22.
• Эти вещества обладают высокой антимикробной активностью ирядом других положительных качеств, но слаборастворимы в
воде. Для дезинфекции используют, как правило, их композиции
- хлорцин, сульфохлорантин-Д.
• Хлорцин (включает хлоризоцианурат калия или натрия) содержит
сравнительно небольшое количество (12-15%) активного хлора,
что позволяет применять его не только в лечебнопрофилактических учреждениях, но и дома. Хлорцин обладает
активностью в отношении грамотрицательных и
грамположительных микроорганизмов, дерматофитов,
микобактерий туберкулеза, вирусов, спор.
• ДП-2 (основа - трихлоризоциануровая кислота) является не
только бактерицидом, но и спороцидом - содержит активного
хлора до 45%. Положительное свойство композиций - сохранение
активности в широком диапазоне рН, что дает возможность
использовать их при различной щелочности природной воды.
23.
• Из соединений йода для дезинфекции наиболее широкоиспользуются йодофоры (С-280, веладин, иозан, супердип,
дайазан и др.) - комплекс йода и носителя, представляющего
собой высокомолекулярное соединение и поверхностноактивные вещества (ПАВ). Выраженное бактерицидное,
туберкулоцидное, фунгицидное, спороцидное действие
йодофоров обусловливает применение этих веществ в основном
в качестве антисептиков и очень ограниченно - для дезинфекции
отдельных объектов. Из йодофоров известны йодопирон и
йодонат, носителями йода в которых являются, соответственно,
поливинилпир-ролидон и сульфонат, повидон-йод (содержит 1%
активного йода). Для обеззараживания рук медицинского
персонала на основе повидон-йода созданы композиции с
сульфонолом и неонолом.
24. В кислородсодержащих дезинфицирующих средствах
В кислородсодержащих дезинфицирующихсредствах
• действующим веществом является кислород.
Кислородсодержащие препараты, например пероксид водорода,
обладают высокой окислительной активностью. Они способны к
образованию свободных радикалов, которые повреждают ДНК,
клеточные мембраны и другие структурные компоненты
микробной клетки. Несмотря на то что ряд микроорганизмов
обладает защитным эффектом от воздействия пероксида
водорода, продуцируя фермент каталазу, разрушающий перекись
на воду и кислород, при дезинфекции используются высокие
концентрации перекиси, которые позволяют преодолеть
указанный защитный механизм.
25.
• Можно выделить следующие положительные свойстваН2О2 высоких концентраций: высокий спектр антимикробной
активности, в том числе на споры бактерий, способность
растворять биологические жидкости, например кровь, быстрое
разложение на нетоксичные продукты, отсутствие запаха.
Несмотря на все достоинства, данный препарат имеет ряд
недостатков: обладает раздражающим и резорбтивным
действием, высокой токсичностью, коррозионной активностью в
отношении ряда металлов.
26. Альдегиды
Альдегиды• - глутаральдегид, янтарный альдегид, формальдегид и другие являются веществами с выраженными антимикробными
свойствами, включающими активность в отношении всех видов
микроорганизмов за счет алкилирования амино- и
сульфгидрильных групп протеинов и подавления синтеза
последних. По этой причине, несмотря на токсичность,
выраженное раздражающее действие и резкий запах, альдегиды
по-прежнему широко используются в клинической практике.
27.
• Препараты, имеющие в своем составе глутаровый альдегид,приобретают улучшенные свойства, не вызывают коррозии
материалов, инструментов, не повреждают ткани и поверхности,
стабильны, что позволяет использовать растворы многократно,
обладают хорошей проникающей способностью, быстро
разлагаются в сточных водах. Фактически дезинфицирующие
средства на основе глутарового альдегида являются «золотым
стандартом».
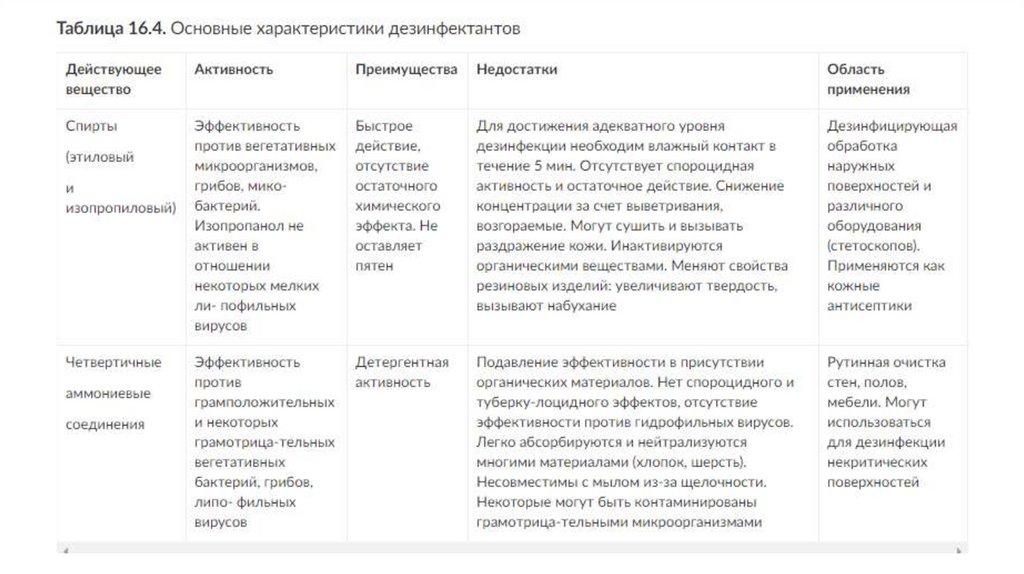
28. В поверхностно-активных веществах
В поверхностно-активных веществах• основным компонентом являются амины, четвертичные
аммониевые соединения (ЧАС), амфолитные поверхностноактивные вещества. По способности ионизироваться в водных
растворах их разделяют на катионные, анионные, амфолитные и
неионогенные ПАВ.
• В качестве самостоятельных дезинфектантов используют только
катионные и амфолитные ПАВ (например, амфолан).
Амфолитные ПАВ имеют ряд преимуществ перед катионны-ми они малотоксичны, действуют на бактерии, грибы и некоторые
вирусы, не утрачивают активности в присутствии жира и белка, не
коррозируют металлы. ПАВ всех других групп применяют как
полезные добавки в составе композиционных
дезинфицирующих средств.
29.
• Четвертичные аммониевые соединения относятся к группекатионных ПАВ. В Европе, Японии и США дезинфицирующие
средства на основе ЧАС применяются лишь для предметов
больничного окружения и запрещены для обработки
инструментов.
• В то же время в России препараты на основе ЧАС составляют
более трети рынка дезинфицирующих средств.
30. В группу гуанидинсодержащих средств
В группу гуанидинсодержащих средств• входят препараты с содержанием полигексаметиленгуанидин
фосфата, хлоргексидина биглюконата.
• Из группы гуанидинов наибольшее распространение как
антисептики и дезинфицирующие средства
получили хлоргексидина биглюконат (гибитан) и метацид.
• Гибитан обладает широким спектром антибактериального
действия, однако вирулицидная активность присуща только его
спиртовым растворам.
• Метацид вызывает гибель грамположительных и
грамотрицательных микроорганизмов, многих дерматофитов.
Положительным качеством его является длительный эффект.
• Особенность этой группы - образование на поверхностях пленки,
которая обеспечивает остаточное бактерицидное действие,
имеют узкий спектр антимикробной активности.
31. СПИРТЫ
• В качестве дезинфицирующих средств и антисептиков находятприменение спирты. Их используют как самостоятельно, так и в
качестве растворителей, усиливающих активность других
дезинфицирующих средств. Спирты обладают бактерицидным и
вирулицидным свойствами. Для дезинфекции наиболее широко
применяют этиловый и изо-пропиловый спирты в концентрации
60-90% (по объему).
32.
• В последние годы одним из важных направлений по поискуновых дезинфицирующих средств стало изучение
группы пероксикислот. Они отличаются высоким
антимикробным свойством. Их растворы обладают
бактерицидностью при концентрации, исчисляющейся долями
процентов: система С-3, Дезоксон-1, С-4 (первомур).
33.
34.
35.
36.
37.
38.
• Следует отметить, что для дезинфекции помещений, в которыхпредъявляются повышенные требования в плане предотвращения
возникновения или распространения инфекций, в основном
используются хлорсодержащие дезинфицирующие средства. В
настоящее время большей популярностью пользуются более
совершенные и качественные виды на основе
дихлоризоциануровой кислоты в виде таблеток, которые имеют
ряд преимуществ в сравнении с традиционными порошковыми и
гранулированными формами:
• ► точность дозировки, удобность в использовании, безопасность;
• ► быстрая растворимость;
• ► компактность;
• ► удобность транспортирования, складирования;
• ► возможность длительного хранения (срок годности от 3 до 5 лет).
39.
• Стерилизация - процесс уничтожения всех известныхмикроорганизмов,включая бактериальные споры. Виды
стерилизации:
• • физическая (сухой горячий воздух, пар, радиация, ультразвук);
• • химическая (газовый и жидкостный).
• Если имеется возможность использовать физическую
стерилизацию или одноразовое оборудование, химическая
стерилизация не применяется.
40. Стерилизация инструментов и перевязочного материала включает следующие этапы:
• • предстерилизационная подготовка;• • укладка и подготовка к стерилизации;
• • стерилизация;
• • хранение стерильного материала.
41. Предстерилизационная подготовка хирургических инструментов
• Все инструменты после операции должны подвергатьсядезинфекции. Для этого использованные инструменты собирают
в операционной в специальный таз для грязных инструментов.
Затем их несут в моечную, где имеется специальная закрытая
емкость с раствором дезинфицирующего средства
например: 0,1% раствор «Жавелиона», время экспозиции - 60 мин;
• 5% раствор «Аламинола» - 60 мин;
• 2% раствор «Бианола» - 15 мин;
• 2% раствор «Бриллиант» - 60 мин;
• 10% раствор «Гигасепт ФФ» - 60 мин;
• 1% раствор «СТЕРАНИОС 20% концентрированный» - 15 мин и
т.д.), грязные инструменты погружают в дезинфицирующий
раствор, разборные инструменты дезинфицируют в разобранном
состоянии.
42.
• Потом их моют под теплой проточной водой (в отдельной раковине)ершами и щетками. Затем погружают в эмалированную емкость с
моющим раствором «А» или «Б».
• Состав моющего раствора «А»: 27,5% раствор перикиси водорода - 17
г., моющее средство «Прогресс, Новость, Астра, Лотос и др.» - 5,0 г.,
дистиллированная вода - 978 мл.
• Состав моющего раствора «Б»: 3% раствор перекиси водорода 200
мл, моющее средство «Прогресс, Новость, Астра, Лотос и др.» - 5,0 г,
дистиллированная вода - 795 мл.
• Температура моющего раствора - 50 °С, время экспозиции - 15 мин.
• После замачивания инструменты моют в моющем растворе ершами,
щетками (особенно тщательно обрабатывают замки, зубчики,
насечки). Затем инструменты ополаскивают теплой проточной водой,
а в конце - дистиллированной водой.
43.
• Перед ополаскиванием в дистиллированной воде необходимопровести контроль качества предстерилизационной
очисткиизделий, путем постановки азопирамовой или
амидопириновой пробы на наличие остаточных количеств крови.
• Контролю подлежит 1% одновременно обработанных изделий
одного наименования (но не менее трех изделий). При
выявлении остатков крови (положительная проба) вся группа
изделий, от которой отбирали изделия для контроля, подлежит
повторной обработке до получения отрицательного результата.
44. Амидопириновая проба
• • Приготовление раствора. Смешивают равные количества 5%спиртового раствора амидопирина, 30% уксусной кислоты и 3%
раствора перекиси водорода (по 2-3 мл).
• • Техника проведения. На стерильную вату наносят полученную
смесь и протирают поршень шприца, цилиндр с наружной
стороны, иглы, канюлю внутри. Затем заливают реактивы в
цилиндр шприца, пропускают их через шприц на вату, проверяя
цилиндр. Надевают иглу и делают то же самое, проверяя иглу.
При наличии крови на вате появляется сине-зеленое
окрашивание. Оно может появиться и при реакции на тройной
раствор, хлорамин, лекарственные вещества.
45. Азопирамовая проба
• • Техника проведения. Готовят 1,0-1,5% раствор солянокислогоанилина в 95% растворе спирта этилового. Его хранят в
холодильнике до 2 месяцев, вне холодильника - не более месяца.
Перед постановкой пробы смешивают равные объемы азопирама и
3% раствора перекиси водорода.
• • Техника проведения. Смесь использовать в течение 1-2 ч. Не
проверять горячие инструменты, не держать раствор возле
нагревательных приборов и на ярком свету. При попадании реактива
на кровь в течение 1 мин появляется фиолетовое окрашивание.
46.
• Инструменты, после операции у больных с анаэробнойинфекцией, дезинфицируют в 6% растворе перекиси водорода в
течение 60 мин, а затем они проходят стандартную
предстерилизационную подготовку, как и другие инструменты.
47. Укладка и подготовка к стерилизации
• Инструменты стерилизуют воздушным (в сухожаровых шкафах), паровым(автоклавирование) и химическим методами.
• Для стерилизации в сухожаровых стерилизаторах инструменты помещают в
металлические коробки (при снятых крышках, крышки стерилизуют рядом) или в
упаковку из бумаги мешочной непропитанной (закладывают уже высушенные
инструменты), или выкладывают их на специальные решетки стерилизатора и
производят просушку инструментов при температуре - 80-85 °С, при открытой
дверце стерилизатора, до полного испарения влаги с инструментов.
• Для стерилизации паром под давлением инструменты кладут в металлические
биксы (выстланные двухслойной хлопчатобумажной простынкой или двойные
полотняные мешки (изготовленные из бязи).
• Перед химическим методом стерилизации хирургические инструменты, после
предстерилизационной обработки, выкладывают на чистые простыни и
производят просушку при комнатной температуре до полного испарения влаги с
поверхностей инструментов.
48.
Общий вид сухожарового стерилизатораОбщий вид сухожарового стерилизатора с
хирургическими инструментами на решетках
стерилизатора (с целью просушки)
49.
Общий вид загруженного металлического биксаОбщий вид загруженного биксами парового
стерилизатора
50. Инструментарии для медицинских манипуляций по риску имеют следующие различия.
• • Критические - проникают в стерильные ткани или сосуды: имплантаты,скальпели, иглы, другие хирургические инструменты и т.д. Стерилизация спороцидные химические вещества, длительный контакт.
• • Полукритические - соприкасаются со слизистыми оболочками (за
исключением стоматологических инструментов): гибкие эндоскопы,
ларингоскопы, эндотрахеальные трубки, а также другие аналогичные
инструменты. Дезинфекция высокого уровня - спороцидные химические
вещества, кратковременный контакт. Термометры, ванны для
гидротерапии. Дезинфекция среднего уровня - больничные
дезинфицирующие средства с указанием в маркировке о наличии
туберкулоцидной активности.
• • Некритические - (соприкасаются с неповрежденной кожей): стетоскопы,
настольные приборы, подкладные судна и др. Дезинфекция низкого
уровня - больничные дезинфицирующие средства без указания в
маркировке о наличии туберкулоцидной активности.
51. Воздушный - производится в воздушных стерилизаторах
Воздушный - производится в воздушныхстерилизаторах
• • при 180 °С (+2 °С или -10 °С) в течение 60 мин;
• • при 160 °С (+2 °С или -10 °С) в течение 150 мин.
• Оба режима рекомендуются для изделий из металла, стекла и
силиконовой резины.
52. Паровой
• - производится в паровых стерилизаторах, которыерасполагаются в специальном помещении - автоклавной, по
«основному» режиму стерилизации:
• • при 132 °С (±2 °С) под давлением 2 атм. (0,2 МПа) в течение 20
мин.
• Данный режим стерилизации рекомендуется для изделий
коррозийно-стойкого металла, стекла, изделий из текстильных
материалов.
53.
Общий вид парового стерилизатора снаружиОбщий вид парового стерилизатора внутри
54.
• Химический - проводится при полном погружении в раствор взакрытых емкостях из пластмассы или покрытых эмалью на время
стерилизационной выдержки, после чего изделие должно быть
промыто стерильной водой.
55. Некоторые препараты для химической (жидкостной) стерилизации
• 6% раствор перекиси водорода - проводится по двум режимам:• • при температуре 18 °С - 360 мин (±5 мин);
• • при температуре 50 °С - 180 мин (±5 мин), температура в
процессе стерилизации не поддерживается. Раствор перекиси
водорода используется в течение 7 суток со дня его
приготовления при условии хранения его в закрытой емкости в
темном месте.
56.
• 8% раствор средства «Лизоформин 3000». В состав средства вкачестве действующих веществ (ДВ) входят: 9,5% глутарового
альдегида, 7,5% глиоксаля и 9,6% дидецилдиметиламмония
хлорида (ЧАС), а также другие компоненты - 6%
алкилполиэтиленгликолевого эфира, 1,8% душистого масла, 0,5%
стабилизатора и красителя Е133. Средство обладает
бактерицидными (в том числе туберкулоцид-ными),
вирулицидными (в том числе в отношении возбудителей
парентеральных вирусных гепатитов и ВИЧ-инфекции),
фунгицидными (в отношении грибов рода Кандида и Трихофитон)
и спороцидными свойствами.
57.
• Для приготовления 1 л рабочего раствора, предназначенного длястерилизации медицинских инструментов, к 920 мл
дистиллированной воды, нагретой до температуры 50±1 °С,
добавляют 80 мл исходного концентрата, имеющего комнатную
температуру (не ниже 20 °С), и быстро перемешивают.
Стерилизацию инструментов проводят в стерильных
эмалированных (без повреждения эмали) или пластмассовых
емкостях, закрывающихся крышками. Изделия, подлежащие
стерилизации, погружают в раствор сразу же после его
приготовления. Стерилизацию осуществляют по одному из
указанных ниже температурных режимов (время экспозиции - 1
ч):
58.
1. • при температуре раствора 40 °С, если на протяжении всеговремени стерили-зационной выдержки возможно
поддержание заданного значения температуры (в
термостатируемых условиях);
2. • при начальной температуре раствора 50 °С, если в процессе
стерилизационной выдержки температура раствора не
поддерживается. В случае применения второго режима
(начальная температура раствора 50 °С) стерилизацию
проводят при температуре воздуха в помещении не ниже 20 °С
в емкостях, содержащих не менее 2 л рабочего раствора
средства, при соотношении объема раствора к объему,
занимаемому изделиями, не менее чем 5:1. При этом
допускается падение температуры раствора за время
стерилизационной выдержки не ниже чем до 35 °С.
59.
• После окончания стерилизационной выдержки изделия извлекаютстерильными пинцетами (корнцангами) из раствора средства и переносят
инструменты в стерильную емкость со стерильной водой для отмывания
изделий от остатков средства.
• Емкости, используемые при отмыве стерильных изделий от остатков
средства, предварительно стерилизуют паровым методом при температуре
132 °С в течение 20 мин.
• Воду для отмыва изделий стерилизуют в стеклянных емкостях аналогично.
• Отмыв осуществляют при полном погружении изделий в воду при
соотношении объема воды к объему, занимаемому изделиями, не менее,
чем 3:1.
•.
60.
• Инструменты из металлов отмывают последовательно в двухемкостях с водой по 5 мин.
• Изделия, в конструкцию которых входят полимерные материалы
(кроме гибких эндоскопов), отмывают последовательно в двух
водах по 10 мин.
• Отмытые от остатков средства стерильные изделия извлекают из
воды, помещают в стерильную простыню и перекладывают
изделия в стерильную стерилизационную коробку, выложенную
стерильной простыней.
• Срок хранения простерилизованных изделий не более трех суток.
• Работу осуществляют в стерильных перчатках.
• Срок годности рабочих растворов - 14 дней
61.
• 6% раствор средства «Новодез Форте». В состав средства в качестве действующих веществвходят: 40% алкилдиметилбензиламмония хлорид и 11% глутаровый альдегид.
• Для приготовления 1 л рабочего раствора необходимо добавить 60 мл концентрата
препарата комнатной температуры к 940 мл дистиллированной воды, подогретой до 55 °С и
быстро перемешать.
• Стерилизацию инструментов проводят в стерильных эмалированных (без повреждения
эмали) или пластмассовых емкостях, закрывающихся крышками. Изделия, подлежащие
стерилизации, погружают в раствор сразу же после его приготовления. Разъемные изделия
погружают в раствор в разобранном виде. Стерилизуемые изделия должны быть свободно
размещены в емкости с раствором, толщина слоя раствора над изделиями должна быть не
менее 1 см.
• Стерилизацию проводят при температуре воздуха в помещении не ниже 20 °С, используя
емкости, содержащие не менее 2 л раствора средства. Режим стерилизации хирургических
инструментов, изготовленных из металла: 6% раствор средства «Новодез Форте» с
начальной температурой - 50 °С (±1 °С), время экспозиции - 60 мин (за время
стерилизационной выдержки допускается падение температуры раствора не ниже чем до
35 °С).
• При проведении стерилизации все манипуляции выполняют, соблюдая асептические
условия, используя стерильные емкости для воды, воду и инструменты, а также стерильные
перчатки для защиты кожи рук. Отмыв инструментов после стерилизации осуществляется
так же, как при обработке средством «Лизоформин 3000». Срок годности рабочих растворов
составляет 14 суток при условии хранения в закрытых емкостях в темном месте.
62.
• Средство «Делансаль» - готовая к применению прозрачнаябесцветная жидкость без механических примесей с характерным
запахом, содержащая 2,3-2,7% глутарового альдегида в качестве
действующего вещества, а также буферные компоненты и
ингибитор коррозии; рН=6,0-6,5. Средство обладает
вирулицидными, бактерицидными (в том числе
туберкулоцидными и спороцидными) и фунгицид-ными
свойствами. Стерилизацию хирургических инструментов
проводят путем погружения в раствор дезинфицирующего
средства (температура раствора не менее 20 °С) стерилизуемых
предметов на 10 ч (600 мин). Средство можно использовать
многократно, если его внешний вид не изменился. При первых
признаках изменения внешнего вида средства (изменение цвета,
помутнение и т.п.) раствор необходимо заменить. Процесс
отмыва стерилизованных инструментов не отличается от средства
«Лизоформин 3000».
63.
• Средство «Бианол» - прозрачный жидкий концентрат ярко-синего цвета; имеет слабыйспецифический запах. Содержит глутаровый альдегид, глиок-саль и алкилдеметиламмония
хлорид в качестве действующих веществ, а также поверхностно-активное вещество,
краситель и воду (рН концентрата - 4,2±0,6). Средство обладает бактерицидными,
вирулицидными, фунгицидными и спо-роцидными свойствами. Не корродирует металлы и
не повреждает термолабильные материалы. Для стерилизации инструментов применяют
20% раствор средства «Бианол» (для приготовления 1 л раствора необходимо к 800 мл
дистиллированной воды добавить 200 мл концентрата), время стерилизационной
выдержки в 20% растворе при температуре 21±1 °С составляет 10 ч. Рабочие растворы
можно применять многократно в течение 10 суток с момента их приготовления, если их вид
не изменился. При первых признаках изменения внешнего вида средства (изменение цвета
или помутнение раствора, появление налета на стенках емкостей, образование хлопьев или
осадка и др.) раствор необходимо заменить. Во избежание разбавления средства при
многократном его использовании погружать в раствор следует только сухие изделия. Отмыв
изделий после стерилизации стандартен.
64.
• Средство «Клиндезин 3000» - готовая к применению прозрачнаябесцветная жидкость. Содержит 2,7% глутарового альдегида в
качестве действующего вещества, а также другие компоненты;
рН=6,0-7,5. Средство обладает вирули-цидными,
бактерицидными (в том числе туберкулоцидными и
спороцидными) и фунгицидными свойствами. Стерилизацию
инструментов проводят раствором, температура которого не
менее 20 °С, в течение 8 ч (480 мин). Раствор для стерилизации
можно использовать многократно (не более 30 суток), если нет
признаков изменения внешнего вида. Отмыв изделий после
стерилизации стандартный.
65.
• Средство «Клиндезин-Форте» - продукт, состоящий из двух жидких компонентов (раствор,содержащий глутаровый альдегид, и прилагаемый к нему активатор), смешиваемых перед
применением для получения активированного раствора. Основной компонент - бесцветная
прозрачная жидкость с типичным запахом глутарового альдегида и примесью аромата
перечной мяты, содержащая 2,5% глутарового альдегида в качестве действующего
вещества; рН=3,2-4,3; расфасован в пластмассовые флаконы вместимостью 3,8 л. К каждому
флакону с раствором, содержащим глутаровый альдегид, прилагается маленький
пластмассовый флакон со 149 г активатора, в виде прозрачной жидкости голубого цвета,
содержащего щелочные ингредиенты, ингибитор коррозии (нитрит натрия), красители.
Активированный (рабочий) раствор средства представляет собой жидкость зеленого цвета;
рН=7,5-8,5. Срок годности активированного раствора средства (после смешивания
компонентов) составляет 28 суток при условии его хранения в закрытых емкостях в темном
прохладном месте. Активированный раствор средства обладает вирулицидными,
бактерицидными (в том числе туберкулоцид-ными и спороцидными) и фунгицидными
свойствами. Фиксирует органические загрязнения, что требует их тщательного удаления с
изделий до дезинфекции и стерилизации. Стерилизацию инструментов проводят
раствором, температура которого не менее 20 °С, в течение 10 ч (600 мин). Отмыв изделий
после стерилизации стандартен.
66.
• Средство «Деконекс 50 ПЛЮС» - концентрат зеленого цвета, содержащий в качестведействующих веществ дидецилдиметиламмоний хлорид 12%, глутаровый альдегид 9,5%, а
также другие компоненты: неиогенные ПАВ, ингибиторы коррозии. Средство проявляет
бактерицидное (в том числе туберкулоцидное), вирулицидное (включая возбудителей
гепатитов и ВИЧ-инфекцию), фунгицид-ное (в отношении грибов рода Кандида и
Трихофитон) и спороцидное действие. Для приготовления 1 л 8% раствора,
предназначенного для стерилизации изделий медицинского назначения, к 920 мл
дистиллированной воды (нагретой до температуры 50±1 °С) добавляют 80 мл концентрата,
имеющего комнатную температуру (не ниже +20 °С), и быстро перемешивают.
Стерилизацию проводят при температуре воздуха в помещении не ниже +20 °С в емкостях,
содержащих не менее 2 л раствора (с начальной температурой раствора +50 °С) в течение
60 мин. При этом допускается падение температуры раствора за время стерилизационной
выдержки не ниже, чем до 35°С. Для стерилизации раствор используют однократно. Отмыв
изделий после стерилизации стандартен.
67. Хранение стерильных хирургических инструментов
• Стерильный хирургический инструмент хранят в специальных шкафах «Для хранениястерильного материала». Шкаф должен быть снабжен замком, ключи от которого находятся
у медицинского персонала. Допуск к шкафам со стерильным материалом имеет лишь
медперсонал.
• Если инструменты стерилизовались в биксах, специальных стерилизационных коробках
(выложенных стерильной простынкой), двойных полотняных мешках или были туда
помещены после стерилизации (без упаковки) любым из методов стерилизации, то срок их
хранения составляет 2-3 суток (при условии, что бикс, стерилизационная коробка или мешок
не вскрывались и герметично закрыты!).
• Инструменты, которые стерилизовались без упаковки (на решетках сухожарового шкафа,
химическим методом стерилизации, паровым методом без упаковки), должны быть
использованы непосредственно после стерилизации. Срок хранения стерильных
хирургических инструментов, выложенных на стерильный стол, составляет 6 ч. По истечении
этого времени хирургические инструменты должны повторно пройти стерилизацию любым
из предложенных методов.
68. Контроль стерильности хирургических инструментов.
Контроль стерильности хирургическихинструментов.
• Контроль стерильности хирургических инструментов
осуществляется двумя способами: прямым (бактериологическое
исследование микробной обсемененности хирургических
инструментов) и непрямым (индикаторы стерильности,
кристаллические химические вещества с известной температурой
плавления, термометры и др.). В настоящее время наиболее
распространенным способом непрямого контроля стерильности
считается использование стандартных химических индикаторов
стерильности серии «Стеритест» для воздушных и паровых
стерилизаторов, а также индикаторов серии «Стеритест» для
упаковки (бикс, стерилизационная коробка, полотняный мешок и
упаковка из бумаги мешочной непропитанной).
69.
• Индикаторы ПАРОВОЙ СТЕРИЛИЗАЦИИ химические одноразовыес липким слоем на обратной стороне индикатора, закрытым
защитной бумагой, МедИС-120/45, МедИС-126/30, МедИС-132/20
• Индикаторы паровой стерилизации химические
одноразовые СТЕРИ-ТЕСТ-П-120/45 и СТЕРИТЕСТ-П-132/20
• МедИС-В-160/150, МедИС-В-180/60 предназначены для
оперативного визуального контроля соблюдения критических
параметров воздушной стерилизации
• СТЕРИТЕСТ-Вл для Индикаторы ВОЗДУШНОЙ СТЕРИЛИЗАЦИИ
трех режимов (160 °С/150 мин, 180 °С/60 мин, 200 °С/30 мин)
химические интегрирующие одноразовые с липким слоем на
обратной стороне индикатора
70.
Индикаторы паровой стерилизацииИндикаторы воздушной стерилизации
71. Преимущества индикаторов:
• • на каждом индикаторе напечатан эталон конечного цветаиндикаторной метки, который она приобретает при соблюдении
параметров стерилизации;
• • четкий, контрастный цветовой переход индикатора облегчает
визуальный контроль и повышает его точность;
• • липкий слой на обратной стороне индикатора облегчает его
закрепление на стерилизуемых упаковках;
• • индикаторы обеспечивают документирование стерилизации;
• • срок годности индикаторов - 24 месяца.
72.
73.
74. Укладка и подготовка к стерилизации перевязочного материала и операционного белья
• Перевязочный материал, так же как и операционное белье, укладывают вметаллические биксы. При отсутствии биксов допускается стерилизация
перевязочного материала в двухслойных полотняных мешках. В
хирургических стационарах чаще всего используется «видовая» закладка
бикса, при которой в бикс укладывают определенный вид перевязочного
материала или операционного белья. К крышке бикса прикреплена бирка
из клеенки с названием содержимого, названия отделения, здесь же
проставляются: дата стерилизации, фамилия и подпись осуществляющего
стерилизацию. Перед закладкой бикс выстилают чистой простынкой (в два
слоя) так, чтобы она закрывала дно, стенки бикса и свешивалась через края
бикса. Далее производят закладку бикса материалом, не забывая при этом,
укладывать в различные отделы бикса индикаторы стерильности. Затем
загруженный материал укрывают сверху свободными краями простыни и
закрывают бикс. «Окошки» бикса должны быть открыты для проникновения
горячего пара внутрь.
75. Стерилизация перевязочного материала и операционного белья
• Производится в металлических биксах или двухслойныхполотняных мешках. Метод стерилизации - автоклавирование
(горячий пар под давлением). Режимы стерилизации:
• • при 132 °С (±2 °С) под давлением 2 атм. (0,2 МПа) в течение 20
мин;
• • при 120 °С (±2 °С) под давлением 1,1 атм. (0,11 МПа) в течение
45 мин.
76. Хранение перевязочного материала и операционного белья
• Происходит в стерильных закрытых биксах или двухслойныхполотняных мешках. Стерильность в обычных биксах и
двухслойных полотняных мешках сохраняется до 3 суток, а в
биксах с фильтрами - до 20 суток и более (в зависимости от
разновидности бикса).
77. Дезинсекция
Проворова В. В.78.
• Дезинсекция — комплекс мер, направленных на уничтожениенасекомых и клещей, являющихся возможными переносчиками
возбудителей инфекционных (паразитарных) болезней.
79.
• Очаговую дезинсекцию в обязательном порядке проводят вочагах трансмиссивных инфекционных болезней, а также при
чесотке и кишечных инфекциях (при наличии в очаге мух).
• Профилактическую дезинсекцию проводят с целью
предупреждения выплода членистоногих, клещей, мух и
заселения ими жилых и хозяйственных построек.
80. Методы защиты от насекомых и клещей
• механические• физические
• химические
• биологические
81.
• Механические методы. Механическая защитаоснована на предупреждении проникновения
членистоногих в помещения путем установки сеток
на окна, дверные проемы, использования
противомоскитных масок для защиты открытых
частей тела.
82.
Физические методы. Чаще всего используютсухой горячим воздух в специальных камерах.
Химические методы. Они основаны на
применении химических веществ,
предназначенных для уничтожения:
• насекомых (инсектициды)
• клещей (акарициды)
• личинок (ларициды)
• яиц насекомых и клещей (овоциды)
83.
• К наиболее часто используемым при дезинсекциихимическим веществам относятся:
• карбофос, который применяют для уничтожения
личинок мух, постельных клопов, синантропных
тараканов и блох, комаров, иксодовых клещей;
• хлорорганические соединения — дихлор используют
для уничтожения тараканов, клопов, вшей, блох,
комаров;
• фосфорорганические соединения — дифос (аббат,
темефос) используют для уничтожения блох, мух,
постельных клопов, вшей;
• карбалиаты — дикрезил используют для борьбы со
многими видами членистоногих, а также для
уничтожения яиц вшей;
• пиретроиды — неопинамин используют для
уничтожения тараканов в пищевых, лечебных, детских
и жилых помещениях, а также постельных клопов,
вшей, блох
84.
Биологические методы (возбудителиболезней членистоногих) бактерии, вирусы,
грибы, простейшие)
В качестве биологических средств защиты от
насекомых и клещей используют:
• бактицид, созданный на основе токсина Bacillus
thuringiensis и использующийся для уничтожения
личинок комаров;
• бактокулицид, который используют для
уничтожения личинок комаров путем обработки
мест их выплода;
• дилимен, используемый для обработки
субстратов, в которых находятся личинки мух,
самки рыжих тараканов;
85.
86. Основные направления дезинсекционных мероприятий (Костина М.Н., 2003):
1. Профилактические мероприятия (уборка, очистка., проветривание жилища, осушениеподвалов, личная гигиена).
2. Воздействие на среду обитания для предотвращения выплода (вылета) имаго - осушение
болот, рыбки и тд.
3. Одновременное воздействие различными средствами (в разных препаративных формах) на
разные стадии развития насекомых или применение комбинированных средств на основе
соединений из различных химических групп .
- Использование не только общепринятых, но и новых химических групп: неоникотиноиды,
фенилпиразолы - для предотвращения резистентности (чаще она характерна для имаго)
-
Бактериальные препараты.
Авермектины - токсические продукты жизнедеятельности грибов Streptomyces
avermitilis
Регуляторы развития насекомых , в том числе ингибиторы синтеза хитина и аналоги
ювенильного гормона .
4. Использование разных форм
-
Пищевые приманки (сухие, жидкие, гранулированные, таблетки в контейнере),
-
Гели.
-
Безинсектицидные средства: липкие средства, домики.
5. Схемы ротации: последовательное (в различной очередности) применение средств с
различным механизмом действия в течение сезона
87. БОРЬБА С КОМАРАМИ
88. БОРЬБА С КОМАРАМИ
1. Основными радикальными мероприятиями,исключающими или ограничивающими выплод
комаров, являются санитарно-гидротехнические
2. Истребительные мероприятия против личинок
(лаврициды): биологические препараты: Бактицид
(Бактокулицид), Бактоларвицид БЛП, Ларвиоль,
Текнар, Форс-Сайт, Юракс и др. Регуляторы развития
: Димилин 25% с.п. Сумиларв 0,5% гранулы, могут быть
также использованы использованы химические
препараты: высшие жирные кислоты и спирты,
которые, растекаясь по поверхности водоема,
образуют монопленку и, проникая через трахеи
личинок, вызывают их гибель.
3. Средства для уничтожения имаго комаров
89. Средства для уничтожения имаго комаров Средства в аэрозольных упаковках
Аэрозоль-Л
Фумизоль
Глоболь-аэрозоль для летающих
Экспель-аэрозоль для летающих
Дихлофос-варан
Перфос
Дихлофос-Л
Пери Л
Дихлофос-симилар
Пипс-форте
Дэсбиоцид С арель
Перфен
КРА-део
Феназоль
КРА-део супер
Флит
Мортеин-аэрозоль против летающих
Пиразоль
Мортеин универсальный аэрозоль
Амизоль
НЕО ДИХЛОФОС
Вираж
Раптор-аэрозоль (для летающих) Р
Глоболь
аптор-супер аэрозоль
Испакт
Рейд против мух и комаров
Пипс-экстра
90. Средства для уничтожения имаго комаров Электрофумигаторы с пластинами (матами)
Альфатоксфуми
Байгон-мастер
• Биозащита — пластины от комаров Bane
мат Е
• Мортеин — пластинки против
комаров
Москитол — нежная защита
Раптор—новая формула
Раптор-стандарт
Глоболь-фумигатор- освободитель
Глорус-пластины
• Рейд—электрофумигатор с
пластинами
• ДИК-эффект Инвент — пластины для
комаров
Комбат суперэффект
Фумитокс
Фумитокс-R
Экспель — фумигаторосвободитель
Экстрамит-К
Эток-10
91.
Средства для уничтожения имаго комаровЭлектрофумигаторы жидкостные
•Байгон гениус
(против комаров)
•КЭЧ-диффузор
•Москитол — жидкость
для фумигатора
- Раптор ликвид плюс
- РЕЙД электрофумигатор
- Фумитокс жидкостной
- Экстрамит Ж
92. Средства для борьбы с платяным педикулезом, зарегистрированные в России и разрешенные для применения
• Для обработки нательного и постельного белья, верхней одежды, постельныхпринадлежностей:
1.КОНЦЕНТРАТЫ ЭМУЛЬСИИ: Акромед, Медифокс, Авицин,
Чистотел
2.МЫЛА: Витар
3.АЭРОЗОЛЬНАЯ УПАКОВКА: А-Пар
• Нательное и постельное белье замачивают в водных
эмульсиях в течение 5—10 мин, затем прополаскивают и
после этого стирают обычным способом.
93. Средства для уничтожения головных и лобковых вшей у взрослого населения и детей с 5 лет, зарегистрированные в России и
разрешенные к применению (по Фроловой А.Н, 2005)• ЛОСЬОНЫ: Нитилон, Нитгифор, Лонцид
• ШАМПУНИ: Биосим перметрин, Бубил , Веда-2, Лаури, Салюцид,
Паразидоз
• МЫЛА : Антиэнтом, Витар
• Для обработки волосистых частей тела экспозиция составляет от
10 до 40 мин в соответствии с инструкцией. Проводится 2
обработки с интервалом 7-10 дней
• При лобковом педикулезе обрабатывают ресницы, брови, бороду,
подмышечные впадины, лобок, волосистые части ног.
• Для уничтожения головных вшей обрабатывают волосы головы
94.
Для быстрого уничтожения тараканов рекомендованыаэрозольные баллоны Карбозоль, Сузоль, Инсектазоль, Эксфос,
Актеллик, Пермет, Рубезоль, Феназоль П, Пиф-Паф, Флит, СуперКобра, Раптор, Фумитокс.
Эффективным средством борьбы с тараканами являются
инсектицидные гели:
• инсектогель П — на основе перметрина;
• инсектогель Ц — на основе циперметрина;
• инсектогель Ф — на основе фенвалерата;
• инсектогель А — на основе альфаметрина;
• Максфорс шабен гель — на основе гидрометилнона;
• НЭКСА-терминатор, Голиаф — на основе фипронила;
• Форс-Сайт — на основе фентиона и альфациперметрина;
• Арбалет — на основе хлорпирифоса (ФОС);
• Ликвидатор — на основе фипронила;
• Глоболь — на основе хлорпирифоса;
• Ультрагель — на основе имидаклоприда (неоникотиноиды).
95. БОРЬБА С РЫЖИМИ ДОМОВЫМИ МУРАВЬЯМИ
Единственно радикальным способом борьбы с муравьями являетсяприменение пищевых отравленных приманок:
• Алстар (содержит сульфторамид 0,5%);
• Анфар, Мирант, Асмур (бура 10%);
• Лафарекс (метопрен 0,5%);
• Фератокс (борная кислота 2,5%, этилмочевина 0,3%);
• Фарацид (бура 99%);
• Стингер (хлорпирифос 0,5%).
Приманки размещают из расчета 5—8 точек на помещение.
96.
• Борьбу с членистоногими проводят силами станций испециализированных отделений центров государственного
санитарно-эпидемиологического надзора. Основные режимы
проводимой обработки, кратность проводимых мероприятий,
способы дезинсекции выбирают в зависимости от вида
насекомых, их численности, санитарного состояния объекта или
очага; они регламентированы соответствующими СанПиНами.
97. Дератизация
98.
• Дератизация — мероприятия, направленные на борьбу сгрызунами, являющимися возможными носителями или
переносчиками возбудителей инфекционных болезней.
99. РОЛЬ ГРЫЗУНОВ ПРИ НЕКОТОРЫХ ИНФЕКЦИОННЫХ БОЛЕЗНЯХ
• Бруцеллез. В неблагоприятных по бруцеллезу хозяйствах до 60% крысявляются носителями бруцелл. Грызуны легко заражаются при поедании мяса
и молока больных животных.
• Лептоспироз. Источниками данной болезни могут быть до 12 видов
мышевидных грызунов. Их зараженность в эпизоотических очагах достигает
85%. У крыс и мышей носительство лептоспир может длиться пожизненно.
• Туберкулез. Крысы восприимчивы к 3 видам возбудителя туберкулеза. На
птицефабриках до 12% крыс могут быть заражены птичьим видом возбудителя
туберкулеза.
• Листериоз. Взрослые крысы чаще переболевают листериозом бессимптомно,
но на протяжении 5—20 дней выделяют листерий с носовой слизью,
экскрементами и мочой.
• Сибирская язва. Все грызуны восприимчивы к возбудителю сибирской язвы.
• Ящур. Крысы переболевают ящуром без клинических признаков и в течение 18
сут могут выделять вирус с калом и мочой.
• Бешенство. Крысы и мыши восприимчивы к вирусу бешенства и мо- жуг
заражаться одна от другой. Больные крысы заражают бешенством и сво- ;
естественных врагов: кошек, собак, лисиц, волков и др.
• Трихинеллез. Крысы и мыши являются основным резервуаром триyелл.
Зараженность крыс трихинеллезом в некоторых местах достигает 100%.
• Чума
100. Пандемии чумы
• «Юстинианова чума» 540-544 гг. - вКонстантинополе ежедневно умирало до 5000
человек, а в отдельные дни смертность достигала
и 10000.
• «Чёрная смерть» («чёрный мор») 1346—1351 гг. жертвами второй пандемии чумы стало 34 млн
человек в Европе, и 78 млн в целом, по
Европе, Азии и Африке.
• Третья пандемия 1855 – 1959 гг. - только в Китае и
Индии общее число умерших составило более 12
миллионов человек.
101.
• В 2013 году на севере Киргизии обнаружена бубонная чума.Именно это страшное инфекционное заболевание стало
причиной смерти 15-летнего мальчика. Он обратился в приемную
Ак-Суйской территориальной больницы за неделю до гибели ,
жалуясь на высокую температуру и появление характерного
бубона на коже.
102.
• Согласно проведенной экспертизе, причинойзаболевания и последующей гибели юноши стал
шашлык из сурка, который он в компании готовил
на южном берегу озера Иссык-Куль.
103.
• В 2016 году на Горном Алтае в Кош-Агачского районе чумойзаразился 10 летний мальчик. Заболевание протекало в бубонной
форме.
104. Дератизация
1. Предупредительные мероприятия. Профилактическиемероприятия предусматривают создание условий,
препятствующих проникновению, заселению, размножению
грызунов и способствующих снижению их численности.
2. Истребительные мероприятия
105. Истребительные мероприятия
1. механический метод предусматривает отлов грызунов сиспользованием специальных орудий лова (капканы, ловушки)
Обычно используется вместе с химическим или для контроля в
эпид очагах зоонозов;
2. химический метод основан на использовании ядовитых
веществ — ратицидов (фосфид цинка, глифтор, монофторин,
ратиндан, зоокумарин);
3. биологический метод основан на применении патогенных для
грызунов микроорганизмов.
106. Тактика дератизации
• Согласно нормативным документам, при проведении дератизации вЛПУ разрешено применение препаратов, оказывающих на грызунов
хроническое действие.
• Используемые для дератизации приманки недопустимо раскладывать
в столовых ЛПУ и в палатах стационаров.
• При раскладывании приманки необходимо использовать подложки и
специальные емкости, исключающие разнос яда грызунами и его
попадание на пищевые продукты, медикаменты.
• После окончания дератизационных работ в ЛПУ емкости с остатками
приманки собирают в полиэтиленовые пакеты и удаляют с территории
больницы.
107.
ДЕРАТИЗАЦИЯСплошная
Одномоментная
(разовая)
Выборочная
Систематическая
Очаговая
108.
• Очаговая дератизация осуществляется в отдельных строениях(участках), где регистрируются инфекционные болезни, в
распространении которых могут принимать участие грызуны, и
проводится в сроки, предусмотренные для заключительной
дезинфекции.
• Выборочная дератизация проводится в населенных пунктах в
основном на эпидемически значимых объектах: мясо- и
рыбокомбинатах, холодильниках, элеваторах,
продовольственных складах, в лечебных и детских учреждениях,
на животноводческих фермах.
109. Сплошная дератизация
• Одномоментная (разовая) дератизация осуществляется вотдельных населенных пунктах или участках 1—2 раза в год.
Намеченный участок подвергают обработке в максимально
короткий срок (7—12 дней). В результате разовых дератизаций
достигается существенное снижение численности грызунов на
определенное время.
• Систематическая дератизация проводится чаще в городах,
имеющих важное политическое и экономическое значение. В
морских портах сплошная систематическая дератизация является
обязательным мероприятием, равленным на санитарную охрану
территории страны.
110.
РОДЕНТИЦИДЫРастительные
Острого
действия
Синтетические
Репелленты
Хронического
действия
111. РОДЕНТИЦИДЫ
• Яды острого действия характеризуются сравнительно быстрым развитиемпроцесса отравления организма при введении в него одной дозы препарата.
Первые симптомы отравления могут появиться через несколько часов. В ряде
случаев с процессом развития отравления у грызунов возникает настороженность
и отказ от повторного употребления приманки с ядом, вызвавшим отравление,
или даже с любым другим препаратом. Кроме того, к некоторым
остродействующим ядам вырабатывается привыкание, и организм грызуна
становится маловосприимчив к этим препаратам.
• Яды хронического действия (антикоагулянты) характеризуются длительным
латентным периодом, медленным развитием процесса отравления при
регулярном потреблении малых доз. Эти препараты, как правило, кумулируют в
организме животного и постепенно приводят к значительным патологическим
изменениям. Оказывая влияние на различные факторы свертывания крови, они в
конечном итоге приводят к нарушению способности крови к свертыванию,
повышают проницаемость капилляров, вызывают массовые внутренние
кровоизлияния и смерть животного. Они чаще всего применяются в
профилактической дератизации. Антикоагулянты довольно быстро завоевали
признание во всем мире и прочно заняли ведущее место среди других
химических средств борьбы с грызунами
Репелленты - это отпучивающие вещества вызывающие резкое
раздражение слизистых при вдыхании.












































































































 Медицина
Медицина








