Похожие презентации:
Величина предельного диффузионного тока
1.
Задача 1. Рассчитайте величину предельного диффузионного тока при восстановлении M3+, если его концентрация4,0 10-4 М, коэффициент диффузии 5,0 10-6 см2с-1, характеристики капилляра: m = 2 мг/с; t = 5 с.
По уравнению Ильковича рассчитаем Iд, выразив концентрацию в мМ:
Iд = 605n D 1/2 m2/3t1/6c = 605 3 (5,0 10-6)1/2 22/3 51/6 0,4 = 605 3 2,24 10-3 1,59 1,31 0,4 = 3,39 мкА
Задача 2. Величина предельного диффузионного тока на полярограмме 1,0 10-3 M Cd(II) на фоне 0,1 М KNO3 равна
8,10 мкА. Из капилляра в течение 1 мин вытекает 15 капель, а масса 25 капель ртути равна 100 мг. Рассчитайте
коэффициент диффузии D иона Cd(II).
Рассчитаем m и t из условий задачи:
m = (100 : 25)(15 : 60) = 1 мг/с
D = [Iд/(605nm2/3t1/6c)]2 =[8,10/(605 2 12/3 41/6 1)]2 = 3,2 10-5 см2с-1
интервале возможных значений D ( n 10-6 - n 10-5 ) см2с-1
t = 60 : 15= 4 с
2.
Задача 3. Предельный диффузионный ток восстановления 4.10-3 М TeO32- на РКЭ равен 61,9 мкА. Масса 20 капельHg, вытекающих за 63 с, равна 0,0945 г. Коэффициент диффузии TeO32- - 7,5 10-6 см2с-1. Используя эти данные,
напишите уравнение электродной реакции.
Рассчитаем m и t из условий задачи: m = 94,5 : 63 = 1,5 мг/с
t = 63 : 20 = 3,15 с
Запишем уравнение Ильковича: 61,9 = 605 n 4 (7.5.10-6)1/2(1,5)2/3(3,15)1/6
= 5,98 ~ 6
Уравнение электродной реакции: TeO32- + 6e + 8H+ = H2Te + 3H2O
Задача 4. Потенциал полуволны обратимого восстановления Cu(II) до Cu(0) на фоне 0,1 М KNO3 равен +0,16 В. При
добавлении диэтилентриамина (En) до концентрации 0,100 М E1.2 смещается до -0,54 В. Оцените константу
устойчивости комплекса Cu(En)2.
lgβ2 комплекса Cu(En)2 рассчитаем по уравнению:
E1/2 (комплекс) - E1/2 (в отсутствие лиганда En) = E1/2 =
lgβ2 = 25,73
β2 =5,35 1025
0,059
0,059 2
lg
lg c
2
En
2
2
3.
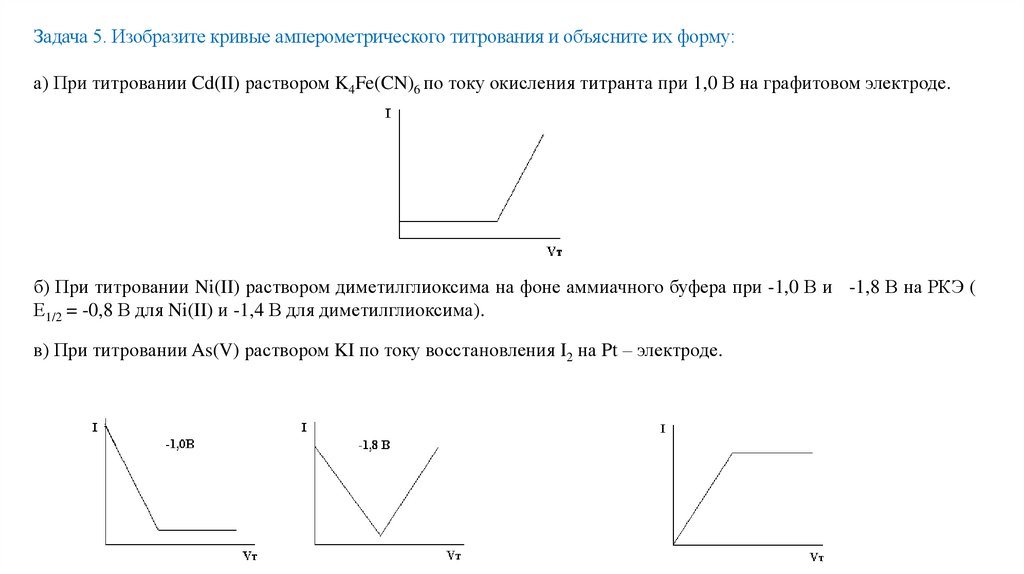
Задача 5. Изобразите кривые амперометрического титрования и объясните их форму:а) При титровании Cd(II) раствором K4Fe(CN)6 по току окисления титранта при 1,0 В на графитовом электроде.
б) При титровании Ni(II) раствором диметилглиоксима на фоне аммиачного буфера при -1,0 В и -1,8 В на РКЭ (
Е1/2 = -0,8 В для Ni(II) и -1,4 В для диметилглиоксима).
в) При титровании As(V) раствором KI по току восстановления I2 на Pt – электроде.


 Физика
Физика Химия
Химия








