Похожие презентации:
Вольтамперометрия
1. Вольтамперометрия
Метод анализа, основанный на изученииполяризационных (вольтамперных) кривых I=f(E),
полученных в электролитической ячейке с
поляризующимся индикаторным электродом и
неполяризующимся электродом сравнения.
Определение большинства элементов и весьма
широкого круга неорганических и органических
соединений в диапазоне концентраций от 10-3 до
10-11 моль/л.
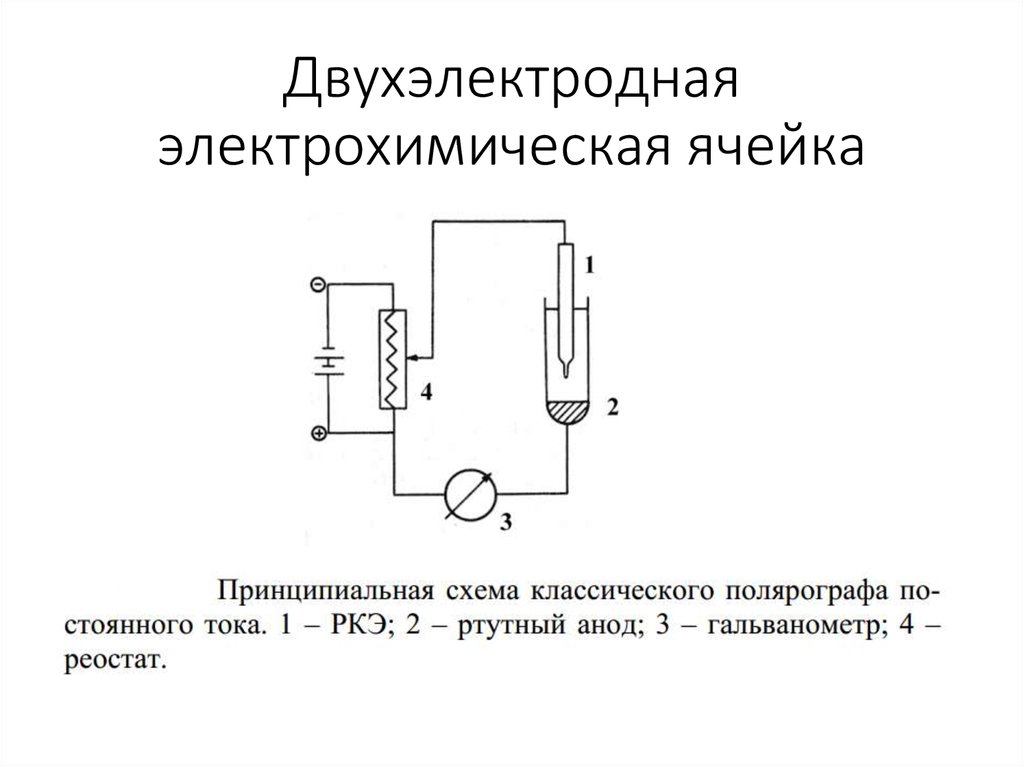
2. Двухэлектродная электрохимическая ячейка
3. Трехэлектродная электрохимическая ячейка
4. Ячейка
• Анод – процессы окисления• Катод – процессы восстановления
• Напряжение, наложенное на ячейку:
Е = ЕА – ЕК + iR
iR – падение напряжения при прохождении тока
через раствор
Для ↓iR – добавление индифферентного
электролита (фона).
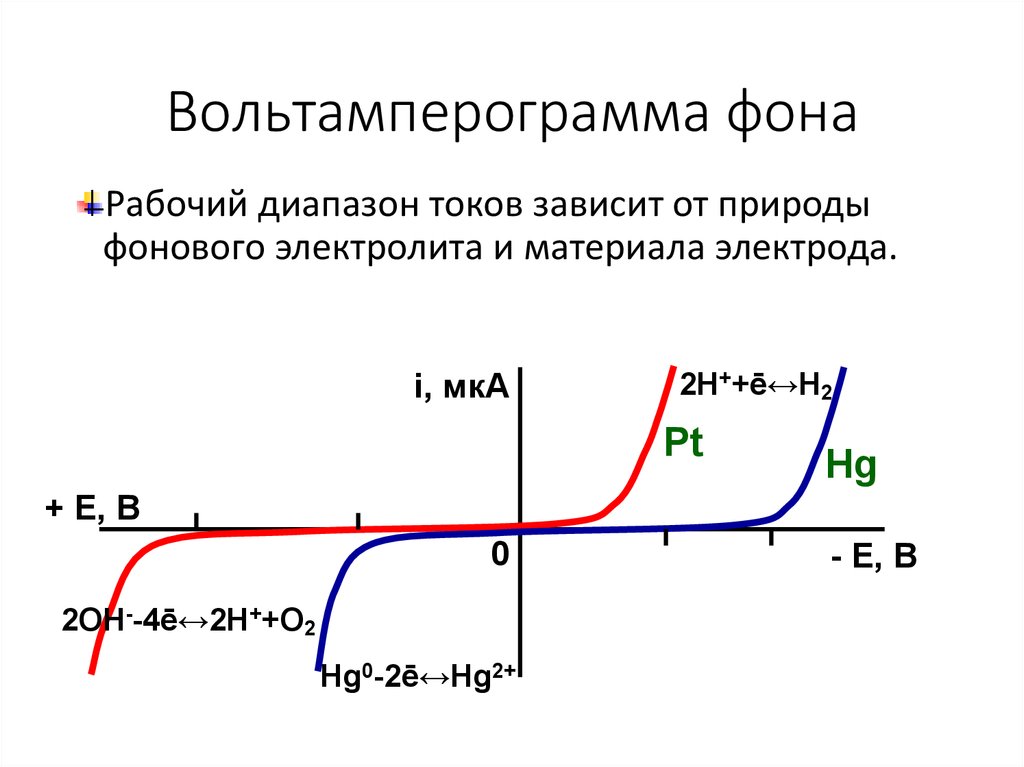
5. Вольтамперограмма фона
Рабочий диапазон токов зависит от природыфонового электролита и материала электрода.
i, мкА
2H++ē↔H2
Pt
Hg
+ Е, В
0
2OH--4ē↔2H++O2
Hg0-2ē↔Hg2+
- Е, В
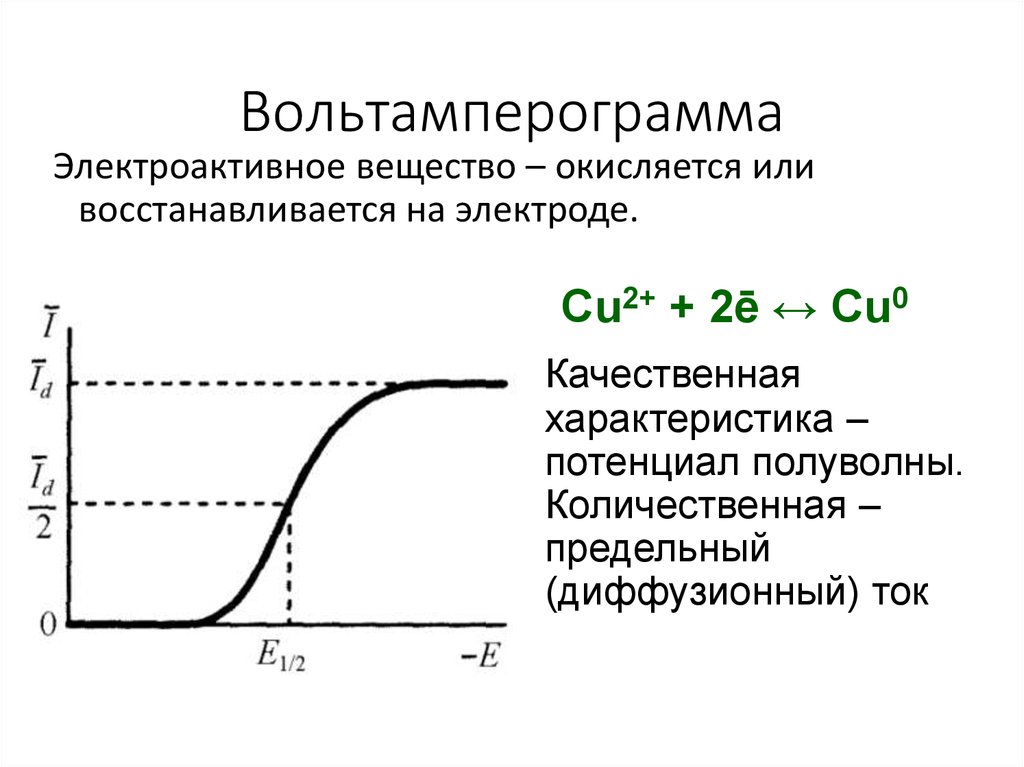
6. Вольтамперограмма
Электроактивное вещество – окисляется иливосстанавливается на электроде.
Cu2+ + 2ē ↔ Cu0
Качественная
характеристика –
потенциал полуволны.
Количественная –
предельный
(диффузионный) ток
7. Уравнение обратимой полярографической волны Гейровского-Ильковича
Id- предельный токz- валентность иона
F- постоянная Фарадея
R- универсальная газовая постоянная
T- абсолютная температура
DRеd- коэффициент диффузии
восстановленной формы
Dox- коэффициент диффузии
окисленной формы
Е0- стандартный электродный
потенциал
8.
На зависимости можно выделить три области.1.
Если
потенциал
рабочего
электрода
меньше
потенциала
выделения электрохимически активного компонента, то имеет место
кинетическая поляризация электрода и на нём не протекает
электрохимическая реакция. Незначительный ток, протекающий
через ячейку, связан с образованием на поверхности электрода
двойного электрического слоя (ДЭС), который можно уподобить
конденсатору. В результате при изменении потенциала электрода
протекает ток заряжения конденсатора (конденсаторный ток, ток
ДЭС). Чем больше ток ДЭС, тем ниже чувствительность метода.
9.
2.При достижении потенциала электрода, равного потенциалу
выделения электрохимически активного компонента, происходит
деполяризация рабочего электрода. Ионы начинают разряжаться на
рабочем электроде с образованием амальгам на ртутном электроде:
Men+ + пе + Hg = M(Hg),
или металлической плёнки на твердотельных электродах:
Men+ + пе = М.
Через электрод протекает ток электролиза (фарадеев ток), который
пропорционален напряжению. В результате электрохимической
реакции концентрация ионов в приэлектродном слое уменьшается.
Происходит перенос вещества из объёма раствора к поверхности
электрода. При этом ток достаточно мал (порядка 10-5 А) и
практически не влияет на концентрацию ионов в глубине раствора.
10.
3.Концентрация
ионов
у
поверхности
рабочего
электрода
становится равной нулю. Перенос вещества из объёма раствора
становится лимитирующей стадией и наступает концентрационная
поляризация рабочего электрода. Перенос вещества из объёма
раствора может происходить за счёт:
конвекционного переноса электрохимически активного компонента
с потоком растворителя;
миграционного переноса ионов под действием электрического
поля;
диффузионного переноса за счёт разности концентраций у
поверхности электрода и в объёме раствора.
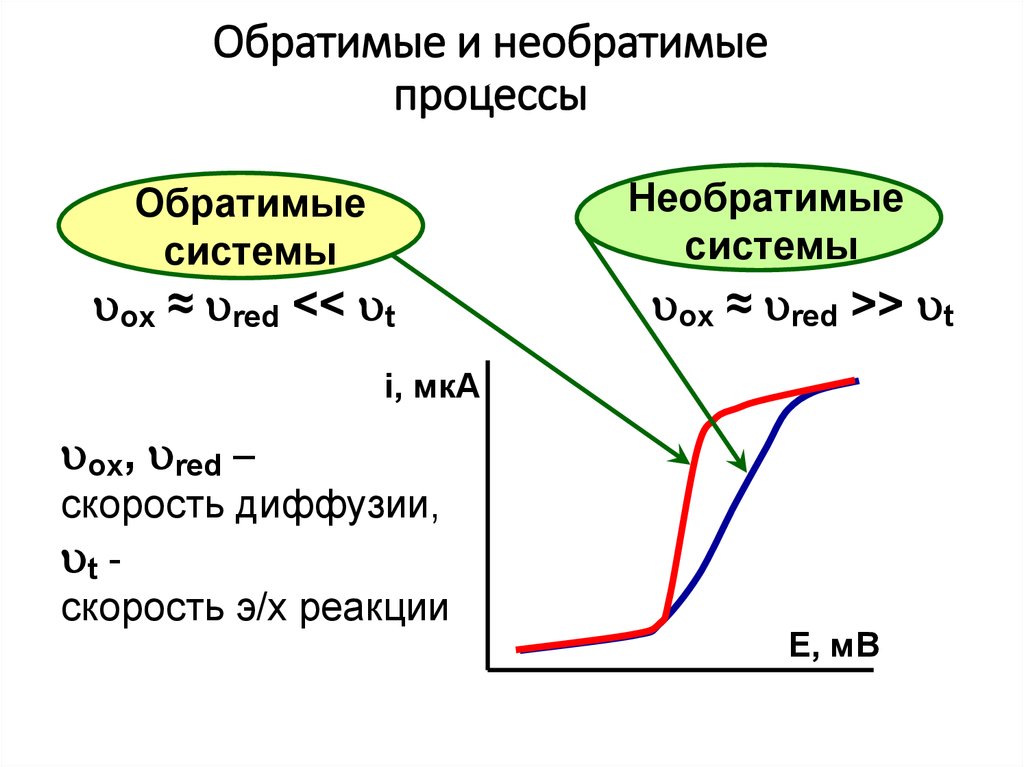
11. Обратимые и необратимые процессы
Необратимыесистемы
Обратимые
системы
ox ≈ red << t
ox ≈ red >> t
i, мкА
ox, red –
скорость диффузии,
t скорость э/х реакции
Е, мВ
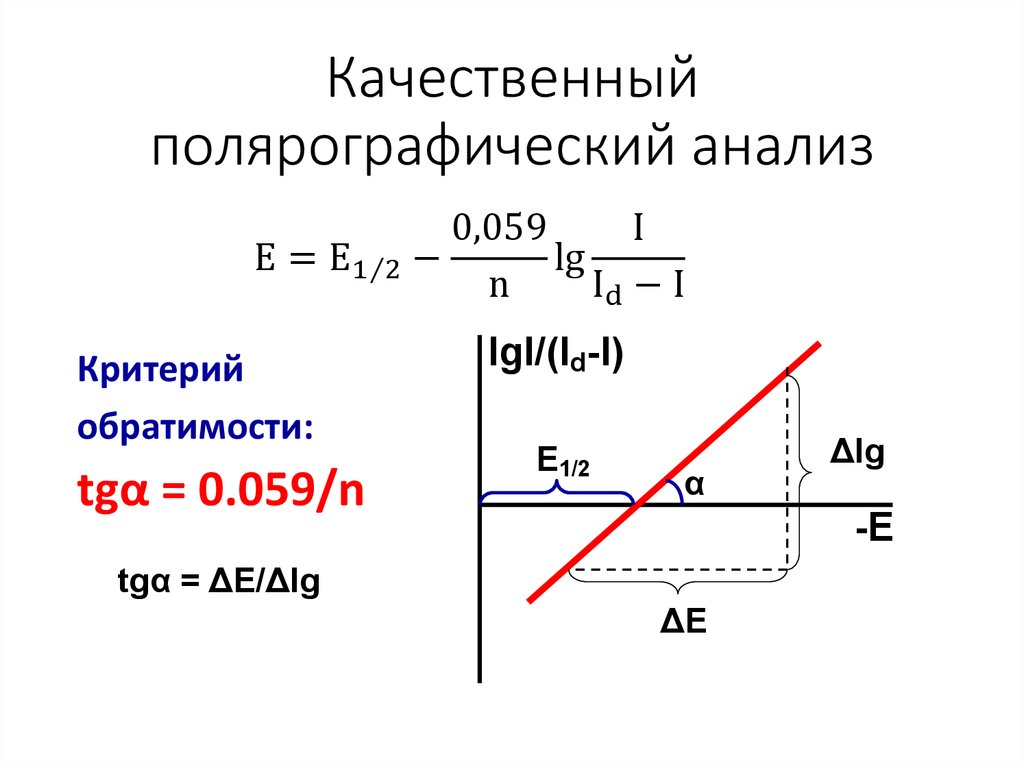
12. Качественный полярографический анализ
0,059I
E = E1Τ2 −
lg
n
Id − I
Критерий
обратимости:
tgα = 0.059/n
lgI/(Id-I)
E1/2
α
Δlg
-E
tgα = ΔE/Δlg
ΔE
13. Количественный полярографический анализ
Уравнение Ильковичаm – масса ртути, вытекающей из капилляра за1 сек, мг
t – время образования капли
n – валентность восстанавливающегося иона
D – коэффициент диффузии
c – концентрация
метод калибровочного графика
10–4–10–5моль/л
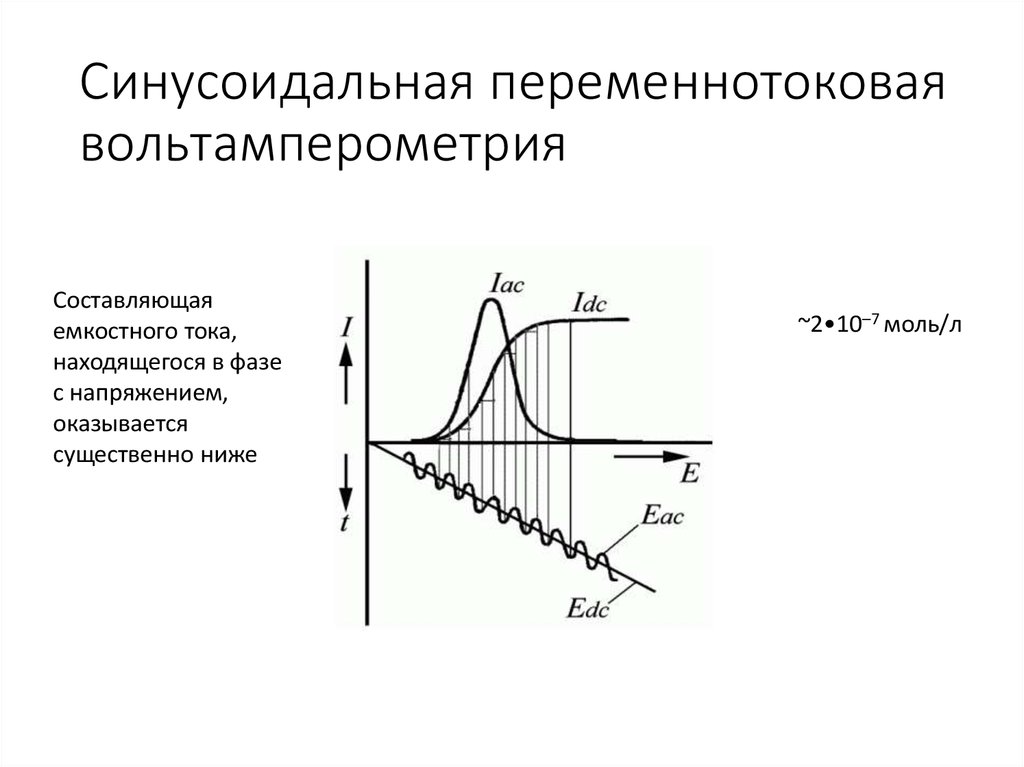
14. Синусоидальная переменнотоковая вольтамперометрия
Составляющаяемкостного тока,
находящегося в фазе
с напряжением,
оказывается
существенно ниже
~2•10–7 моль/л
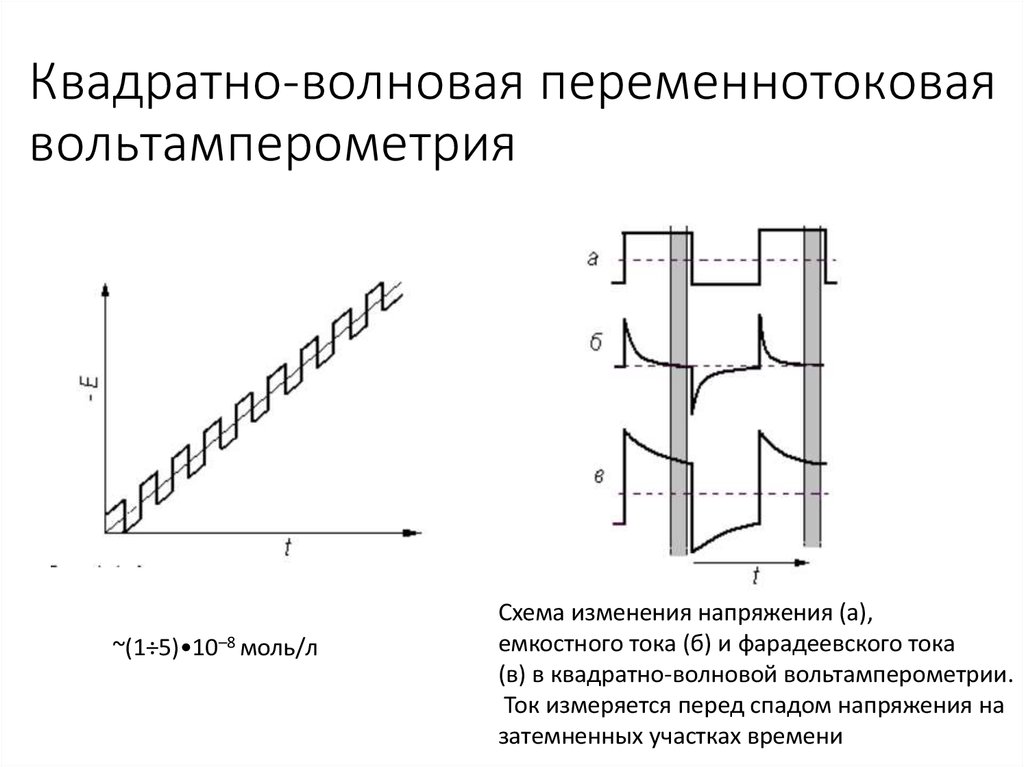
15. Квадратно-волновая переменнотоковая вольтамперометрия
~(1÷5)•10–8 моль/лСхема изменения напряжения (а),
емкостного тока (б) и фарадеевского тока
(в) в квадратно-волновой вольтамперометрии.
Ток измеряется перед спадом напряжения на
затемненных участках времени
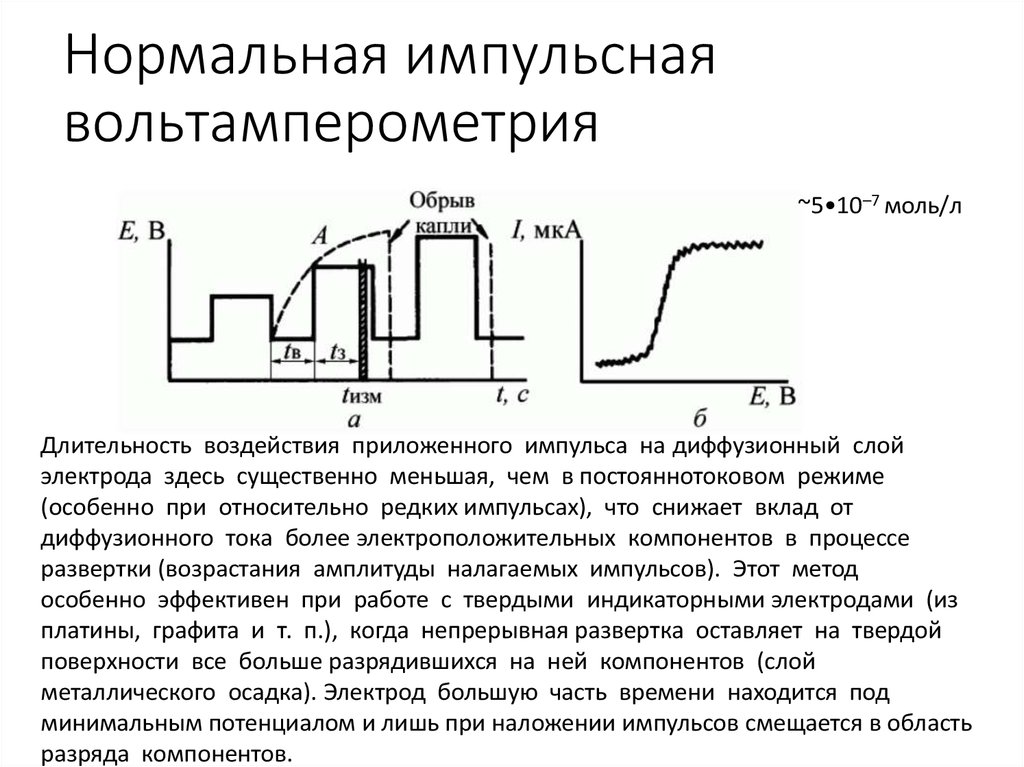
16. Нормальная импульсная вольтамперометрия
~5•10–7 моль/лДлительность воздействия приложенного импульса на диффузионный слой
электрода здесь существенно меньшая, чем в постояннотоковом режиме
(особенно при относительно редких импульсах), что снижает вклад от
диффузионного тока более электроположительных компонентов в процессе
развертки (возрастания амплитуды налагаемых импульсов). Этот метод
особенно эффективен при работе с твердыми индикаторными электродами (из
платины, графита и т. п.), когда непрерывная развертка оставляет на твердой
поверхности все больше разрядившихся на ней компонентов (слой
металлического осадка). Электрод большую часть времени находится под
минимальным потенциалом и лишь при наложении импульсов смещается в область
разряда компонентов.
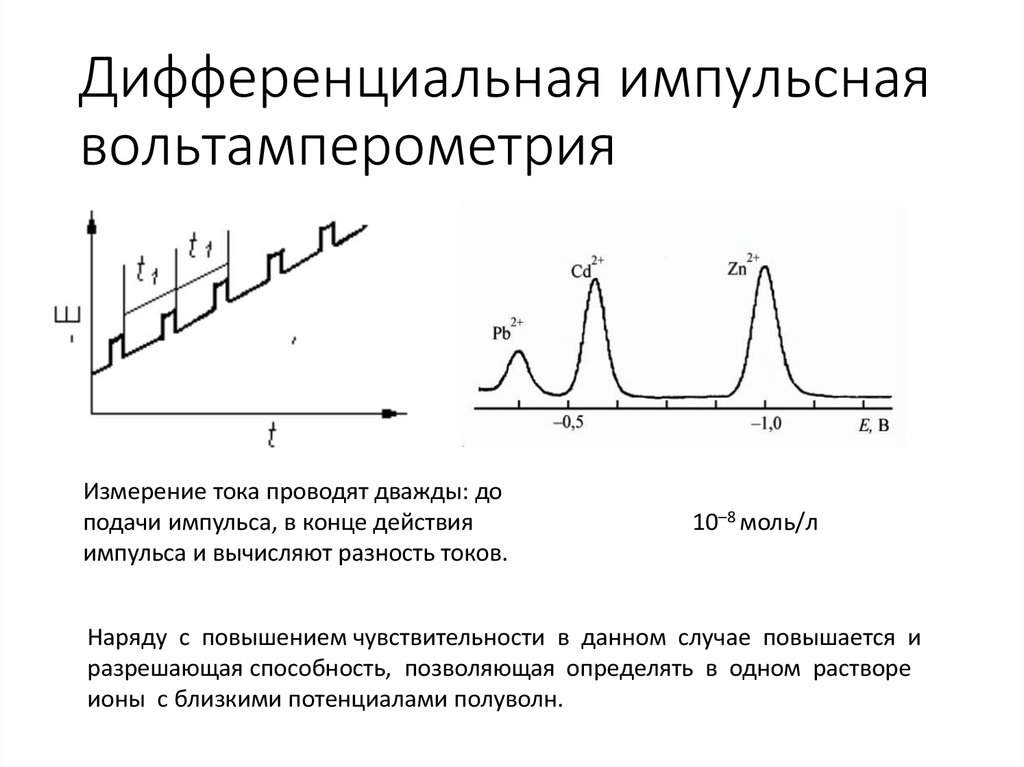
17. Дифференциальная импульсная вольтамперометрия
Измерение тока проводят дважды: доподачи импульса, в конце действия
импульса и вычисляют разность токов.
10–8 моль/л
Наряду с повышением чувствительности в данном случае повышается и
разрешающая способность, позволяющая определять в одном растворе
ионы с близкими потенциалами полуволн.
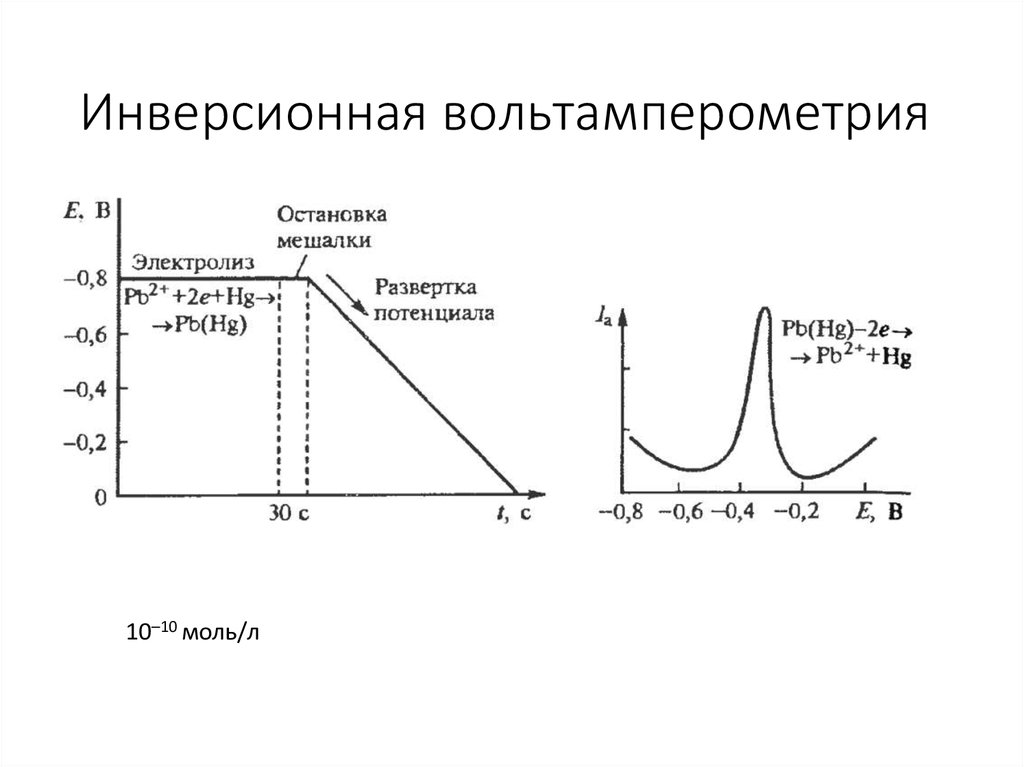
18. Инверсионная вольтамперометрия
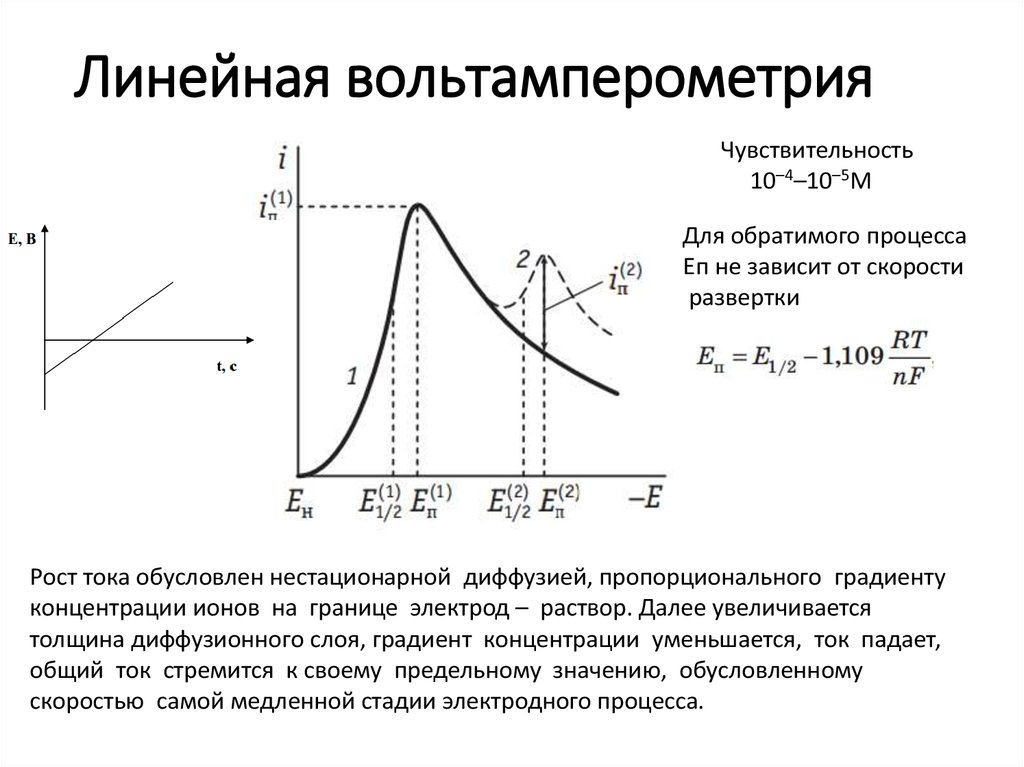
10–10 моль/л19. Линейная вольтамперометрия
Чувствительность10–4–10–5М
Для обратимого процесса
Еп не зависит от скорости
развертки
Рост тока обусловлен нестационарной диффузией, пропорционального градиенту
концентрации ионов на границе электрод – раствор. Далее увеличивается
толщина диффузионного слоя, градиент концентрации уменьшается, ток падает,
общий ток стремится к своему предельному значению, обусловленному
скоростью самой медленной стадии электродного процесса.
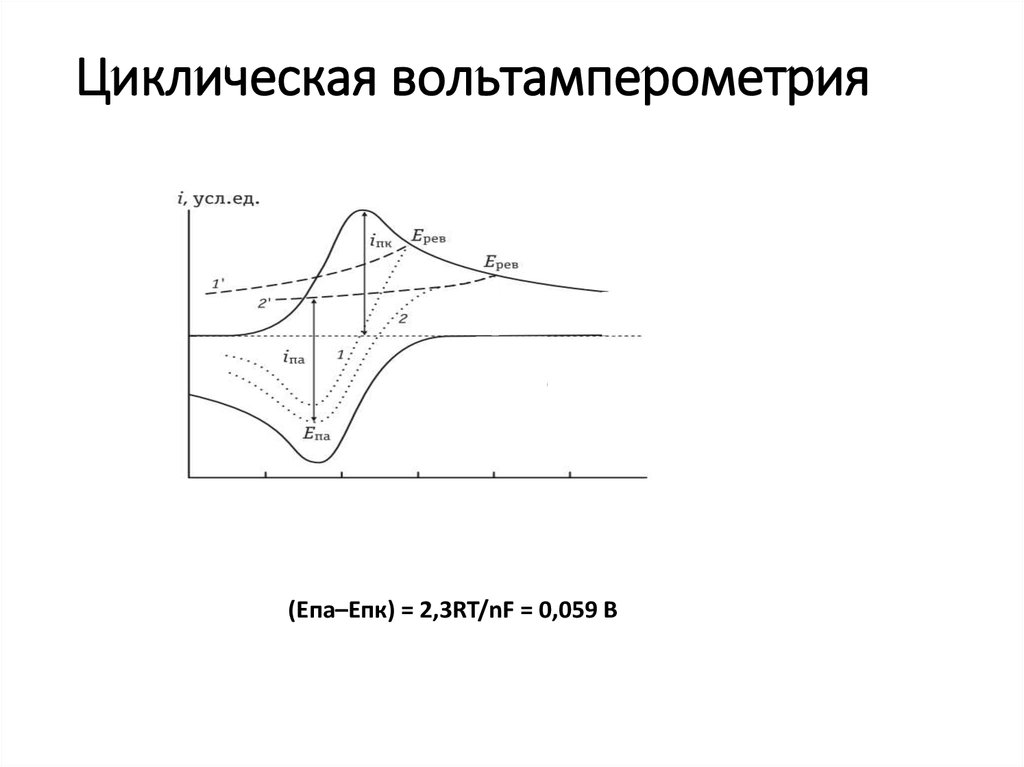
20. Циклическая вольтамперометрия
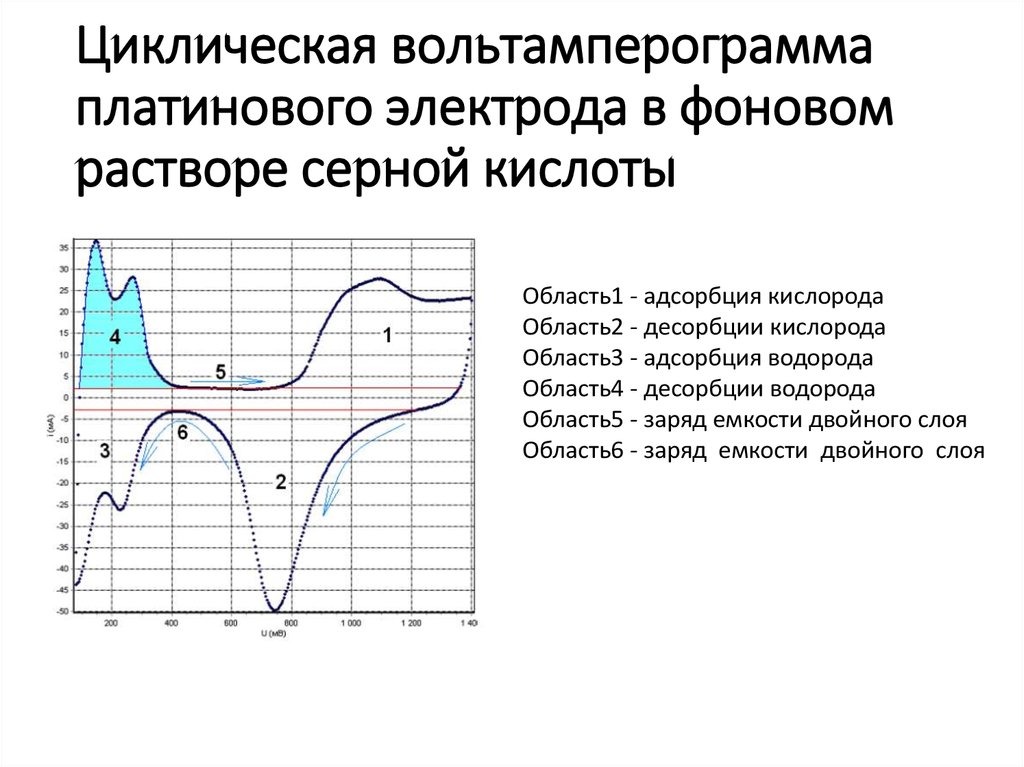
(Епа–Епк) = 2,3RT/nF = 0,059 В21. Циклическая вольтамперограмма платинового электрода в фоновом растворе серной кислоты
Область1 - адсорбция кислородаОбласть2 - десорбции кислорода
Область3 - адсорбция водорода
Область4 - десорбции водорода
Область5 - заряд емкости двойного слоя
Область6 - заряд емкости двойного слоя
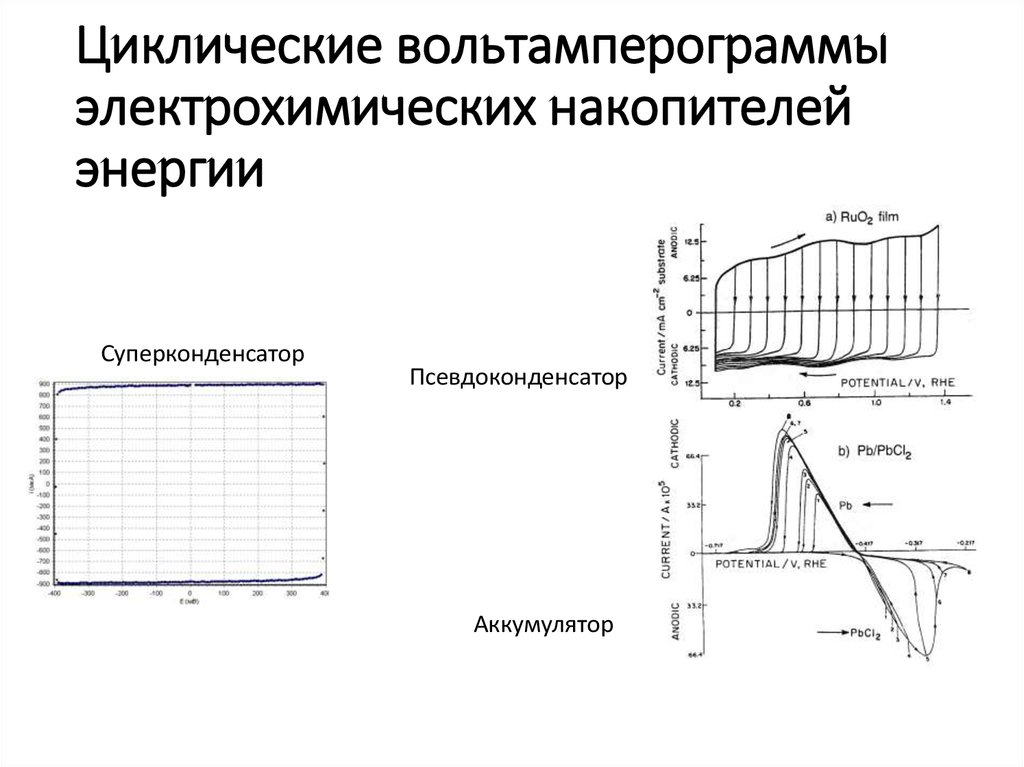
22. Циклические вольтамперограммы электрохимических накопителей энергии
СуперконденсаторПсевдоконденсатор
Аккумулятор








 Химия
Химия








