Похожие презентации:
Циклоалканы
1. Циклоалканы.
2. Общая формула - СnH2n
Циклоалканы – этоуглеводороды, в которых
все атомы углерода
замкнуты в цикл.
Общая формула - СnH2n
3.
Гомологический ряд алкановCH2
CH2
H2C
H2C
CH2
циклопропан
H2C
CH2
H2C
CH2
циклобутан
CH2
H2C
CH2
циклопентан
CH2
H2C
CH2
H2C
CH2
CH2
циклогексан
4. Строение молекул
Гибридизация sp3Угол связи равен 109 градусов
5. Строение молекул
Сходство с предельнымиуглеводородами:
Каждый атом углерода в
циклоалканах находится в
состоянии sp3-гибридизации и
образует четыре s-связи С-С и С-Н.
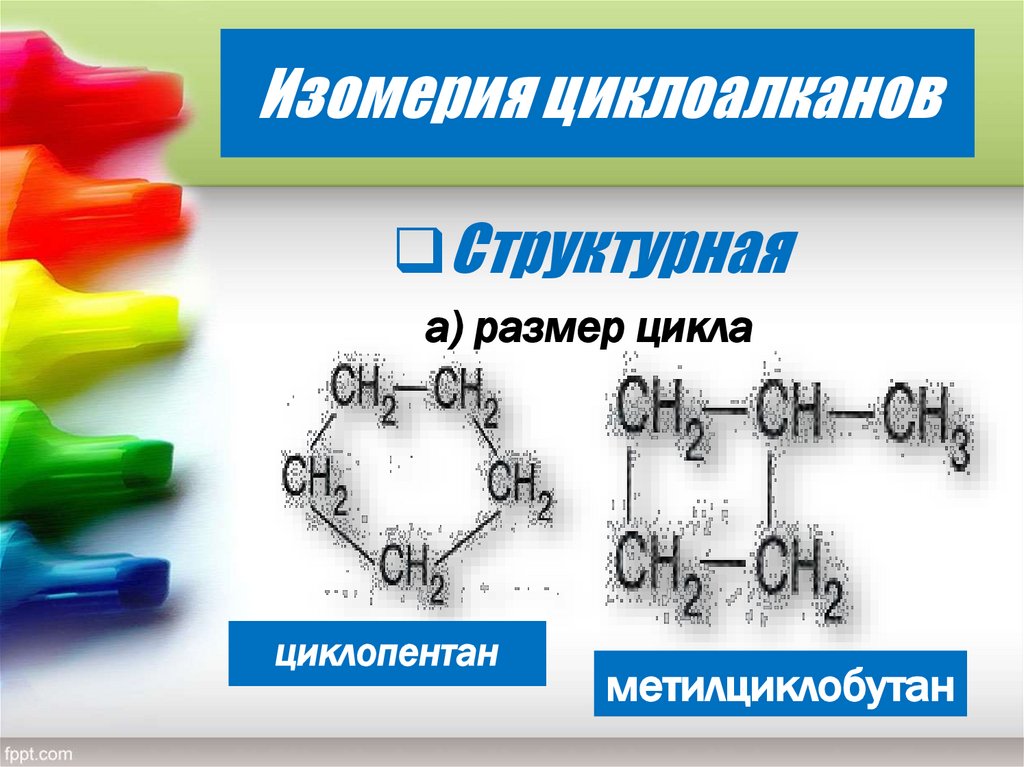
6. Изомерия циклоалканов
Структурнаяа) размер цикла
циклопентан
метилциклобутан
7. Изомерия циклоалканов
Структурнаяг) межклассовая
Циклоалканы
Сn H2n
Алкены
Сn H2n
Имеют одну молекулярную формулу, но разное
строение, т.е. являются
изомерами.
8.
СH2H2 С
СH2
H2 С
СH2
С5H10
ЦИКЛОПЕНТАН
H2 С=СH - СH2 - СH2 - СH3
С5H10
ПЕНТЕН-1
9. Нахождение в природе
Циклоалканы главным образом находятся в составенекоторых нефти. Отсюда и другое название
циклоалканов – нафтены. Пяти – и шестичленные
циклоалканы были впервые выделены их нефти и
изучены профессором Московского университета
В.В. Марковниковым
10. ФИЗИЧЕСКИЕ СВОЙСТВА
Число атомов 3-4 Число атомов 5-15 Число атомов >15Газы
Жидкости
Твердые вещества
Температура кипения и плавления
циклоалканов выше, чем у алканов с
равным количеством атомов углерода
Чем больше размер цикла, тем больше
температура кипения;
В воде практически не растворимы, но
растворимы в органических растворителях;
11. Химические СВОЙСТВА
Химические свойства циклопарафиновзависят от числа атомов углерода,
составляющих цикл.
Низшие циклоалканы (циклопропан и
циклобутан) ведут себя как ненасыщенные
углеводороды, они способны вступать в
реакции присоединения.
Циклоалканы с большим количеством
углеродных атомов в цикле ведут себя как
алканы, для них характерны реакции
замещения.
12. Реакции присоединения
1) ГидрированиеПри каталитическом гидрировании
трех-,четырех- и пятичленные циклы
разрываются с образованием алканов
+ H2 120ºC, Ni
циклобутан
Н3С- СH2 -СH2 -СH3
бутан
13.
Реакции присоединения2) Галогенирование
Трехчленный цикл при галогенировании
разрывается,
присоединяя атомы галогена
+ Br2 BrCH2–CH2–CH2Br
циклопропан
1,3-дибромпропан
14. Реакции присоединения
3) ГидрогалогенированиеЦиклопропан и его гомологи
взаимодействуют
с галогеноводородами с разрывом цикла.
+ HBr
циклопропан
BrCH2–CH2–CH3
1-бром пропан
15.
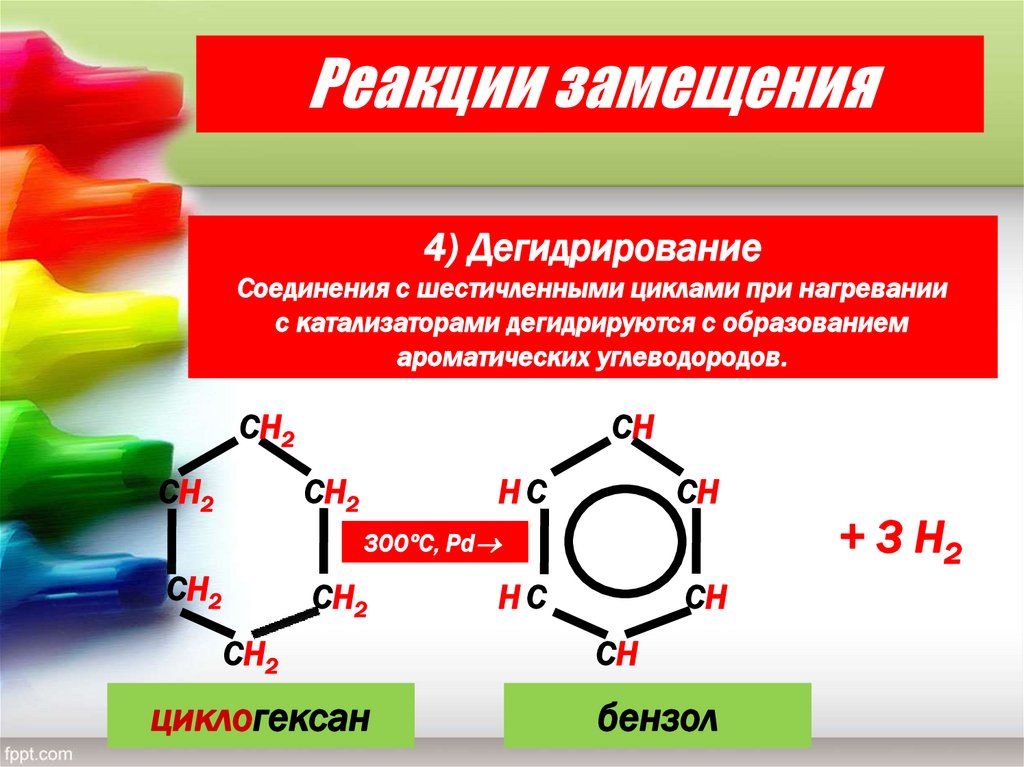
Реакции замещения4) Дегидрирование
Соединения с шестичленными циклами при нагревании
с катализаторами дегидрируются с образованием
ароматических углеводородов.
СH2
СH2
СH
СH2
HС
СH
+ 3 H2
300ºC, Pd
СH2
СH2
СH2
циклогексан
HС
СH
СH
бензол
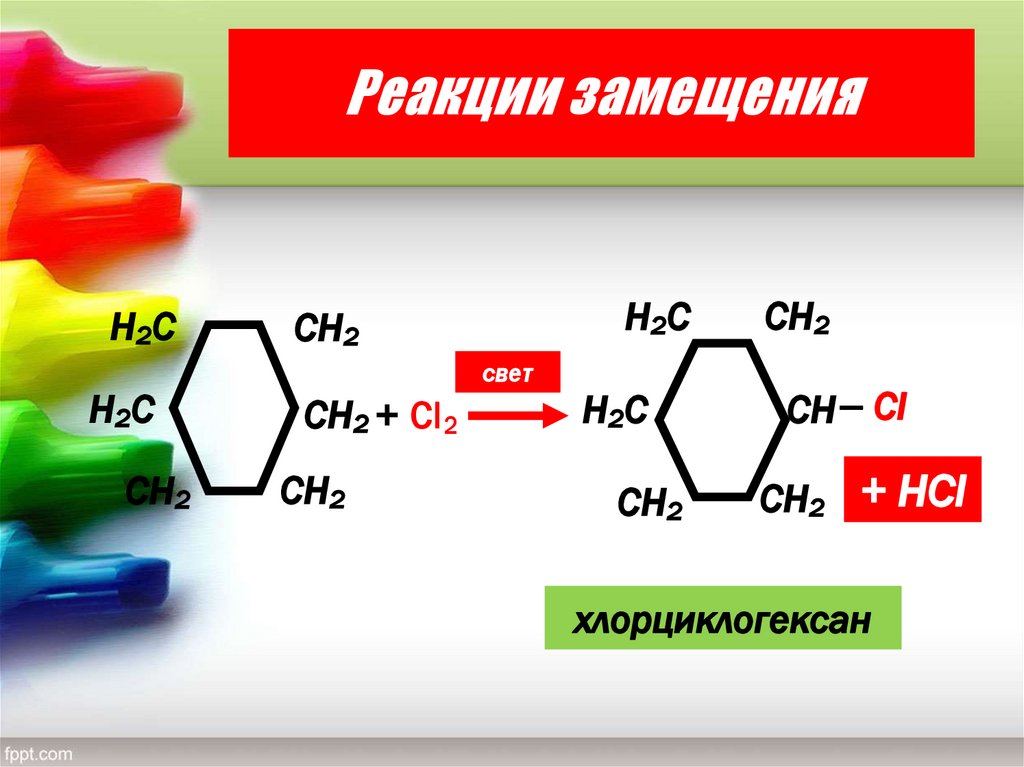
16. Реакции замещения
H 2CH 2C
CH2
H 2C
CH2
свет
CH2 + Cl2
CH2
H 2C
CH2
CH2
CH Cl
CH2 + HCl
хлорциклогексан
17. Реакция горения
Полное окисление (горение) собразованием воды и углекислого газа
2 С5Н10 + 15 О2свет
10 СО2 + 10 Н2О + Q
18.
ПолучениеI. В промышленности
1) Из нефти
При переработке нефти выделяют главным
образом циклоалканы С5 - С7
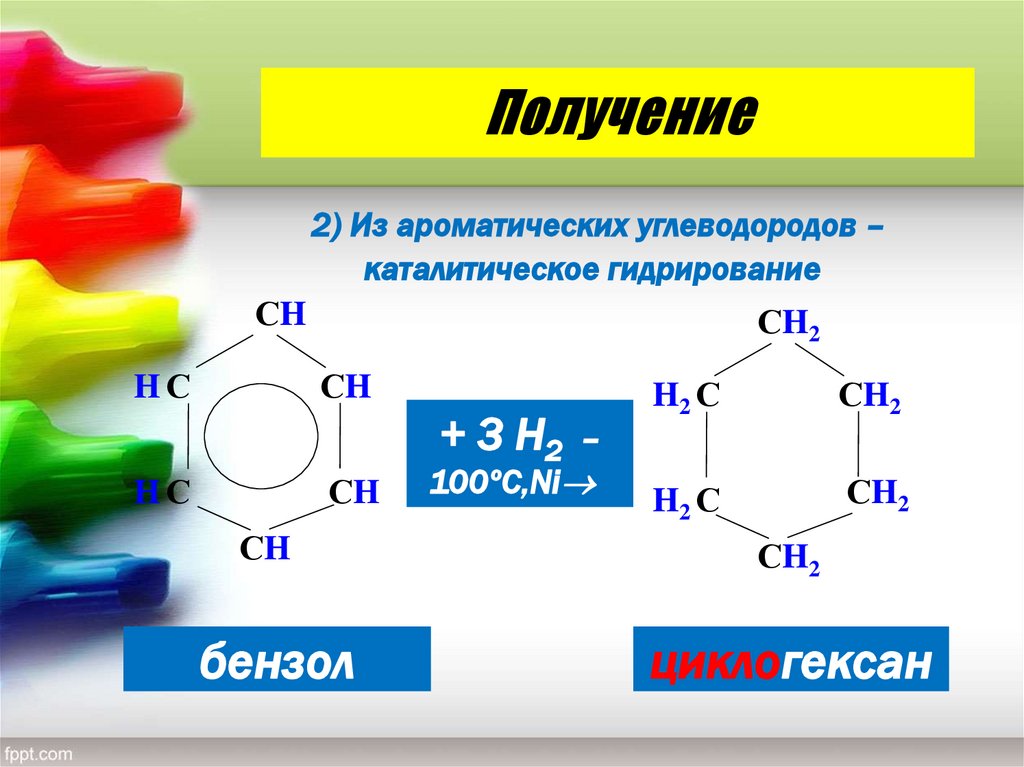
19. Получение
2) Из ароматических углеводородов –каталитическое гидрирование
СH
HС
СH2
СH
+ 3 H2 –
HС
СH
100ºC,Ni
H2 С
СH2
H2 С
СH2
СH
СH2
бензол
циклогексан
20. Получение
II . В лабораторииИз дигалогенпроизводных алканов
(внутримолекулярная реакция Вюрца):
H2 С
H2 С
С H2
С H2
1,4-дибромбутан
циклобутан
Br
+2NaBr
Br
21.
ПрименениеПрактическое значение имеют циклогексан,
метилциклогексан, и некоторые другие. В
процессе ароматизации нефти эти соединения
превращаются в ароматические углеводороды –
бензол, толуол и другие вещества. Которые широко
используются для синтеза красителей,
медикаментов и т. д. Циклопропан применяют для
наркоза.

















 Химия
Химия








