Похожие презентации:
Углеводороды
1.
Углеводороды2.
Что надо знать о веществах?1. Формула (из чего состоит)
2. Структура (как устроено)
3. Физические свойства
4. Химические свойства
5. Способы получения
(лаб. и промышл.)
6. Практическое применение
3.
Алканы СnH2n+2ациклические, насыщенные углеводороды,
в молекулах которых атомы связаны одинарными
связями
4.
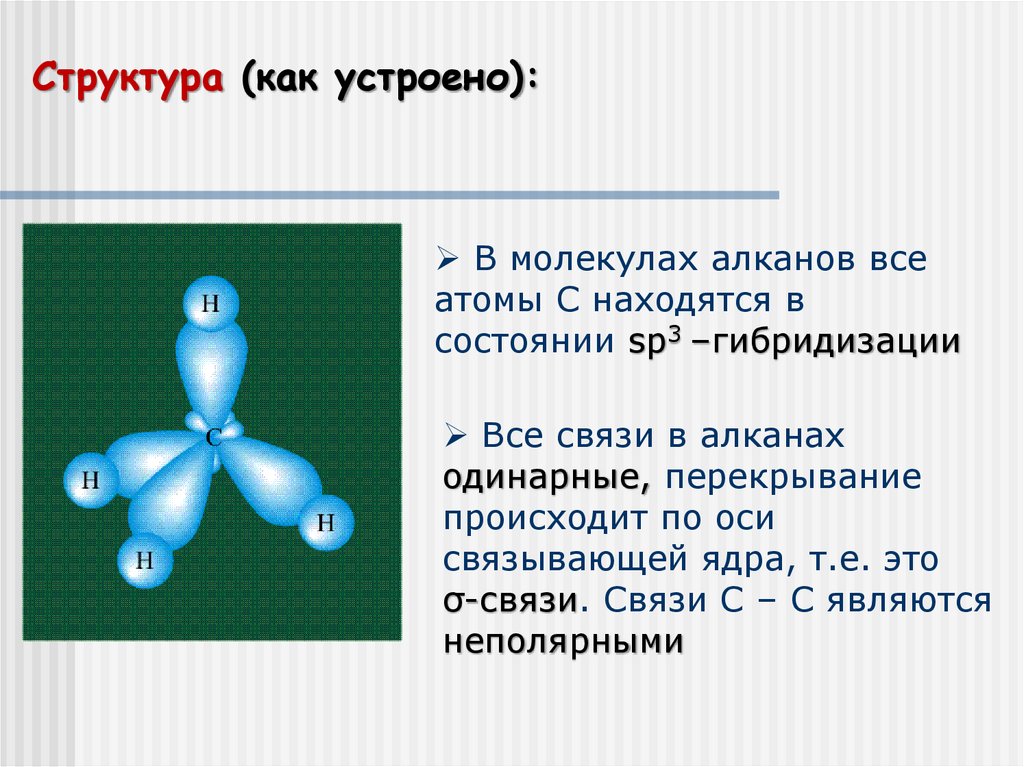
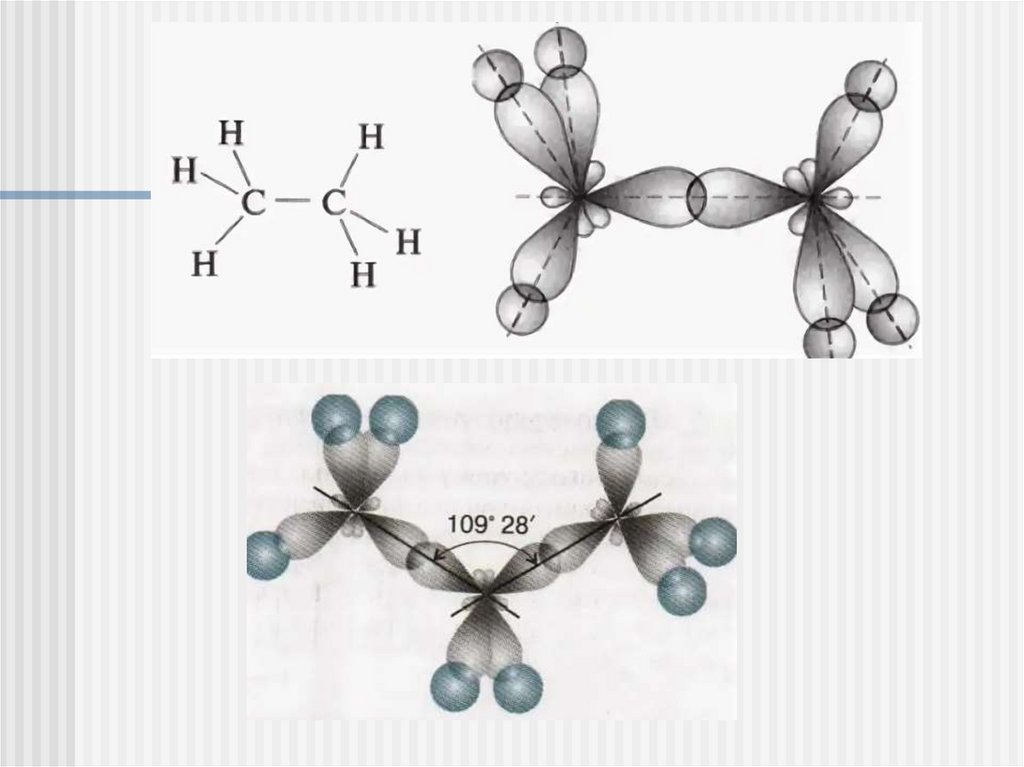
Структура (как устроено):В молекулах алканов все
атомы С находятся в
состоянии sp3 –гибридизации
Все связи в алканах
одинарные, перекрывание
происходит по оси
связывающей ядра, т.е. это
σ-связи. Связи С – С являются
неполярными
5.
6.
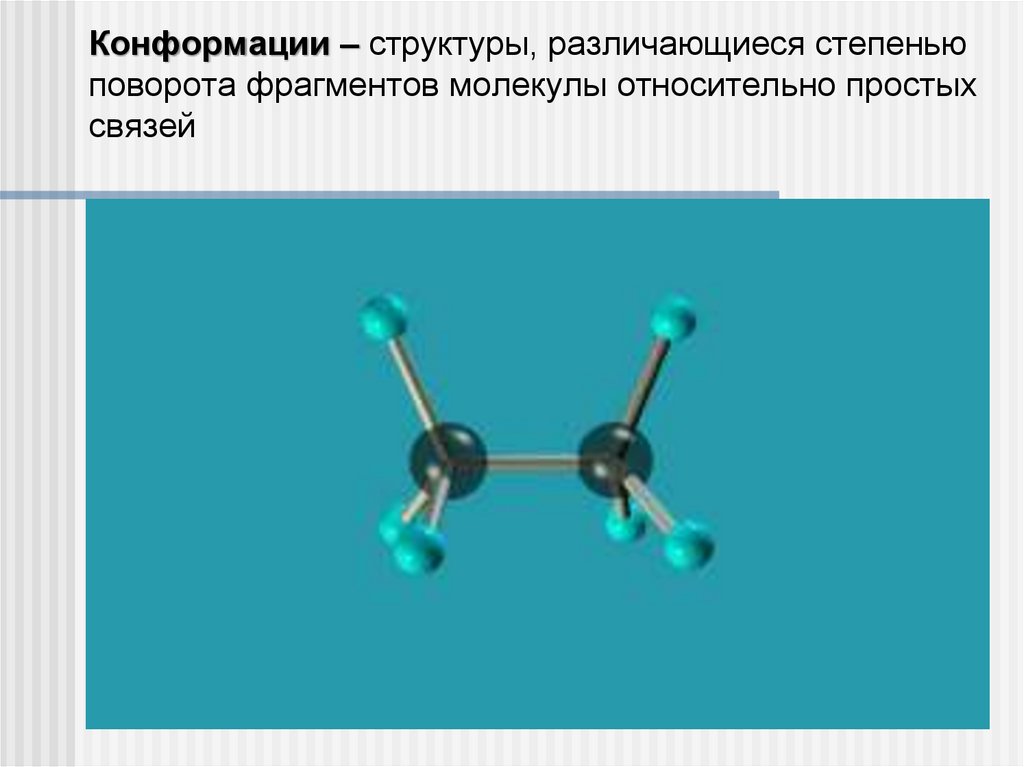
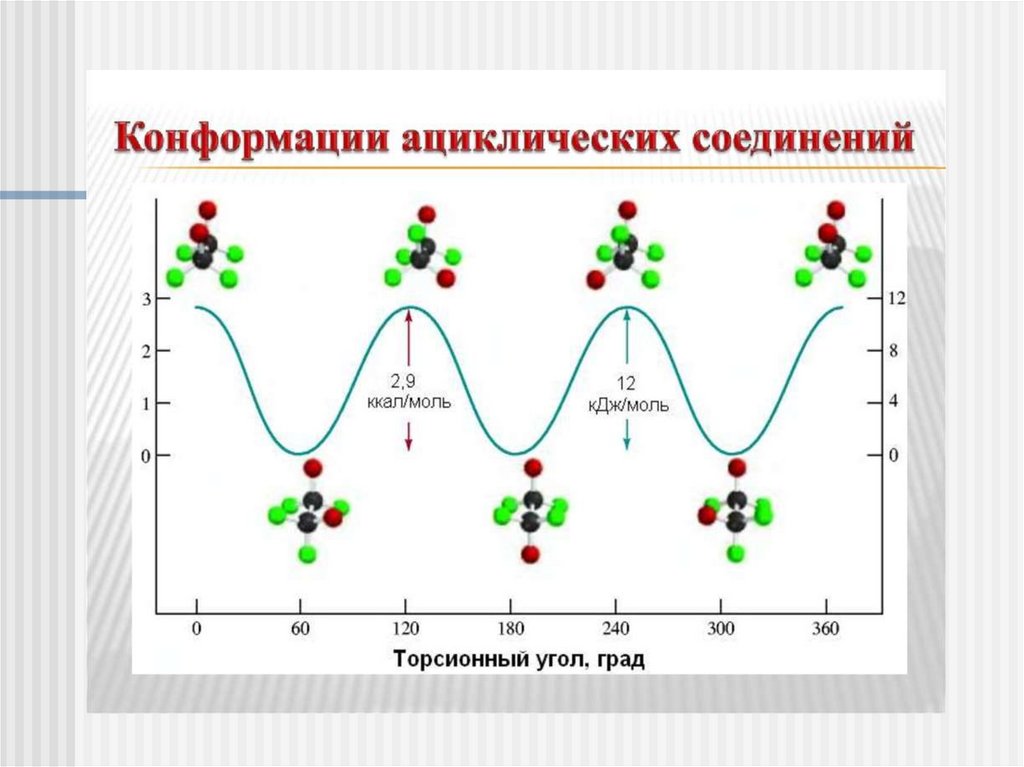
Конформации – структуры, различающиеся степеньюповорота фрагментов молекулы относительно простых
связей
7.
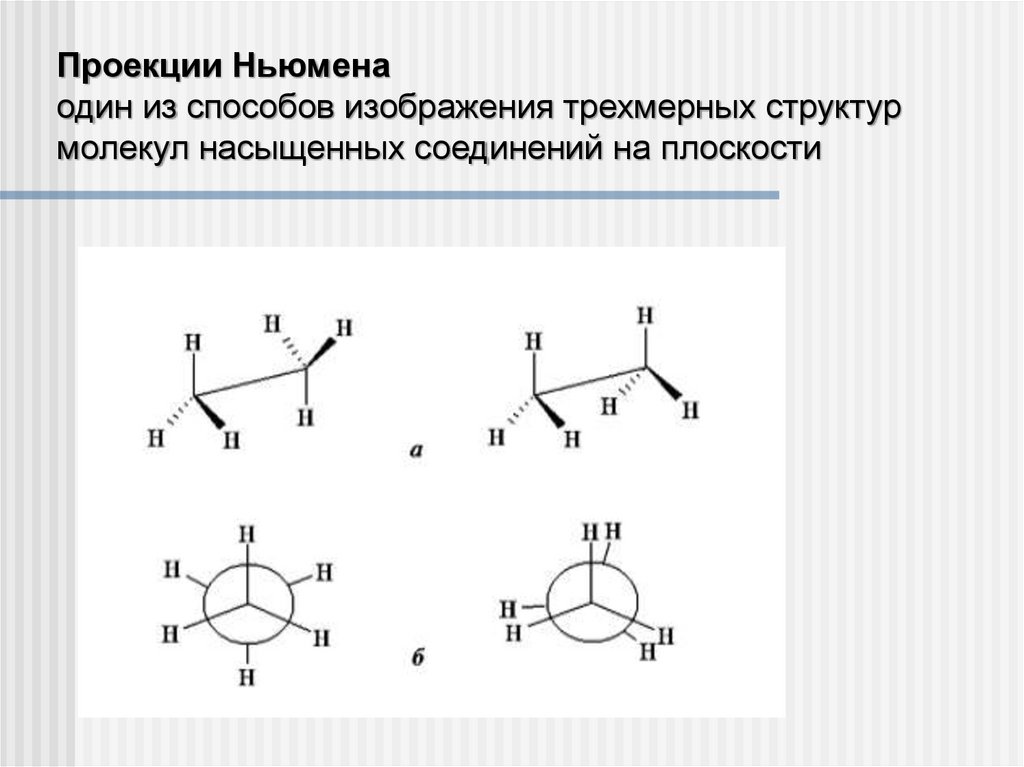
Проекции Ньюменаодин из способов изображения трехмерных структур
молекул насыщенных соединений на плоскости
8.
9.
Физические свойства10.
Зависимость температур кипения отстроения алканов
Увеличение молекулярной массы и длины цепи, приводит к
увеличению взаимодействия между молекулами и тем самым к
увеличению Ткип
Разветвление цепи приводит к ослаблению
межмолекулярного воздействия, следовательно при одинаковой
М массе, более высокую Ткип. имеют неразветвленные алканы
11.
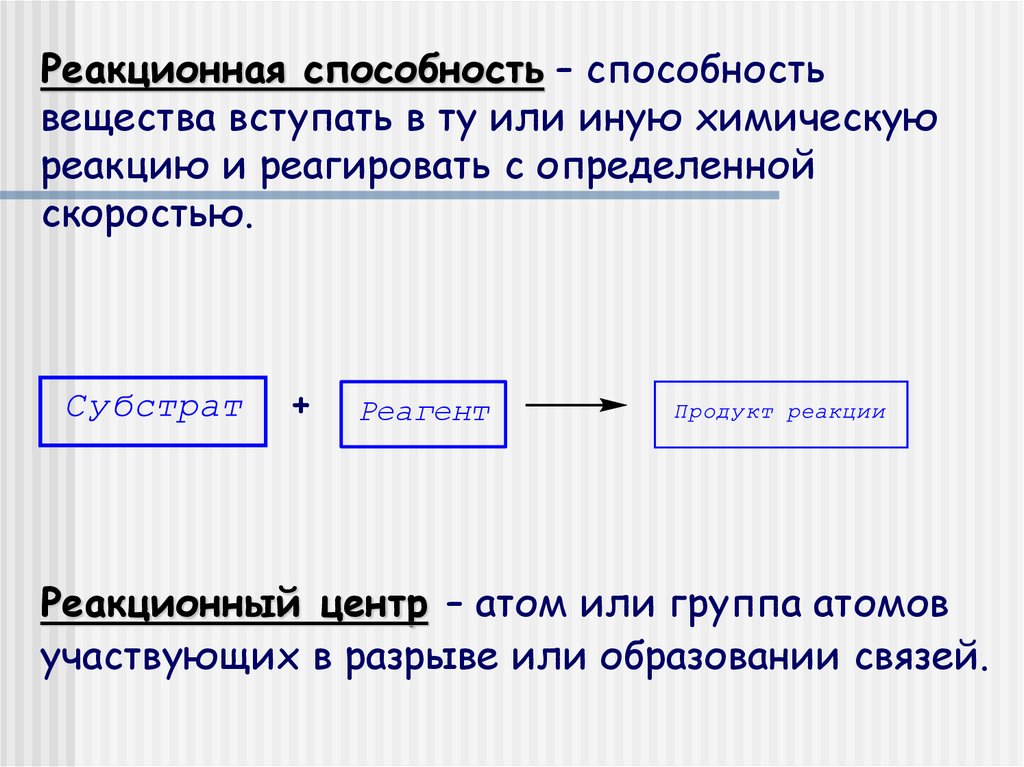
Реакционная способность – способностьвещества вступать в ту или иную химическую
реакцию и реагировать с определенной
скоростью.
+
Реагент
Реакционный центр – атом или группа атомов
участвующих в разрыве или образовании связей.
12.
Существует два типа разрыва ковалентнойсвязи:
Гомолитический
Х ׃Y → X• + Y
Свободный радикал –
атом или группа атомов
с неспаренным
валентным электроном
Гетеролитический
E ׃Nu → E+ + NuЭлектрофил E+(люблю
электроны) – это частицы
образующие новые к.с. за
счет пары электронов
партнера
Нуклеофил Nu- это
частицы, образующие
новые к.с. со своим
партнером, предоставляя
для этого пару
15
электронов
13.
По направлению (конечному результату)органические реакции делят:
замещение;
Без изменения
• присоединение;
скелета молекулы
• отщепление;
• расщепление
С изменением
(крекинг или «олиз»);
скелета молекулы
• соединение
(синтез, конденсация)
• изомеризация
(внутримолекулярная перестройка)
14.
В зависимости от типа атакующей частицыорганические реакции делят:
Радикальные (атакующая частица-радикал R)
Электрофильные (атакующая частица-электрофил
Е+)
Нуклеофильные (атакующая частица-нуклеофил
N -)
15.
Химические свойстваАлканы не склонны к ионному разрыву связей,
но способны расщепляется гомолитически при
атаке свободными радикалами
16.
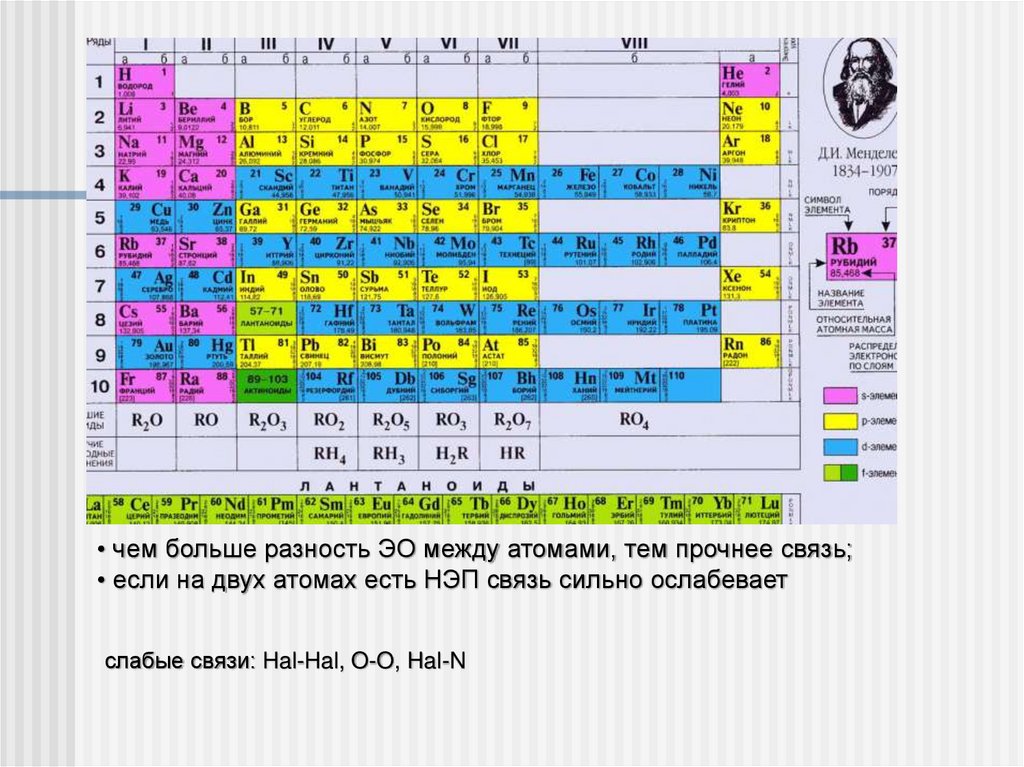
• чем больше разность ЭО между атомами, тем прочнее связь;• если на двух атомах есть НЭП связь сильно ослабевает
слабые связи: Hal-Hal, O-O, Hal-N
17.
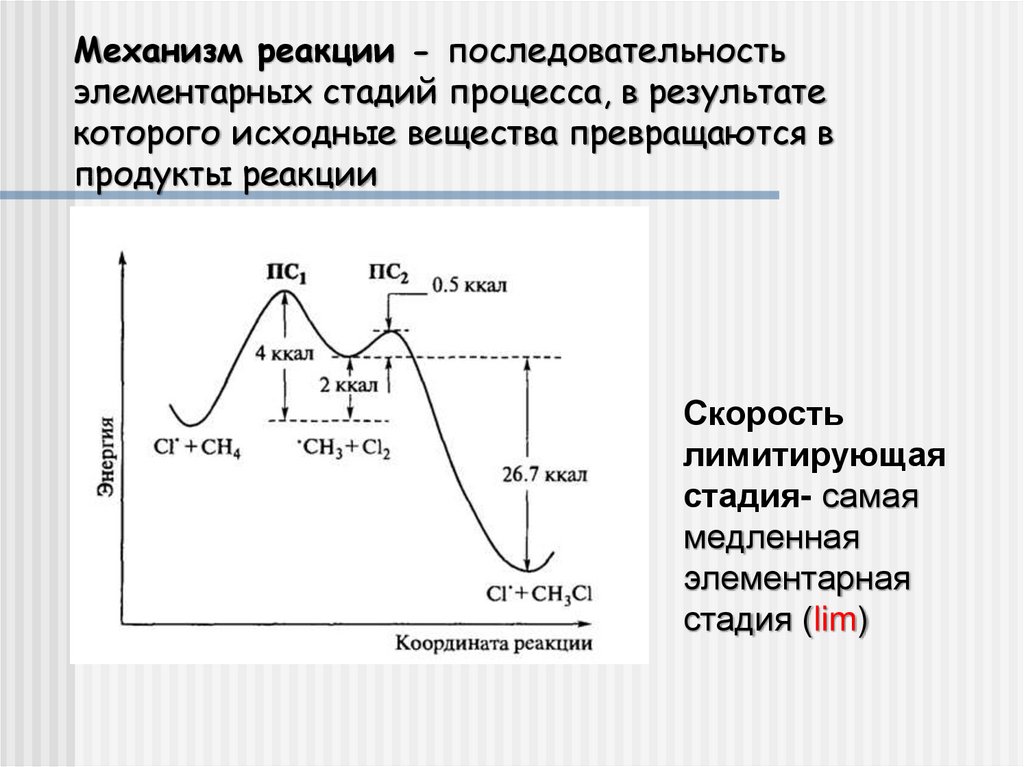
Механизм реакции - последовательностьэлементарных стадий процесса, в результате
которого исходные вещества превращаются в
продукты реакции
Скорость
лимитирующая
стадия- самая
медленная
элементарная
стадия (lim)
18.
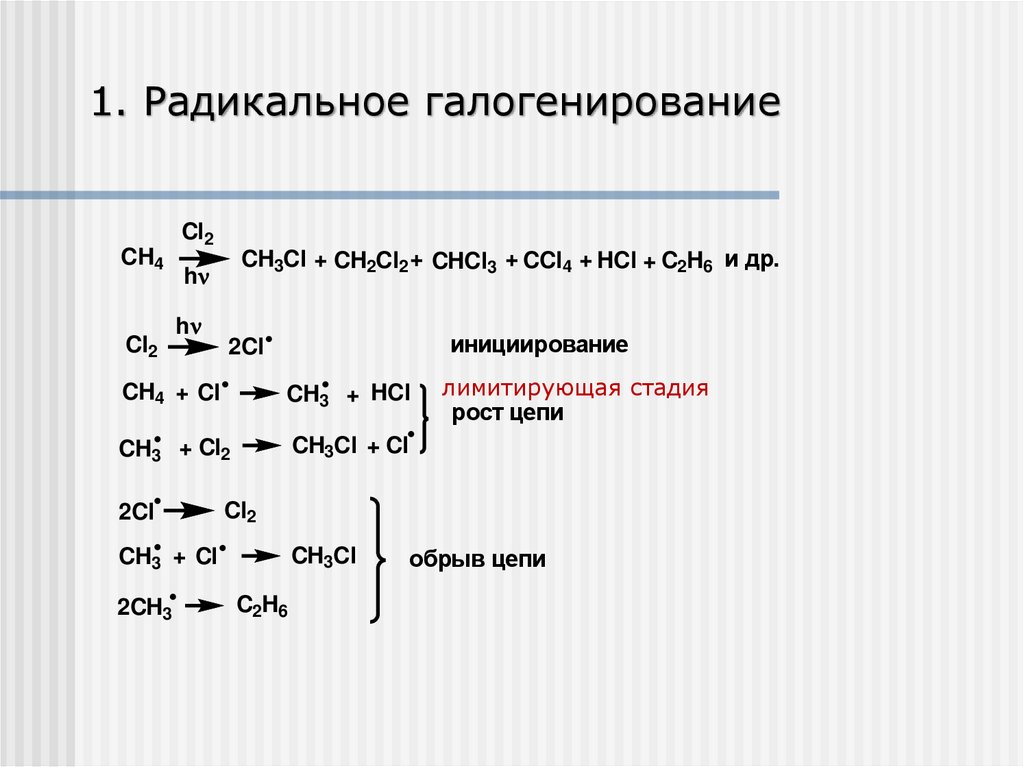
Реакции радикального замещения (SR)Зарождение цепи (стадия инициирования)
Х ׃Х → X• + Х
Роста цепи
Alk ׃H + X•→ Alk • + НХ
Alk • + Х ׃Х → Alk – Х + X
Обрыв цепи
X• + Х• → Х ׃Х
Alk • + X•→ Alk – Х
19.
1. Радикальное галогенированиеCH4
Cl2
Cl2
CH3Cl + CH2Cl2 + CHCl3 + CCl4 + HCl + C2H6 и др.
h
h
инициирование
2Cl
CH4 + Cl
CH3 + HCl
CH3 + Cl2
CH3Cl + Cl
2Cl
Cl2
CH3 + Cl
2CH3
лимитирующая стадия
рост цепи
CH3Cl
C2H6
обрыв цепи
20.
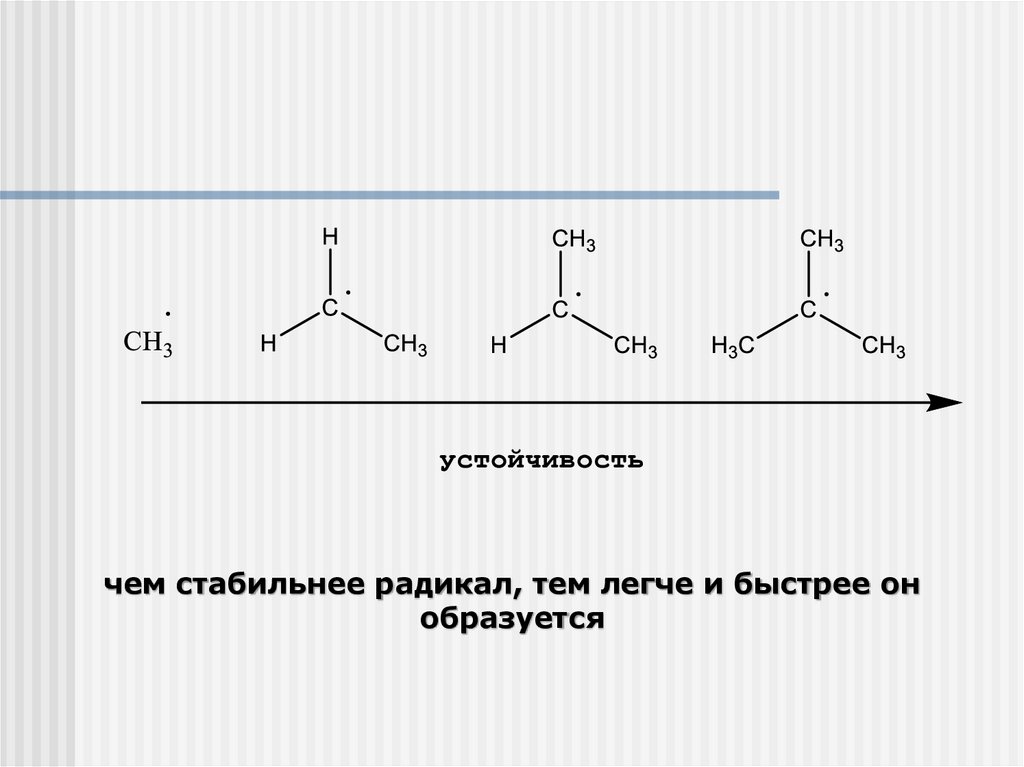
чем стабильнее радикал, тем легче и быстрее онобразуется
21.
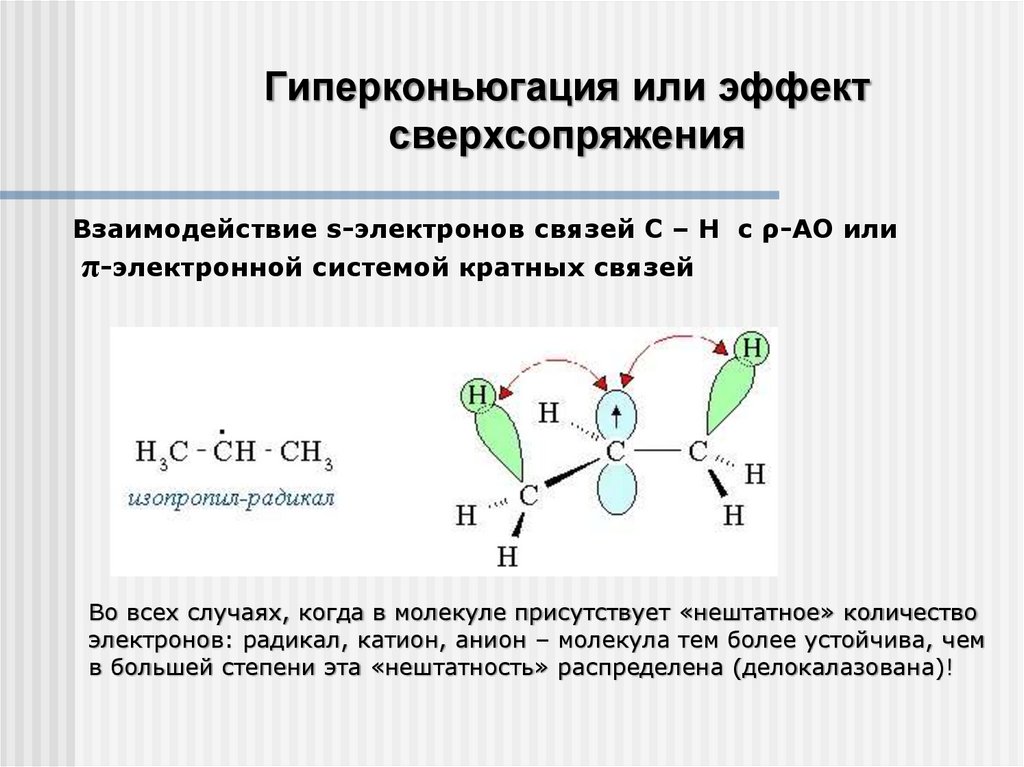
Гиперконьюгация или эффектсверхсопряжения
Взаимодействие s-электронов связей С – Н с ρ-АО или
π-электронной системой кратных связей
Во всех случаях, когда в молекуле присутствует «нештатное» количество
электронов: радикал, катион, анион – молекула тем более устойчива, чем
в большей степени эта «нештатность» распределена (делокалазована)!
22.
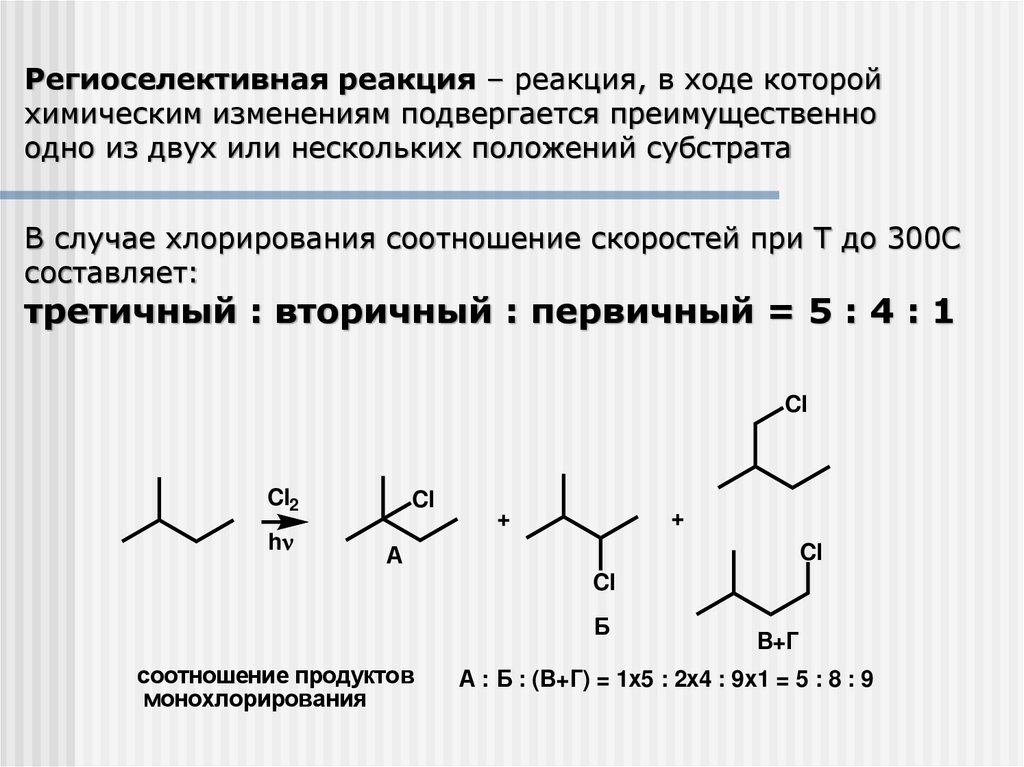
Региоселективная реакция – реакция, в ходе которойхимическим изменениям подвергается преимущественно
одно из двух или нескольких положений субстрата
В случае хлорирования соотношение скоростей при Т до 300С
составляет:
третичный : вторичный : первичный = 5 : 4 : 1
Cl
Cl2
h
Cl
+
+
А
Cl
Cl
Б
соотношение продуктов
монохлорирования
В+Г
А : Б : (В+Г) = 1х5 : 2х4 : 9х1 = 5 : 8 : 9
23.
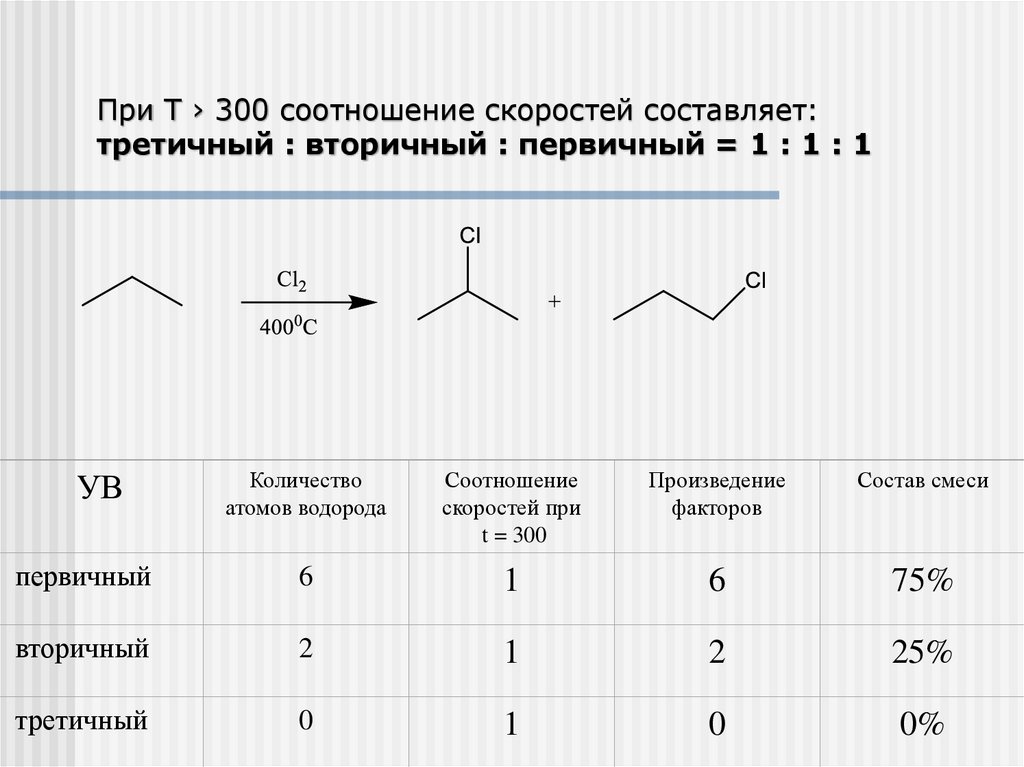
При T › 300 соотношение скоростей составляет:третичный : вторичный : первичный = 1 : 1 : 1
Количество
атомов водорода
Соотношение
скоростей при
t = 300
Произведение
факторов
Состав смеси
первичный
6
1
6
75%
вторичный
2
1
2
25%
третичный
0
1
0
0%
УВ
24.
Бромирование алкановВ случае бромирования соотношение скоростей составляет:
третичный : вторичный : первичный = 1600 : 82 : 1
Иодирование алканов не происходит, при фторировании
алканов происходит разрыв всех связей С-С
25.
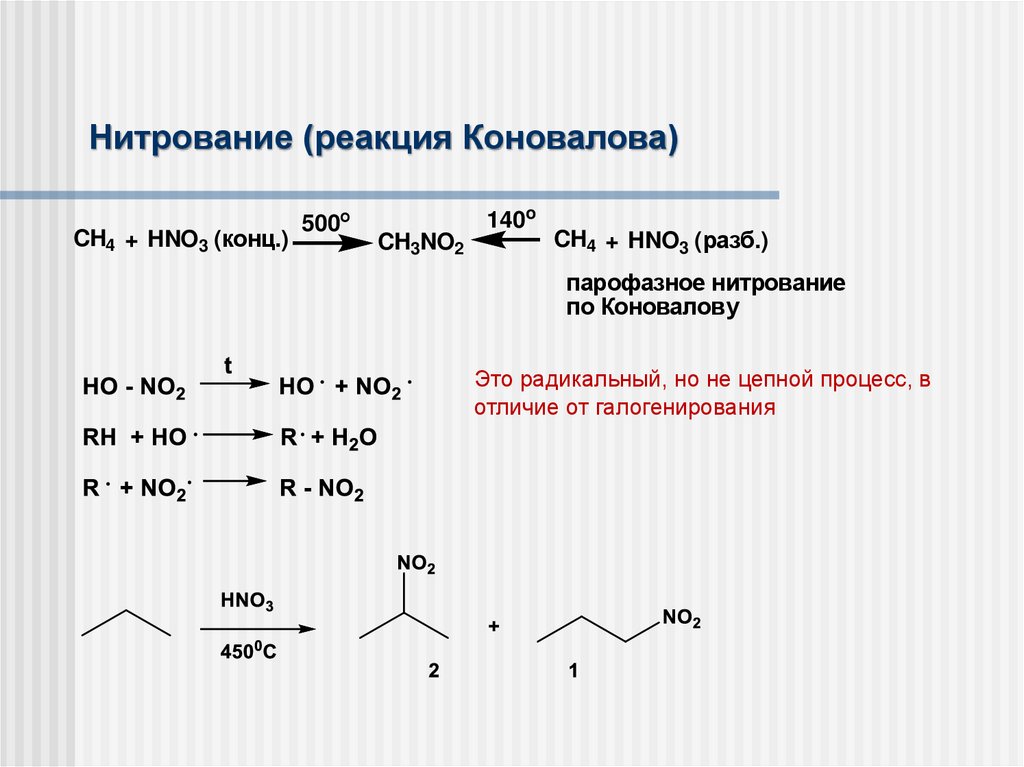
Нитрование (реакция Коновалова)CH4 + HNO3 (конц.)
500о
140o
CH3NO2
CH4 + HNO3 (разб.)
парофазное нитрование
по Коновалову
Это радикальный, но не цепной процесс, в
отличие от галогенирования
26.
Сульфоокисление:RH = циклогексан или высшие алканы
27.
Сульфохлорирование (реакция Рида)CH4 + SO2 + Cl2
Cl2
h
h
CH3SO2Cl
инициирование
2Cl
лимитирующая CH4 + Cl
стадия
CH3 + SO2
CH3 + HCl
рост цепи
CH3SO2
CH3SO2 + Cl2
CnH2n+2 + SO2 + Cl2
CH3SO2Cl + Cl
h
NaOH
CnH2n+2SO2Cl
H2 O
CnH2n+2SO3Na
алкилсульфонаты - ПАВ (синтетические моющие средства, детергенты)
Получать третичные сульфохлориды не удается этим методом !
28.
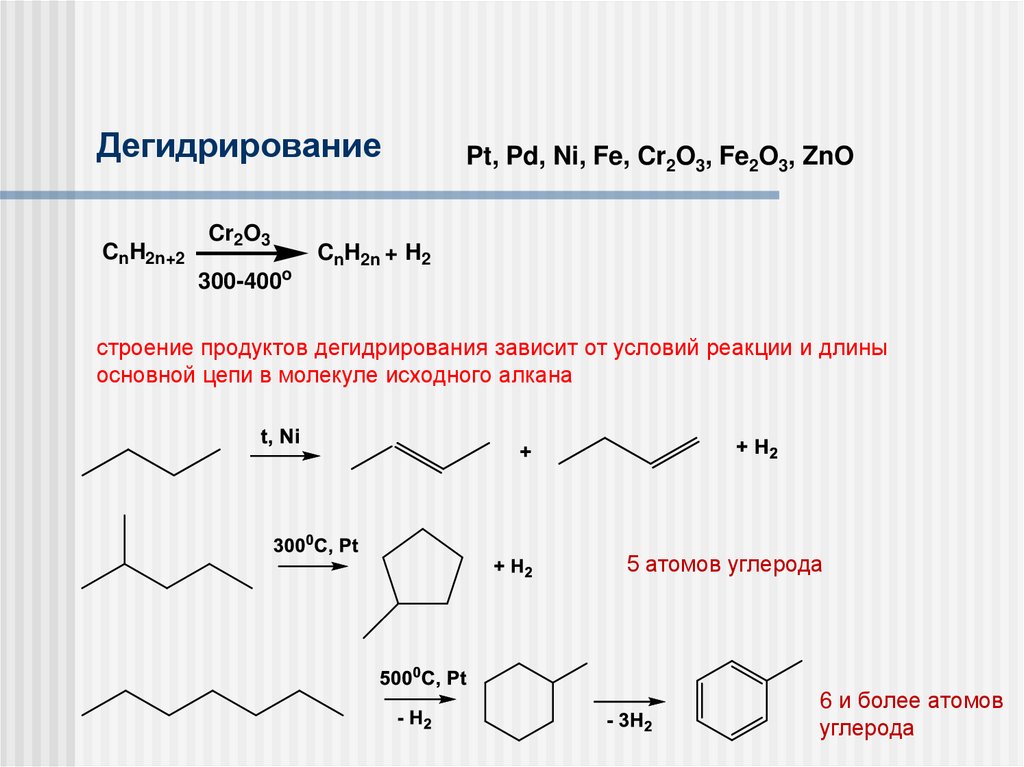
ДегидрированиеCnH2n+2
Cr2O3
300-400o
Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO
CnH2n + H2
строение продуктов дегидрирования зависит от условий реакции и длины
основной цепи в молекуле исходного алкана
5 атомов углерода
6 и более атомов
углерода
29.
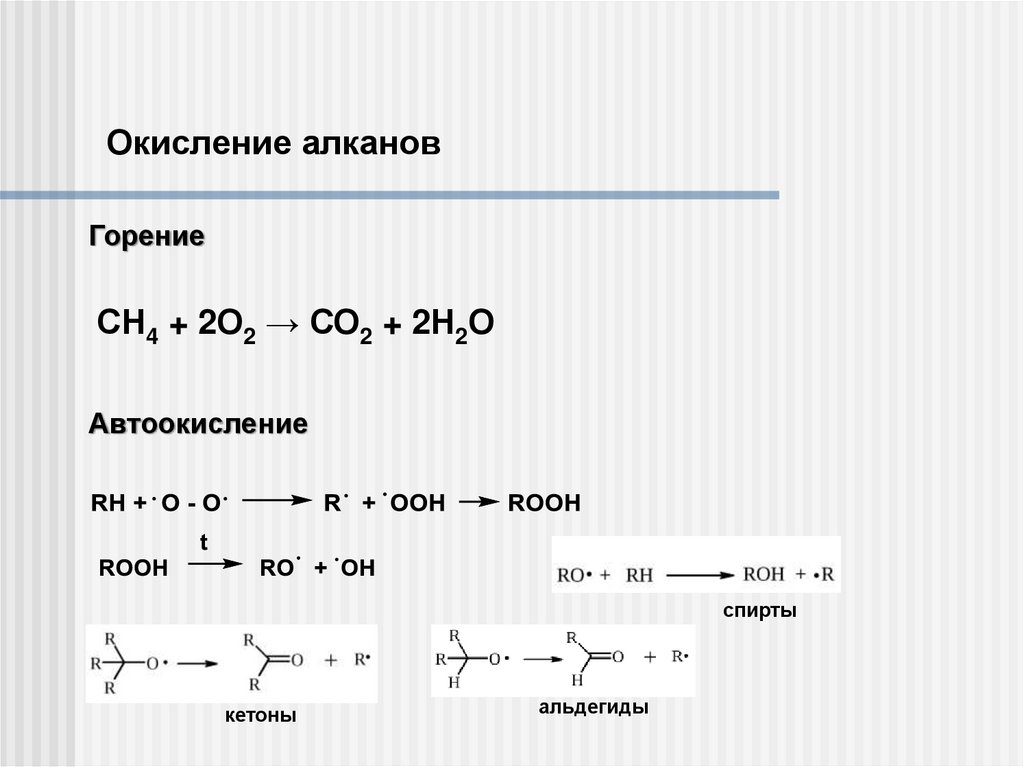
Окисление алкановГорение
СН4 + 2О2 → СО2 + 2Н2О
Автоокисление
спирты
кетоны
альдегиды
30.
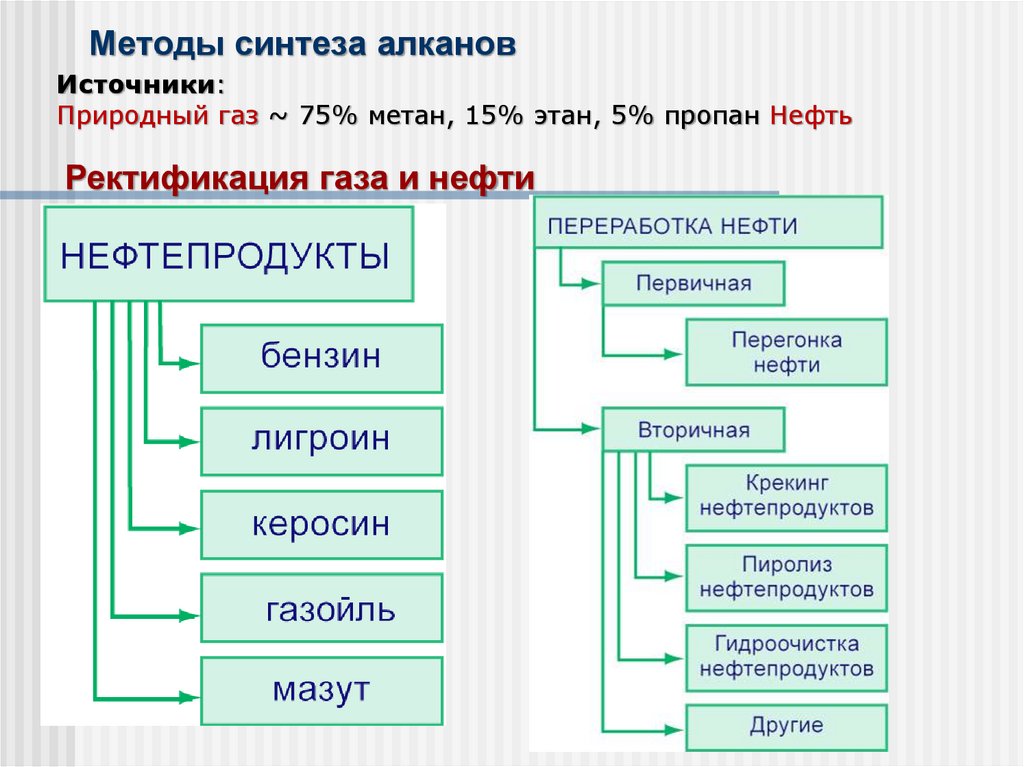
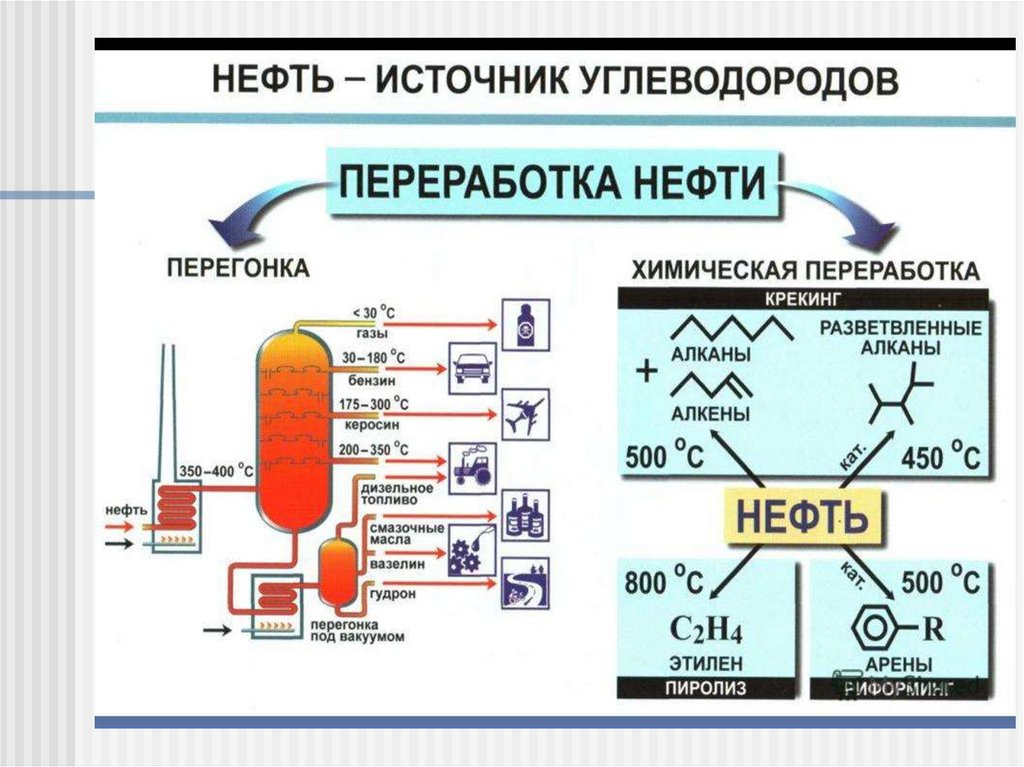
Методы синтеза алкановИсточники:
Природный газ ~ 75% метан, 15% этан, 5% пропан Нефть
Ректификация газа и нефти
31.
32.
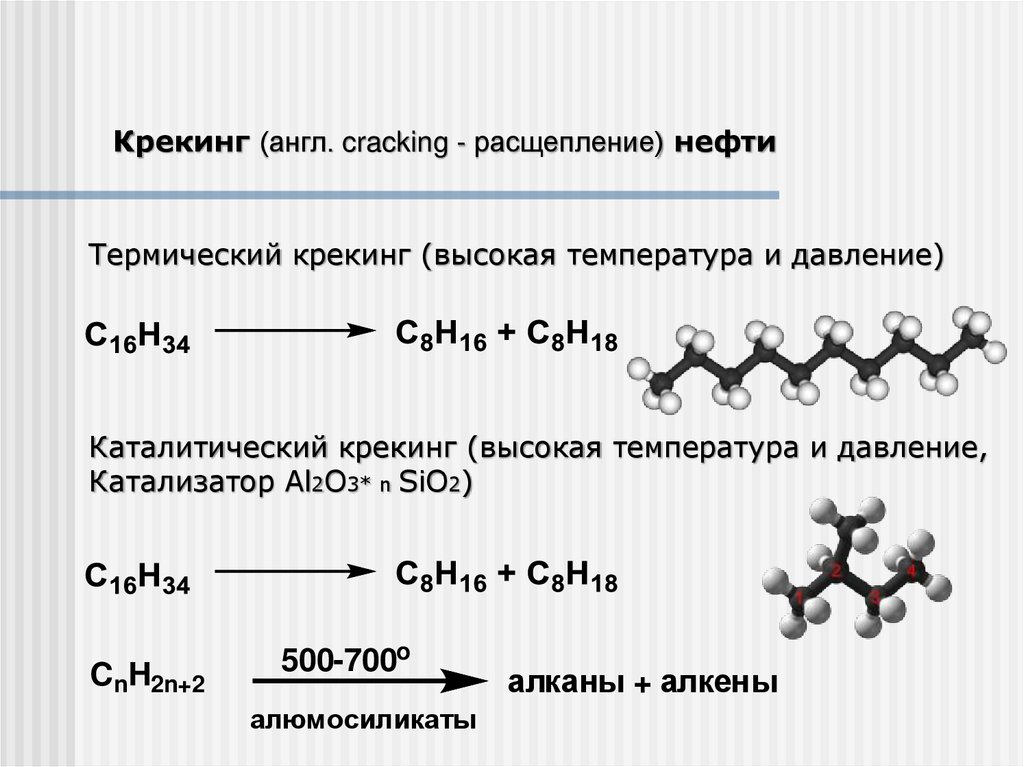
Крекинг (англ. cracking - расщепление) нефтиТермический крекинг (высокая температура и давление)
Каталитический крекинг (высокая температура и давление,
Катализатор Al2O3* n SiO2)
CnH2n+2
500-700o
алюмосиликаты
алканы + алкены
33.
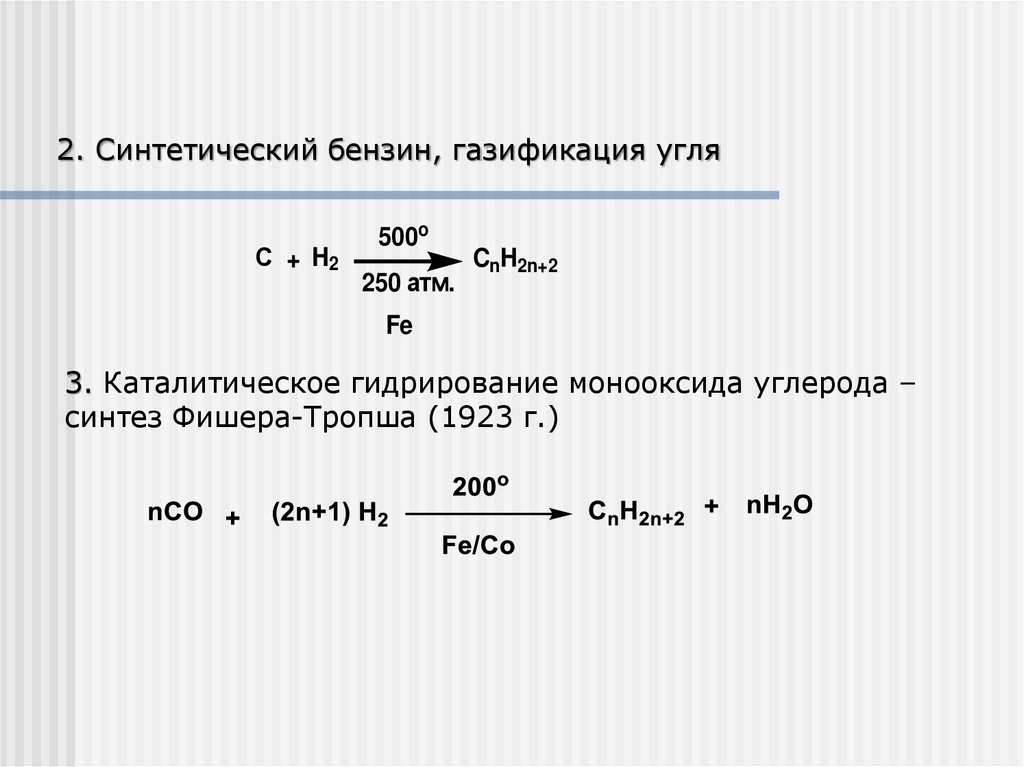
2. Синтетический бензин, газификация угляС + H2
500o
250 атм.
CnH2n+2
Fe
3. Каталитическое гидрирование монооксида углерода –
синтез Фишера-Тропша (1923 г.)
34.
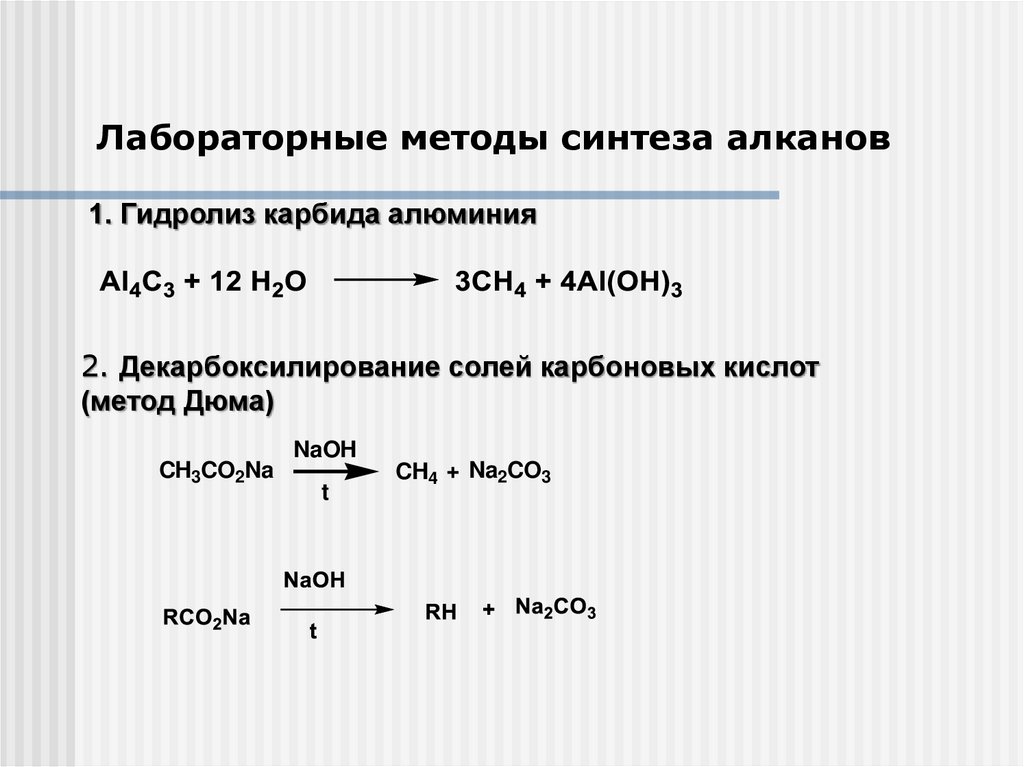
Лабораторные методы синтеза алканов1. Гидролиз карбида алюминия
2. Декарбоксилирование солей карбоновых кислот
(метод Дюма)
CH3CO2Na
NaOH
t
CH4 + Na2CO3
35.
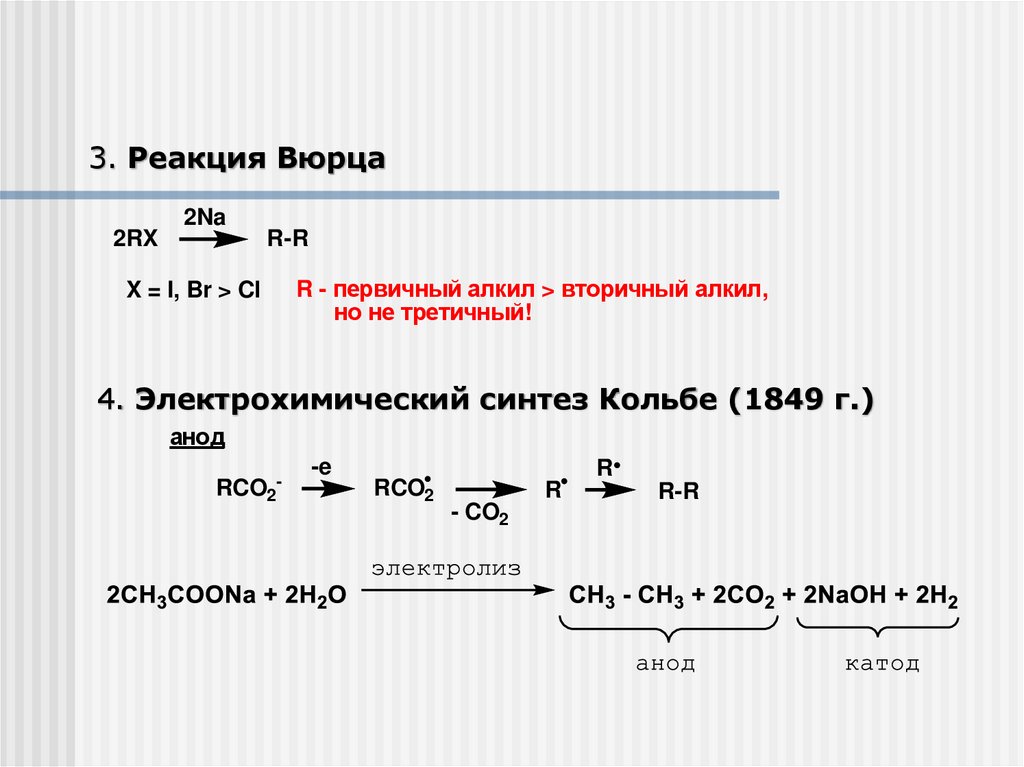
3. Реакция Вюрца2Na
2RX
R-R
X = I, Br > Cl
R - первичный алкил > вторичный алкил,
но не третичный!
4. Электрохимический синтез Кольбе (1849 г.)
анод
RCO2-
-e
RCO2
R
R
- CO2
R-R
36.
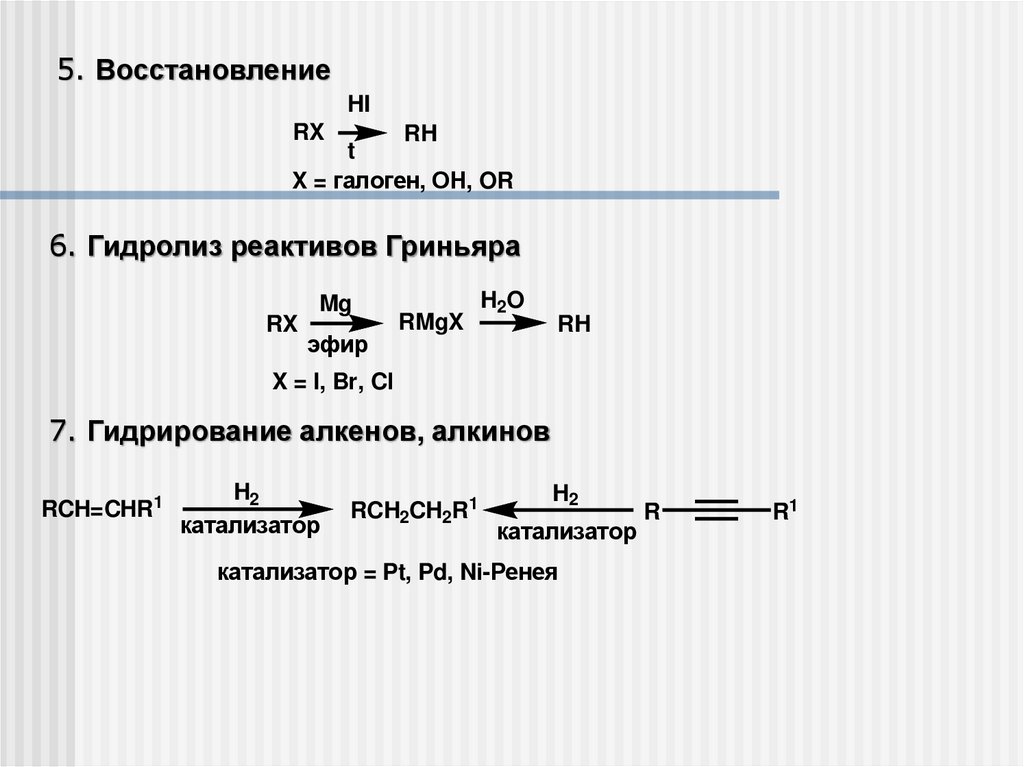
5. ВосстановлениеHI
RX
RH
t
X = галоген, ОН, OR
6. Гидролиз реактивов Гриньяра
RX
Mg
эфир
RMgX
H2O
RH
X = I, Br, Cl
7. Гидрирование алкенов, алкинов
RCH=CHR1
H2
катализатор
RCH2CH2R1
H2
катализатор
катализатор = Pt, Pd, Ni-Ренея
R
R1













 Химия
Химия








