Похожие презентации:
Кинетика параллельных и последовательных реакций. Параллельные реакции (урок 3.1)
1.
Урок 3.1. Кинетика параллельныхи последовательных реакций
Параллельные реакции
В параллельных реакциях вещества
реагируют по нескольким направлениям.
Параллельная реакция, состоящая
из двух мономолекулярных реакций:
A B
k1
k2
A
D
0
C
(
0
)
C
Начальные условия: A
A, веществ B и D в
системе не было
2.
Кинетика для параллельных стадий процессаКинетическое уравнение для вещества A имеет вид:
dС A
k1С A k 2С A k1 k 2 С A
d
Реакция 1-го порядка, причем скорость
есть сумма скоростей по обоим направлениям.
Лимитирующей стадией является наиболее быстрая
реакция.
Решение для А можно записать:
0 k1 k 2
A
СA С e
Кинетическое уравнение для вещества B
dС B
k1С A k1С A0 e k1 k2
d
3.
Решение для В:k1С A0
СB
1 e k1 k2
k1 k 2
Аналогично для компонента D
k 2С
СD
1 e k1 k2
k1 k 2
0
A
С B k1
в любой момент времени, кроме
С D k 2 начального.
4.
0k
c
k1c 0A
c C 2 A 1 e k1 k 2 t
cB
1 e k1 k 2 t
k1 k 2
k1 k 2
k1 k 2
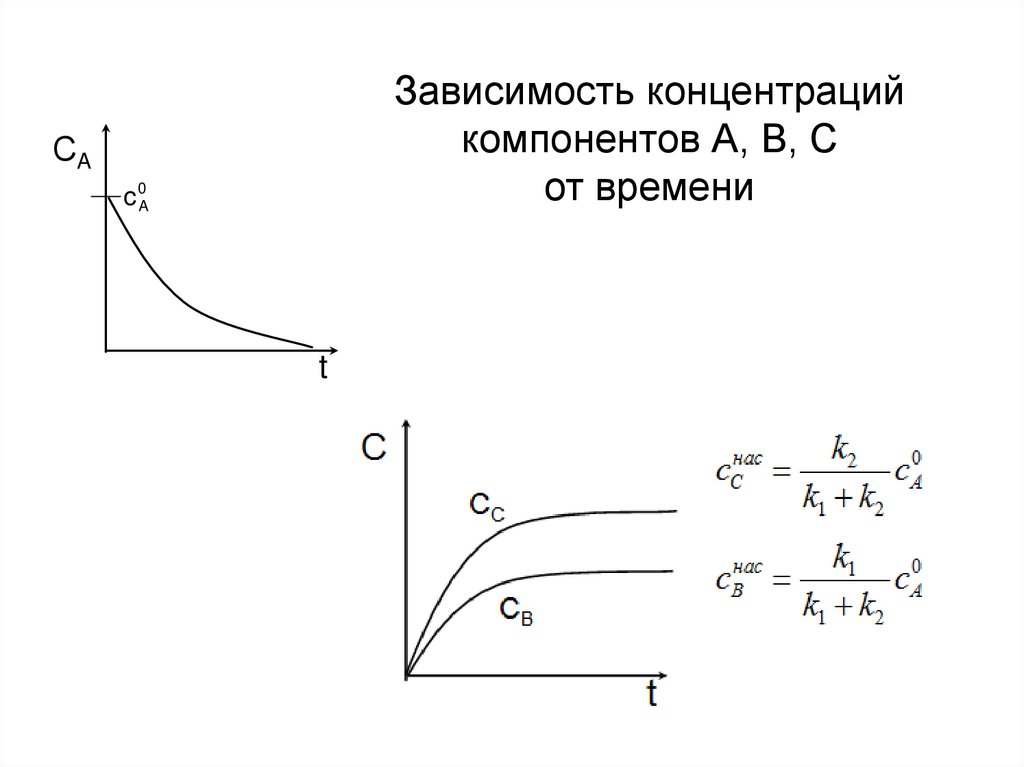
В любой момент,Зависимость
кроме t=0, c B c C концентраций
dc B
k 1c A ;
dt
С k2
Скомпонентов А, В,
нас
СA
от
времени
С
С
c 0A
c
СB
t
cC
t
нас
B
k1 k2
c A0
k1
c A0
k1 k2
5.
Последовательные реакцииВ последовательных реакциях процесс проходит
через ряд последовательных стадий.
Рассмотрим кинетику простейшей реакции
– две последовательные элементарные
реакции первого порядка
A B D
k1
k2
Начальные условия: C A ( 0) C0 веществ B и D в
системе не было
В любой момент времени.
С A C B C D C0
6.
Кинетика для последовательных стадий процессаКинетическое уравнение 1-ой стадии
dС A
k1С A
d
Кинетическое уравнение 2-ой стадии
dС D
k 2 С B k 2 С0 С A С D
d
7.
Решая эти уравнения, получим зависимостиконцентрации для каждого вещества:
С A С0 e
k1
k2
k1
k1
k2
СD С0 1
e
e
k2 k1
k2 k1
k1
k1
k2
С B С0
e e
k 2 k1
8.
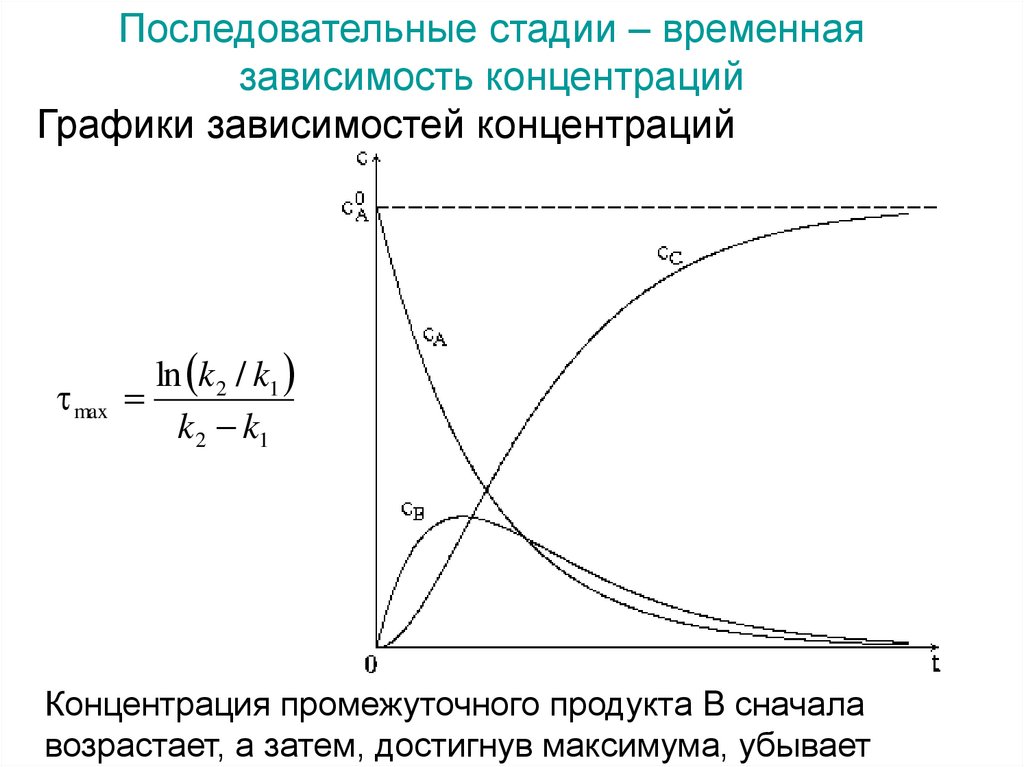
Последовательные стадии – временнаязависимость концентраций
Графики зависимостей концентраций
ln k 2 / k1
max
k 2 k1
Концентрация промежуточного продукта B сначала
возрастает, а затем, достигнув максимума, убывает
9.
Последовательные стадии – предельные случаиРассмотрим два предельных случая:
k 2t
c
c
1
e
1) k1>>k2. В этом случае D
0
Это уравнение реакции 1-го порядка, причем ее скорость
определяется константой
k2. Следовательно, лимитирующей
.
стадией в этом случае будет вторая (более медленная) реакци
.
2) k2>>k1. В этом случае c D c 0 1 e
k1t
Это также уравнение реакции 1-го порядка, но ее скорость
определяется константой k1. Следовательно, лимитирующей
стадией в этом случае будет первая (в этом случае
более медленная) реакция. Таким образом, скорость
последовательной реакции определяется скоростью самого
медленного ее этапа.
.







 Химия
Химия








