Похожие презентации:
Электролит және бейэлектролит ерітінділердің коллигативті қасие
1. Қ.А.Ясауи атындағы Халықаралық қазақ-түрік университеті CӨЖ Тақырыбы: Электролит және бейэлектролит ерітінділердің коллигативті қасие
Қ.А.Ясауи атындағы Халықаралық қазақ-түрік университетіCӨЖ
Тақырыбы: Электролит және бейэлектролит ерітінділердің
коллигативті қасиеттері
Қабылдаған:Айболова Г.
Орындаған:Адас Б.
Тобы:ЖМ-107
Түркістан – 2016 ж
2. Жоспар
1.2.
3.
4.
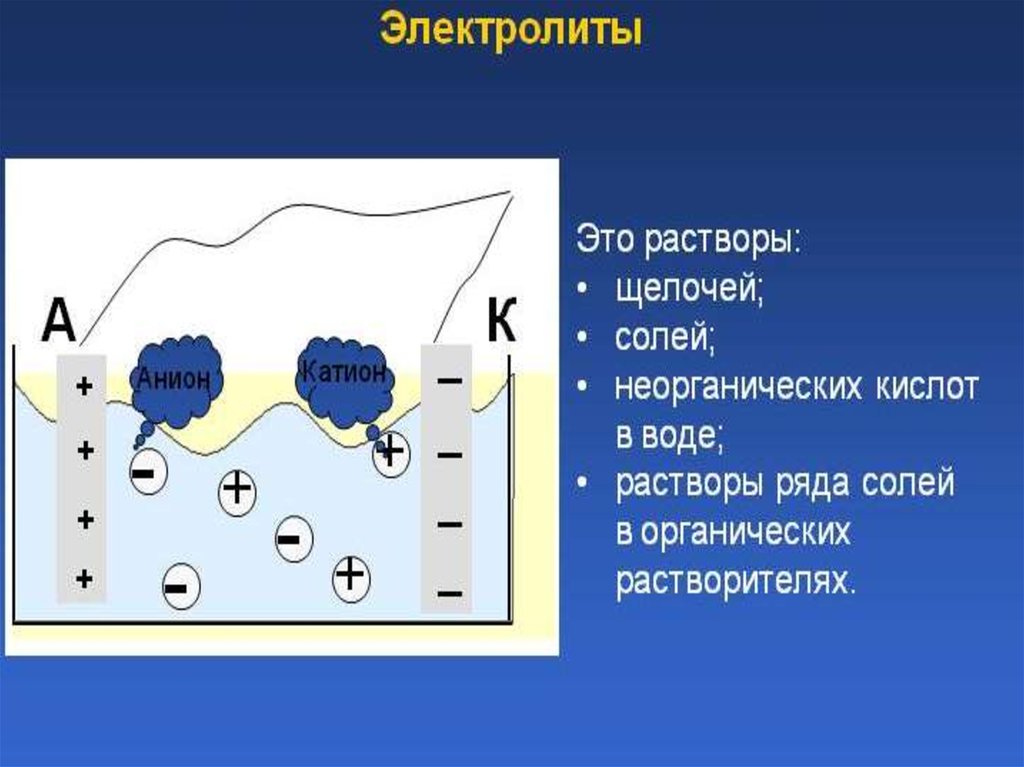
Электролиттер
Бейэлектролиттер
Коллигативті қасиет туралы түсінік
Электролит ерітінділерінің
коллигативтік қасиеті
3.
Электролиттер• ( грек. lysіs – еру, ыдырау) – еріген немесе
балқыған күйде электр тогын өткізетін
заттар.Электролиттерге қышқыл, негіз,
тұздың судағы ерітінділері жатады; бұларда
электр тогы иондар арқылы тасымалданады.
Электролит ерітінділерінен ток өткенде
электродтарда тотығу-тотықсыздану
процестері – электролиз жүзеге асады.
• Электролиз Фарадей заңдарына сәйкес жүреді,
ол таза металдар, хлор, күшті сілтілер алуда
кеңінен қолданылады. Диссоциациялану
дәрежесіне қарай Электролит әлсіз (3%-ға
дейін) және күшті (30%-дан артық) болып екі
негізгі топқа бөлінеді.
4.
• Әлсіз Электролит. диссоциацияланғанерітінділерде иондарға жартылай ыдырайды (қ.
Электролиттік диссоциация). Әлсіз Э-ге көптеген
органик. қышқылдар, негіздер, сондай-ақ кейбір
бейорганик. қышқылдар мен негіздер (мысалы.,
H2S, H2SO3, HCN, NH4OH) жатады.
• Күшті Электролиттик ерітінділерде түгелдей
ионға ыдырайды. Барлық тұздар, көптеген
органик. және бейорганик. қышқылдар мен
негіздер күшті Э-ге (HCl, HBr, HІ, HNO3, H2SO4,
LіOH, NaOH, KOH) жатады. Ғылым мен
техникада Элертролиттердин маңызы зор. Тірі
организмдер денесіндегі барлық сұйықтар
Электролиттер. болып саналады.
5. Бейэлектролиттер
– ерітінділері электр тогын өткізбейтін,ерігенде иондарға ыдырамайтын полюссіз байланысы
бар бейорганикалық және органикалық қосылыстар.
Мыс., оттек, азот, қант, эфир, спирт, глицерин, т.б. Ерітінді
қасиеті құрамындағы жекеленген бөліктердің қасиетінен
өзгеше болады. Ерітіндіні сипаттайтын қасиеттерге:
осмостық қысым, қату және қайнау температуралары, бу
қысымы, т.б. жатады. Бейэлектролиттердің сұйық
ерітінділері мен заттардың газ күйінің арасында ұқсастық
барын алғаш рет голланд ғалымы Я. Вант-Гофф байқаған
(1887). Ол газ күйге арналған теңдеуін ерітінділер үшін де
қолданған. Бейэлектролиттердің қату және қайнау
температураларындағы өзгеріс Рауль заңымен
сипатталады
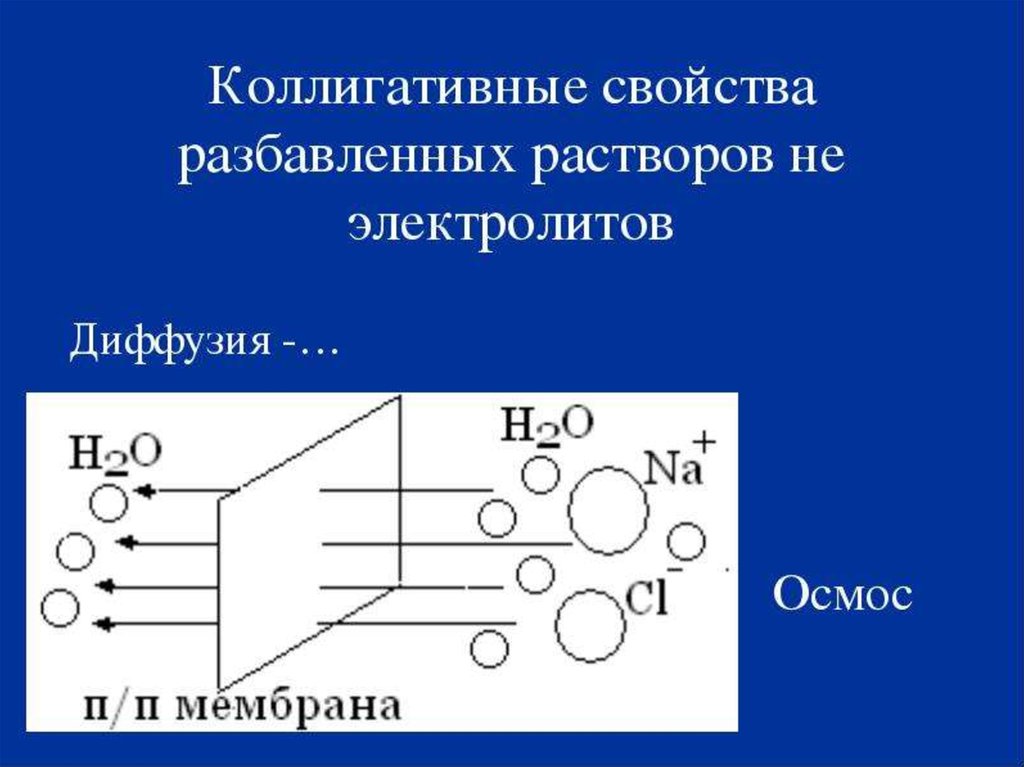
6. Коллигативті қасиет туралы түсінік
• Коллигативті қасиет деп бейэлектролиттіңсұйытылған ерітінділерінің еріген зат
табиғатына тәуелсіз, тек ерітіндідегі оның
бөлшек санына тәуелді қасиеті. Осыған
жататындары: осмос, ерітінді үстіндегі еріткіш
қысымының төмендеуі, таза еріткішке
қарағанда ерітіндінің қайнау
температурасының жоғарылауы және қату
температурасының төмендеуі.
7.
8. Электролит ерітінділерінің коллигативтік қасиеті
• Электролит ерітінділері коллигативтік қасиеттерді сипаттайтыншама мәнінің жоғарылауын береді. Оларға да
бейэлектролиттерді есептеудегі сол формулалар мен заңдар
қолданылады, бірақ изотоникалық коэффициент ескеріледі.
Электролит диссоциациясы бірдей молярлық концентрацияда
ерітіндідегі еріген зат (молекула, ион) бөлшектерінің жалпы
саны бейэлектролит ерітіндісімен салыстырғанда
жоғарылауына әкеледі. Бірдей молярлық концентрацияда
электролит ерітіндісіндегі бөлшек саны бейэлектролит
ерітіндісімен салыстырғанда неше есе артқанын
изотоникалық коэффициент i көрсетеді. Изотоникалық
коэффициент электролиттік диссоциацияға тәуелді:
• i =1- (n-1),
• где - электролиттік диссоциация дәрежесі
n –диссоциация нәтижесінде электролит ыдырағандағы
ион саны
9.
10.
• Электролиттерді есептеу үшінформулалардың математикалық өрнегі:
• Раульдің бірінші заңы:
• Раульдің екінші заңы: Тқайнау = iּЕּb(x),
• Раульдің үшінші заңы: Тқату = iּКּb(x),
• Вант-Гофф заңы: (осмостық қысым): =
iСRT,
11.
12.
• Бейэлектролит және электролитерітінділерінің коллигативтік
қасиетін сипаттайтын заңдардан
ерітіндінің изотоникалық
коэффициентін қатынас ретінде
анықтауға болады:
Т кайнау ( эл)
Т кату ( эл)
( эл)
i
(бейэл) Т кайнау (бейэл) Т кату (бейэл)












 Химия
Химия








