Похожие презентации:
Эпоэтин альфа в лечении анемии у пациентов со злокачественными солидными опухолями
1.
Эпоэтин альфа влечении анемии у
пациентов
со злокачественными
солидными опухолями
в процессе проведения
противоопухолевой
лекарственной терапии
Владимирова Любовь Юрьевна
д.м.н., проф., заведующая отделением
противоопухолевой лекарственной терапии
ФГБУ «НМИЦ онкологии» Минздрава России
2.
Анемия– одно из наиболее часто встречающихся осложнений, у
пациентов с онкологическими заболеваниями. Показатели заболеваемости
варьируются от от 22,7% 1 до 63% 2.
Ухудшает качество жизни пациентов со злокачественными опухолями, вызывает вялость,
утомляемость и другие симптомы. На повышенную утомляемость не менее 1 дня в месяц
жалуется 76 % пациентов, а 24-32 % пациентов испытывают повышенную утомляемость
ежедневно3,4.
Оказывает неблагоприятное влияние на показатели выживаемости. Подтверждена связь
низких показателей гемоглобина и/ или гипоксии опухолевой ткани с ухудшением прогноза и
показателей общей выживаемости при многих типах опухолей3.
По данным метаанализа 60 исследований было показано увеличение риска смерти у
пациентов с анемией при раке легкого, простаты, лимфомах, опухолях головы и шеи3, 5.
Снижает вероятность достижения эффекта лучевой терапии более чем в 2 раза6, а
вероятность достижения эффекта химиотерапии более чем в 1,5 раз7.
Увеличивает общие расходы на лечение онкологических пациентов в 1,6 раза, количество
дней, проведённых в стационаре - более чем в два раза, число лекарственных назначений - на
34%7.
1. E.Kifle,M.Hussein,J.Alemu,and W.Tigeneh,“Prevalence of anemia and associated factors among newly diagnosed patients with solid malignancy at tikur anbessa specialized hospital, radiotherapy center, addis ababa, Ethiopia,”
Advances in hematology, vol. 2019, Article ID 8279789, 8 pages, 2019.
2. K. Neoh, S. Stanworth, S.-R. Pasricha, and M. I. Bennett, “Estimating prevalence of functional iron deficiency anemia in advanced cancer,” Supportive Care in Cancer, vol. 25, no. 4, pp. 1209–1214, 2017
3. Снеговой А. В. и др. Анемии в онкологии: современные возможности поддерживающей терапии. Клиническая онкогематология. Фундаментальные исследования и клиническая практика 2016, т. 9, №. 3, с. 326-335.
4. Cella D. Quality of life and clinical decisions in chemotherapy-induced anemia. Oncology (Williston Park). 2006 Jul:20(8 Suppl 6):25-8.
5. Caro JJ. Salas M. Ward A, et al. Anemia as an independent prognostic factor for survival in patients with cancer: a systemic, quantitative review. Cancer. 2001;91(12):2214-21
6. Brizel DM, Dodge RK. Clough RW, Dewhirst MW. Oxygenation of head and neck cancer. changes during radiotherapy and impact on treatment outcome. Radiother Oncol 1999,53(2) 113-117.
7. Белоусов Ю.5., Омельяновский В.В., Белоусов Д.Ю. Четыре стратегии лечения анемий у онкологических больных в России. Качественная Клиническая Практика. 2008; (2): 71-78
3.
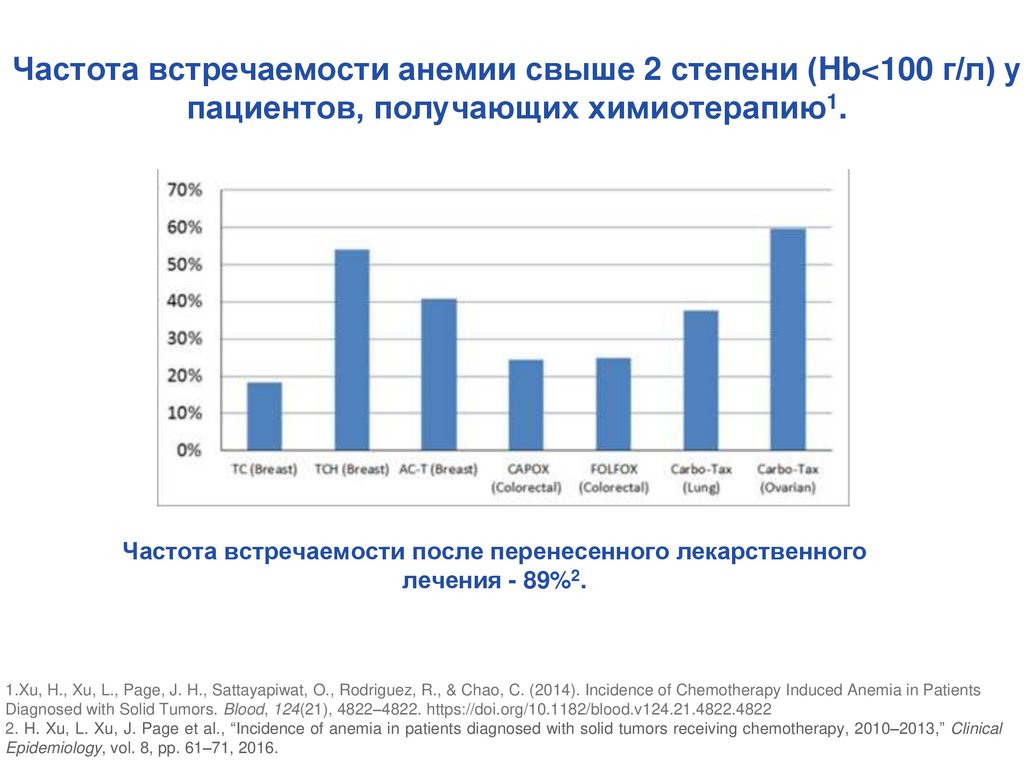
Частота встречаемости анемии свыше 2 степени (Hb<100 г/л) упациентов, получающих химиотерапию1.
Частота встречаемости после перенесенного лекарственного
лечения - 89%2.
1.Xu, H., Xu, L., Page, J. H., Sattayapiwat, O., Rodriguez, R., & Chao, C. (2014). Incidence of Chemotherapy Induced Anemia in Patients
Diagnosed with Solid Tumors. Blood, 124(21), 4822–4822. https://doi.org/10.1182/blood.v124.21.4822.4822
2. H. Xu, L. Xu, J. Page et al., “Incidence of anemia in patients diagnosed with solid tumors receiving chemotherapy, 2010–2013,” Clinical
Epidemiology, vol. 8, pp. 61–71, 2016.
4.
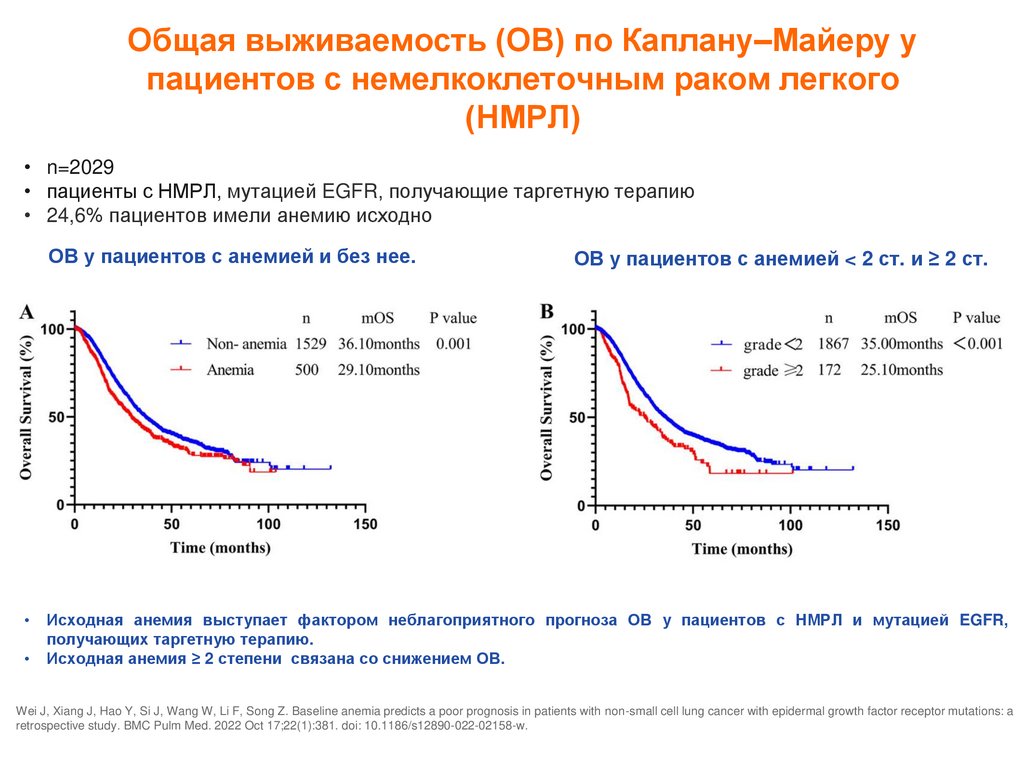
Общая выживаемость (ОВ) по Каплану–Майеру упациентов с немелкоклеточным раком легкого
(НМРЛ)
• n=2029
• пациенты с НМРЛ, мутацией EGFR, получающие таргетную терапию
• 24,6% пациентов имели анемию исходно
ОВ у пациентов с анемией и без нее.
ОВ у пациентов с анемией < 2 ст. и ≥ 2 ст.
Исходная анемия выступает фактором неблагоприятного прогноза ОВ у пациентов с НМРЛ и мутацией EGFR,
получающих таргетную терапию.
Исходная анемия ≥ 2 степени связана со снижением ОВ.
Wei J, Xiang J, Hao Y, Si J, Wang W, Li F, Song Z. Baseline anemia predicts a poor prognosis in patients with non-small cell lung cancer with epidermal growth factor receptor mutations: a
retrospective study. BMC Pulm Med. 2022 Oct 17;22(1):381. doi: 10.1186/s12890-022-02158-w.
5.
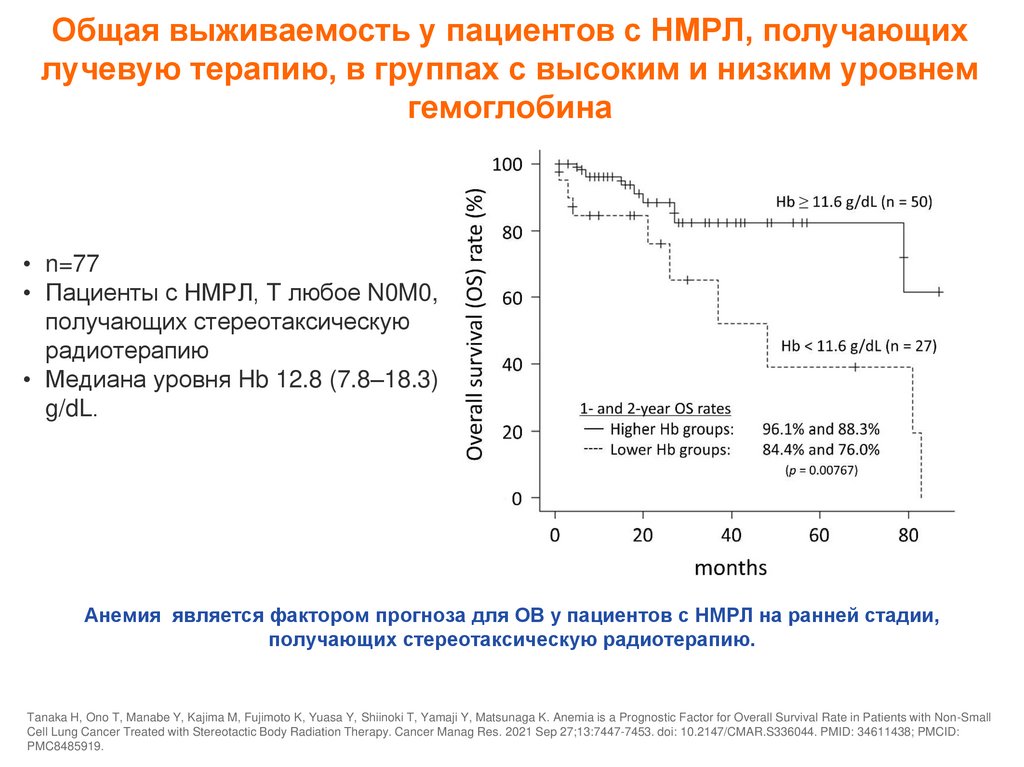
Общая выживаемость у пациентов с НМРЛ, получающихлучевую терапию, в группах с высоким и низким уровнем
гемоглобина
• n=77
• Пациенты с НМРЛ, T любое N0M0,
получающих стереотаксическую
радиотерапию
• Медиана уровня Hb 12.8 (7.8–18.3)
g/dL.
Анемия является фактором прогноза для ОВ у пациентов с НМРЛ на ранней стадии,
получающих стереотаксическую радиотерапию.
Tanaka H, Ono T, Manabe Y, Kajima M, Fujimoto K, Yuasa Y, Shiinoki T, Yamaji Y, Matsunaga K. Anemia is a Prognostic Factor for Overall Survival Rate in Patients with Non-Small
Cell Lung Cancer Treated with Stereotactic Body Radiation Therapy. Cancer Manag Res. 2021 Sep 27;13:7447-7453. doi: 10.2147/CMAR.S336044. PMID: 34611438; PMCID:
PMC8485919.
6.
Цель исследованияДать клиническую оценку эффективности и безопасности
применения Эральфона для лечения анемии у пациентов
со злокачественными солидными опухолями в процессе
проведения противоопухолевой лекарственной терапии.
7.
Материалы и методыИсследование проводилось с 2018 по 2021 гг.
184 пациента
Критерии включения пациентов в
исследование:
Наличие солидных опухолей (гистологически
подтвержденных);
Необходимость лекарственного лечения;
Hb ≤ 100 г/л.
8.
Методы исследованияОценивался исходный уровень Hb.
Уровень Нb оценивался еженедельно, лечение проводилось в течение 8 недель
При ⇧ Hb до 120 г/л и более лечение ЭПО приостанавливалось
При ⇩ Hb < 120 г/л лечение возобновлялось в той же дозе.
Всем пациентам назначались пероральные или парентеральные препараты
железа.
Лечение Эральфоном прекращали через 8 недель, в случае отсутствия эффекта
(повышение Hb менее чем на 10 г/л при исходном уровне Hb ≤ 100 г/л).
Пациенты получали лечение препаратом Эральфон в одной из
дозировок:
- 12 000 МЕ 3 раза в неделю п/к
- 40 000 МЕ 1 раз в неделю п/к
Медиана времени терапии Эральфоном составила 5,8 нед. (1–8
нед.).
Перед каждым курсом противоопухолевой лекарственной терапии
нежелательные явления (НЯ), которые могли быть ассоциированы
с применением ЭПО (согласно критериям CTCAE 4.0).
9.
Методы исследованияПациенты были стратифицированы:
- по исходной степени выраженности анемии;
- по этапам лечения ЗНО (неоадъювантная, адъювантная терапия,
лечение метастатического процесса);
- по наличию или отсутствию метастатического поражения костей;
- по наличию кровотечений в анамнезе;
- по предшествующему химиотерапевтическому анамнезу и
лучевой терапии;
- по режиму применения Эральфона.
В каждой из выделенных категорий пациентов оценивали:
частоту достижения целевого эффекта от лечения (повышение Hb
на 20 г/л от исходного уровня в течение 8 недель от начала
терапии)
частоту полного эффекта (повышение Hb до 120 г/л и выше)
медиану времени до достижения максимального
антианемического эффекта.
10.
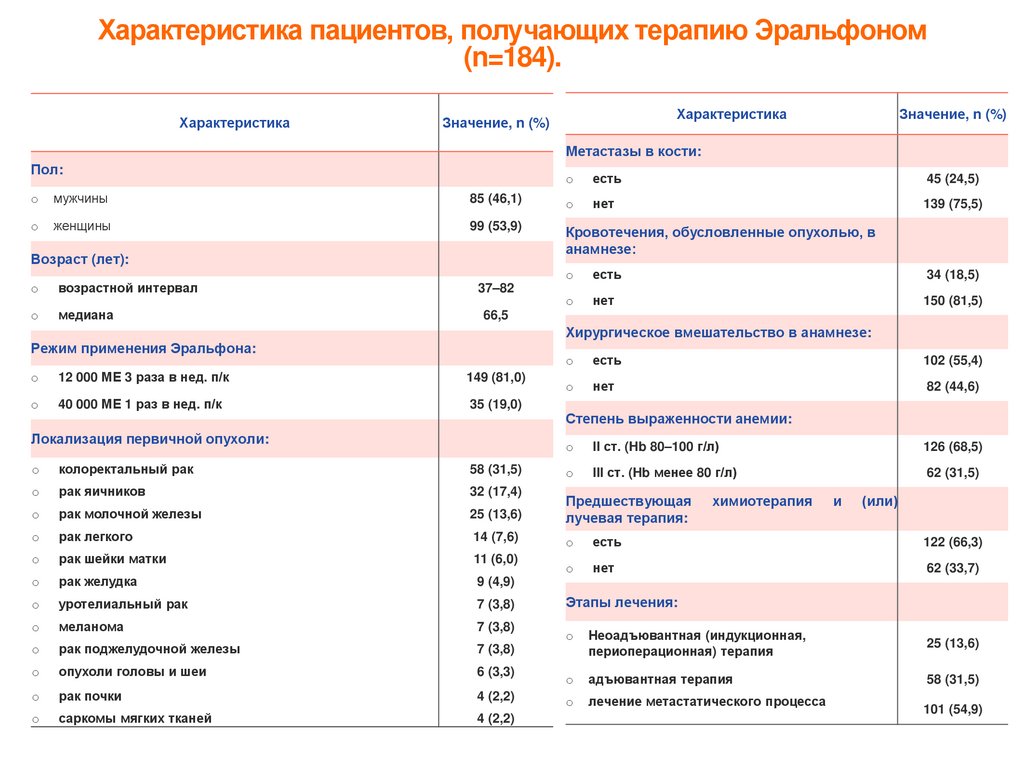
Характеристика пациентов, получающих терапию Эральфоном(n=184).
Характеристика
Характеристика
Значение, n (%)
Значение, n (%)
Метастазы в кости:
Пол:
o
есть
45 (24,5)
нет
139 (75,5)
o
мужчины
85 (46,1)
o
o
женщины
99 (53,9)
Кровотечения, обусловленные опухолью, в
анамнезе:
Возраст (лет):
o
o
возрастной интервал
медиана
37–82
o
есть
34 (18,5)
o
нет
150 (81,5)
66,5
Хирургическое вмешательство в анамнезе:
Режим применения Эральфона:
o
12 000 МЕ 3 раза в нед. п/к
149 (81,0)
o
40 000 МЕ 1 раз в нед. п/к
35 (19,0)
Локализация первичной опухоли:
o
есть
102 (55,4)
o
нет
82 (44,6)
Степень выраженности анемии:
o
II ст. (Hb 80–100 г/л)
126 (68,5)
III ст. (Hb менее 80 г/л)
62 (31,5)
o
колоректальный рак
58 (31,5)
o
o
рак яичников
32 (17,4)
o
рак молочной железы
25 (13,6)
Предшествующая
лучевая терапия:
o
рак легкого
14 (7,6)
o
есть
122 (66,3)
o
рак шейки матки
11 (6,0)
рак желудка
o
нет
62 (33,7)
o
9 (4,9)
o
уротелиальный рак
7 (3,8)
o
меланома
7 (3,8)
o
рак поджелудочной железы
7 (3,8)
o
опухоли головы и шеи
o
o
химиотерапия
и
(или)
Этапы лечения:
o
Неоадъювантная (индукционная,
периоперационная) терапия
25 (13,6)
6 (3,3)
o
адъювантная терапия
58 (31,5)
рак почки
4 (2,2)
o
лечение метастатического процесса
саркомы мягких тканей
4 (2,2)
101 (54,9)






 Медицина
Медицина








