Похожие презентации:
Химическая связь. Лекция №3
1.
Все взаимодействия, приводящие к объединению химическихчастиц (атомов, молекул, ионов и т. п.) в вещества делятся на
химические связи и межмолекулярные взаимодействия.
Химическая связь
Химическая связь – это
совокупность сил, удерживающих
вместе два или несколько атомов
или ионов.
2.
3.
Атомы не могут связываться друг с другом произвольно. Каждый атомспособен связываться с конкретным количеством других атомов,
причем связанные атомы располагаются в пространстве строго
определенным образом.
Причину этих ограничений следует искать в свойствах электронных
оболочек атомов, а точнее - в свойствах внешних электронных
оболочек, которыми атомы взаимодействуют друг с другом.
4.
Завершенная внешняя электронная оболочкаобладает меньшей (т.е. более выгодной для атома)
энергией, чем незавершенная. По правилу октета
завершенная оболочка содержит 8 электронов:
ns2np6
Таковы внешние электронные оболочки атомов
благородных газов, за исключением гелия (n = 1), у
которого завершенная оболочка состоит из двух sэлектронов (1s2) просто потому, что p-подуровня на
1-м уровне нет.
Внешние оболочки всех элементов, кроме
благородных газов, являются незавершенными
и в процессе химического взаимодействия они
завершаются.
5.
Классическаятеория
химической
связи,
была
предложена Косселем (ионная связь) и Льюисом
(ковалентная связь) на рубеже 19-20 столетий. Обе теории
исходили именно из положения об особой стабильности 2-х
и 8-электронных оболочек.
6.
7.
Для квантово-механического описания образования ковалентной связииспользуют два подхода – метод валентных связей (МВС) и метод
молекулярных орбиталей (ММО). Мы будем пользоваться только первым
подходом (МВС). Рассмотрим его основные положения
Ковалентная связь
Основные положения метода валентных связей (МВС)
1. В образовании связи участвуют электроны только внешней электронной
оболочки;
2. Химическая связь образуется двумя валентными электронами с
антипараллельными спинами. При этом электронные орбитали
перекрываются, и между атомами появляется область с повышенной
электронной плотностью.
8.
• 3. Химическая связь осуществляется втом направлении, в котором обеспечивается
наибольшее
перекрывание
атомных
орбиталей.
• 4. Из нескольких связей данного атома наиболее прочной
будет связь, которая получилась в результате наибольшего
перекрывания атомных орбиталей.
• 5. На схемах и в структурных формулах каждая
ковалентная связь между атомами обозначается чертой —.
Например, структурная формула молекулы водорода будет
иметь вид H—H.
9.
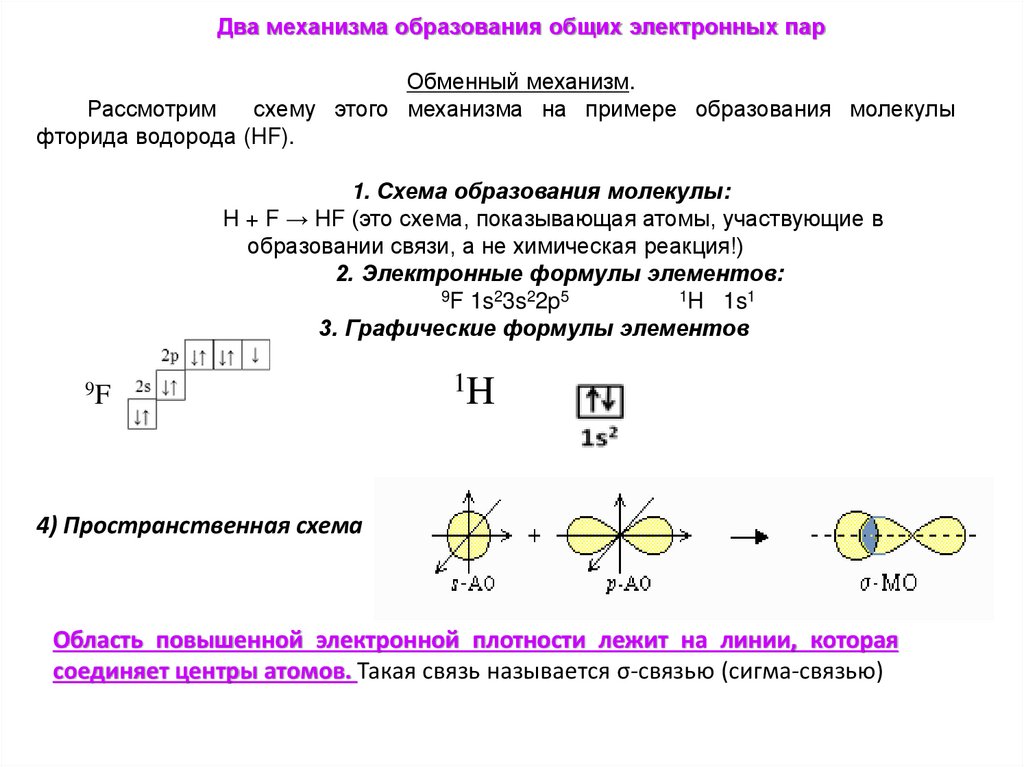
Два механизма образования общих электронных парОбменный механизм.
Рассмотрим
схему этого механизма на примере образования молекулы
фторида водорода (HF).
1. Схема образования молекулы:
H + F → HF (это схема, показывающая атомы, участвующие в
образовании связи, а не химическая реакция!)
2. Электронные формулы элементов:
9F 1s23s22p5
1H 1s1
3. Графические формулы элементов
9F
1H
4) Пространственная схема
Область повышенной электронной плотности лежит на линии, которая
соединяет центры атомов. Такая связь называется σ-связью (сигма-связью)
10.
В образовании σ-связи могут принимать участие следующие типыорбиталей: s-s (как при образовании атома водорода), s-p (схема
образования молекулы HF), p-p, p-d, d-d и др
11.
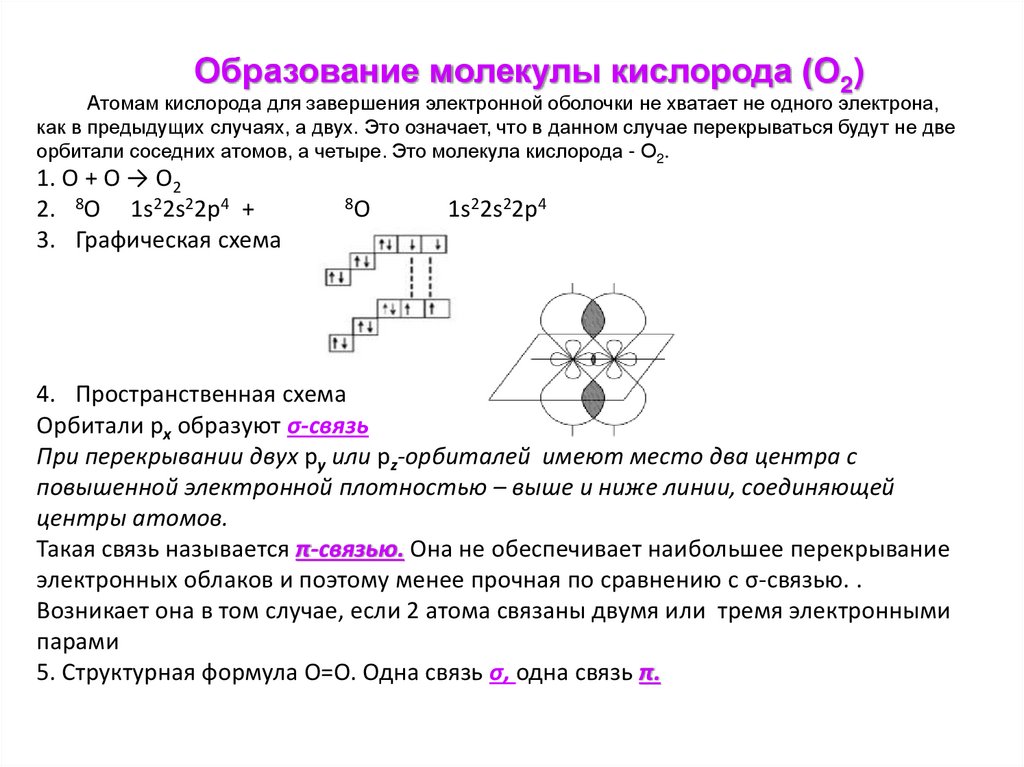
Образование молекулы кислорода (О2)Атомам кислорода для завершения электронной оболочки не хватает не одного электрона,
как в предыдущих случаях, а двух. Это означает, что в данном случае перекрываться будут не две
орбитали соседних атомов, а четыре. Это молекула кислорода - О2.
1. О + О → О2
2. 8O 1s22s22p4 +
3. Графическая схема
8O
1s22s22p4
4. Пространственная схема
Орбитали рх образуют σ-связь
При перекрывании двух ру или pz-орбиталей имеют место два центра с
повышенной электронной плотностью – выше и ниже линии, соединяющей
центры атомов.
Такая связь называется π-связью. Она не обеспечивает наибольшее перекрывание
электронных облаков и поэтому менее прочная по сравнению с σ-связью. .
Возникает она в том случае, если 2 атома связаны двумя или тремя электронными
парами
5. Структурная формула О=О. Одна связь σ, одна связь π.
12.
.Число общих электронных пар между связанными атомами
характеризует кратность связи.
Структурная формула молекулы кислорода запишется как О=О. Одна
из этих связей –σ, другая π. Любая двойная связь состоит из одной
σ-связи и одной π-связи. σ-связь более прочная по сравнению с πсвязью, так как область перекрывания электронных облаков в этом
случае меньше. π-связь образуют следующие наборы орбиталей: p-p,
p-d, d-d
13.
Если связь между двумя атомами образована тремя общимиэлектронными парами, то такая связь называется тройной связью. Любая
тройная связь состоит из одной σ-связи и двух π-связей. Образование
тройной связи можно проследить на примере молекулы азота
7N + 7N → N
2
2. Электронная формула 1S22s22p3
3. Графическая формула
5. Пространственная схема
6. Структурная формула
В молекуле азота 1 σ-связь и две π-связи
14.
Валентность элементов в ковалентныхсоединениях
В образовании ковалентных связей участвуют неспаренные электроны.
Валентность элемента – это число химических связей, которые образует
атом этого элемента в химических соединениях.
Поскольку одна химическая связь образуется парой неспаренных электронов
различных атомов, то валентность элемента определяется числом неспаренных
электронов в его атоме
Число неспаренных электронов многих элементов увеличивается при
переходе атома из основного состояние в возбужденное состояние.
Пример
Атом хлора
15.
Пространственная конфигурация молекул по моделигибридизации валентных орбиталей.
Для определения пространственной формы молекул
наиболее широко используется модель гибридизации
валентных орбиталей. Идею о гибридизации атомных
орбиталей выдвинул американский ученый Лайнус Полинг
(1901-1994).
Согласно квантово-механическим расчетам, σ- и π-связи
должны отличаться по энергии. Опыт опровергает квантовомеханические расчеты. Все связи оказываются равноценными
(и по энергии, и по длине). Для объяснения этого введено
представление о гибридизации валентных орбиталей, которое
позволяет предсказывать пространственную конфигурацию
молекулы
16.
Гибридизация - это смешивание и выравнивание по форме и по энергииорбиталей одного и того же атома, участвующих в образовании связей.
В результате гибридизации первоначальная форма облаков изменяется, и
образуются два облака, имеющие форму ассиметричной гантели. электронная
плотность в гибридной орбитали сконцентрирована по одну сторону в
большей степени, чем по другую. Благодаря такому неравномерному
распределению электронной плотности вокруг ядра, гибридное облако
способно к более глубокому перекрыванию, чем обычное, и дает
энергетически более выгодную связь.
17.
sp-гибридизацияГибридизуется одна s- и одна р-орбиталь, образуются две
гибридные орбитали, которые располагаются на одной
прямой под углом 180°. Молекула общего вида АХ2 имеет
линейную структуру. Примеры соединений: ВеН2, ВеС12,СО2,
CS2. Типы гибридизации
18.
Гибридизуются одна s- и две р-орбитали, образуются три гибридные орбитали, которыерасполагаются в одной плоскости под углом 120°. Молекула общего вида АХ3 имеет треугольную, плоскую
структуру.
Примеры соединений: ВCl3, ВН3, SO3. sр2-гибридизация характерна также для орбиталей углерода в
молекуле этилена.Строение молекулы BCl3.
1. Электронная формула:
5B 1s22s22p1
17Cl
1s22s22p63s23p5
2. Переход атома бора в возбужденное состояние:
3. Пространственная схема В образовании связи участвуют одна s- и две р-орбитали, что приводит к
образованию трех гибридных орбиталей, расположенных под углом 120о. У каждого атома хлора по неспаренному
электрону.
19.
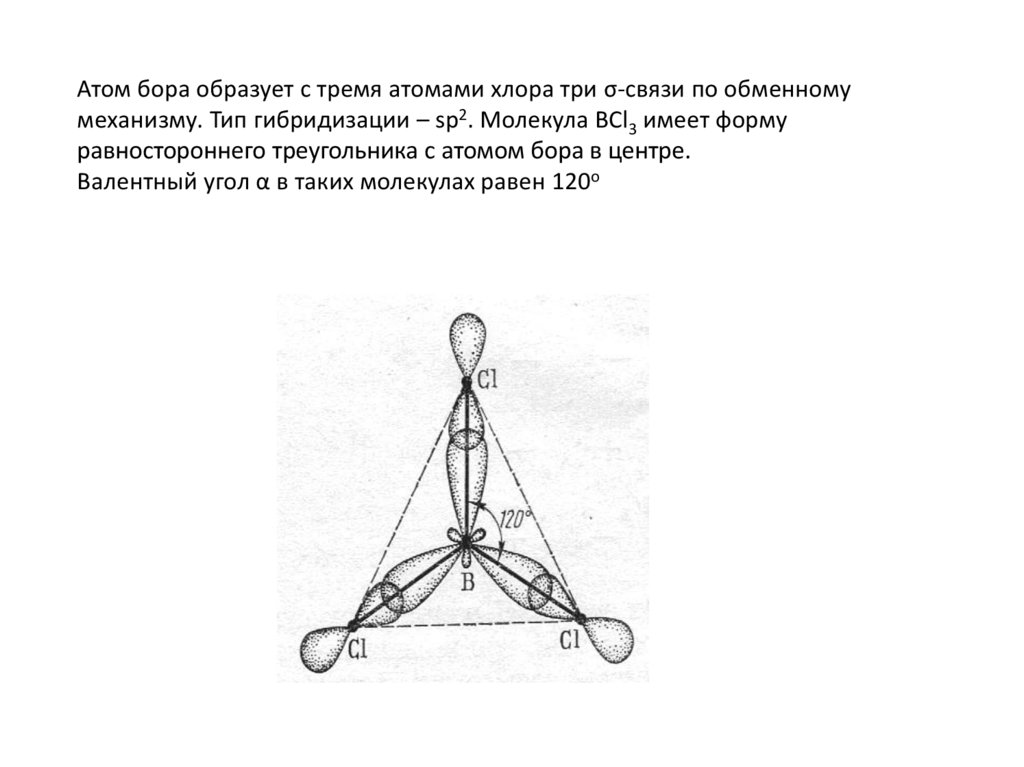
Атом бора образует с тремя атомами хлора три σ-связи по обменномумеханизму. Тип гибридизации – sp2. Молекула BCl3 имеет форму
равностороннего треугольника с атомом бора в центре.
Валентный угол α в таких молекулах равен 120о
20.
sp3- гибридизацияГибридизуются одна s и три р-орбитали. Четыре гибридных облака направлены к
вершинам тетраэдра и располагаются в пространстве под углом 109028′.
Молекула общего вида АВ4 имеет форму тетраэдра.
Строение молекулы метана. Электронная формула
6С
1H
1s22s22p2
1s1
2. Схема перехода атома углерода в возбужденное состояние:
3. Гибридизация s- и трех р-орбиталей атома углерода.
4.Образование σ- связей между четырьмя
гибридными орбиталями атома углерода и
s-орбиталями четырех атомов водорода.
21.
Атом углерода образует четыре одинарныесвязи с атомами водорода, все эти связи – σ-связи
Все орбитали валентных электронов
углерода гибридизуются. Четыре sp3 гибридные
орбитали углерода располагаются вокруг ядра под
углом 109о28′
Орбитали водорода перекрываются с sp3гибридными орбиталями углерода. Образуется
прочная молекула метана с четырьмя связями.
22.
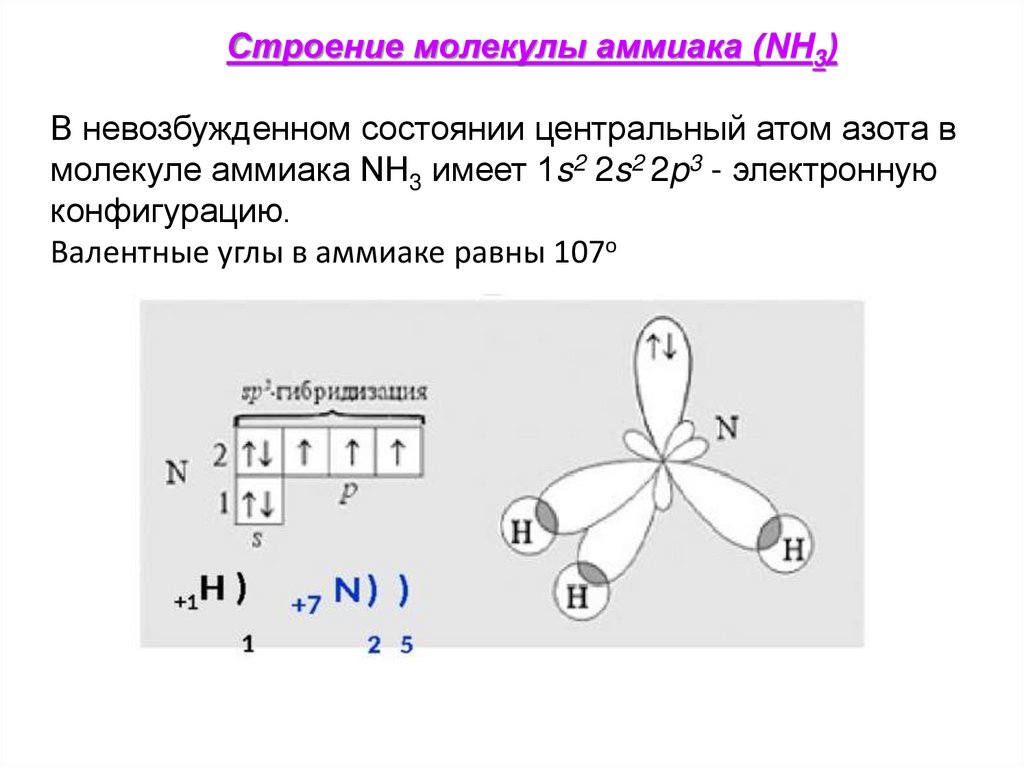
Строение молекулы аммиака (NH3)В невозбужденном состоянии центральный атом азота в
молекуле аммиака NH3 имеет 1s2 2s2 2p3 - электронную
конфигурацию.
Валентные углы в аммиаке равны 107о
23.
24.
2. Донорно-акцепторный механизм образования ковалентной связи:В этом случае образование ковалентной связи происходит за
счет пары электронов, не участвовавшей ранее в образовании связи
(неподеленной электронной пары) и вакантной орбитали другого атома.
Рассмотрим механизм образования иона NH4+
1) NH3 + H+ → NH4+
2) 7N 1s22s22p3 1H+
1s0
3) Графическая схема:
Молекула NH3 образуется по обменному механизму, а при сближении ее с
ионом водорода неподеленная электронная пара азота занимает
вакантную орбиталь атома водорода, что приводит к образованию общей
электронной пары и, следовательно, к образованию ковалентной связи.
Атом, предоставляющий электроны в общее пользование, называется
донором (в данном случае это азот), а атом, имеющий вакантную
орбиталь – акцептором (водород).
25.
26.
Количественные характеристики химической связи.1.Энергия связи –минимальная энергия,
небходимая для разрыва связи
2. Длина связи –расстояние между атомами (l)
3. Валентные углы
4. Электpоoтрицательность (χ) - способность атома
удерживать внешние (валентные) электроны. Она
определяется степенью притяжения этих электронов к
положительно заряженному ядру.
Это свойство проявляется в химических связях как
смещение электронов связи в сторону более
электроотрицательного атома.
Электроотрицательность элементов растет
слева направо вдоль периода и снизу вверх в группах
Периодической системы Д.И. Менделеева ( смотрите
таблицу в методичке).
27.
28.
Полярность связей и молекул.Молекула состоит из атомов разных элементов (НС1, СО и т. д.). В этом
случае электроны смещены к атому с большей электроотрицательностью и
центры тяжести положительных и отрицательных зарядов не совпадают,
образуется электрический диполь
Электрический диполь - система из двух равных по величине и
противоположных по знаку зарядов q, находящихся на расстоянии l,
называемом длиной диполя. Длина диполя - векторная величина. Ее
направление условно принято от отрицательного заряда к положительному.
Такие молекулы называют полярными молекулами или диполями.
Мерой полярности служит произведение q*l,
называемое электрическим моментом диполя
μ= q·l.
Единицей измерения μ служит Дебай (Д). 1 Д = 3,3 · 10 -30 Кл·м.
В молекулах, состоящих из двух одинаковых атомов μ = 0. Эти молекулы
называют неполярными.
29.
Межмолекулярные взаимодействияСилы Ван-дер-Ваальса
Если бы взаимодействие между молекулами отсутствовало, то все
вещества находились бы в состоянии идеального газа.
Уравнение состояния для идеального газа описывается уравнением
Менделеева-Клапейрона
PV = νRT, где ν-число молей газа.
Силы межмолекулярного взаимодействия были названы именем голландского
физика Ван-дер-Ваальса, который внес большой вклад в изучение процессов
конденсации газов. Уравнение Ван-дер-Ваальса имеет следующий вид:
30.
Типы межмолекулярного взаимодействияОриентационное взаимодействие.
Оно проявляется, если вещество состоит из полярных молекул -- диполей
(диполь-дипольное взаимодействие).
Eор= −2 μ1μ2/4π ε0r3
μ1 и μ2 - дипольные моменты взаимодействующих диполей, r- расстояние
между ними.
31.
Взаимодействие диполь - индуцированный диполь(индукционное взаимодействие).
Присутствие полярной молекулы вблизи другой,
которая может быть полярной или неполярной, оказывает
на вторую молекулу поляризующее действие и вызывает
появление в ней индуцированного дипольного момента.
Индуцированный дипольный момент имеет то же
направление, что и постоянный. Взаимодействие
постоянного диполя одной молекулы с наведенным
диполем второй понижает энергию системы на величину,
называемую энергией индукционного взаимодействия
Еинд.
Eинд= −2 μ2α/r6,
где μ- момент наведенного диполя.
32.
Дисперсионное взаимодействие.Этот вид взаимодействия имеет место между неполярными
молекулами. В чистом виде дисперсионноевзаимодействие проявляется у
благородных газов, которые при понижении температуры сжижаются. В
неполярных молекулах распределение электронной плотности симметрично и
дипольный момент отсутствует, электронные облака постоянно колеблются
относительно ядер, образуя временные или мгновенные диполи. Мгновенный
диполь одной молекулы А поляризует другую молекулу В и вызывает
появление в ней индуцированного диполя. Обе молекулы будут иметь
дипольные моменты, направленные в одну сторону, и притягиваться друг к
другу. В следующий момент диполь в молекуле А может быть направлен в
противоположную сторону. И снова наведенный в молекуле В диполь станет
таким, что между молекулами возникнет притяжение. Дипольные моменты
возникают лишь на мгновение, но число молекул велико (6,02 *1023/моль) и
суммарный эффект их взаимодействия — это постоянно действующие силы
притяжения. В результате дисперсионного взаимодействия энергия системы
понижается.
Eдисп= −2 μмгн2α2/r6,
где μ - момент мгновенного диполя. Силы притяжения между неполярными
частицами (атомами, молекулами) являются весьма короткодействующими.
33.
Водородная связьПомимо
универсального
ван-дер-ваальсова
взаимодействия между молекулами может возникать
водородная связь.
Водородная связь возникает между молекулами, в
которых атом водорода связан с атомом элемента,
обладающего высокой электроотрицательностью.
34.
35.
36.
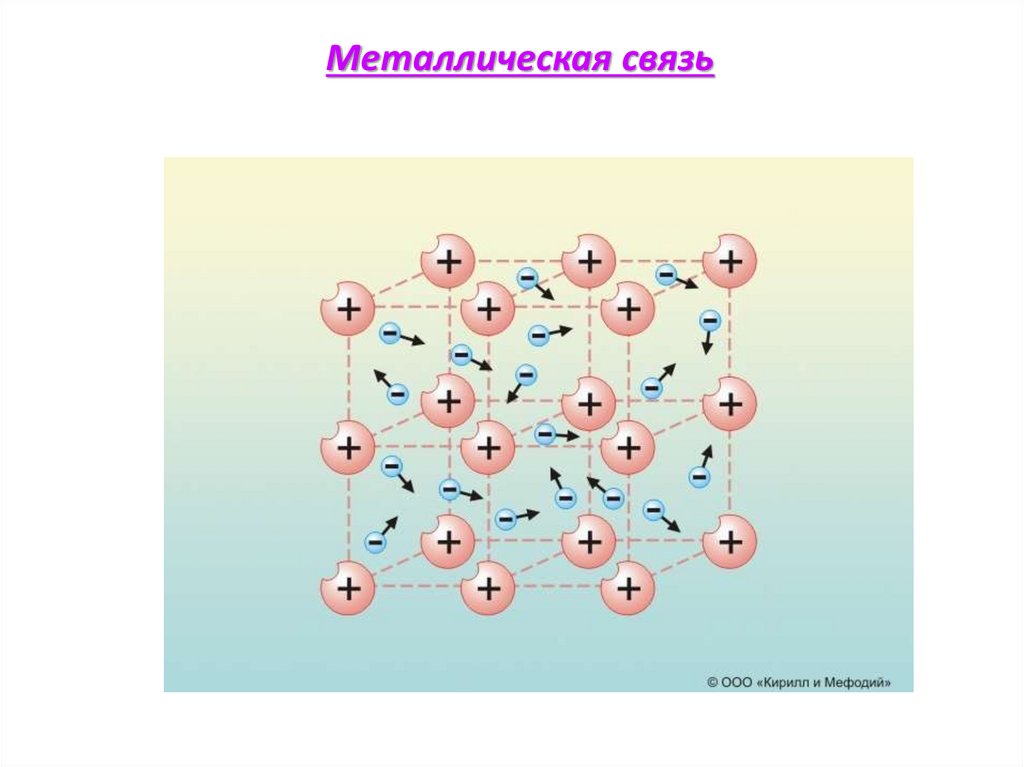
Металлическая связь37.
1. Химическая связь – это совокупность сил, удерживающих вместе два илинесколько атомов или ионов.
2. Характер химической связи зависит от электронной структуры
взаимодействующих частиц
3. На расстоянии, называемом длиной связи, потенциальная энергия
системы минимальна и молекула обладает максимальной устойчивостью.
4. Если взаимодействующие атомы одинаковы, область перекрывания
электронных облаков находится на одинаковом расстоянии от ядер атомов. Такая
связь называется ковалентной неполярной. Электрический момент диполя равен
нулю.
5. При взаимодействии атомов разных элементов область перекрывания
электронных облаков смещена по направлению к атому, электроотрицательность
которого выше. В этом случае связь называется ковалентной полярной. Чем
больше полярность связи, тем выше электрический момент диполя
6. В предельном случае, когда разность электроотрицательностей очень
высока, валентный электрон полностью переходит от одного атома к другому,
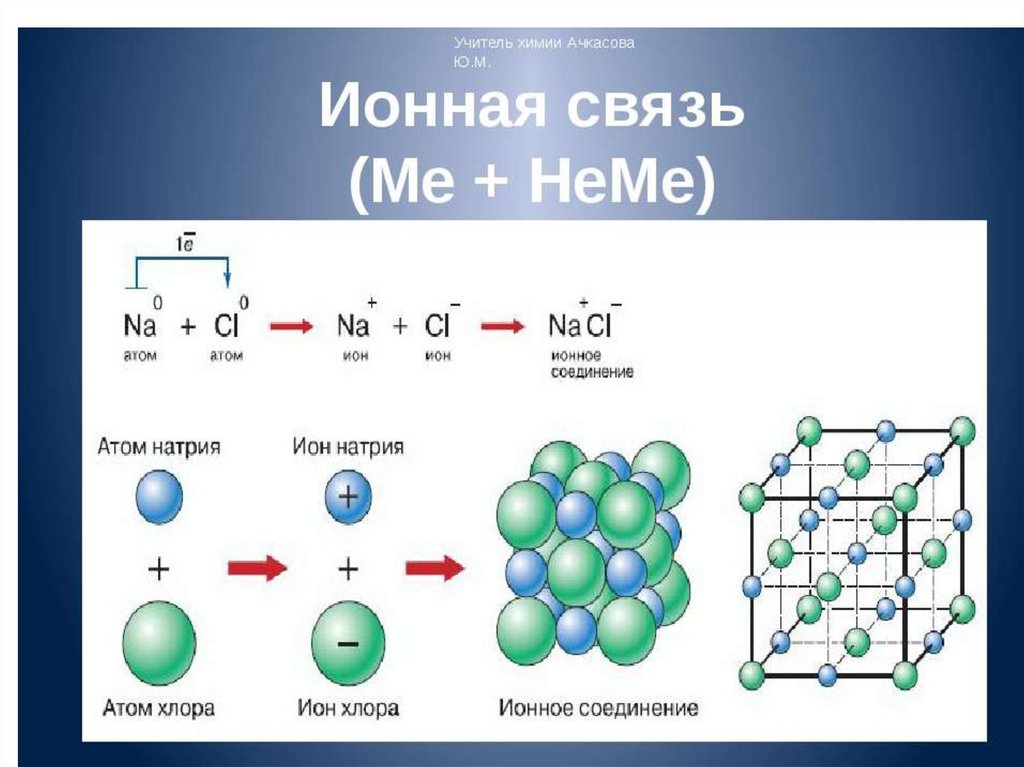
образуя ионы. Ионы взаимодействуют электростатически. Такая связь называется
ионной.
7. Металлическая связь осуществляется за счет общих электронов, свободно
перемещающихся по кристаллу и связывающих между собой положительные
ионы в кристаллах металлов.
8. Межмолекулярные взаимодействия ‣Межмолекулярные взаимодействия
— взаимодействия между молекулами и/или атомами, не приводящие к
образованию ковалентных (химических) связей.
Межмолекулярные взаимодействия имеют электростатическую природу.































 Химия
Химия








