Похожие презентации:
Диаграммы «давление–состав» и «температура–состав» для равновесия «жидкость–пар» в бинарных системах
1.
Диаграммы «давление–состав» и«температура–состав» для
равновесия «жидкость–пар» в
бинарных системах
2.
Можно построить 2 диаграммы, обычноприменяют 2 типа диаграмм:
Изобарическая диаграмма, p= const
T f N
ж
2
; T f N
nap
2
Изотермическая диаграмма, Т=const
p f(N )
T const
p f(N )
ж
2
nap
2
2
3.
Согласно закону Дальтона общее давление пара надидеальным раствором
p pk
pk f p, N
nap
k
Во всем интервале концентраций будет действовать
закон Рауля
3
4.
Для бинарного раствора можно записатьp2 p N
p2 p N
o
2
nap
2
pN
N
nap
2
ж
2
p N
о
2
ж
2
ж
2
p
nap
о N2
p2
4
5.
p p1 p2 p 1 No
1
ж
2
p
о
2
N
ж
2
p p1о p2о p1о N 2ж
p
nap
о
о
p p o N 2 p2 p1
p2
o
1
5
6.
p p p p pNo
2
o
1
p p p N
o
2
o
2
nap
2
p
о
2
nap
2
p
p
о
1
о
2
p
о
1
p
о
1
p
о
2
p p
p o
p2 N p p1о
o
1
nap
2
o
2
о
2
6
7.
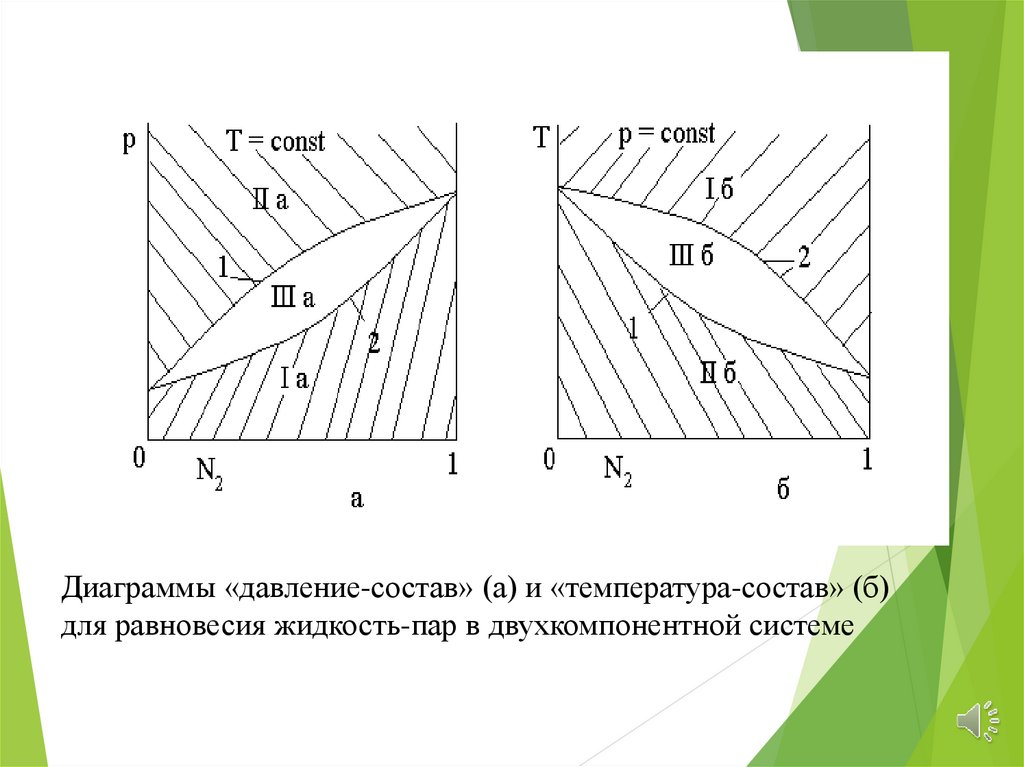
Диаграммы «давление-состав» (а) и «температура-состав» (б)для равновесия жидкость-пар в двухкомпонентной системе
8.
Области Iа и Iб отвечают множеству точек,представляющих газовую (паровую) фазу, тогда
как области IIa и IIб соответствуют множеству
точек, относящихся к жидкости
8
9.
Границы областей IIa и IIб представляют собойлинии р = р(N2ж)) (Т = const) и Т = Т(N2ж) (р =
const) для равновесия «жидкость-пар». Это
зависимость давления насыщенного пара (при Т
=const) и температуры кипения (при р = const) от
состава жидкой фазы. Они называются линиями
кипения.
9
10.
Границы областей Ia и Iб р = р(N2п) (Т = const) иТ = Т (N2п) (р = const) - зависимости давления
насыщенного пара (при Т = const) и температуры
конденсации пара (при р = const) от его состава
Это линии конденсации.
10
11.
Линии кипения и конденсации должнысходиться при N2 = 0 и N2 = 1, т.к. состав
жидкости и газа в случае чистых веществ
совпадают.
11
12.
Т=constp
p
Т=const
p
p
жидкость
A
жидкость
p10
b
c
a
d
p20
c
a
0
p1
пар
(2)
(1)
0
1
a)
A
(1)
0
p 20
b
d
пар
(2)
1
b)
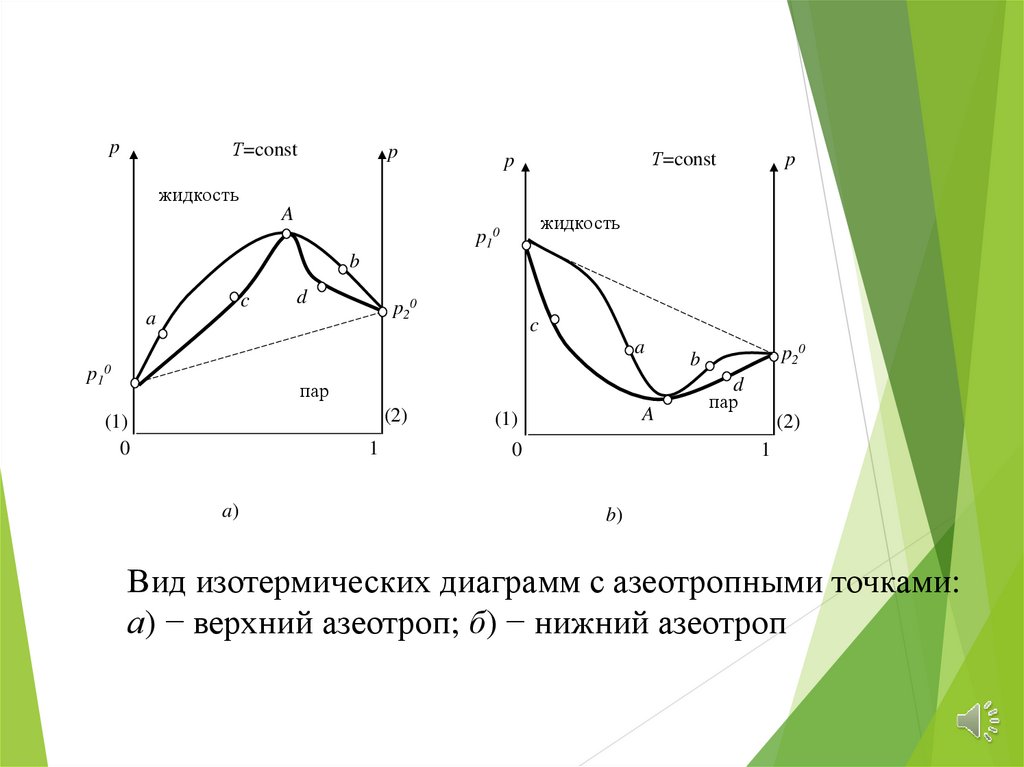
Вид изотермических диаграмм с азеотропными точками:
а) − верхний азеотроп; б) − нижний азеотроп
13.
1 закон: В равновесной системе пар по сравнениюс жидкостью относительно богаче тем
компонентом, давление которого к раствору
повышает общее давление пара, т.е. понижает
температуру кипения при данном давлении (т.е.
пар над двухкомпонентной жидкостью обогащен
более легколетучим компонентом).
14.
2 закон Гиббса – Коновалова (касается болеечастного случая). Экстремумы на кривых общего
давления пара и температуры кипения отвечают
такому равновесию раствора и его насыщенного
пара, при котором составы обеих фаз одинаковы.
Такие составы называются азеотропными и они
не разделяются на компоненты методом обычной
перегонки (дистилляции)
14
15.
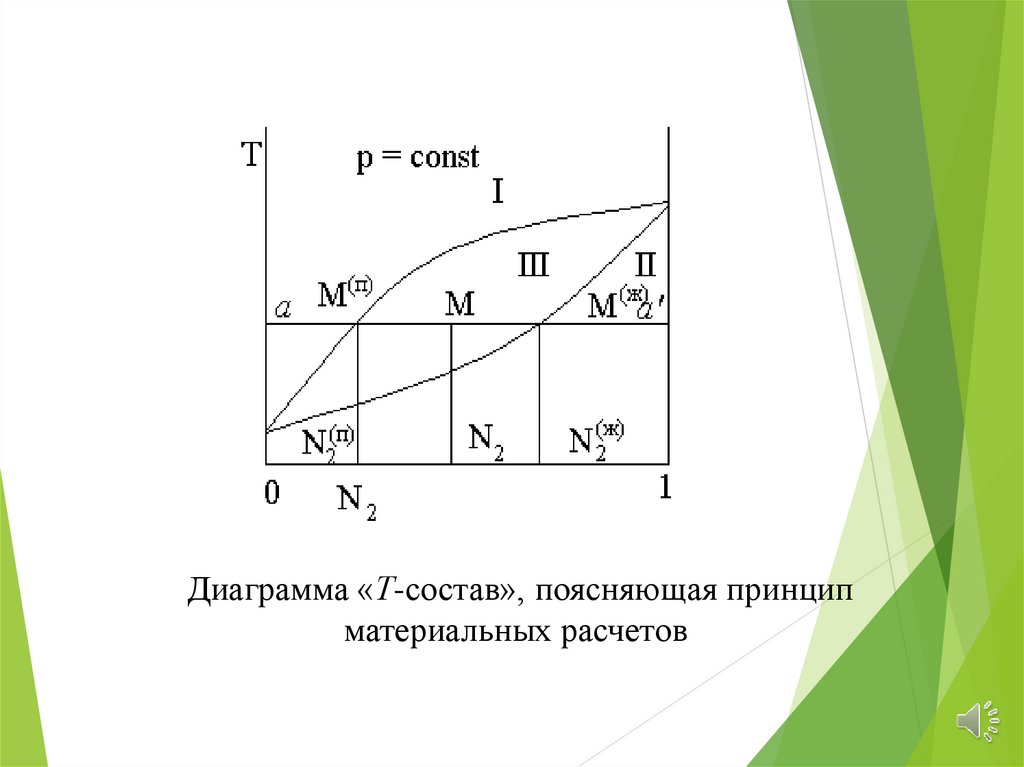
Диаграмма «Т-состав», поясняющая принципматериальных расчетов
16.
Количество фаз, находящихся в равновесии(масса или число молей) обратно
пропорционально отрезкам, на которые точка,
отвечающая составу системы делит ноду,
соединяющую данные фазы
16
17.
Запишем уравнение баланса числа молей 2-гокомпонента
n2 = nжN2ж + nпарN2пар
n2 = n N2 = nжN2 + nпарN2пар
где n – полное число молей в системе; nж и nпар –
число молей в жидком и газообразной фазах
соответственно; N2ж, N2пар , N2 – мольная доля
второго компонента в жидкости, паре и в системе в
целом.
18.
Если на оси состава, откладывались мольные доли,то правило рычага записывается как
n
N N2
nap
n
N 2 N 2ж
ж
nap
2
если массовые доли, то нужно использовать
формулу
m ж 2nap 2
nap
ж
m
2 2
18
19.
Значения N2, N2ж и N2пар снимаются с диаграммы, чтопозволяет вычислить отношение nж/nпар
С другой стороны
n n
ж
nap
m
m
n
M M 1 N1 M 2 N 2
где m – масса системы; М – ее мольная масса. Решая
совместно уравнения, находят значения nж и nпар по
отдельности
20.
Зная составы жидкости (N2ж) и пара (N2пар), можнонайти теперь число молей и массу компонентов в
каждой из фаз
n1пар = nпар - n2пар
m1ж
=
n1ж
M1
n1ж = nж - n2ж
m1пар = n1пар M1пар
20
21.
n2пар = nпар N2парn2ж = nж N2ж
m2пар
m2ж = n2ж M2ж
= n2
пар
M2
пар
а так же массы фаз
mпар = m1пар + m2пар
mж = m1ж + m2ж
21


















 Химия
Химия








