Похожие презентации:
Строение атома углерода
1. Предмет органической химии. Строение атома углерода
2.
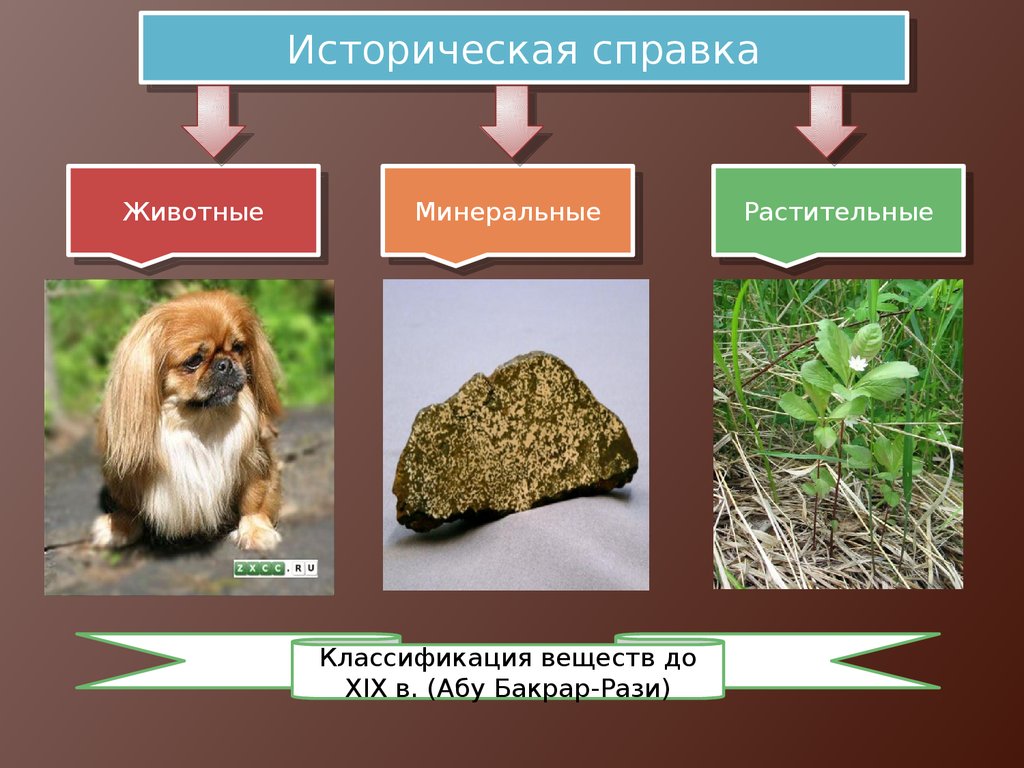
ИсторическаяИсторическая справка
справка
Животные
Животные
Минеральные
Минеральные
Классификация веществ до
XIX в. (Абу Бакрар-Рази)
Растительные
Растительные
3. Долгое время считали, что органические вещества содержатся только в организмах (витализм)
4. Берцелиус Йёнс Якоб (1779-1848)
Впервые ввел терминорганическая
химия
и
органические вещества.
Органическую химию
определил
как
химию
растительных и животных
веществ, образующихся под
влиянием
особой
«жизненной силы».
5.
В середине 19 столетия былипроведены
первые
синтезы
органических веществ:
1828 г. нем. химик Ф. Вёлер синтезировал
карбамид (CH4N2O)
1842 г. русский химик Н.Н. Зинин получил
анилин (C6H5NH2 )
1845 г. нем. химик А. Кольбе - уксусную
кислоту (С2Н4О2)
1861 г. русский химик А.М. Бутлеров –
сахаристое вещество
6. Органическая химия - это химия соединений углерода (Кекуле, середина XIX в.)
7. Особенности органических веществ.
8. 1) В состав органических веществ входят углерод и водород. 2) Они горючи и при горении образуют воду и углекислый газ. 3) Наиболее распростран
1) В состав органических веществвходят углерод и водород.
2) Они горючи и при горении
образуют воду и углекислый газ.
3) Наиболее распространенным
типом связи между атомами в
органических соединениях
является ковалентная связь.
9. 4) Органические вещества построены более сложно, чем неорганические, и многие имеют огромную молекулярную массу.
10.
Самая большая формула:C5750 H7227 О4131 N2215 S690
(19913 атомов!)
В составе ДНК бактериофагов
11.
Строение атома углерода.Валентные состояния
атома углерода.
12. Графическая и электронная формула внешнего энергетического уровня атома углерода
2 2s2 2p2С
1s
+6
……
13. Графическая и электронная формула внешнего энергетического уровня атома углерода в возбужденном состоянии
С* 1s2 2s1 2p3……
14.
Гибридизация – взаимное выравниваниеэлектронных облаков в атоме углерода по
форме и энергии (Л.Полинг, 20-е годы XX
века)
15.
Типы гибридизации:sp3-гибридизация
sp2-гибридизация
sp-гибридизация
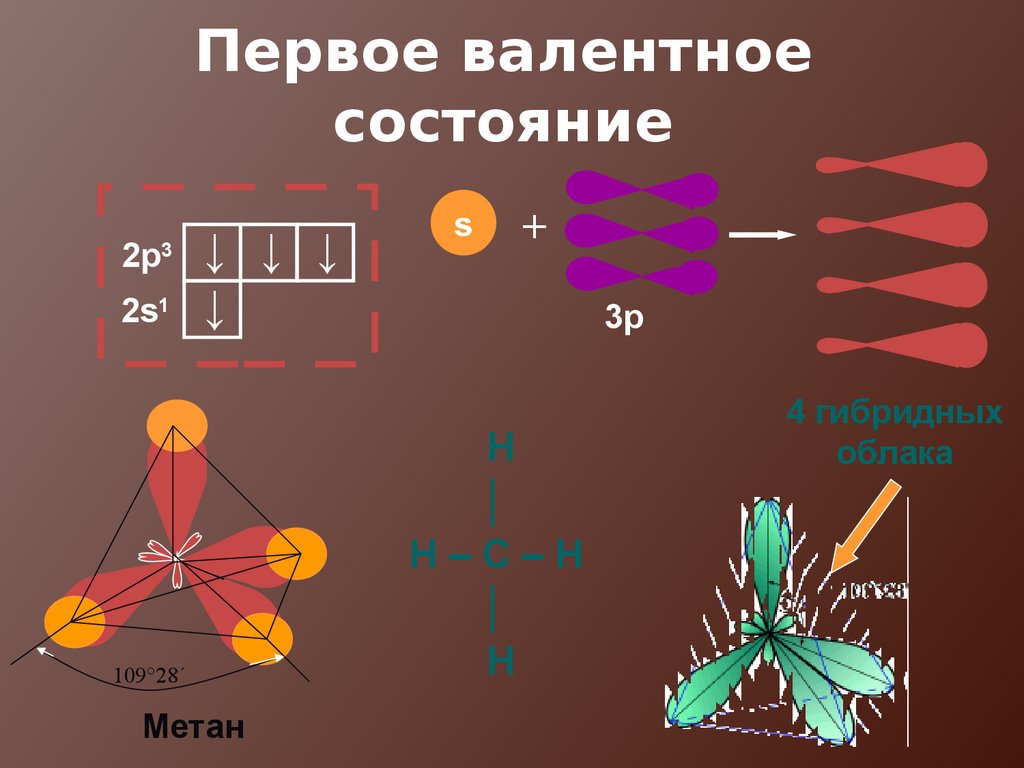
16. Первое валентное состояние
2p3
2s1
↓ ↓ ↓
↓
109°28´
Метан
s
+
3p
Н
│
Н–С–Н
│
Н
4 гибридных
облака
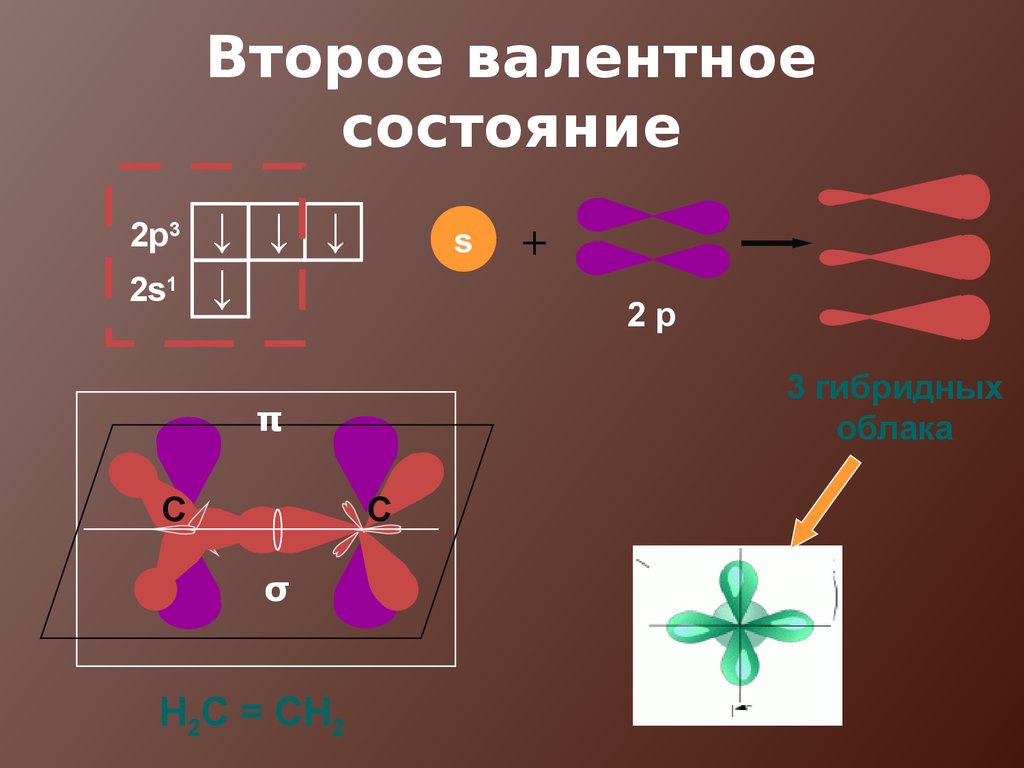
17. Второе валентное состояние
2p32s1
↓ ↓ ↓
↓
s
2p
3 гибридных
облака
π
C
C
σ
Н2С = СН2
+
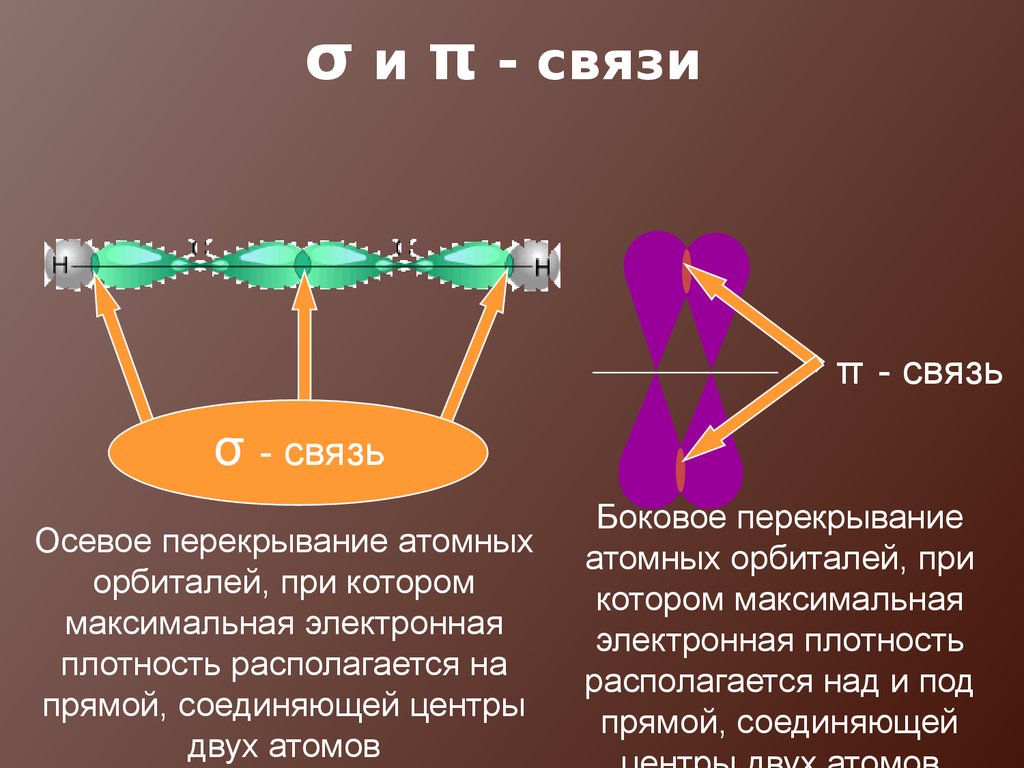
18. σ и π - связи
π - связьσ - связь
Осевое перекрывание атомных
орбиталей, при котором
максимальная электронная
плотность располагается на
прямой, соединяющей центры
двух атомов
Боковое перекрывание
атомных орбиталей, при
котором максимальная
электронная плотность
располагается над и под
прямой, соединяющей
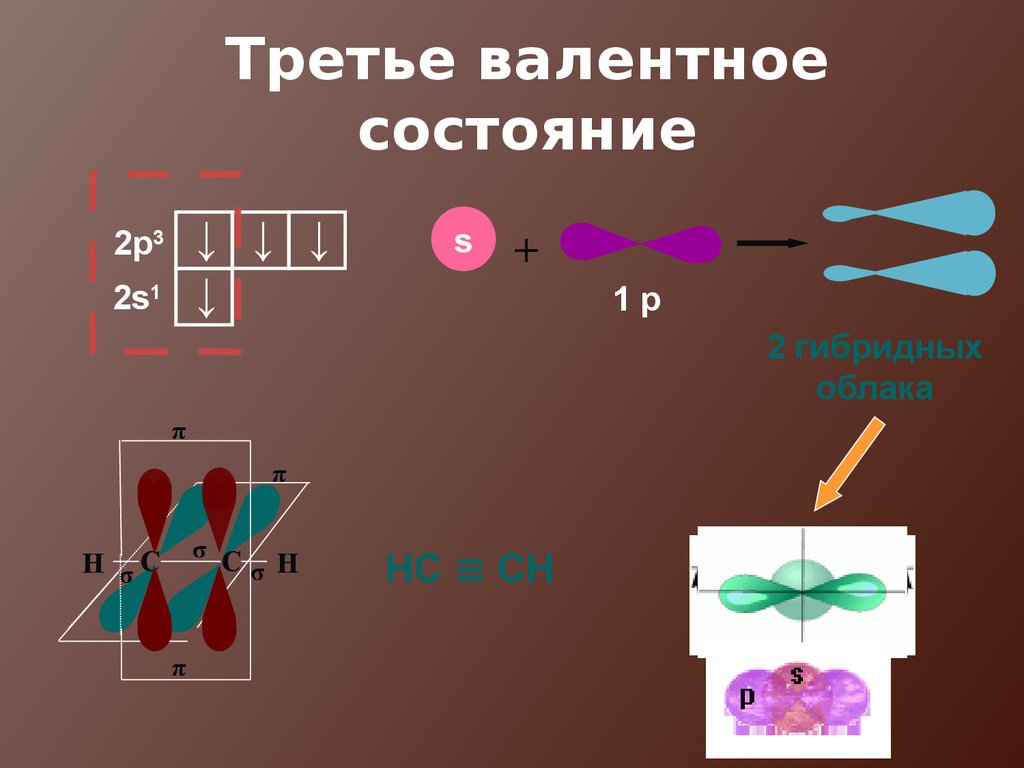
19. Третье валентное состояние
↓ ↓ ↓↓
2p3
2s1
s
+
1p
2 гибридных
облака
π
π
σ С
σ Н
Н σС
π
π
НС ≡ СН
20. ! Чем больше перекрывается электронных областей, тем больше выделяется энергии – тем прочнее связь
L C – C – 0,154 нм – первое гибридноесостояние
L С = С – 0,134 нм – второе гибридное
состояние
L С ≡ С – 0,112 нм – третье
гибридное состояние
L С – Н – мало изменяется от класса к
классу и равна, примерно, 0,111 нм.
21. Проблемный вопрос: каким образом можно определить величину энергии связи?
Е С – С – 339 кДж/мольЕ С = С - 614 кДж/моль
Е С ≡ С – 840 кДж/моль
Е С- Н – 415 кДж/моль
22.
1) Что такое гибридизация?Какие бывают типы
гибридизации?
2) Какие типы перекрывания
электронных облаков есть у атома
углерода?

















 Химия
Химия








