Похожие презентации:
Строение атома углерода
1.
СТРОЕНИЕ АТОМА УГЛЕРОДА2.
… ЭТО ОСОБЫЙ ХИМИЧЕСКИЙЭЛЕМЕНТ : ОН ОСНОВА
МНОГООБРАЗИЯ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ,
ИЗ КОТОРЫХ ПОСТРОЕНЫ ВСЕ
ЖИВЫЕ ОРГАНИЗМЫ.
Д.И.Менделеев
3.
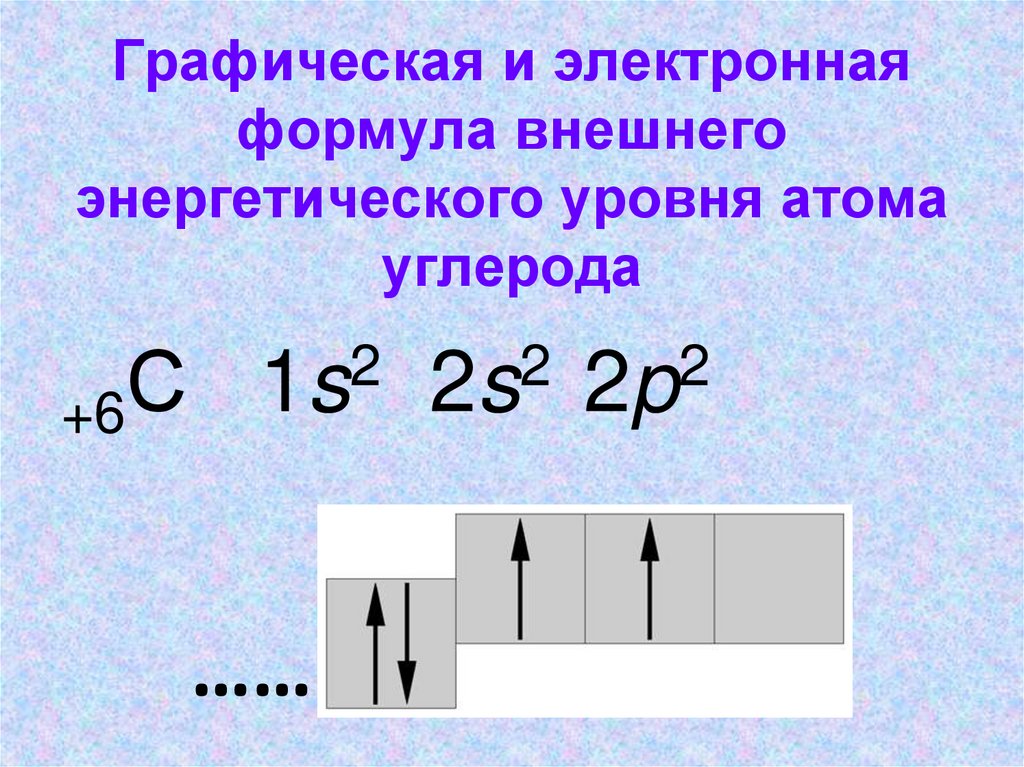
Графическая и электроннаяформула внешнего
энергетического уровня атома
углерода
С
+6
2
1s
……
2
2s
2
2p
4.
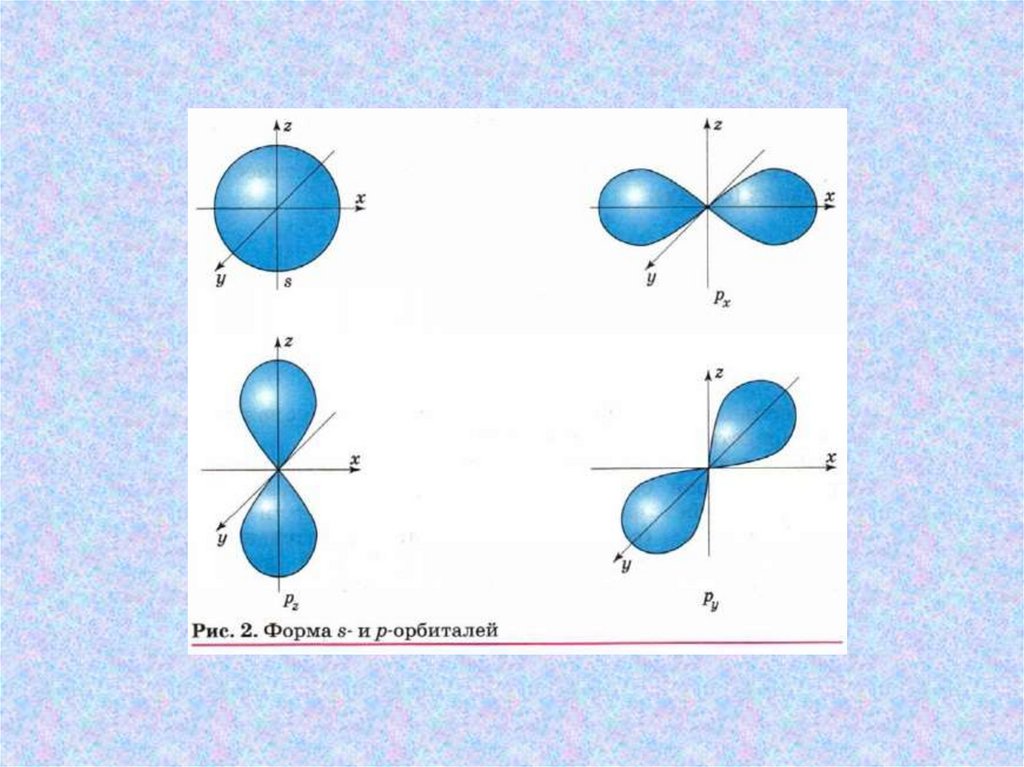
Орбитали в атоме углерода• Атом углерода имеет два вида орбиталей: sорбитали сферической формы и р-орбитали в
форме гантели или объёмной восьмёрки. Эти
орбитали отличаются друг от друга не только
формой, но и удалённостью от ядра атома. Чем
более удалена от ядра орбиталь, тем большую
энергию имеет электрон на этой орбитали.
• Энергия электрона — важнейшая характеристика
его состояния. Причём, и это очень важно, энергия
электрона в атоме может принимать только
определённые значения, а сам электрон может
занимать орбиталь различных энергетических
уровней. Эти орбитали отличаются значением
энергии находящегося на них электрона.
5.
6.
Возбужденное состояние атомауглерода
• Валентность химического элемента чаще всего
определяется числом неспаренных электронов.
Атом углерода, как видно из электронно-графической
формулы, имеет два неспаренных электрона,
поэтому с их участием могут образоваться две
электронные пары, осуществляющие две
ковалентные связи. Однако в органических
соединениях углерод не двух-, а четырёхвалентен.
Это можно объяснить тем, что в возбуждённом
(получившем дополнительную энергию) атоме
происходит распаривание 2s-электронов и переход
одного из них на 2р-орбиталь. Дело в том, что при
образовании двух дополнительных связей
выделяется значительная энергия, которая с лихвой
компенсирует ее затраты на перевод атома углерода
в возбужденное состояние.
7.
Графическая и электроннаяформула внешнего
энергетического уровня атома
углерода в возбужденном
состоянии
С*
1s2 2s1 2p3
……
8.
ВАЛЕНТНЫЕ СОСТОЯНИЯ АТОМА УГЛЕРОДА• Атомы углерода, входящие в состав органических соединений,
могут находиться в трёх валентных состояниях.
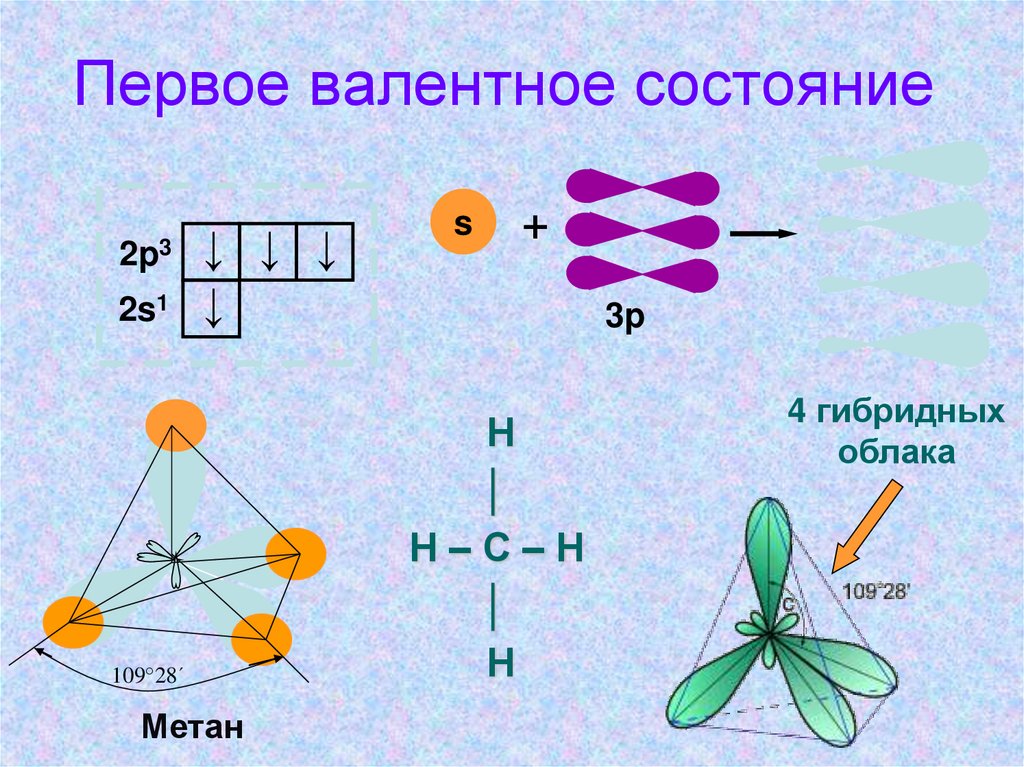
• Первое валентное состояние атома углерода рассмотрим на
примере молекулы метана СН4.
• При образовании молекулы метана СН4 атом углерода из
основного состояния переходит в возбуждённое, в котором
имеет четыре неспаренных электрона: один s- и три рэлектрона. Эти электроны участвуют в образовании четырёх sсвязей с четырьмя атомами водорода. При этом следует
ожидать, что три связи С—Н, образованные за счёт спаривания
трёх р-электронов атомов углерода с тремя s-электронами трёх
атомов водорода (s—р), должны бы отличаться от четвёртой
(s—s) связи прочностью, длиной, направлением. Расчёт
электронной плотности в молекуле метана показывает, что все
связи в его молекуле равноценны и направлены к вершинам
тетраэдра. Это объясняется тем, что при образовании
молекулы метана ковалентные связи возникают за счёт
взаимодействия не «чистых», а так называемых гибридных, т.
е. усреднённых по форме и размерам (а следовательно, и по
энергии), орбиталей. Таким образом обеспечивается лучшее
перекрывание орбиталей атомов углерода и водорода, а
значит, более прочная связь.
9.
• Гибридизация – взаимное выравниваниеэлектронных облаков в атоме углерода
(Лайнус Полинг, 30-е годы XX века)
10.
Типы гибридизации:sp3-гибридизация
sp2-гибридизация
sp-гибридизация
11.
Первое валентное состояние2p3
2s1
↓ ↓ ↓
↓
109°28´
Метан
s
+
3p
Н
│
Н–С–Н
│
Н
4 гибридных
облака
12.
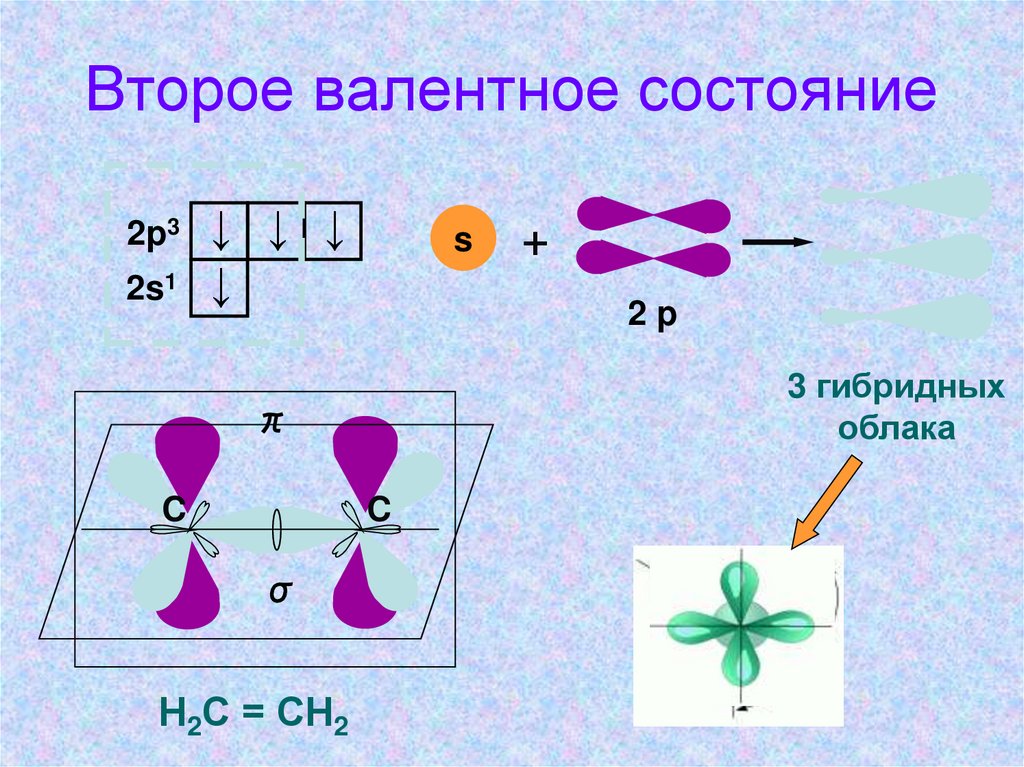
Второе валентное состояние2p3
2s1
↓ ↓ ↓
↓
s
2p
3 гибридных
облака
π
C
C
σ
Н2С = СН2
+
13.
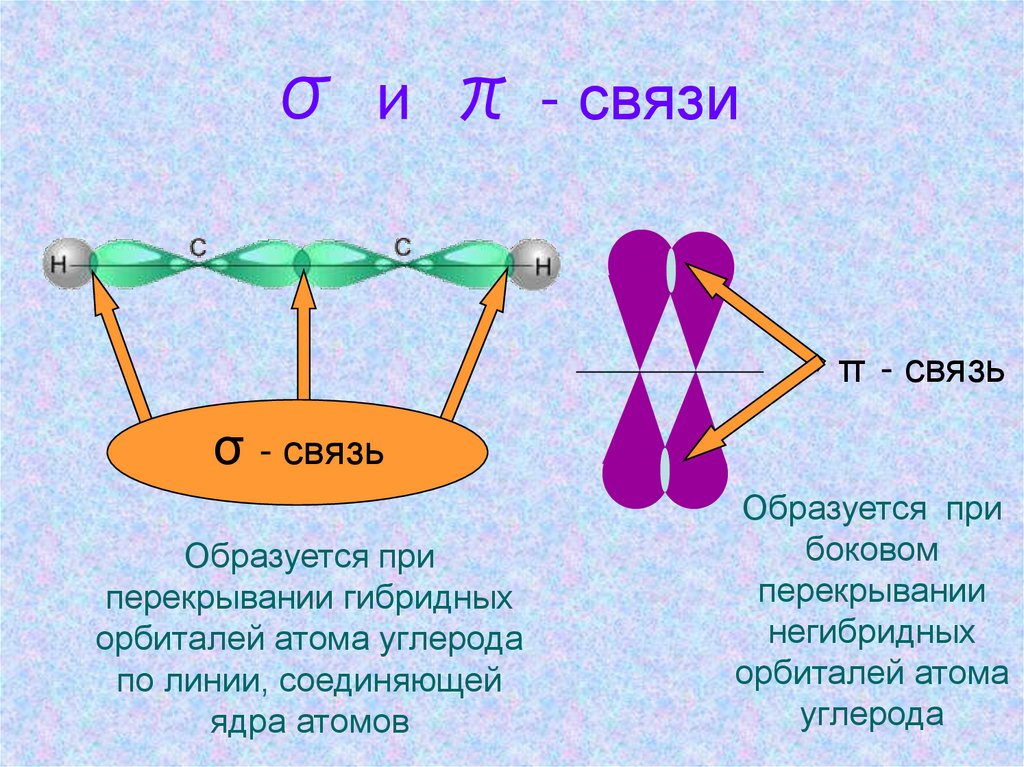
σ и π - связиπ - связь
σ - связь
Образуется при
перекрывании гибридных
орбиталей атома углерода
по линии, соединяющей
ядра атомов
Образуется при
боковом
перекрывании
негибридных
орбиталей атома
углерода
14.
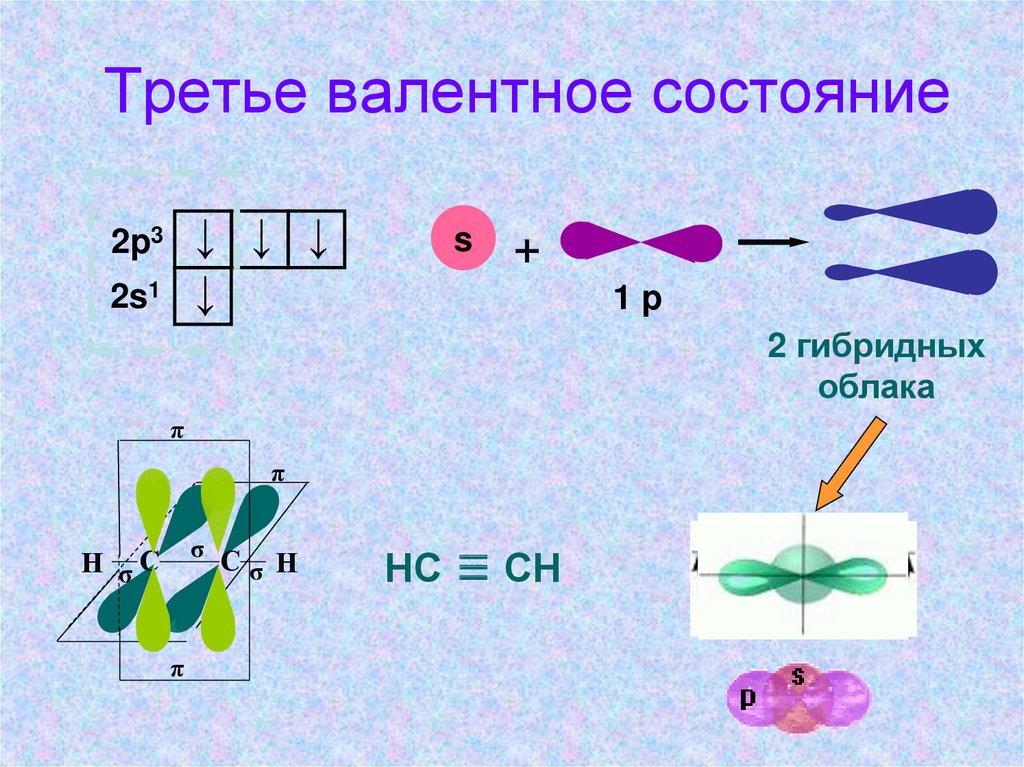
Третье валентное состояние↓ ↓ ↓
↓
2p3
2s1
s
+
1p
2 гибридных
облака
π
π
σ С
σ Н
Н σС
π
π
НС ≡ СН







 Химия
Химия








