Похожие презентации:
Окислительно-восстановительные реакции. Метод электронного баланса. Урок химии в 9-м классе
1. Окислительно-восстановительные реакции. Метод электронного баланса
Урок химии в 9-м классе2. Повторение
Что такое атом?Что такое ион?
Чем отличается ион от атома?
Какие типы реакций вам знакомы?
Что такое степень окисления?
Как определять степень окисления?
3.
Правила вычисления степени окисления (СО) элементов:4. Выполните задание
Определите степени окисления атомовхимических элементов по формулам их
соединений:
H2S, O2, NH3, HNO3, Fe, K2Cr2O7
5. Выполните проверку
+1 -20
H2S
O2
0
-3 +1
NH3
+1 +6
-2
Fe K2Cr2O7
+1 +5 -2
HNO3
6.
Расставьте степени окисления элементов в реакциях.Сравните, как ведут себя степени окисления в
процессе реакции.
+1
+1
-1
-2 +1
+1
-1
+1
-2
HCl + NaOH = NaCl + H2O
+1
-1
0
+2
-1
0
2 HCl + Zn = ZnCl2 + H2
Окислительновосстановительная
реакция
Реакции, в которых происходит изменение степеней
окисления, называются
окислительно-восстановительными
7.
2 H++1Cl-1 + Zn0 = Zn+2Cl2-1 + H2200H+
Zn0
- 2 е-
окисление
+ 2 е-
восстановление
- окислитель
- восстановитель
8.
Окисление – процесс отдачи электронов.Восстановление – процесс присоединения
электронов.
Окислитель – элемент, принимающий
электроны.
Восстановитель – элемент, отдающий
электроны.
9.
Отдает или принимает?Изначально атом не
заряжен, т.к. число
протонов равно числу
электронов
-
-
-
+5
-
-
-
-4
-3
-2
-1
0
+1
+2
+3
+4
+5
+6
Отдает электроны (- е-)
Принимает электроны (+ е-)
10.
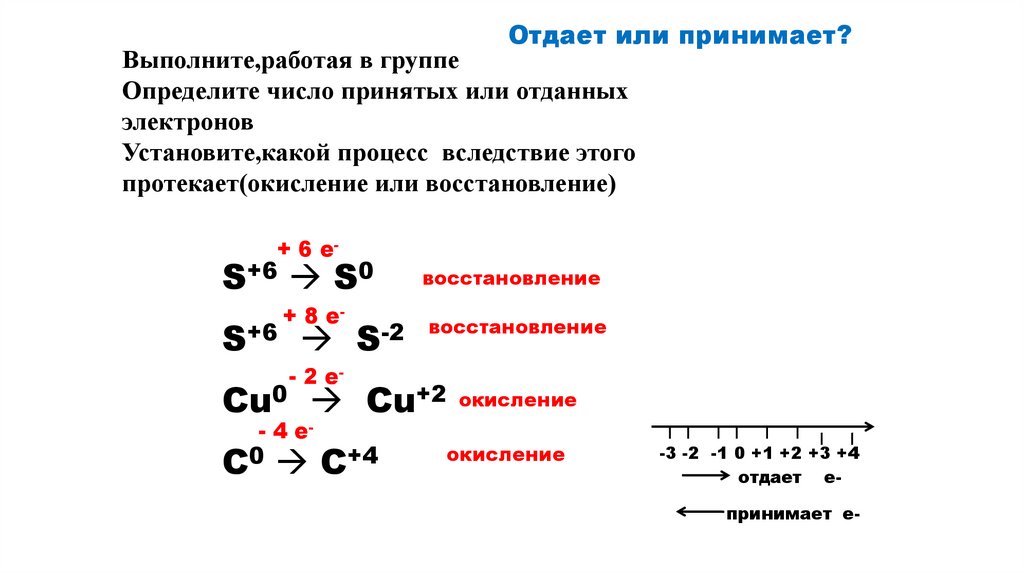
Отдает или принимает?Выполните,работая в группе
Определите число принятых или отданных
электронов
Установите,какой процесс вследствие этого
протекает(окисление или восстановление)
+ 6 e-
S+6 S0
S+6
+ 8 e-
S-2
восстановление
восстановление
- 2 e-
Cu0 Cu+2 окисление
- 4 e-
C0 C+4
окисление
-3 -2 -1 0 +1 +2 +3 +4
отдает е-
принимает е-
11.
Какая польза от теории ОВР?Например, расстановка коэффициентов в
сложных уравнениях – метод электронного
баланса
+1 -1
+1
+7 -2
+2
-1
+1 -1
0
+1 -2
16 HCl +2 KMnO4 =2 MnCl2 +2 KCl +5 Cl2+ 8 H2O
Mn+7
+5е
2Cl-1
-2е
Mn+2
Cl20
Mn+7 – окислитель
Сl -1 – восстановитель
2
Восст-ие
10
5 окисление
12.
План составления уравнений ОВР и электронногобаланса к ним
1. Записать схему реакции.
2. Определить, атомы каких элементов изменяют степень
окисления.
3. Составить электронные уравнения процессов окисления и
восстановления.
4. Подобрать общее делимое для отданных и принятых электронов
и коэффициенты для электронных уравнений.
5. Перенести эти коэффициенты в уравнение ОВР и подобрать
коэффициенты перед формулами других веществ.
13.
Задание найти окислительно-восстановительную реакцию иуравнять ее методом электронного баланса
Карбонат кальция + соляная кислота
CaCO₃ + 2HCl(разб.) → CaCl₂ + CO₂↑ + H₂O
Нитрат серебра + Медь
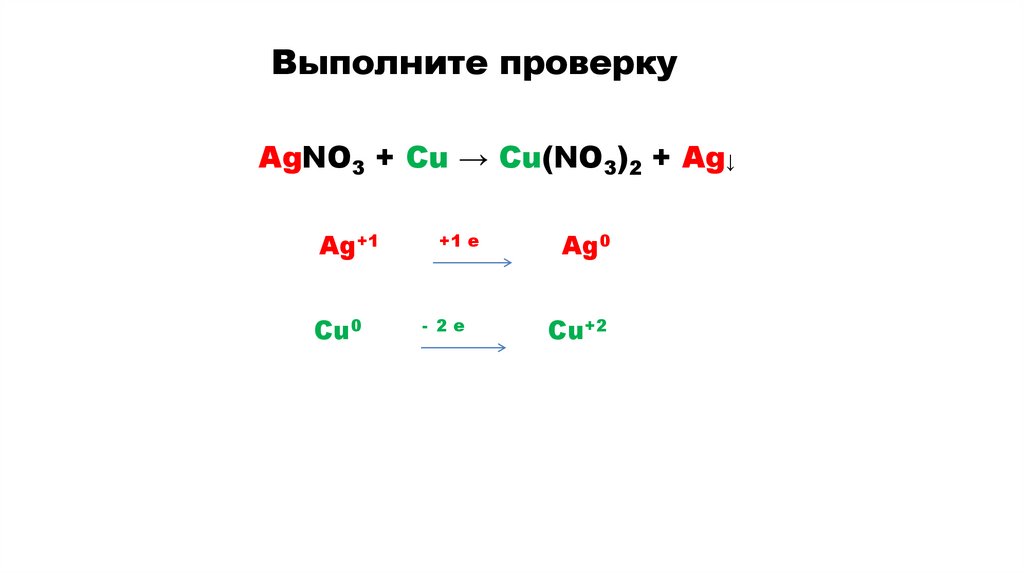
AgNO3 + Cu → Cu(NO3)2 + Ag↓
14.
Выполните проверкуAgNO3 + Cu → Cu(NO3)2 + Ag↓
Ag+1
Cu0
+1 e
- 2e
Ag0
Cu+2
15. Расставьте коэффициенты методом электронного баланса
16. Домашнее задание:
• Прочитать конспект, выучить определения (окислитель,восстановитель,ОВР).
Методом электронного балланса расставить коэффициенты в
уравнении:
HCl + MnO2 → MnCl2 + Cl2 + H2O














 Химия
Химия








