Похожие презентации:
Химические реакции или химические явления
1.
2.
Химические реакции или химические явления – это такие процессы,в результате которых из одних веществ образуются другие,
отличающиеся от них по составу и (или) строению.
3.
ислу и составу исходнбразовавшихся вещес
Реакции
разложения
Реакции
соединения
Реакции замещения
Реакции обмена
4.
Реакции соединения – это такие реакции,при которых из двух и более веществ образуется
одно сложное вещество
5.
Реакции замещения – это такие реакции,при которых атомы простого вещества,
замещают атомы какого-нибудь элемента
в сложном веществе
6.
Реакции разложения – это такие реакции,при которых из одного
сложного вещества образуется несколько
новых веществ
7.
Реакции обмена – это такие реакции,при которых
два сложных вещества обмениваются своими
составными частями
8. Определите тип реакции
1) 4 NO2 + O2 + 2H2O = 4 HNO32) 2KMnO4 = MnO2 + K2MnO4 +O2
3) C + FeO = CO + Fe
4) KOH + HCl = KCl + H2O
5) Cu + 2 AgNO3 = 2 Ag + Cu(NO3) 2
9.
По тепловому эффекту10.
Количество теплоты, которое выделяется в результате реакции,называется тепловым эффектом данной химической реакции.
Экзотермическими называются реакции,
которые протекают с выделением теплоты.
Эндотермическими называются реакции,
которые протекают с поглощением теплоты.
11.
Определить типреакции
Н2 + Сl2 = 2 НСl
СН4 + 2 О2 = 2 Н2О + СО2
N2 + O2 = 2 NO
2 СН4 = C2H2 + 3 H2
12.
Понаправлен
ию:
13.
Необратимыми называются такие реакции,которые протекают в данных условиях
только в одном направлении, то есть до конца,
до полного израсходования одного из реагирующих веществ.
Признаки необратимой химической реакции:
•образование осадка;
•образование газа;
•образование малодиссоциирующего вещества.
14.
Химические реакции, протекающиепри данных условиях во взаимно
противоположных направлениях,
называются обратимыми.
15.
Определить типреакции
N2+ 3 H2 ⇆ 2 NH3
NaCl + AgNO3 = AgCl↓+ NaNO3
16.
По фазовомусоставу :
Гомогенные
реакции
Гетерогенные
реакции
17.
Гомогенные реакции – реакции,при которых реагирующие вещества находятся
в одном агрегатном состоянии (в одной фазе).
H 2 (TB ) F2 ( Г ) 2 HF( Г )
CH3COOH ( Р Р) C2 H5OH ( Р Р) CH3COOC2 H5( Р Р) H 2O( Ж )
Гетерогенные реакции – реакции,
при которых реагирующие вещества находятся
в разных агрегатных состояниях (в разных фазах).
2 Al(ТВ ) 3СuCl2( р р ) 3Сu(ТВ ) 2 AlCl3( р р )
CaC2(ТВ ) 2H 2O( Ж ) C2 H 2 Ca(OH )2( р р )
18.
По наличиюкатализатора:
19.
Вещества, которые ускоряют химические реакции,активно участвуют в них, но сами в итоге не расходуются,
называются катализаторами.
Явления ускорения химических реакций
благодаря присутствию некоторых веществ
носит название катализа.
MnO2
2 KClO3 2 KCl 3O2
H 2 SO4
C2 H 5OH CH 2 CH 2 H 2O
20.
2 HgO 2 Hg O2C2 H 4 3O2 2CO2 2 H 2O
21.
По изменениюстепени
окисления
элементов:
22.
Реакции, идущие с изменением степеней окисленияатомов элементов называются окислительно-восстановительными.
Степень окисления – условный показатель,
характеризующий заряд атома в соединениях.
Окисление – процесс отдачи электронов атомом, молекулой или ионом.
Восстановление – присоединение электронов атомом, молекулой или ионом.
Окислитель – атом, молекула или ион, принимающий электроны,
при этом окислитель восстанавливается
Восстановитель - атом, молекула или ион, отдающий электроны,
при этом окислитель окисляется
23.
12
2
Mg H SO4 Mg SO4 H
0
Li2O H 2O 2LiOH
0
2
24.
Определить тип реакции2 Na + 2 H2O = 2 NaOH + H2
S+ O2 = SO2
HCl + NaOH = NaCl + H2O
Cu + 2 AgNO3 = 2 Ag + Cu(NO3) 2
KCI + AgNO3 = AgCl + KNO3
25. Определить тип реакций
СН4 + Cl2 = CH3Cl+ HClNaOH +HCl = NaCl + H2O
CO2 + C = 2 CO
4FeS2 + 11 O2 = 2Fe2O3 + 8 SO2
26.
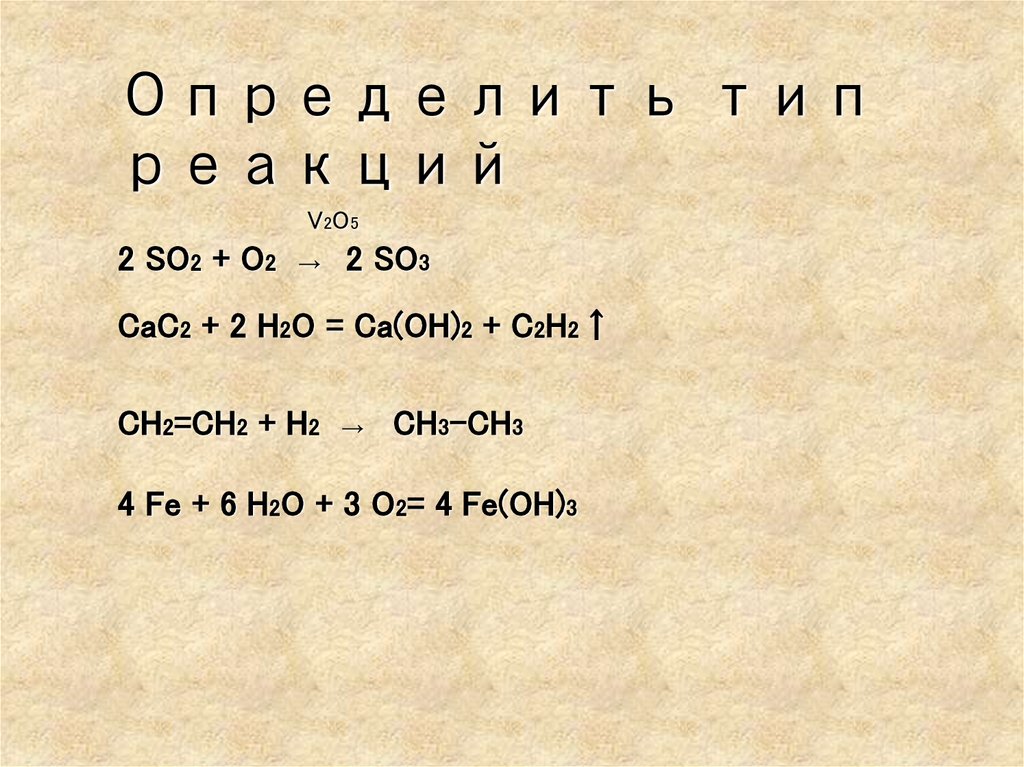
Определить типреакций
V2O5
2 SO2 + O2 → 2 SO3
CaC2 + 2 H2O = Ca(OH)2 + C2H2↑
CH2=CH2 + H2 → CH3-CH3
4 Fe + 6 H2O + 3 O2= 4 Fe(OH)3

























 Химия
Химия








