Похожие презентации:
Система антиоксидантной защиты
1. Система антиоксидантной защиты
2.
Глобин3.
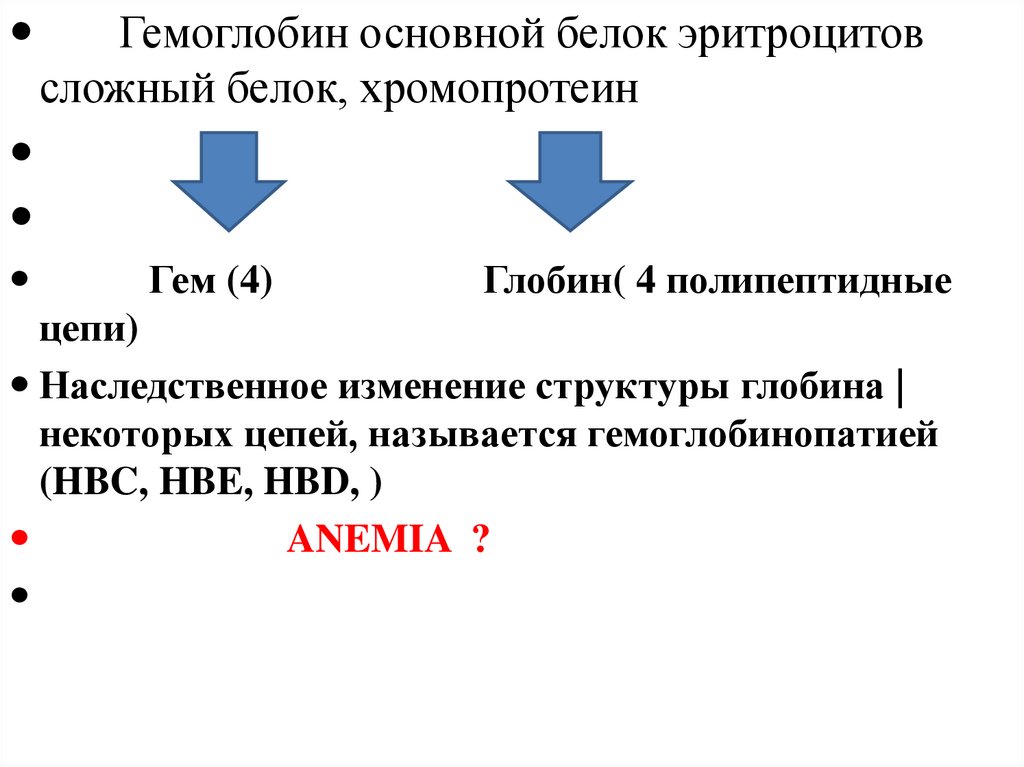
Гемоглобин основной белок эритроцитовсложный белок, хромопротеин
Гем (4)
Глобин( 4 полипептидные
цепи)
Наследственное изменение структуры глобина |
некоторых цепей, называется гемоглобинопатией
(HBC, HBE, HBD, )
ANEMIA ?
4.
Физиологические виды HbHbF – фетальный гемоглобин,
2α-2γHbA – молодых - 2α-2β80%
HbA2 –2% взрослых, 2α- 2δ-
Физиологические
производные НВ
HbO2 – оксигемоглобин,
HbCO2 – Карбгемоглобин
ГЛО
БИН
5.
Физиологические производные НВHbO2 – оксигемоглобин,
HbCO2, НВNHCOOH –
карбгемоглобин (Fe 2+)
Физиологические производные НВ
НВCO- карбоксигемоглобин
НВOH или – метгемоглобин
(Fe 3+)
6.
7.
8.
9.
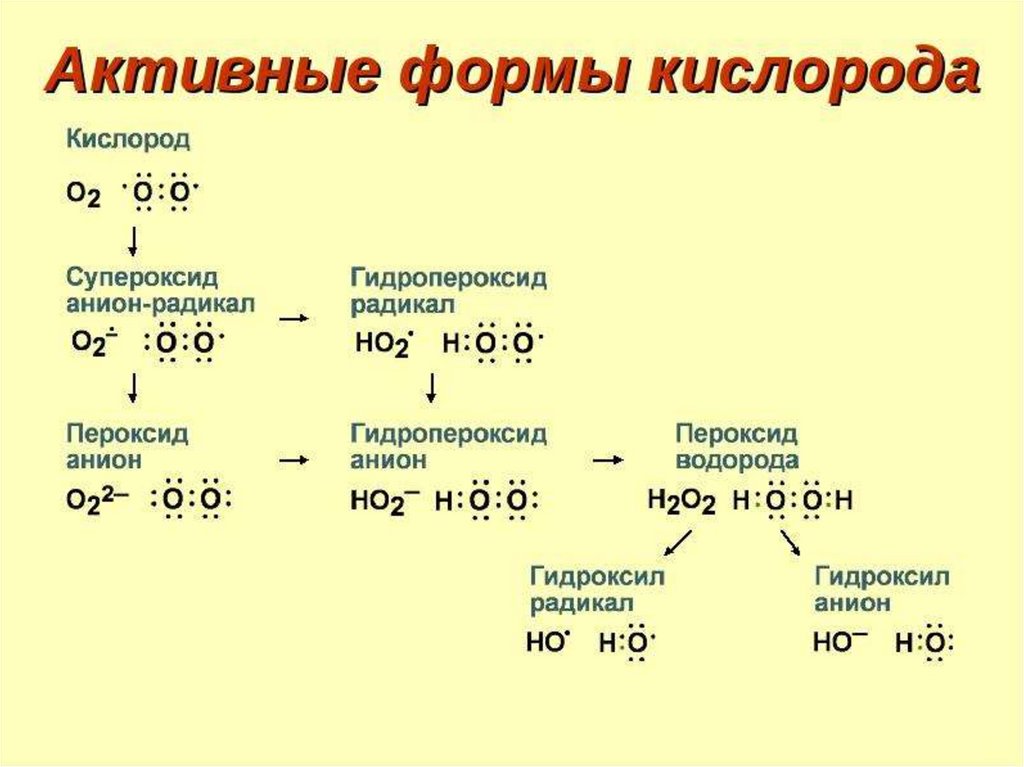
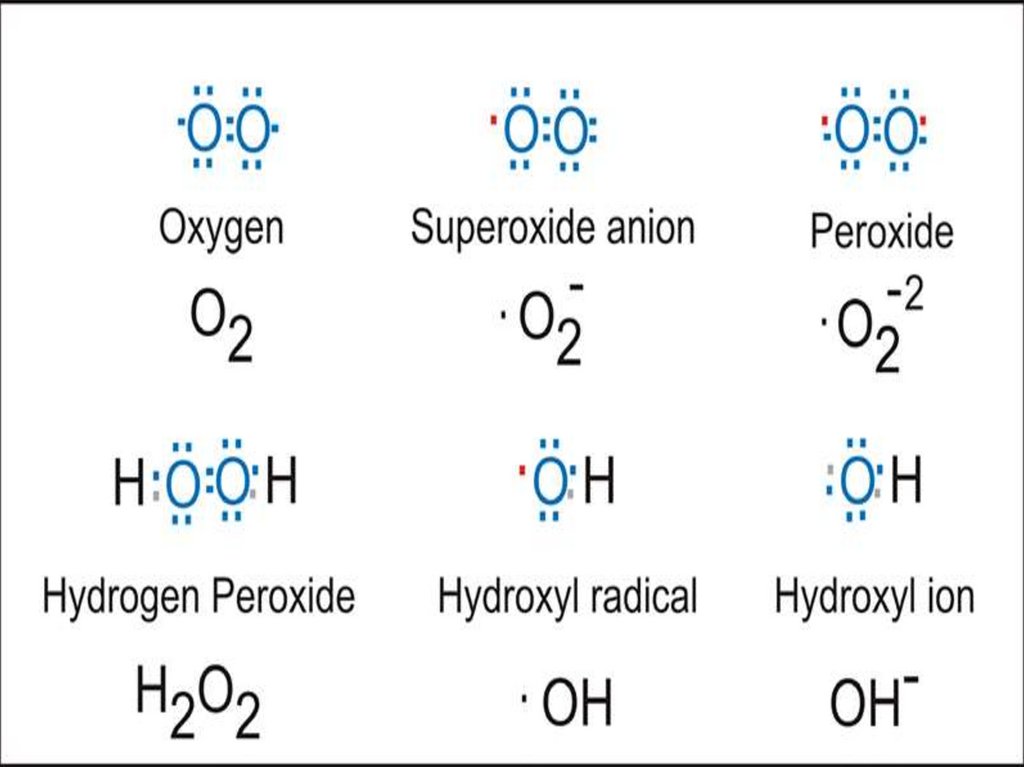
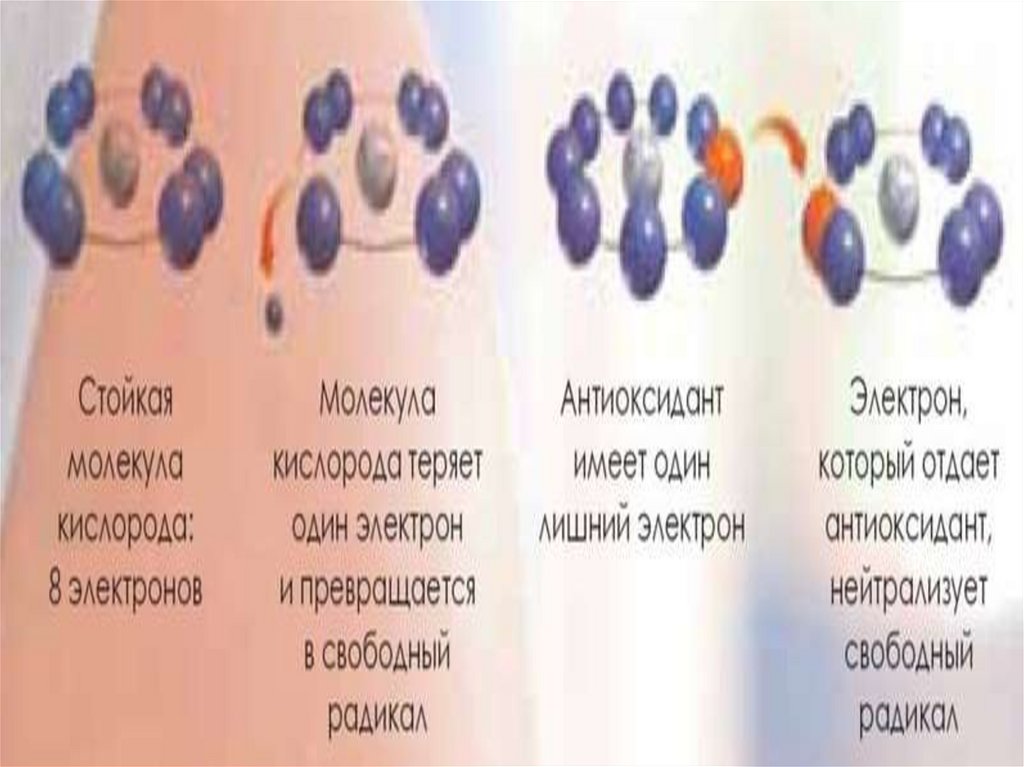
Супероксиданион-радикал
о2‾
Супероксидный
анион-радикал
является одной из наиболее опасных
форм активного кислорода, так как
имеет продолжительное время жизни
и становиться источником других
АФК.
10.
2) Пероксид водорода H2O2Пероксид водорода относится к окислителям
средней силы и в стрессовых условиях проявляет
двойственные функции: с одной стороны, он
является токсичным продуктом, с другой –
выполняет защитную сигнальную роль. Пероксид
водорода относительно стабилен и может легко
диффундировать через мембраны. Однако его
роль определяется не столько собственной
химической реактивностью, сколько участие в
образовании более токсичных АФК.
11.
3) Гидроксильный радикал ОН • наиболее сильныйокислитель, не способен к внутриклеточной
миграции, так как моментально реагирует с
биомолекулами. Основным источником ОН
служат реакции Фентона (1-2) и Хабера-Вейса (3),
при участии пероксида водорода и
восстановленных ионов металлов переменной
валентности, в частности меди и железа: О 2 •‾ +
Fe 3+ → Fe 2+ + О 2 ( 1) Fe 2+ + Н 2 О 2 → Fe 3+ +
OH‾ + ОН • ( 2) О 2 •‾ + Н 2 О 2 → OH‾ + ОН • + О
2 ( 3)
12.
4) Синглетный кислород О 2 Возникновениепреимущественно связано с фотохимическими
реакциями: поглощением пигментом (Р) кванта
света ( hν ) и переносом энергии с его
возбужденных синглетных ( 1 Р) и триплетных (
3 Р) состояний на молекулярный кислород.
Синглетный
кислород
может
быстро
реагировать с большинством органических
молекул (RH), продуцируя гидропероксиды (4):
RH + 2 1 О 2 → ROOH ( 4)
13.
14.
15.
16.
17.
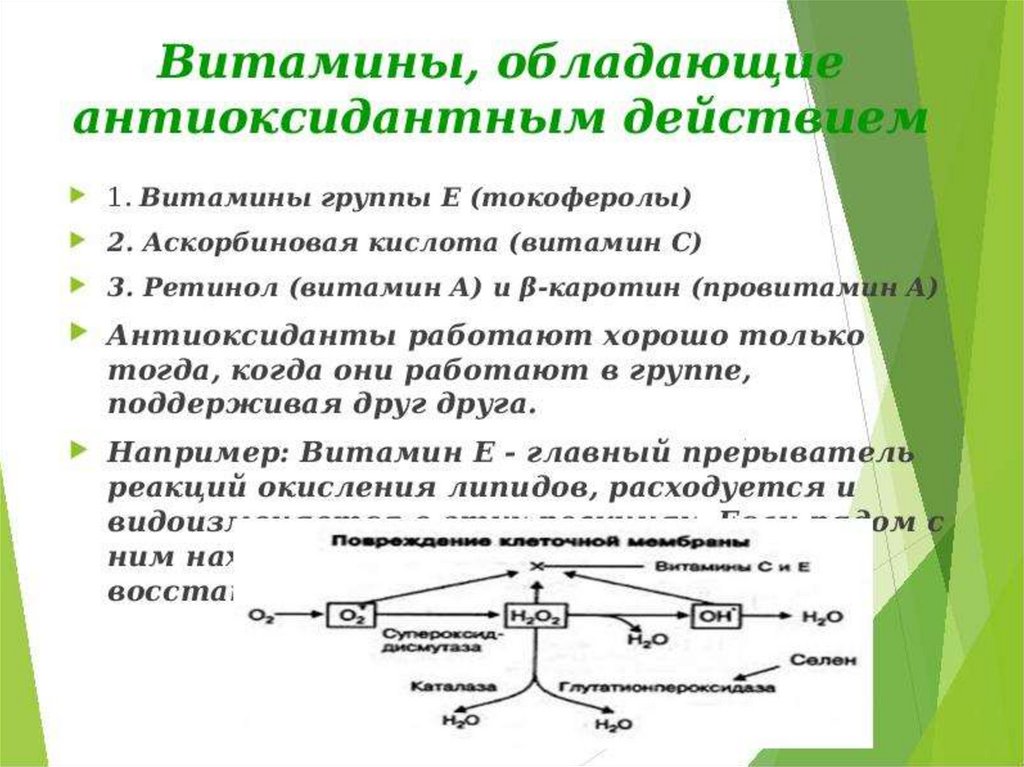
Aнтиоксидантная система/ защитная система клеток/
состоит из 4 ферментов:
Угроза со стороны активных
радикалов устраняется действием
ферментов АОС
18.
19.
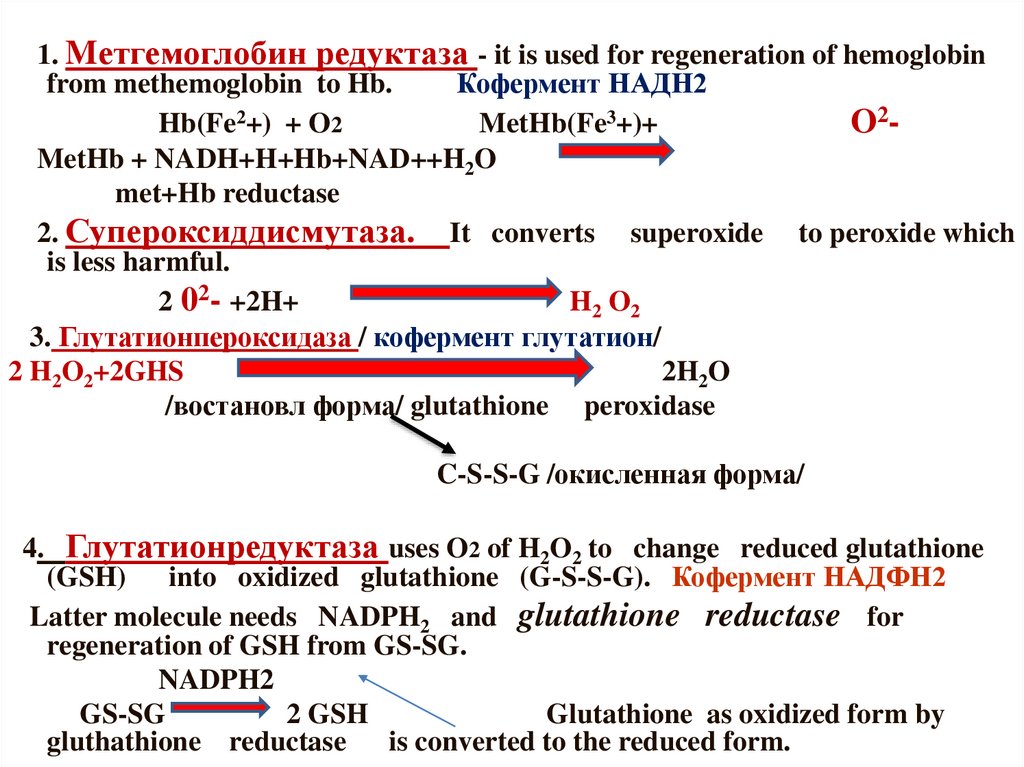
1. Methemoglobin reductase - it is used for regeneration of hemoglobinfrom methemoglobin to Hb.
It is needed in HADH+H
Hb(Fe2+) + O2
MetHb(Fe3+)+
O2MetHb + NADH+H+Hb+NAD++H2O
met+Hb reductase
2. Superoxide dismutase. It converts superoxide to peroxide which
is less harmful.
2 02- +2H+
H2 O2
3. Glutathionperoxidase / coenzyme-glutathion/
2 H2O2+2GHS
2H2O
/redused form/ glutathione peroxidase
C-S-S-G /oxidized/
4. Glutathione reductase uses O2 of H2O2 to change reduced glutathione
(GSH) into oxidized glutathione (G-S-S-G).
Latter molecule needs NADPH2 and glutathione reductase for
regeneration of GSH from GS-SG.
NADPH2
GS-SG
2 GSH
Glutathione as oxidized form by
gluthathione reductase is converted to the reduced form.
20.
1. Mетгемоглобин редуктаза - it is used for regeneration of hemoglobinfrom methemoglobin to Hb.
Кофермент НАДН2
Hb(Fe2+) + O2
MetHb(Fe3+)+
O2MetHb + NADH+H+Hb+NAD++H2O
met+Hb reductase
2. Супероксиддисмутаза. It converts superoxide to peroxide which
is less harmful.
2 02- +2H+
H2 O2
3. Глутатионпероксидаза / кофермент глутатион/
2 H2O2+2GHS
2H2O
/востановл форма/ glutathione peroxidase
C-S-S-G /окисленная форма/
4. Глутатионредуктаза uses O2 of H2O2 to change reduced glutathione
(GSH) into oxidized glutathione (G-S-S-G). Кофермент НАДФН2
Latter molecule needs NADPH2 and glutathione reductase for
regeneration of GSH from GS-SG.
NADPH2
GS-SG
2 GSH
Glutathione as oxidized form by
gluthathione reductase is converted to the reduced form.
21.
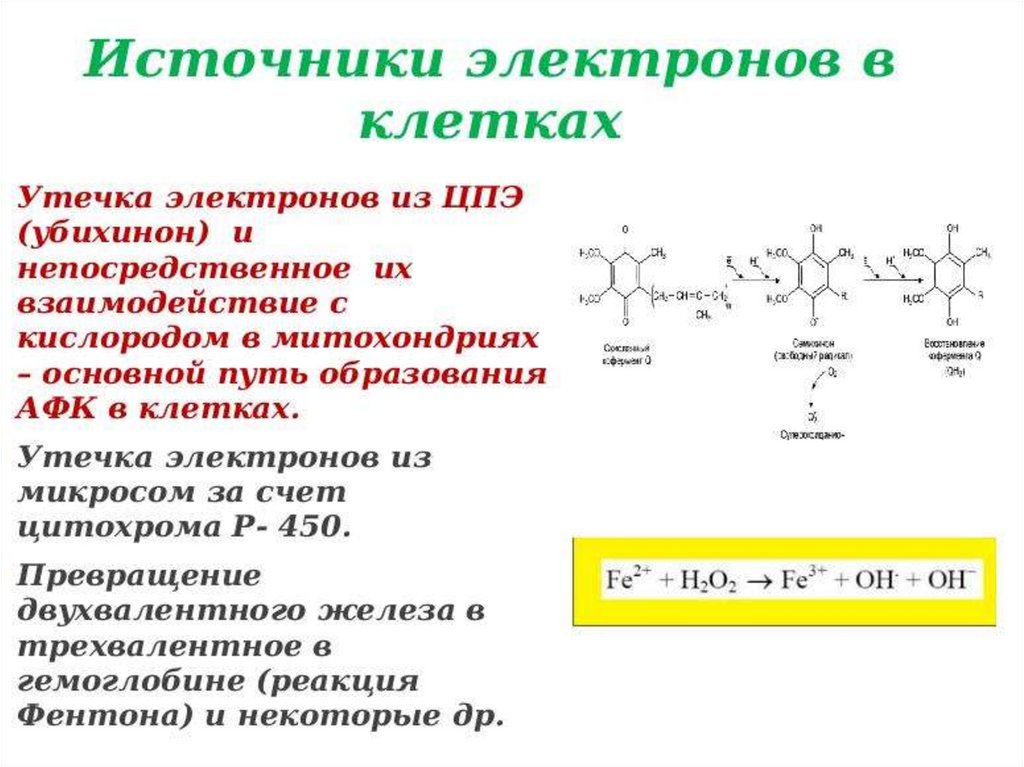
• Кислород может не только быть использовандля
образования оксигемоглобина,
но
и
вызвать
не
ферментативное
окисление
гемоглобина в метгемоглобин, в котором железо
трехвалентно.
• Метгемоглобин
(HbOН)
относится
патологическим производным гемоглобина.
• Образование
метгемоглобина
может
происходить при попадании в организм
окислителей, таких как бертолетова соль,
нитраты, нитриты, анилин, нитробензол и др.
• Метгемоглобин не присоединяет кислород, и
поэтому не может обеспечить дыхание тканей.
22.
• Образованиеметгемоглобина
происходит
постоянно: ежедневно около 0,5% всего
гемоглобина превращается в метгемоглобин.
• Метгемоглобин снова восстанавливается в
гемоглобин
ферментом
метгемоглобинредуктазой
использующей
НАДН2 или НАДФН2.
• Окисление гемоглобина в метгемоглобин
кислородом
приводит
к
образованию
супероксидного аниона (О2-):
• Hb(Fe++) + O2
MetHb(Fe+++) + O2-
23.
• Супероксидный анион может действовать ворганизме как окислитель (акцептор электрона) и
как восстановитель (донор электрона).
• Действуя как окислитель, получая еще один электрон,
в водной среде он превращается в пероксид водорода:
O2- + е- + Н+
HО-ОH
• Перекись водорода в свою очередь может
восстанавливаться супероксидным анионом с
образованием свободного гидроксильного радикала
(ОН*):
O2- + HO-OH
ОН* + ОН- + О2
24.
• Гидроксильный радикал при взаимодействии ссупероксидным анионом образует синглетный
кислород ("О2), в молекуле которого оба
электрона
внешней
орбиты
имеют
разнонаправленный спин:
O2- + ОН*
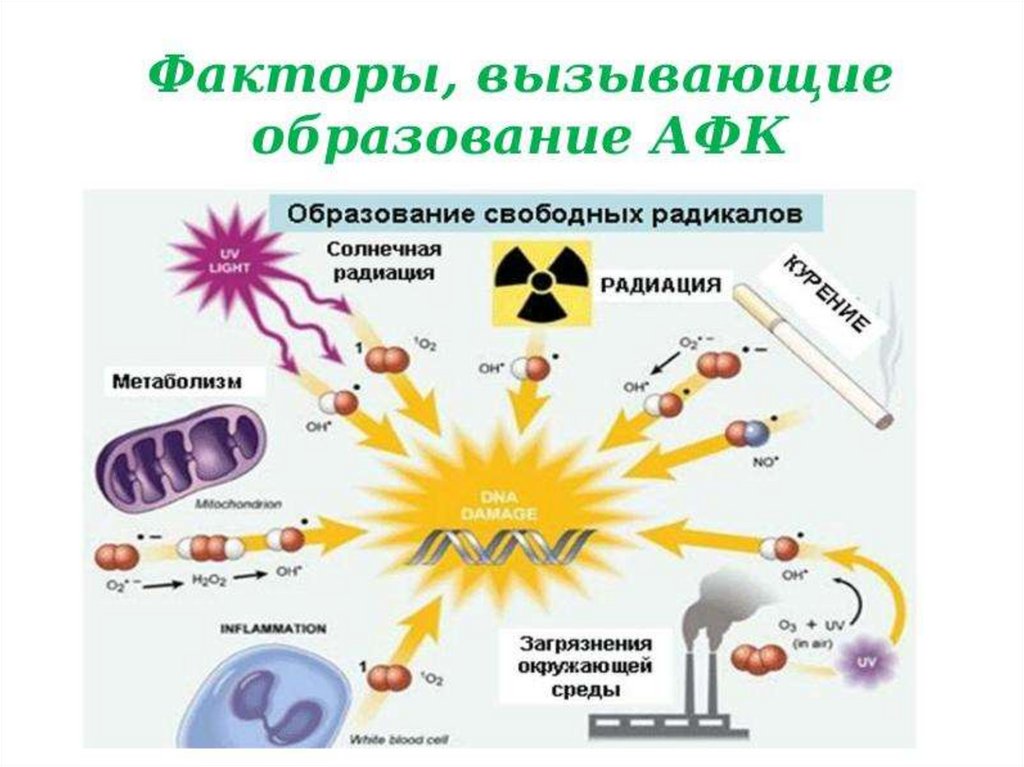
"О2 + ОН• Активные формы кислорода в организме
образуются в реакциях самопроизвольного
(не ферментативного) окисления ряда веществ,
в том числе и лекарств, а также в реакциях,
катализируемых различными оксидазами.
25.
• Супероксид (О2-), гидроксильный радикал(ОН*), перекись водорода и синглетный
кислород ("О2)
имеют
высокую
химическую активность
и реагируют со
многими веществами организма, в том числе
с нуклеиновыми кислотами,
белками и
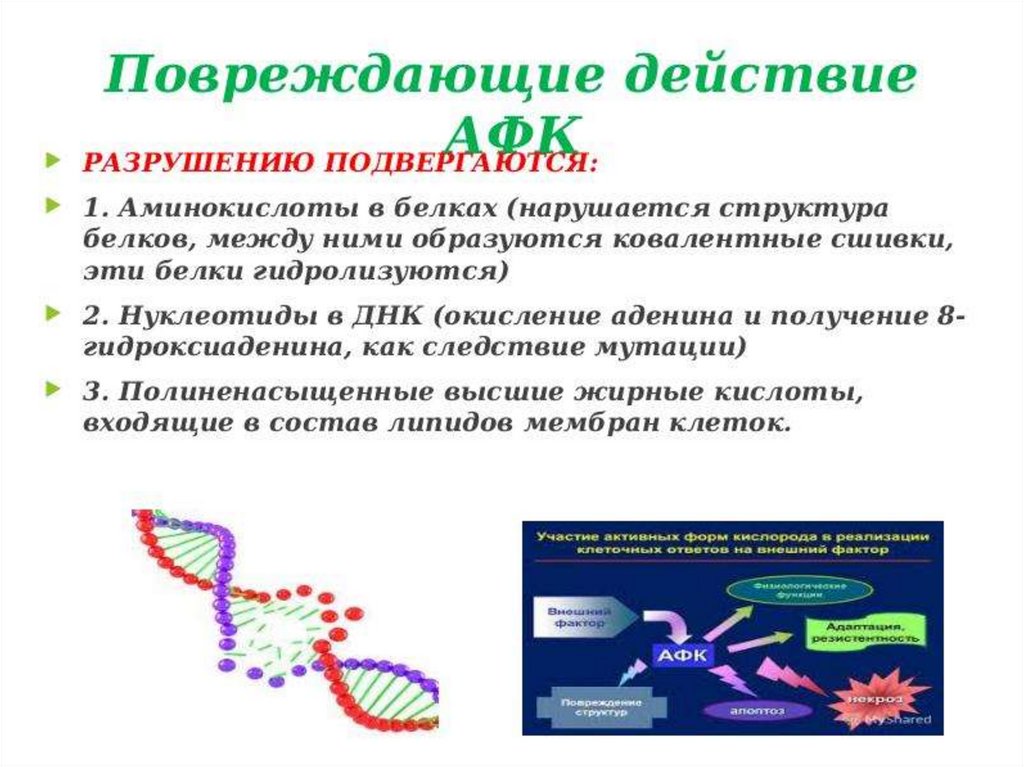
липидами.
• Наибольшее повреждающее действие активные
формы кислорода оказывают на липиды,
запуская
цепную
реакцию
образования
пероксидов ненасыщенных жирных кислот.
• Пероксиды не стабильны и распадаются с
образованием альдегидов.
26.
• Пероксидноеокисление
липидов
уменьшает
гидрофобность
липидов,
изменяет их конформацию, приводит к
образованию ковалентных сшивок между
молекулами липидов или липидов и белков.
• Вследствие
этого
при
окислении
мембранных липидов резко повреждаются
структуры и функции мембран.
• А это в свою очередь приводит к гемолизу
эритроцитов.
27.
• Во всех клетках, в том числе и в эритроцитах,имеются механизмы защиты от токсического
действия кислорода.
• Так супероксидный анион может под воздействием
суперокисддисмутазы превращаться в перекись
водорода:
• O2- + O2- + 2Н+
Н2О2 + О2
супероксиддисмутаза
Перекись водорода разрушается каталазой
образованием воды и кислорода:
2(Н2О2)
2( Н2О ) + О2
каталаза
с
28.
• Снижениеактивности
ферментов АОС приводит
таким образом к увеличению
АФК и служит причиной
гибели клеток (гемолиза
эритроцитов).
29.
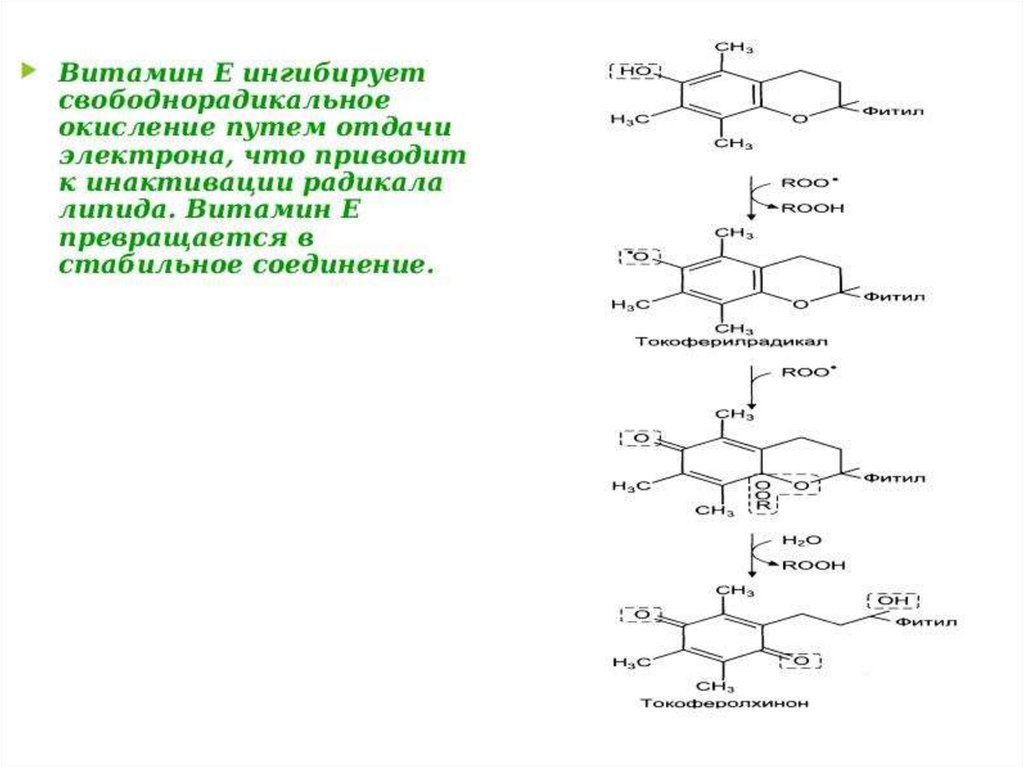
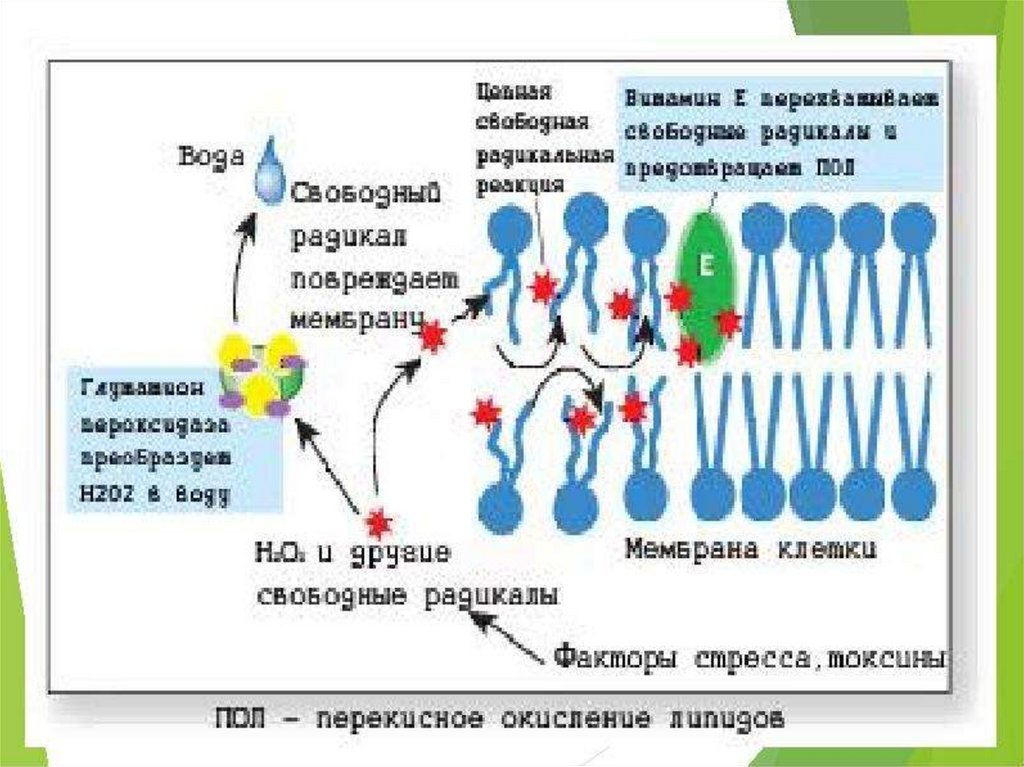
• Естественныеантиоксиданты
30.
31.
По химической природе биоантиокислители представляютсобой широкий класс соединений: ферменты (СОД, каталаза
ГПО), фенолы и полифенолы (токоферолы, пирокатехин,
производные
галловой
кислоты), флавоноиды
(рутин,
кверцетин), стероидные гормоны (лецитин, кефалин ) и многие
другие соединения. В зависимости от растворимости различают
жирорастворимые (витамины Е, А, К, стерины, убихинон ) и
водорастворимые (витамины С, В6, РР, серотонин, SHсодержащие соединения) биоантиокислители.
По молекулярной массе выделяют группу низкомолекулярных
антиоксидантов ( глутатион, аскорбат, каротин, токоферол) и
высокомолекулярных, не способных проникать через биологические
барьеры (это, прежде, ферменты ).
По механизму действия : антиокислители, соединения
антирадикального
действия,
антиоксиданты-ловушки,
антиоксиданты-тушители.
32.
33.
34.
35.
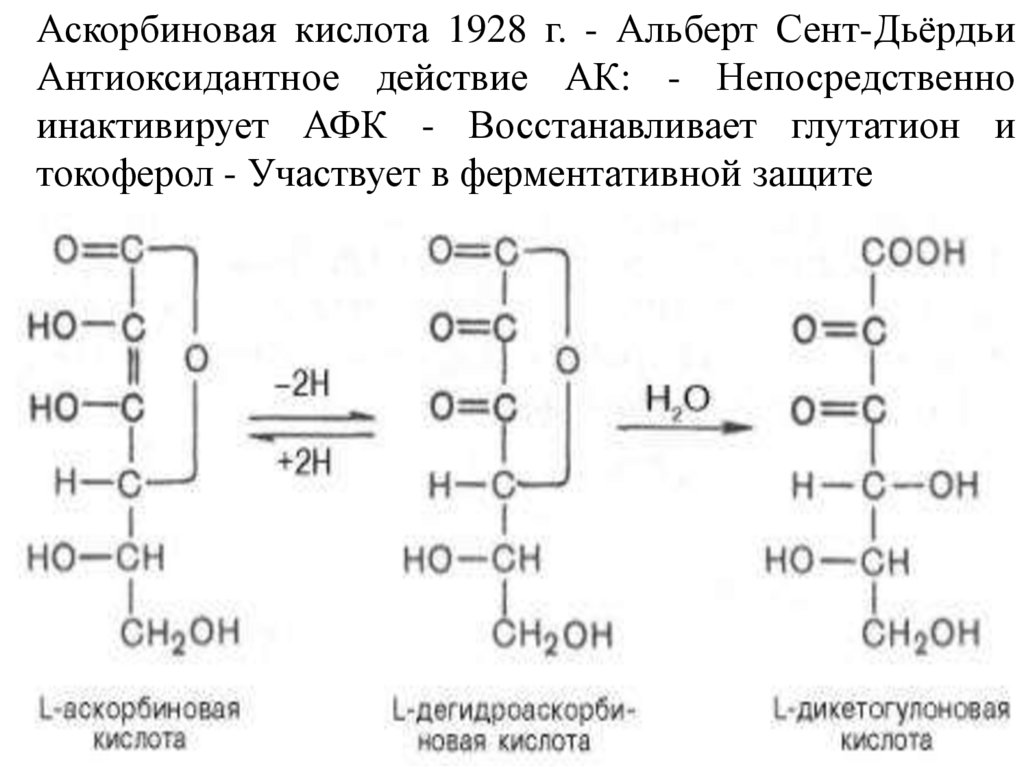
Аскорбиновая кислота 1928 г. - Альберт Сент-ДьёрдьиАнтиоксидантное действие АК: - Непосредственно
инактивирует АФК - Восстанавливает глутатион и
токоферол - Участвует в ферментативной защите
36. Глутатион 1928 г. - Альберт Сент-Дьёрдьи Антиоксидантное действие глутатиона : - Участвует в ферментативной защите -
Глутатион 1928 г. - Альберт Сент-Дьёрдьи Антиоксидантноедействие глутатиона : - Участвует в ферментативной защите Непосредственно инактивирует АФК - Связывает ионы меди,
препятствует образованию гидроксильного радикала
37.
Флавоноиды активны в отношении радикалов,возникающих как в липидной, так и водной фазах,
и ингибируют процессы ПОЛ на стадии
инициации, взаимодействуя с активными формами
кислорода О 2 •‾, Н 2 О 2., RO 2 •, ОН •,
синглетным кислородом и на стадии продолжения
цепи, выступая донорами атомов водорода для
липидных радикалов. Многие
флавоноиды
действую
как
хелаторы
ионов
металлов
переменной валентности и способны тем самым
ингибировать ПОЛ. Также восстанавливают
окисленный
глутатион
и
окисленную
аскорбиновую кислоту.
38.
КаротиныНезамещенные каротиноиды, не содержат
атомов кислорода, являются чистыми
углеводородами
и
обычно
имеют
оранжевый цвет в-каротин
Ксантофиллы
Каротиноиды,
характеризуются
наличием
кислородсодержащих
функциональных
групп, окрашенные в цвета от желтого до
красного зеаксантин
Функции:
антенная,
защитная,
фотопротекторная
39. ВОПРОСЫ?????
1. Что такое АФК?2. Повреждающее действие АФК?
3. Назовите ферменты АОС
эритроцита?
4. Роль ферментов АОС?
5. Природные антиоксиданты и их роль?
40.
Спасибо завнимание!




























 Биология
Биология








