Похожие презентации:
Явления переноса
1. ЯВЛЕНИЯ ПЕРЕНОСА
2.
Явлениями переноса называются процессы,возникающие в системе (газе) при наличии
неоднородности плотности, скоростей
направленного движения отдельных слоёв газа
относительно друг друга, температуры. Это
соответственно: диффузия, внутреннее трение
(вязкость), теплопроводность. Тепловое
движение молекул стремится выровнять
существующие неоднородности, поэтому явления
переноса сопровождаются направленным переносом массы, импульса, внутренней энергии.
3. Длина свободного пробега
Под длиной свободного пробега (λ)понимают путь, проходимый молекулой
между двумя последовательными
столкновениями:
v
Z ,
где < υ > - средняя скорость молекулы,
<Z> — среднее число столкновений,
испытываемых молекулой за секунду.
1
2 d 2 n0
4. ДИФФУЗИЯ
Это явление переноса, возникающее вгазе при наличии в нём неоднородности
плотности и сопровождающееся
направленным переносом массы.
• •
•• •••••••••• •••••••• •••• •• • • • • • • •
ΔS
• ••••• ••••••• •••••••••• ••••••• ••••••••••• •• ••• • •• • • • • • •
••••••••••••••••••••••••••••••••••••••••• ••• ••••• ••••• ••••• • •• •• ••• • • •
•••••• ••• • •••• • •• •••• • ••
• ••••••••••••• ••••••• ••• • ••• • ••••• • • • •• •
Х
•
•••• •• ••••• •••• •••••• ••••• •• • •••••• • •• • •• • • • • • • •
•
•• • •• •• • • •• •• • •• •• • •• • •
• • • •
ρ2
ρ1
ρ1 > ρ2
dρ/dx = grad ρ – градиент плотности
5.
- уравнение диффузииd
dM D
dSdt
или закон Фика
dx
или:
M D
S t
D – коэффициент диффузии x
1
D <υ> <λ>.
3
<υ> - средняя скорость теплового движения
< λ> - средняя длина свободного пробега молекулы
jM = dM / (dS dt) – удельный поток массы – масса, переносимая
d
jM D
dx
в единицу времени через единицу площади
- закон Фика
j D grad
M
6. Внутреннее трение -
Внутреннее трение явление переноса, вызванное неоднородностьюскоростей направленного движения различных
слоёв газа и сопровождающееся направленным
переносом импульса.
Х
dи/dx = grad и
х
и2
и
ΔS
dx
0
и1 > и2
и1
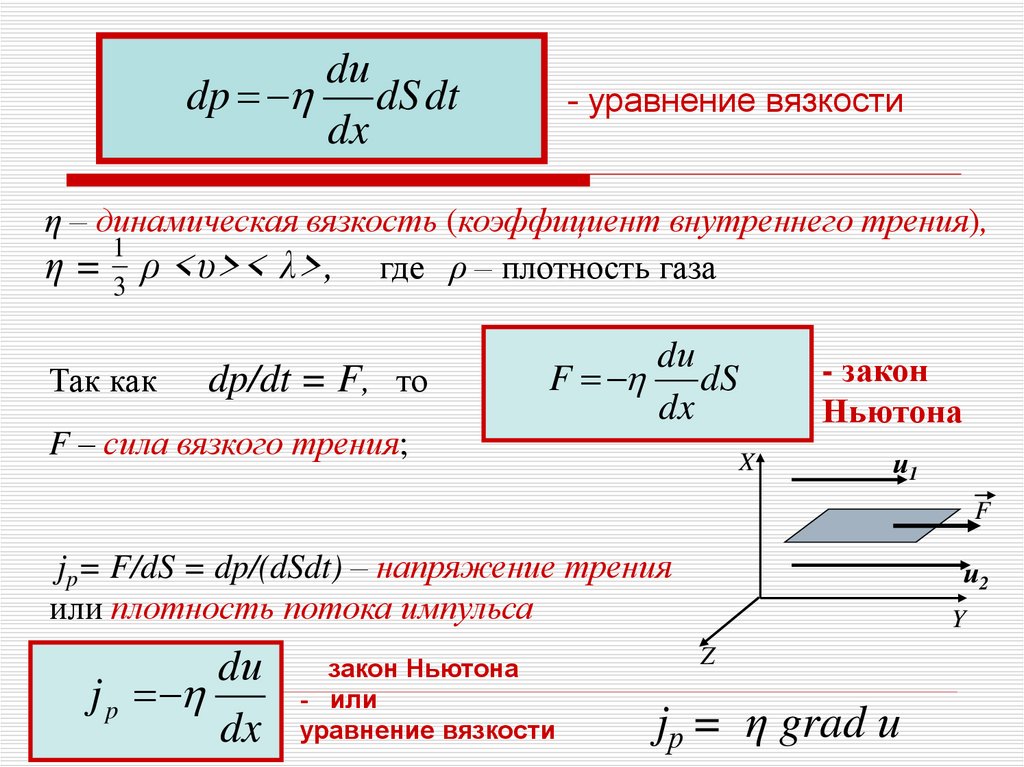
7.
dиdp dS dt
dx
- уравнение вязкости
η – динамическая вязкость (коэффициент внутреннего трения),
1
η = ρ <υ>< λ>, где ρ – плотность газа
3
Так как
dp/dt = F, то
F – сила вязкого трения;
dи
F dS
dx
- закон
Ньютона
X
и1
F
jp= F/dS = dp/(dSdt) – напряжение трения
или плотность потока импульса
dи
j p
dx
закон Ньютона
- или
уравнение вязкости
и2
Y
Z
jр = η grad и
8. Теплопроводность -
Теплопроводность это явление переноса, вызванное неоднородностьютемпературы в объёме газа и сопровождающееся
переносом энергии в форме теплоты.
Т1
ΔЅ
Т2
X
Т1 > Т2
dТ/dx = gradT
9. δQ = - χ dS dt
dTδQ = - χ dx dS dt
- уравнение теплопроводности
(закон Фурье)
χ - коэффициент теплопроводности
1
сv ρ <υ> <λ>
3
сv – удельная теплоёмкость при постоянном объёме
Q
jE
dS dt
- плотность теплового потока
dT
jE
- уравнение теплопроводности
dx
(закон Фурье)
jЕ = χ grad T
10. Анализ коэффициентов переноса
1;
2
2 d n0
р = nokT;
1
D <υ> <λ>.
3
1
η = ρ <υ>< λ>.
3
1
сv ρ <υ> <λ>.
3
8 RT
;
cV
i R
2
<υ>~T1/2, <λ> ~ no-1 ~ p-1;
D ~ T1/2; D ~ 1/p.
<υ>~T1/2, <λ> ~ 1/no ~ 1/p; ρ ~ no;
ρ<λ> ≠ f (p); η ~ T1/2; η ≠ f (p)
cv ≠ f (T,p); ρ<λ> ≠ f (р);
<υ> ~ Т1/2; χ ~ T 1/2;
χ ≠ f (p).
11. Таблица явлений переноса
ЯвлениеДиффузия
Переносимая физи –
ческая величина
Основной закон
явления
Масса
d
dM D
dSdt
dx
d
(ρ ≠ const)
j
M
Внутреннее
трение
(и ≠ const )
Импульс
Теплопроводность
(Т ≠ const )
Внутренняя
энергия
D
Коэффициент
явления переноса
D
1
<υ> λ>.
3
dx
dи
dp dS dt
dx
dи
j p
dx
δQ = - χ dT dS dt
dx
dT
jE
dx
1
ρ<υ><λ>
3
1
сv ρ <υ><λ>
3
12.
Реальныегазы
13. Силы и энергия взаимодействия молекул
Уравнение состояния идеального газа для 1 моль:рV0=RT; (Т=const), при p→∞ V→0, что невозможно!
Радиус молекулы r~10-10м.
Объём молекулы v= ∕3 π r 3 ≈ 4.10-30 м-3
При нормальных условиях концентрация молекул
no=3·1025 м-3, их объём V’ =no. v ≈ 10-4 м-3.
При р=5000 атм V ≈ 2.10-4 м-3 , V’ = 0,5 V объём молекул необходимо учитывать!
14.
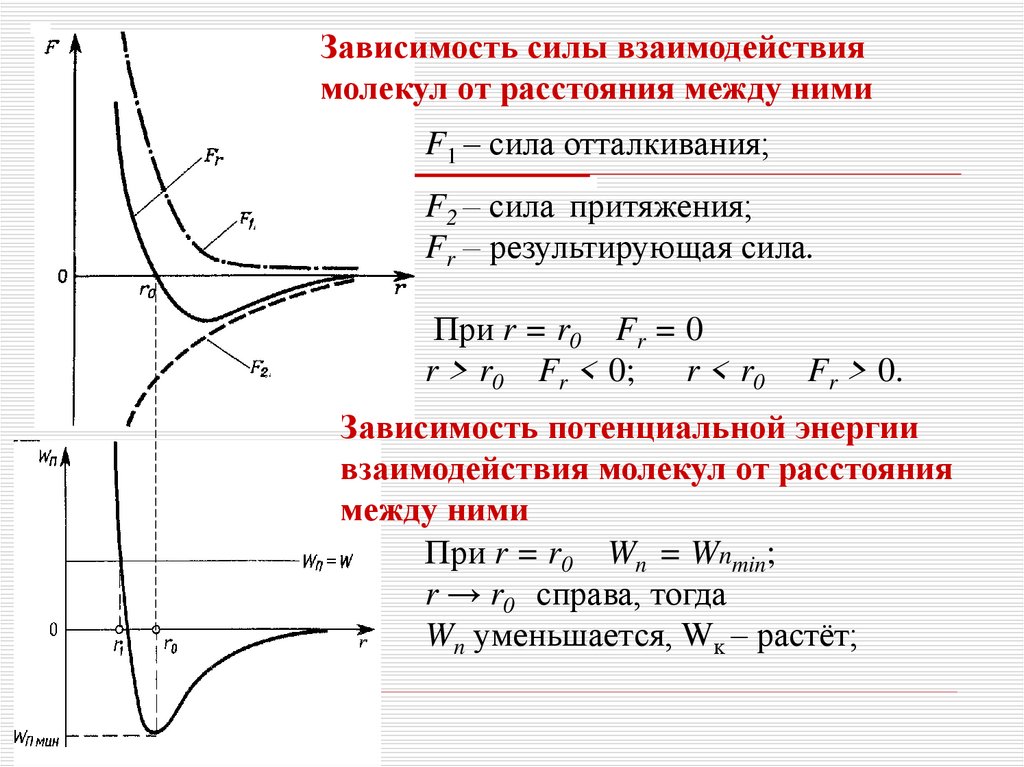
Зависимость силы взаимодействиямолекул от расстояния между ними
F1 – сила отталкивания;
F2 – сила притяжения;
Fr – результирующая сила.
При r = r0 Fr = 0
r > r0 Fr < 0; r < r0
Fr > 0.
Зависимость потенциальной энергии
взаимодействия молекул от расстояния
между ними
При r = r0 Wn = Wnmin;
r → r0 справа, тогда
Wn уменьшается, Wĸ – растёт;
15. Уравнение Ван-дер-Ваальса
pV0=RT; для учёта объёма, занятогомолекулами, произведена замена:
V0 → (V0 - b)
b – поправка Ван-дер-Ваальса на объём, занятый
молекулами.
Согласно расчётам, собственный объём молекул Vo'= ¼ b
Для учёта взаимодействия молекул
введено понятие «внутреннее давление»:
pi = а / V0²
а - поправка Ван-дер-Ваальса на взаимодействие
молекул.
Общее давление: р + рi = р + а / V0²
16. (р + а/V0²)(V0 - b) = RT -
уравнение(р + а/V0²)(V0 - b) = RT - Ван-дер -Ваальса
или уравнение состояния для одного моля реального газа
Для произвольной массы газа заменим:
V = (m / μ) V0 = ν V0,
получим:
или:
a V
( p 2 )( b) RT
V
2
2
m a
m
m
уравнение
(p
)(
V
b
)
RT
Ван-дер -Ваальса
2
2 V
или уравнение состояния реального газа
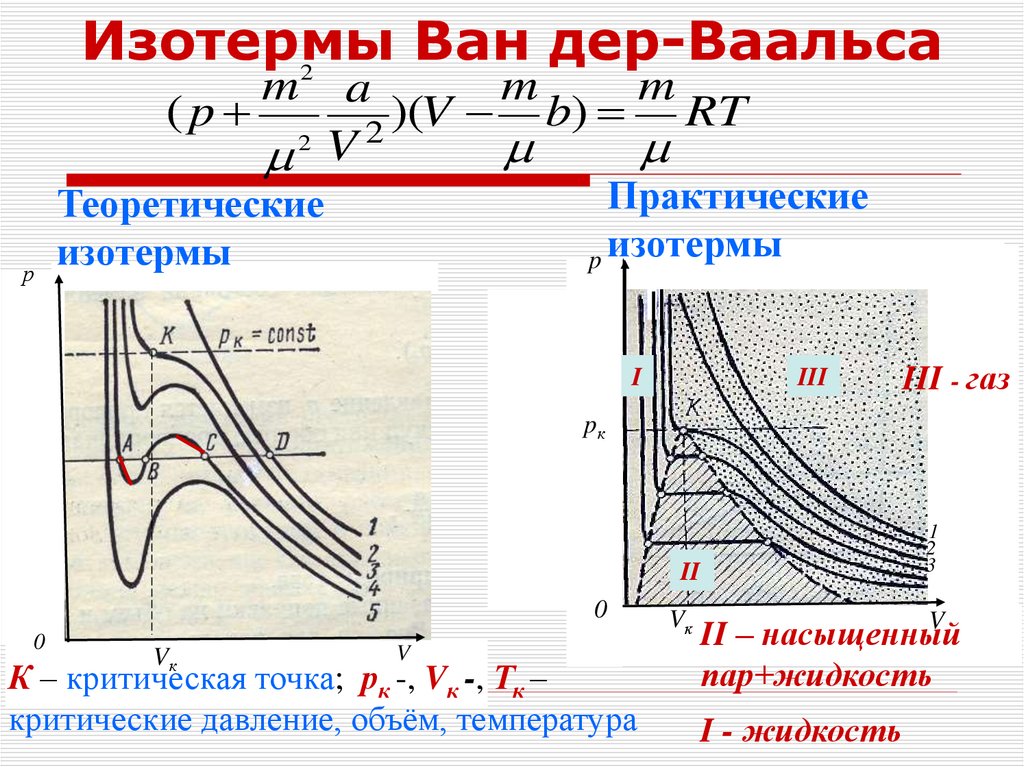
17. Изотермы Ван дер-Ваальса
2m
m
m
a
(p
)(V b) RT
2
2 V
Практические
p изотермы
Теоретические
изотермы
р
I
III
··
·
·
···
·
··
·
III - газ
pк
1
2
3
II
0
0
Vк
V
К – критическая точка; рк -, Vк -, Тк –
критические давление, объём, температура
Vĸ
V
II – насыщенный
пар+жидкость
I - жидкость
18. Внутренняя энергия реального газа
iДля 1 моля идеального газа имели: U = Wк=
RT.
2
Для реального газа:
U р.г. Wк W p
Работа, затрачиваемая на преодоление сил
притяжения
А = dWp = ріdV = (а/V02) dV
a
a
Wn 2 dV
const ,
Для 1 моля
V0
V0
При V → ∞
Wn→ 0,
следовательно const = 0.
Т.об. для 1моля реального газа внутренняя энергия равна
i
a
RT
U p.г.=
2
V0















 Физика
Физика