Похожие презентации:
Современные представления о природе химической связи и строении молекул
1. Современные представления о природе химической связи и строении молекул
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯО ПРИРОДЕ ХИМИЧЕСКОЙ СВЯЗИ
И СТРОЕНИИ МОЛЕКУЛ
2.
Изолированные атомы в природе встречаются очень редко.Чаще всего атомы А реагируют между собой, образуя
молекулу А2. Молекула – это физически устойчивая система из
определенного числа ядер и электронов.
При взаимодействии атомов А и В образуются молекулы
АВ и этот процесс протекает самопроизвольно, т.е. ∆G< 0.
Известно, что ∆G = ∆Н –Т∆S.
В нашем случае из двух частиц образуется одна и в этом
случае ∆S имеет отрицательное значение, но чтобы ∆G была
отрицательной величиной надо, чтобы ∆Н имело
отрицательное значение, т.е. образование химической связи –
это экзотермический процесс. Таким образом, образование
молекул АВ сопровождается понижением полной энергии
системы, т.е. ЕАВ < ЕА + ЕВ
(запас энергии молекулы АВ < суммы энергии исходных
атомов А и В ).
3.
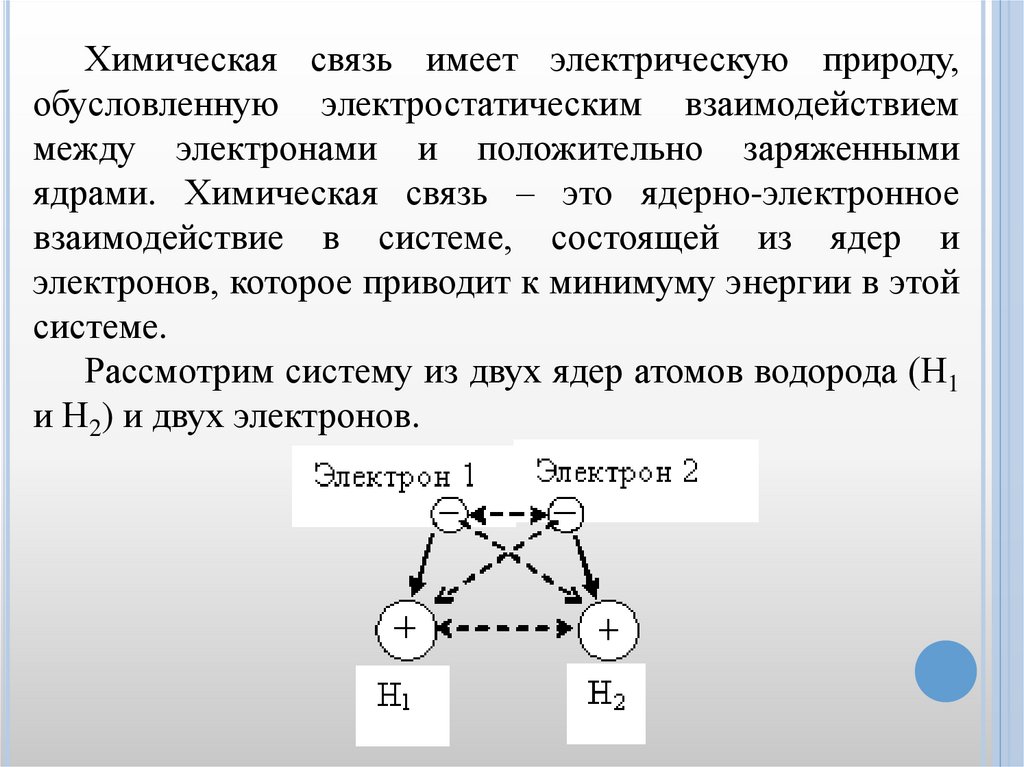
Химическая связь имеет электрическую природу,обусловленную электростатическим взаимодействием
между электронами и положительно заряженными
ядрами. Химическая связь – это ядерно-электронное
взаимодействие в системе, состоящей из ядер и
электронов, которое приводит к минимуму энергии в этой
системе.
Рассмотрим систему из двух ядер атомов водорода (Н1
и Н2) и двух электронов.
4.
Действуют силы:1. Межъядерное отталкивание
2. Силы притяжения;
3. Силы межэлектронного отталкивания.
Химическая связь возникает тогда, когда силы ядерноэлектронного
притяжения
уравновешивают
силы
отталкивания между ядрами. Энергия системы из ядер и
электронов будет зависеть от расстояния между ядрами.
При изменении положения ядер изменяется потенциальная
энергия системы, т.е. потенциальная энергия есть функция
межъядерного расстояния (r ): Епот.= f ( r ). Эта зависимость
изображается графически.
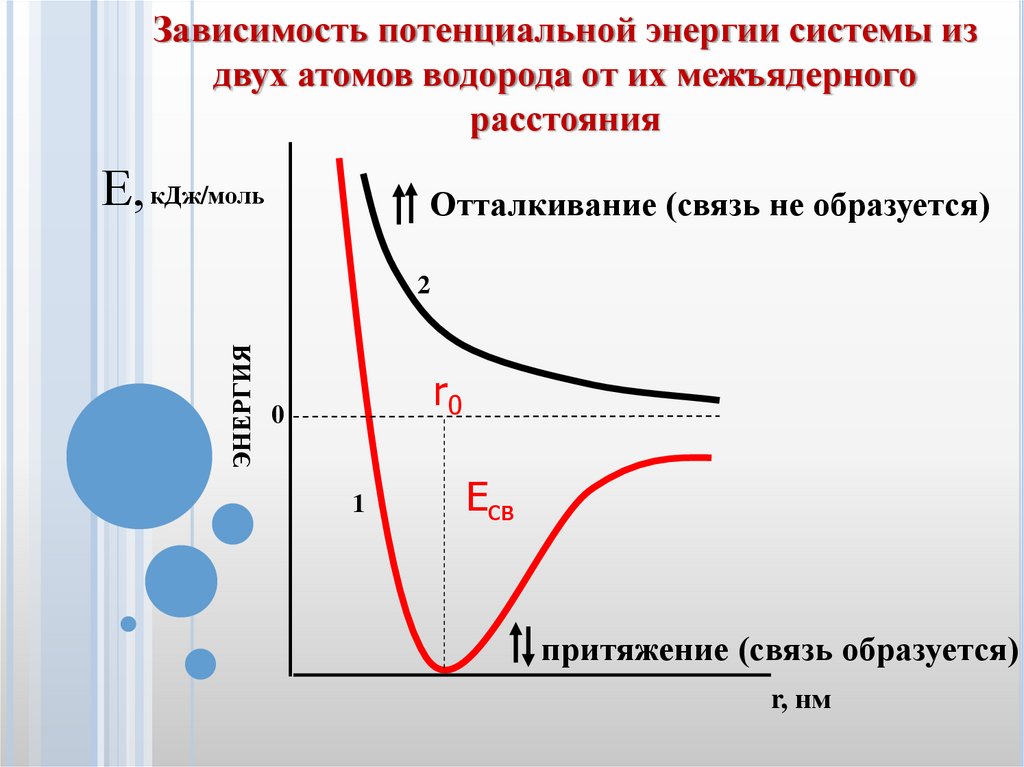
5.
Зависимость потенциальной энергии системы издвух атомов водорода от их межъядерного
расстояния
Е, кДж/моль
Отталкивание (связь не образуется)
ЭНЕРГИЯ
2
r0
0
1
Есв
притяжение (связь образуется)
r, нм
6.
r0 - длина связи – это то расстояние, при которомсилы отталкивания равны силам притяжения; Е связи
– это та энергия, которая выделяется при образовании
химической связи, т.е. минимум потенциальной
энергии.
Химическая связь может образоваться только при
условии, что спины электронов взаимодействующих
атомов антипараллельны (кривая 1). Но электронные
облака с параллельными спинами не способны к
перекрыванию: при сближении они отталкиваются и
связь не образуется (кривая 2).
7.
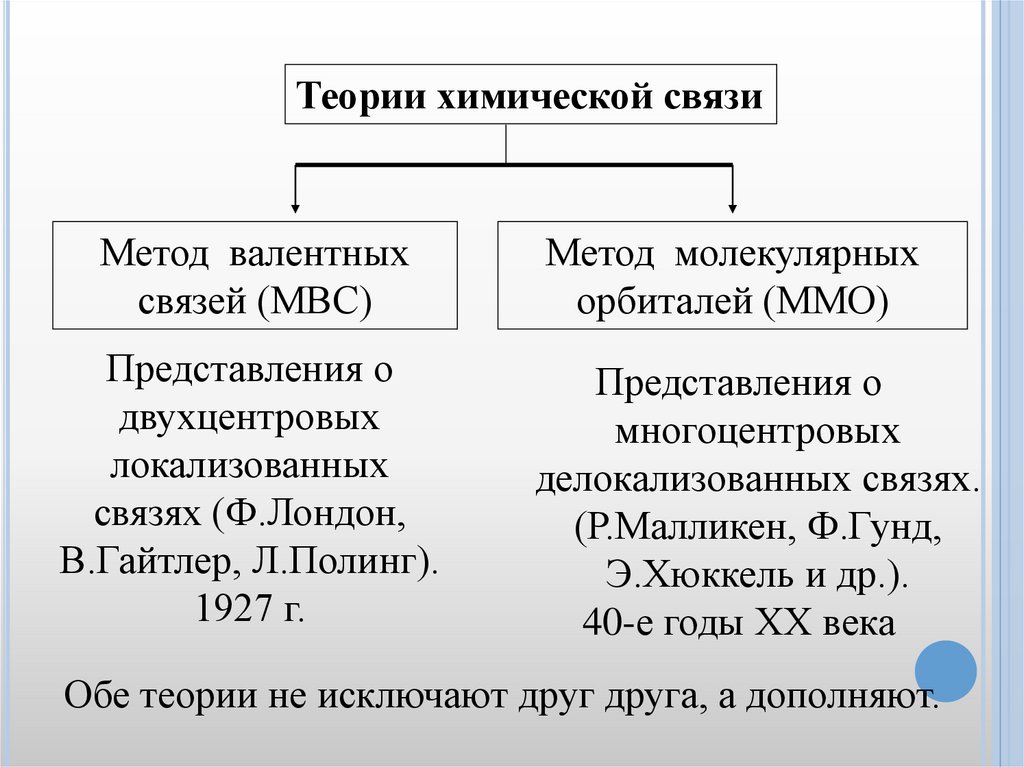
Теории химической связиМетод валентных
связей (МВС)
Метод молекулярных
орбиталей (ММО)
Представления о
двухцентровых
локализованных
связях (Ф.Лондон,
В.Гайтлер, Л.Полинг).
1927 г.
Представления о
многоцентровых
делокализованных связях.
(Р.Малликен, Ф.Гунд,
Э.Хюккель и др.).
40-е годы ХХ века
Обе теории не исключают друг друга, а дополняют.
8.
ОСНОВНЫЕ ЗАДАЧИ1. Теоретическое предсказание вида потенциальных кривых
различных связей (длина, энергия связи)
2. Описание состояния электронов в молекуле и объяснение
свойств молекул.
Без знания типа химических связей невозможно выяснить
патологию на молекулярном уровне.
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ (МВС)
Основные положения.
1. Химическая связь образуется за счет возникновения
общих электронных пар. Одинарная связь образована одной
парой электронов; двойная связь образована двумя парами
электронов. Необходимо иметь в виду, что образование
электронных пар – это не причина образования химической
связи, а условие ее образования. Причина образования
химической связи – это ядерно-электронное взаимодействие.
9.
2. В образовании общих электронных пар участвуюттолько электроны с антипараллельными спинами.
3. При образовании химической связи происходит
перекрывание атомных орбиталей (АО) и в межъядерной
области наблюдается увеличение электронной плотности.
+
Чем в большей степени происходит перекрывание АО, тем
прочнее химическая связь.
4. Если электронные облака перекрываются по линии,
соединяющей центры атомов, то это σ - связь, если вне
линии – то это π - связь.
10.
ss
s
р-p
p
-cвязи
-cвязи
p -p
p-d
d-d
Еσ. > Еπ.
5. Единицей валентности в МВС служит общая электронная
пара. Валентность элемента равна числу неспаренных
электронов или числу общих электронных пар.
Однако, общие электронные пары образуются и по донорноакцепторному механизму.
11.
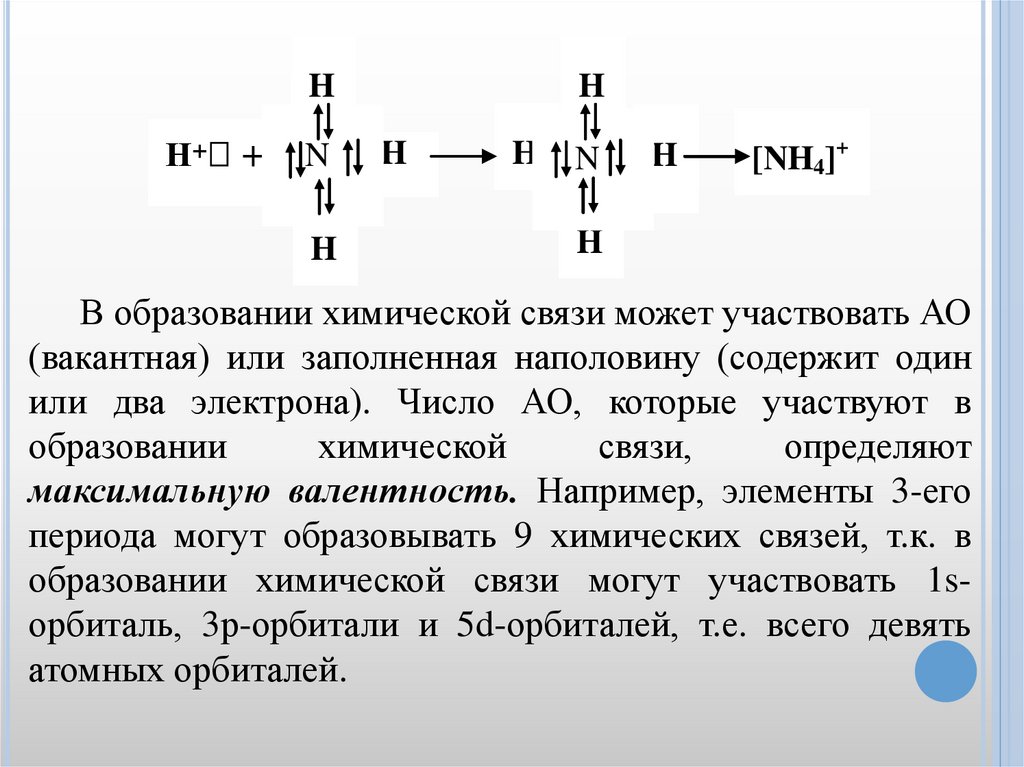
HН+ +
N
H
H
H
H
N
H
[NH4]+
H
В образовании химической связи может участвовать АО
(вакантная) или заполненная наполовину (содержит один
или два электрона). Число АО, которые участвуют в
образовании
химической
связи,
определяют
максимальную валентность. Например, элементы 3-его
периода могут образовывать 9 химических связей, т.к. в
образовании химической связи могут участвовать 1sорбиталь, 3р-орбитали и 5d-орбиталей, т.е. всего девять
атомных орбиталей.
12.
СВОЙСТВА КОВАЛЕНТНОЙ ХИМИЧЕСКОЙ СВЯЗИ.1. ЭНЕРГИЯ СВЯЗИ. Мерой прочности химической связи
является энергия связи – это есть энергия, которую нужно
затратить для разрыва связи. За энергию связи можно
также считать энергию, которая выделяется при
образовании связи. А – В → А + В – Е связи. Энергия
связи измеряется в Дж, кДж. Чем больше энергия связи,
тем прочнее связь. Энергия связи зависит от природы
атомов, образующих связь; от кратности связи между
атомами.
Пример: Н – Н Е = 436 кДж/моль;
Н – Cl Е = 431 кДж/моль;
Cl - Cl Е = 242 кДж/моль.
13.
2. ДЛИНА СВЯЗИ. Длина химической связи – эторасстояние между центрами атомов, образующих
химическую связь между собой, т.е. расстояние между
ядрами двух атомов. Длина связи зависит от природы
атомов, образующих между собой связь и от кратности
связи между атомами. Как правило, с увеличением
энергии связи длина связи уменьшается (в однотипных
соединениях), с увеличением кратности связи длина
связи уменьшается.
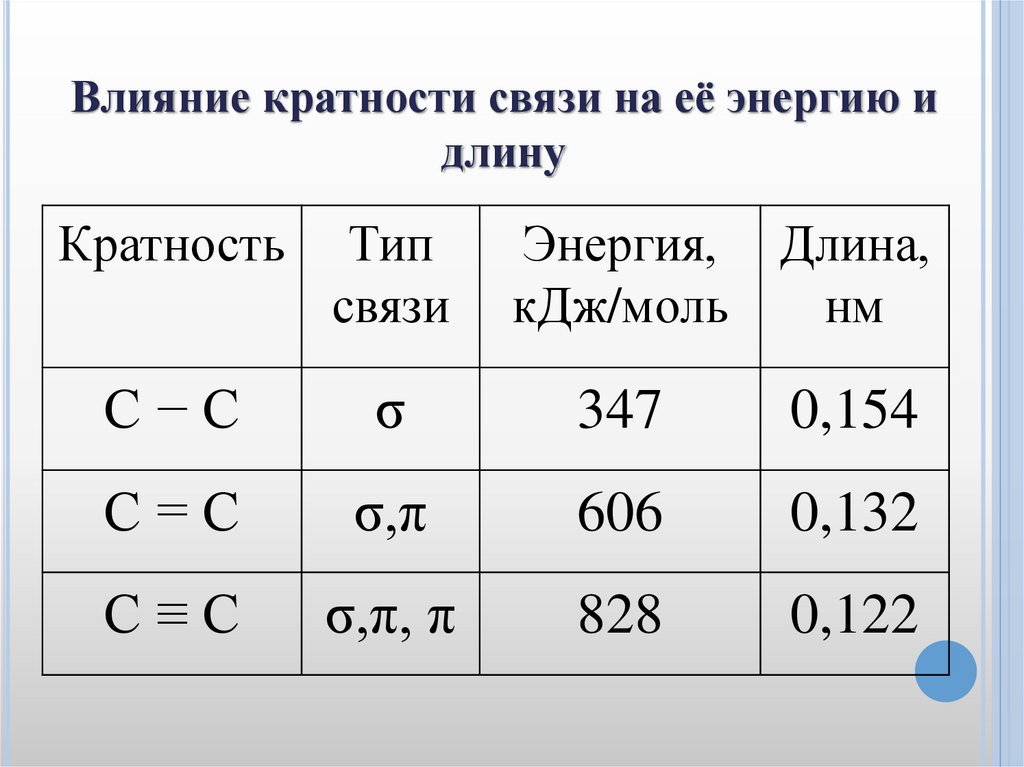
3. КРАТНОСТЬ СВЯЗИ. Определяется числом общих
электронных пар (по МВС). Имеются молекулы, в
которых кратность связи больше единицы. Например, в
молекуле кислорода содержится двойная связь, в
молекуле азота – тройная. С увеличением кратности
связи, как правило, энергия связи увеличивается, а длина
связи уменьшается.
14.
Влияние кратности связи на её энергию идлину
Кратность
Тип
связи
Энергия, Длина,
кДж/моль
нм
С−С
σ
347
0,154
С=С
σ,π
606
0,132
С≡С
σ,π, π
828
0,122
15.
4. НАСЫЩАЕМОСТЬ – это способность данного элементаобразовывать ограниченное число связей с другими
элементами. Для элементов II периода максимальная
насыщаемость равна четырем (1s +3р = 4). Например, при
возбуждении атома углерода электрон с 2s-подуровня
переходит на 2р-подуровень.
h
В результате образуются четыре наполовину заполненные
валентные
орбитали
и
атом
углерода
становится
четырехвалентным, т.к. максимальная насыщаемость его равна
четырем. Для атома элемента серы в 3-ем периоде
максимальная насыщаемость равна шести, т.к. может
образоваться шесть наполовину заполненных валентных
орбиталей (1s +3р + 2d = 6). В этом случае атом серы
становится шестивалентным.
16.
3s3p
3d
3s
3p
3d
Элементы пятых и шестых периодов могут проявлять
валентность равную восьми: 1s+3р+2d+2f =8, где
1s,3p,2d, и 2f –валентные орбитали.
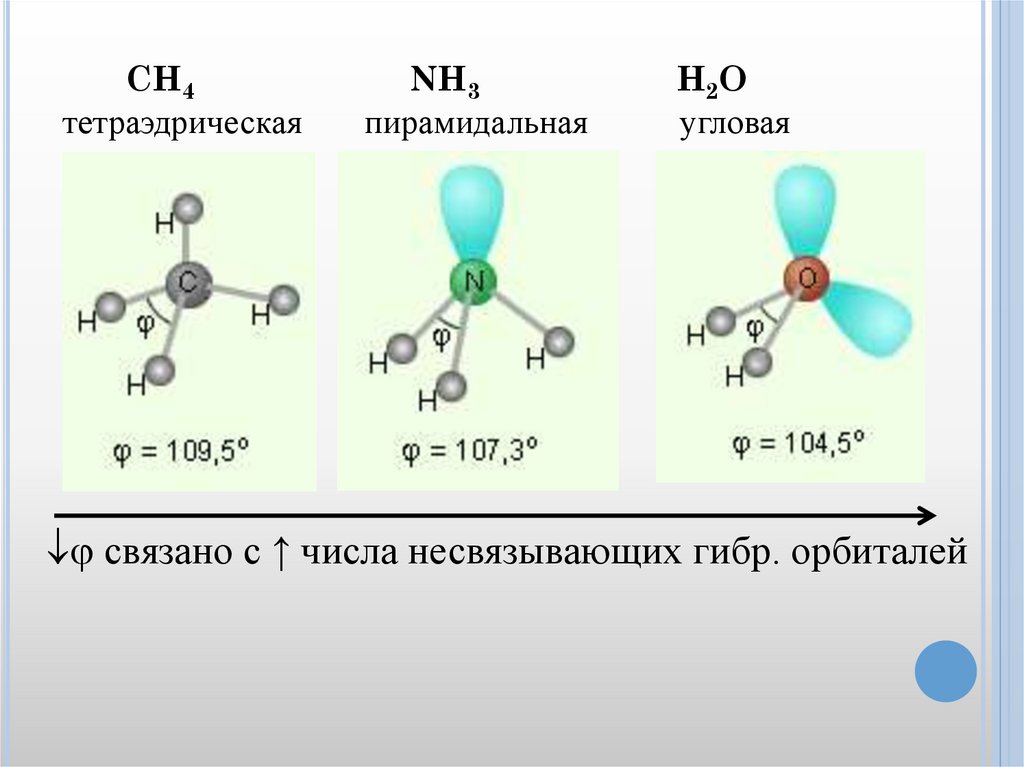
5. НАПРАВЛЕННОСТЬ ковалентной химической
связи. Химическая связь возникает в том направлении,
при котором достигается максимальное перекрывание
АО, приводящее к минимуму полной энергии
системы. Угол, образованный между направлениями
двух связей, носит название валентного угла.
17.
CH4тетраэдрическая
NH3
пирамидальная
H2O
угловая
связано с ↑ числа несвязывающих гибр. орбиталей
18.
6. ПОЛЯРНОСТЬ СВЯЗИ. Если химическая связь образуетсямежду атомами равных размеров и с одинаковой
электроотрицательностью,
то
образуется
неполярная
ковалентная связь (Н:Н). Если электроотрицательности атомов
различны, но не сильно отличаются друг от друга, то
происходит смещение электронной плотности (общей
электронной пары) к более электроотрицательному атому и
образуется полярная ковалентная связь (Н:Cl).
Смещение
электронной
плотности
приводит
к
несовпадению центров положительных и отрицательных
зарядов, молекула поляризуется и принимает характер диполя.
Диполь представляет собой электрически нейтральную
систему с двумя одинаковыми по величине положительными и
отрицательными зарядами, находящимися на определенном
расстоянии (длина диполя) друг от друга.
19.
Полярность молекулы оценивается дипольныммоментом ( μ) : μ = q · ℓ , где q – эффективный заряд, ℓдлина диполя.
Дипольный
момент
молекулы
характеризует
способность молекул ориентироваться в электрическом
поле между положительными и отрицательными
электродами. Дипольный момент выражается в кулон на
метр (Кл⋅м). В качестве единицы измерения используют
также внесистемную единицу измерения дебай D, равную
3,3⋅10-30 Кл⋅м.
Дипольный момент молекулы зависит:
- от полярности связей;
- от геометрии молекулы;
- от наличия неподеленных пар электронов.
20.
Неполярные молекулыМолекула неполярна, если суммарный всех
связей = 0.
1
F
-
Ве
2
2 +
F
-
1 2 0
21.
Полярные молекулы1
+ H
2 -
+ H
S
2
1 2 0
22.
В большинстве химических соединений химическаясвязь сочетает свойства ковалентной и ионной связи.
Поэтому ее можно считать ковалентной с определенной
долей ионности. Степень ионности характеризуется
эффективным зарядом атомов и возрастает с
увеличением разности электроотрицательностей.
7. ПОЛЯРИЗУЕМОСТЬ ковалентной связи – это
смещение электронной плотности в электрическом или
магнитном
поле. Если молекулу А:В поместим в
электрическое
поле,
то
происходит
смещение
электронной плотности или даже разрыв химической
связи. Возможны два случая разрыва химической связи:
гомолитический и гетеролитический.
23.
В случае гомолитического разрыва электронысвязующей пары распределяются по одному между
возникающими
атомами
или
группами
атомов
(радикалами):
При гетеролитическом
разрыве ковалентной
связи оба электрона связующей пары полностью
переходят к одному из возникающих атомов, причем
один из этих атомов приобретает положительный, а
другой – отрицательный электрический заряд:
Поляризуемость связи зависит от заряда атомов,
образующих связь, от размеров атомов и формы
орбиталей.
24.
Гибридизация атомных орбиталей. Для объясненияпространственного строения молекул в МВС используется
концепция гибридизации АО. Под гибридизацией следует
понимать такую комбинацию АО различной форм и энергии
с образованием такого же количества новых, но уже
одинаковых по форме и энергии гибридных орбиталей.
Гибридная орбиталь в большей степени вытянута по одну
сторону от ядра, чем по другую, поэтому степень ее
перекрывания с орбиталью другого атома больше, а значит
гибридная орбитель образует более прочную связь по
сравнению с негибридными орбиталями. Таким образом, в
образовании химических связей участвуют не только
исходные s-, p-, d- орбитали, но и гибридные АО, которые
образуются из исходных АО.
25.
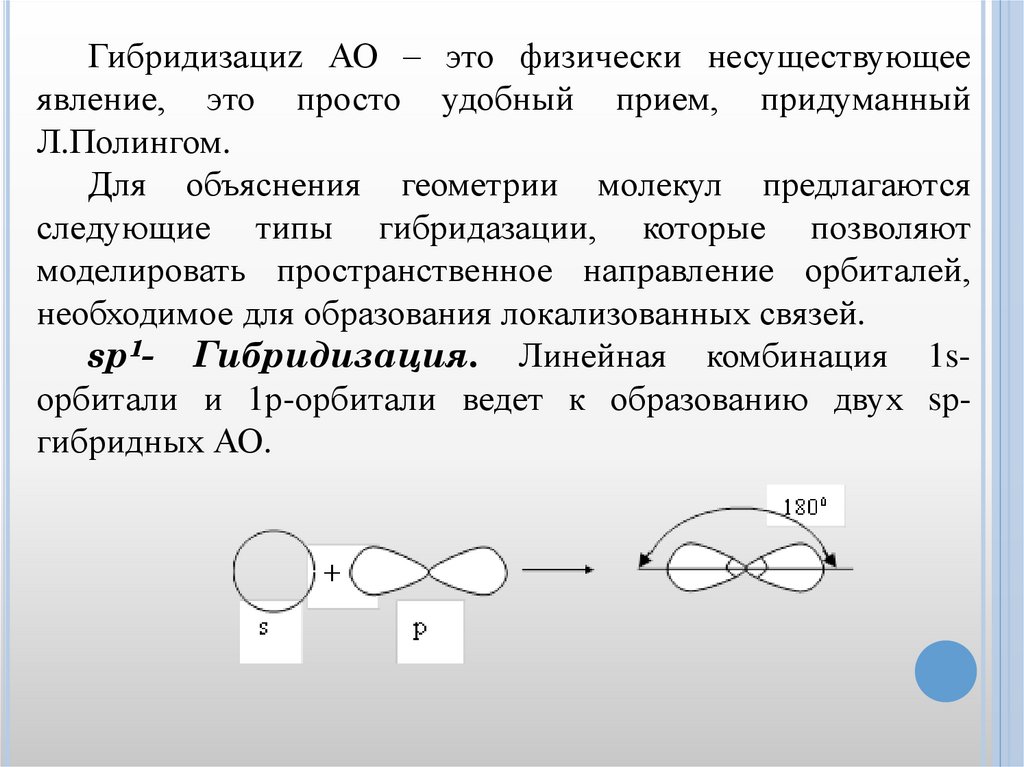
Гибридизациz АО – это физически несуществующееявление, это просто удобный прием, придуманный
Л.Полингом.
Для объяснения геометрии молекул предлагаются
следующие типы гибридазации, которые позволяют
моделировать пространственное направление орбиталей,
необходимое для образования локализованных связей.
sp1- Гибридизация. Линейная комбинация 1sорбитали и 1р-орбитали ведет к образованию двух sргибридных АО.
26.
Два гибридных sр-облака в результате взаимногоотталкивания располагаются относительно ядра атома под
углом 1800. В результате такого расположения гибридных
облаков молекулы состава АВ2 имеют линейную
конфигурацию, т.е. ядра всех взаимодействующих атомов
располагаются на одной прямой. Линейную конфигурацию
имеют молекулы ВеСl2, BeBr2, ZnCl2, CO2 и др.
Be
Cl
Cl
sp2-Гибридизация. Это гибридизация одной sорбитали и двух р-орбиталей. В результате комбинации трех
исходных орбиталей возникают три гибридные sp2 –
орбитали. Они располагаются в одной плоскости под углом
1200 друг к другу. Происходит выравнивание электронных
облаков.
27.
1200+
+
1200
1200
Соединения бора, ионы СО2-3, NO-3 , имеют строение в
виде плоского треугольника с валентными углами 1200. Это
позволяет предположить sр2-гибридизацию атомов бора,
углерода, азота.
sp3-Гибридизация. Образуется в результате линейной
комбинации одной s-орбитали и трех р-орбиталей. Четыре
sр3-гибридные орбитали располагаются под углом 109028ʹ
друг к другу. Они направлены к вершине тетраэдра, в центре
которого находится ядро атома углерода.
28.
++
+
Молекулы СН4, NH3, H2O, CCl4, CF4, SiH4, SiBr4, ионы –
SO42-, ClO4-, PO43- и т.д. имеют одинаковое пространственное
(тетраэдрическое) расположение связей. Этот факт можно
объяснить sр3- гибридизацией атомных орбиталей.
Гибридизация (смешивание) s-, px-, py-, pz и dz2- АО дает
пять sp3d –гибридных орбиталей, расположение которых в
пространстве соответствует тригональной бипирамиде. Такое
строение имеет PCl5.
Смешивание s-, px-, py-, pz ,dz2 и dx2- y 2- АО дает шесть sp3d2
–гибридных орбиталей, направленных к вершинам октаэдра.
Такое строение имеет SF6.
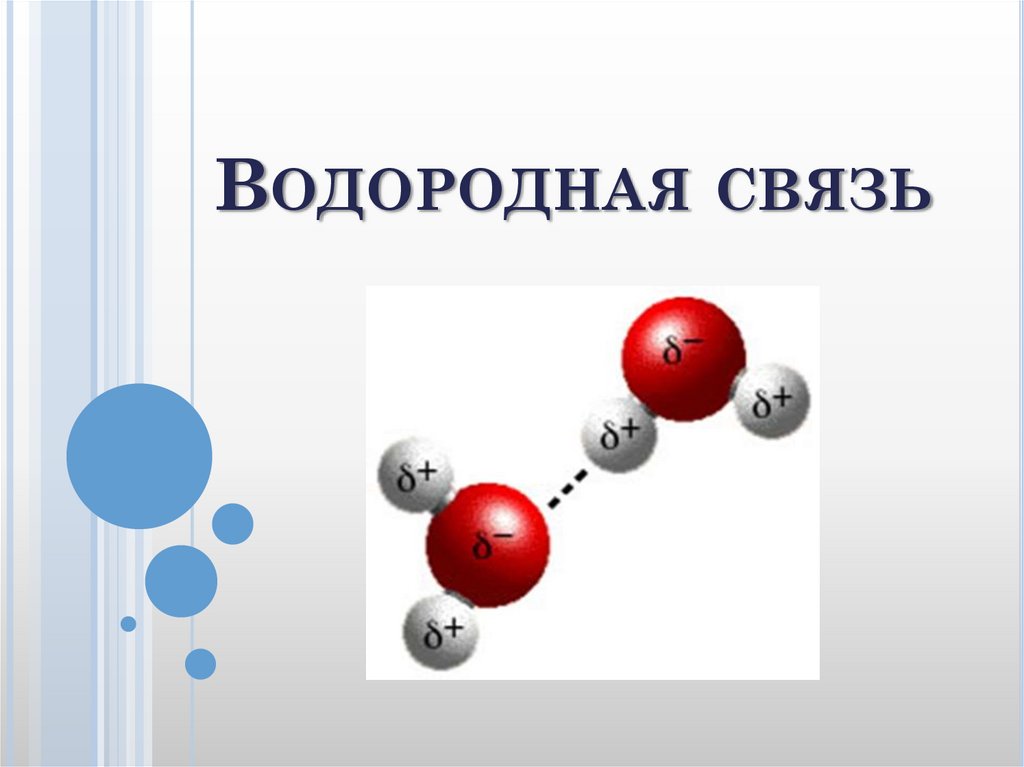
29. Водородная связь
ВОДОРОДНАЯ СВЯЗЬ30.
Водородная связь осуществляется между положительнополяризованным атомом водорода одной молекулы и
отрицательно поляризованным атомом другой молекулы:
X H ... X
где: Х – атом одного из наиболее электроотрицательных
элементов – F, O, N, реже Cl, S. Водородная связь обозначается
тремя точками. Если водородная связь образуется между
разными молекулами, то она называется межмолекулярной,
если связь образуется между двумя группами атомов одной и
той же молекулы, то она называется внутримолекулярной.
Например, межмолекулярная водородная связь возникает
между молекулами фтороводорода и молекулами воды.
31.
При возникновении межмолекулярных водородных связейобразуются димеры, тримеры или полимерные структуры:
Образование межмолекулярных водородных связей
приводит к изменению свойств веществ: повышению
вязкости, диэлектрической постоянной, температур
плавления и кипения. С помощью межмолекулярной
водородной связи соединены цепи нуклеиновых
кислот, образующих двойную спираль. Здесь имеются
два типа связей между нуклеиновыми основаниями
N–H⋯N и
N–H⋯O
32.
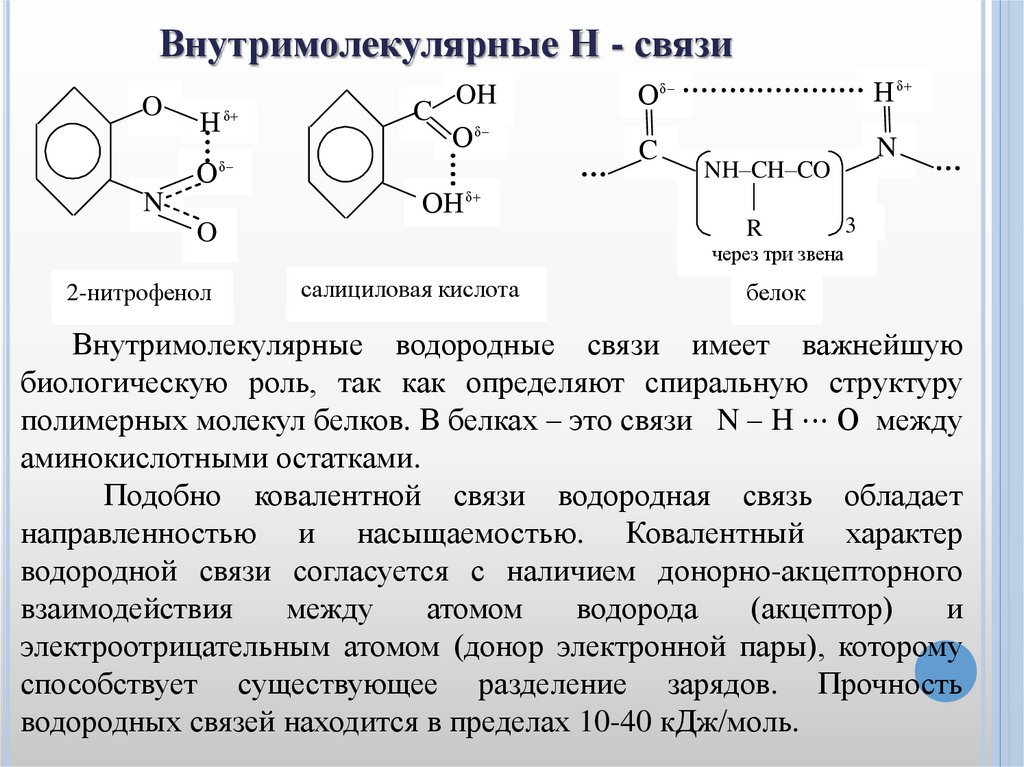
Внутримолекулярные Н - связиO
Н δ
О
N
C
OH
Оδ
Н δ
Оδ
C
N
δ
ОН δ
O
2-нитрофенол
NH–CH–CO
3
R
через три звена
салициловая кислота
белок
Внутримолекулярные водородные связи имеет важнейшую
биологическую роль, так как определяют спиральную структуру
полимерных молекул белков. В белках – это связи N – H ⋯ О между
аминокислотными остатками.
Подобно ковалентной связи водородная связь обладает
направленностью и насыщаемостью. Ковалентный характер
водородной связи согласуется с наличием донорно-акцепторного
взаимодействия
между
атомом
водорода
(акцептор)
и
электроотрицательным атомом (донор электронной пары), которому
способствует существующее разделение зарядов. Прочность
водородных связей находится в пределах 10-40 кДж/моль.
33.
Межмолекулярное взаимодействиеМежмолекулярное взаимодействие отличается от
химического тем, что оно проявляется на значительно
больших расстояниях и характеризуется отсутствием
насыщаемости и специфичности, небольшими энергиями.
Действие именно этих сил проявляется при расширении
газов, конденсации, адсорбции, растворении и других
процессах. Эти силы представляют собой взаимодействия
нескольких типов, но их объединяют под общим
названием
ван-дер-ваальсовы
силы
в
честь
голландского физика Д.Д. Ван-дер-Ваальса, впервые
постулировавшего существование сил притяжения,
действующих между атомами и молекулами.
34.
Как и силы связи между атомами, ван-дер-ваальсовы силыимеют электрическую природу. Они обусловлены полярностью
и поляризуемостью молекул. Различают три типа
межмолекулярного взаимодействия.
1. ОРИЕНТАЦИОННОЕ ВЗАИМОДЕЙСТВИЕ (или дипольдипольное) взаимодействие проявляется между полярными
молекулами (постоянными диполями). К полярным молекулам
относят и соединения с ионной связью, т.к. они отличаются
только степенью полярности. При сближении полярные
молекулы
ориентируются
относительно
друг
друга
противоположно заряженными концами диполей. Возможно
как осевое расположение диполей (а), так и боковое
притяжение диполей (б).
35.
С увеличением полярности молекул усиливаетсяпритяжение
молекул
и
больше
ориентационное
взаимодействие. При повышении температуры, а также в
газовой фазе начинает преобладать энергия теплового
движения и взаимодействие диполь-диполь не происходит.
2. ИНДУКЦИОННОЕ ВЗАИМОДЕЙСТВИЕ между полярной и
неполярной молекулами: первая деформирует электронное
облако второй. В результате у неполярной молекулы возникает
временный электрический момент диполя, а затем обе
молекулы взаимодействуют как диполи. Этот вид
взаимодействия проявляется
а главным образом в растворах
б
полярных соединений в неполярных растворителях.
36.
Индукционное взаимодействие практически не зависитот температуры, а зависит от дипольного момента
молекулы и поляризуемости молекул.
3. ДИСПЕРСИОННОЕ ВЗАИМОДЕЙСТВИЕ обусловлено
взаимодействием между двумя неполярными молекулами
за счет возникновения их мгновенных микродиполей.
37.
Именнодисперсионное
взаимодействие
способствует сжижению и кристаллизации веществ,
состоящих
из
неполярных
и
с
трудом
поляризующихся молекул (N2, H2 и др.) или из
отдельных атомов инертных газов.
Энергия связи межмолекулярного взаимодействия
на 2-3 порядка меньше (она редко превышает 4-5
кДж/моль), чем энергия ковалентной связи.
Межмолекулярные
взаимодействия
играют
существенную роль в стабилизации белков,
полисахаридов и нуклеиновых кислот.
38. Метод молекулярных орбиталей (ММО).
МЕТОДМОЛЕКУЛЯРНЫХ
ОРБИТАЛЕЙ (ММО).
39.
Основные положения1. При образовании молекулы электронные облака атомов
перекрываются, атомные орбитали «перемешиваются», и из
них получаются новые, молекулярные орбитали (МО). В
образовании молекулы участвуют не только валентные
электроны, а происходит обобществление всех электронов.
Электроны вращаются по многоцентровым молекулярным
орбиталям сложных молекул.
2. МО – это объем пространства в поле нескольких ядер, где
вероятность нахождения электронов составляет 90-95%.
3. Для получения МО используют метод линейной комбинации
атомных орбиталей МЛКАО. Из двух АО разных атомов
образуется две МО:
а) связывающая, которая характеризуется меньшим
запасом энергии по сравнению с запасом энергии АО;
б) разрыхляющая – с большим запасом энергии.
40.
Наличие электрона на связывающей орбитали приводит купрочнению химической связи, а на разрыхляющей – к
ослаблению ее, вплоть до полного разрыва. На связывающей
орбитали электронная плотность сосредоточена между атомами;
на разрыхляющей – за атомами. Перекрываются s-орбитали всегда
по линии, соединяющей ядра атомов. Возникающие при этом
молекулярные орбитали обозначают буквой σ, а соответствующую
химическую связь называют σ-связью.
4. Электроны заполняют молекулярные орбитали, как и
атомные орбитали в порядке возрастания энергии, при этом
соблюдается принцип запрета Паули и правило Гунда.
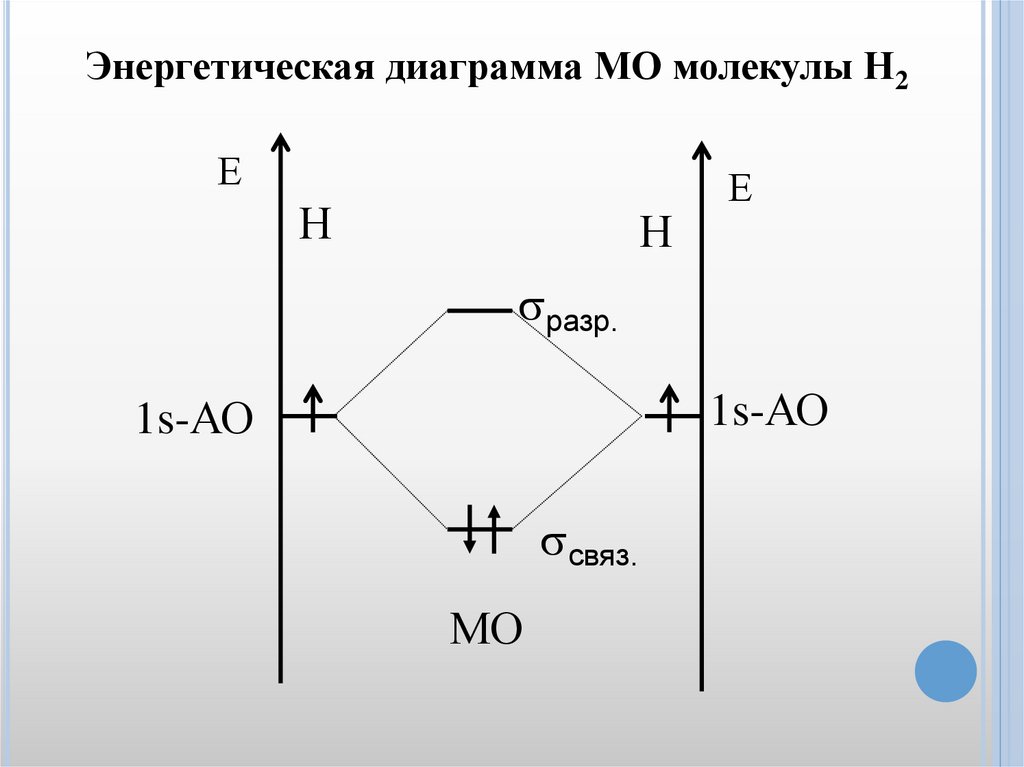
5. Число МО равно сумме АО соединяемых атомов. Например,
когда молекула водорода образуются из двух атомов при
перекрывании двух атомных s-орбиталей возникают две
молекулярные орбитали: связывающая (σсвяз) и разрыхляющая
(σразр.)
41.
Энергетическая диаграмма МО молекулы Н2Е
Н
Н
Е
разр.
1s-АО
1s-АО
связ.
МО
42.
6. Химическая связь в ММО характеризуется энергиейи порядком связи (n). Порядок связи равна половине
разности электронов на связывающих (Nсв.) и
разрыхляющих (Nр ) молекулярных орбиталях.
n
N св. N р
2
Если число Nсв.= Nр, то n = 0 и молекула не образуется.
С увеличением n в однотипных молекулах растет энергия
связи. В отличие от метода валентных связей в ММО
допускается, что химическая связь может быть образована
не только парой электронов, но и одним электроном и
соответственно порядок связи может быть не только
целым, но и дробным числом: n = 1/2 , 1, 3/2 , 2 ….
43.
Энергетические диаграммы молекул имолекулярных ионов.
С позиций ММО можно объяснить существование довольно
прочного
молекулярного
иона Не2+ и
невозможность
существования прочной двухатомной молекулы Не2. В первом
случае из трех имеющихся в этой системе 1s-электронов два
поступают на связывающую молекулярную орбиталь σсв. а третий
(размещение которого на этой орбитали согласно принципу Паули
невозможно) – на разрыхляющую орбиталь σразр.
44.
Поэтому возникает химическая связь с кратностью 1/2 . Вовтором случае из четырех электронов в системе Не +Не два
поступают на связывающую молекулярную орбиталь, а два на
разрыхляющую и в этом случае химическая связь не возникает.
Сравнительная характеристика методов МВС и ММО.
Метод валентных связей относительно прост и нагляден и
позволяет
предсказывать
свойства
многих
молекул
(пространственная конфигурация, полярность, энергия и длина
связей). Однако, свойства некоторых молекул и ионов МВС
объяснить не в состоянии. Согласно МВС условием образования
химической связи является образование электронных пар, но
существуют свободные радикалы, молекулярные ионы (Н2+, Не2+ ,
О2-), которые имеют неспаренные электроны. Согласно МВС
молекула О2 не имеет неспаренных электронов, но молекула О2
парамагнитна, а значит имеет неспаренные электроны и
втягивается в магнитное поле.
45.
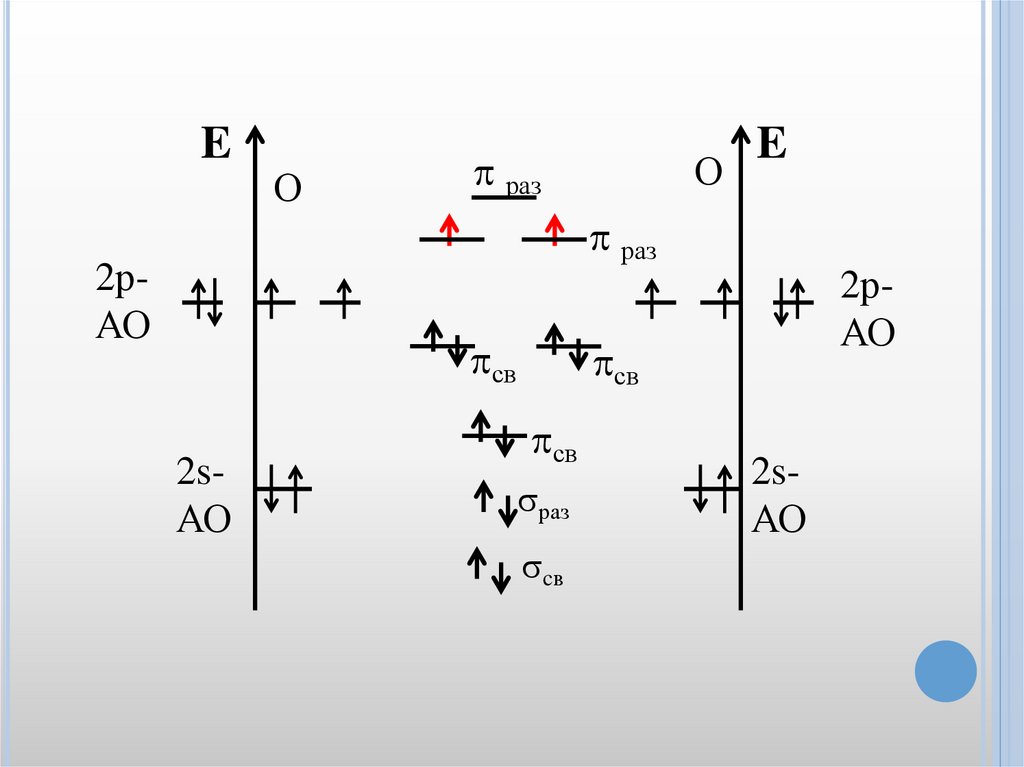
Методмолекулярных
орбиталей
позволяет объяснить ряд явлений и
фактов, непонятных с точки зрения
метода валентных связей. Например, из
энергетической диаграммы молекулы
кислорода в ММО видно, что молекула
кислорода имеет два неспаренных
электрона
и,
следовательно,
она
парамагнитна.
46.
E2рАО
О
раз
раз
св
2sАО
О
E
2рАО
св
св
раз
cв
2sАО
47.
ММО имеет общий подход приописании
всех
химических
соединений, но он ненагляден и
не объясняет геометрии молекул.
Выбор
метода
определяется
объектом
исследования
и
поставленной задачей.




































 Химия
Химия








