Похожие презентации:
Химическая связь и строение молекул
1. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Лекция 3:Ковалентная связь
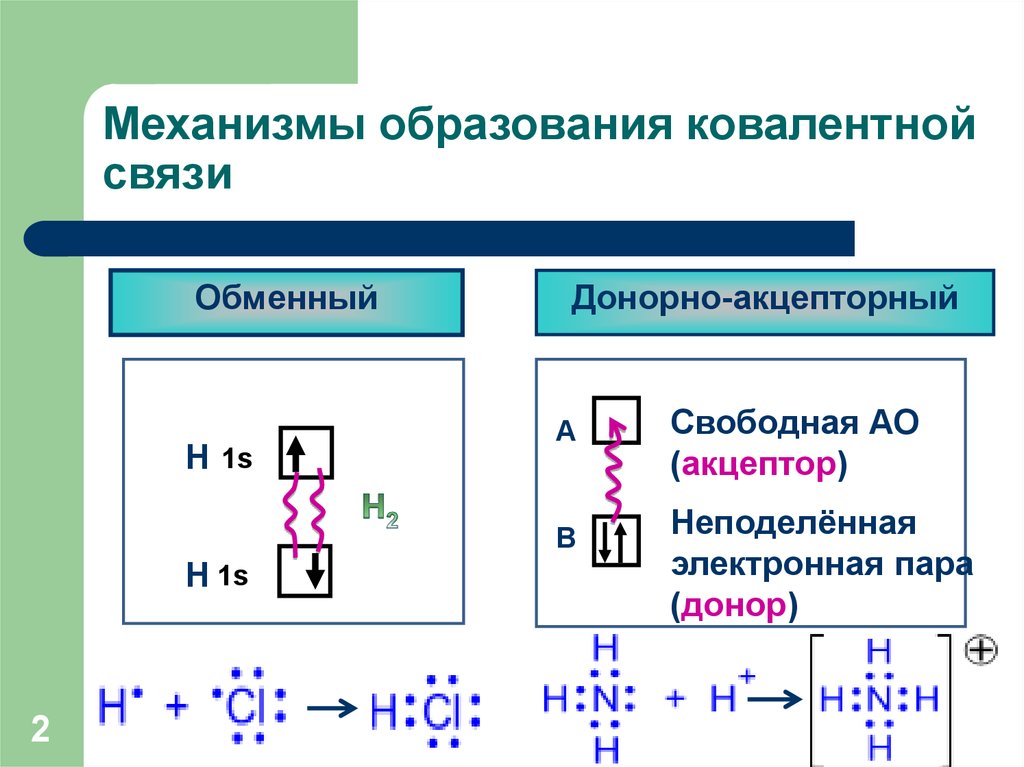
2. Механизмы образования ковалентной связи
ОбменныйН 1s
Донорно-акцепторный
А
В
Н 1s
2
Свободная АО
(акцептор)
Неподелённая
электронная пара
(донор)
3. Пример I: образование ковалентной связи в молекуле N2
Состав сухого воздуха на уровне моряГаз
Содержание,
%об.
Газ
Содержание,
%об.
N
2р
2s
N
2р
2s
Есвязи NΞN = 941,4 кДж/моль
3
Есвязи N―N = 193 кДж/моль
4. Пример II: образование ковалентной связи в молекуле СО
2рО
2s
С
2р
2s
4
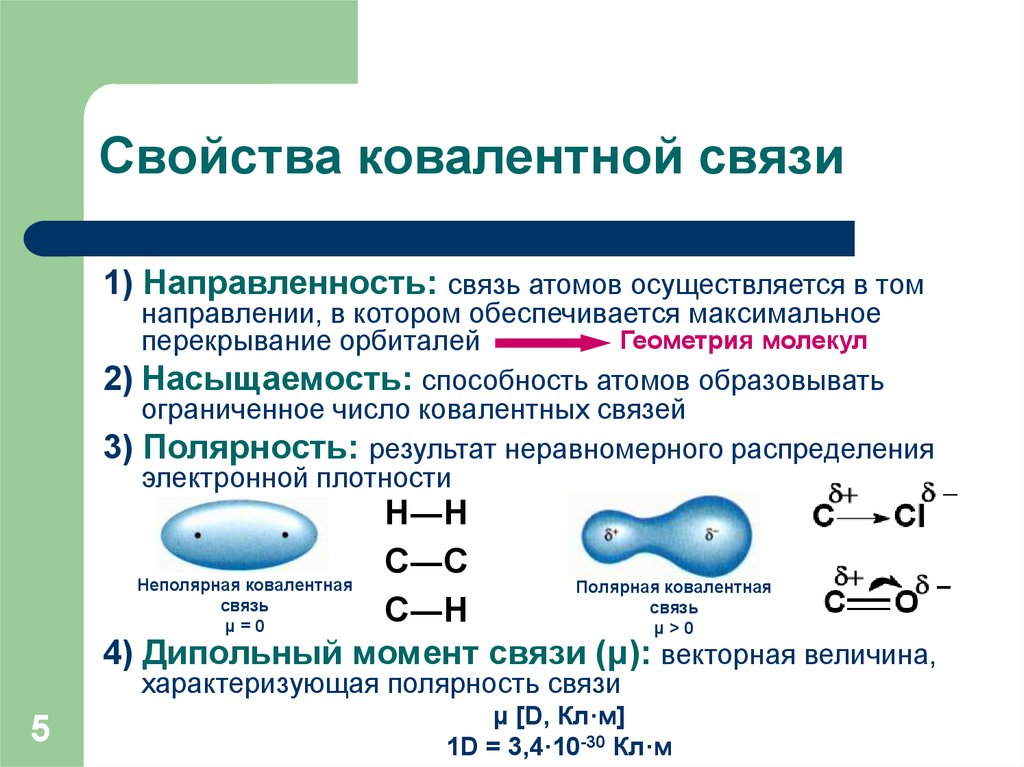
5. Свойства ковалентной связи
1) Направленность: связь атомов осуществляется в томнаправлении, в котором обеспечивается максимальное
Геометрия молекул
перекрывание орбиталей
2) Насыщаемость: способность атомов образовывать
ограниченное число ковалентных связей
3) Полярность: результат неравномерного распределения
электронной плотности
Н―Н
С―С
Неполярная ковалентная
Полярная ковалентная
связь
связь
С―Н
μ=0
μ>0
4) Дипольный момент связи (μ): векторная величина,
характеризующая полярность связи
5
μ [D, Кл·м]
1D = 3,4·10-30 Кл·м
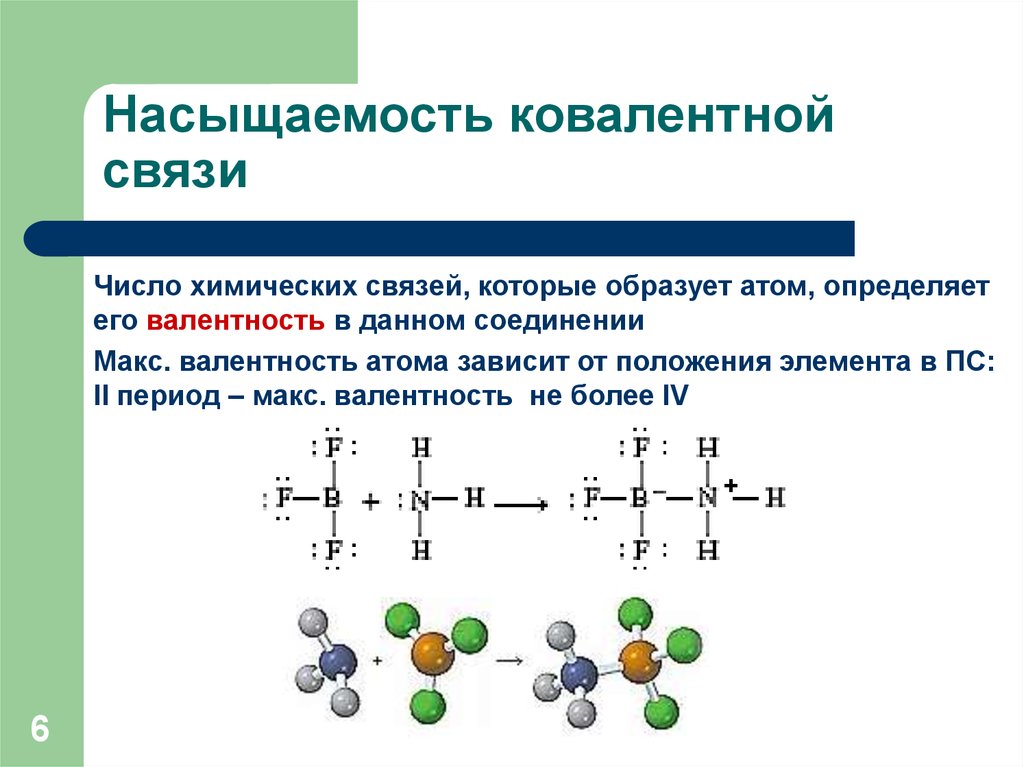
6. Насыщаемость ковалентной связи
Число химических связей, которые образует атом, определяетего валентность в данном соединении
Макс. валентность атома зависит от положения элемента в ПС:
II период – макс. валентность не более IV
+
6
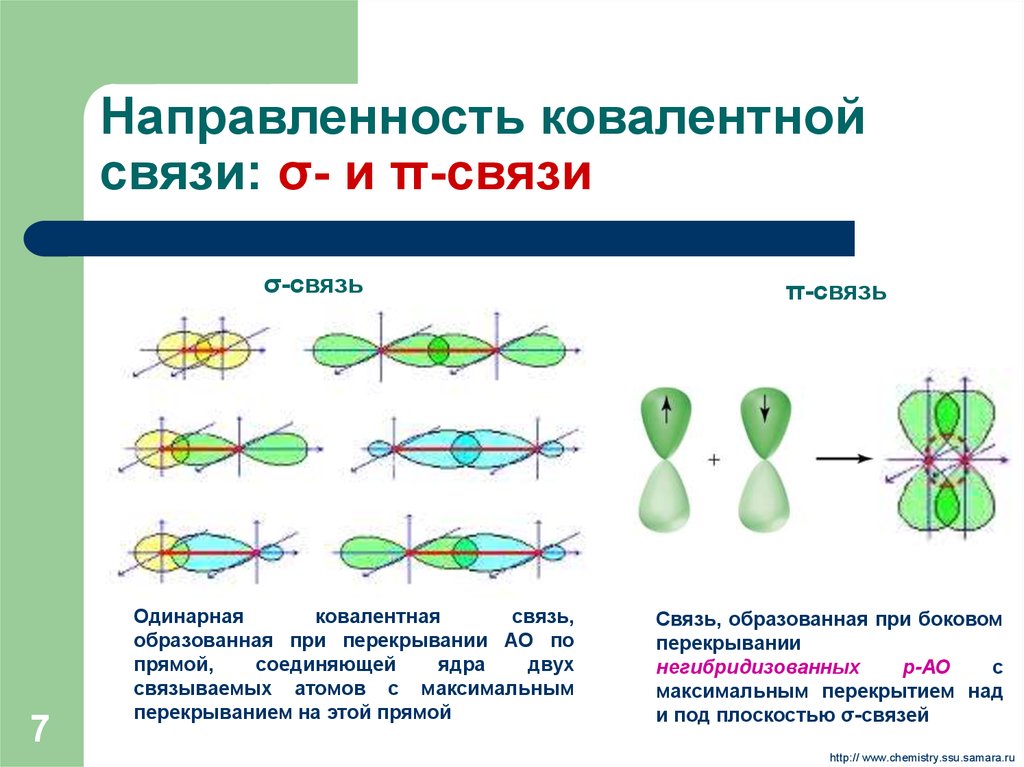
7. Направленность ковалентной связи: σ- и π-связи
σ-связь7
Одинарная
ковалентная
связь,
образованная при перекрывании АО по
прямой,
соединяющей
ядра
двух
связываемых атомов с максимальным
перекрыванием на этой прямой
π-связь
Связь, образованная при боковом
перекрывании
негибридизованных
р-АО
с
максимальным перекрытием над
и под плоскостью σ-связей
http:// www.chemistry.ssu.samara.ru
8. Примеры молекул, содержащих кратные связи
πσ
σ
σ
σ σ
σ π
σ
π
σ
π
σ
σ
π
π
этилен С2Н4
8
ацетилен С2Н2
9. Геометрия молекул: Теория отталкивания электронных пар валентных орбиталей (ОЭПВО)
Молекула принимает форму, при которойотталкивание внешних электронных пар вокруг
центрального атома минимально
1)
2)
9
Конфигурация связей многовалентного атома
обуславливается исключительно числом связывающих и
несвязывающих пар в валентной оболочке центрального
атома.
Ориентация облаков электронных пар валентных
орбиталей определяется максимальным взаимным
отталкиванием заполняющих их электронов.
10. Некоторые правила для ОЭПВО
• Атомы связываются так, чтобы сформироватьоктет
• Связывающие электронные пары занимают
меньше пространства, чем несвязывающие
• Силы отталкивания уменьшаются в ряду:
Неподеленная
электронная пара
vs.
неподеленная
электронная пара
10
>
Неподеленная
электронная пара
vs.
связывающая
электронная пара
>
Связывающая
электронная пара
vs.
связывающая
электронная пара
• С двойными и тройными связями обращаются
также, как с одинарными
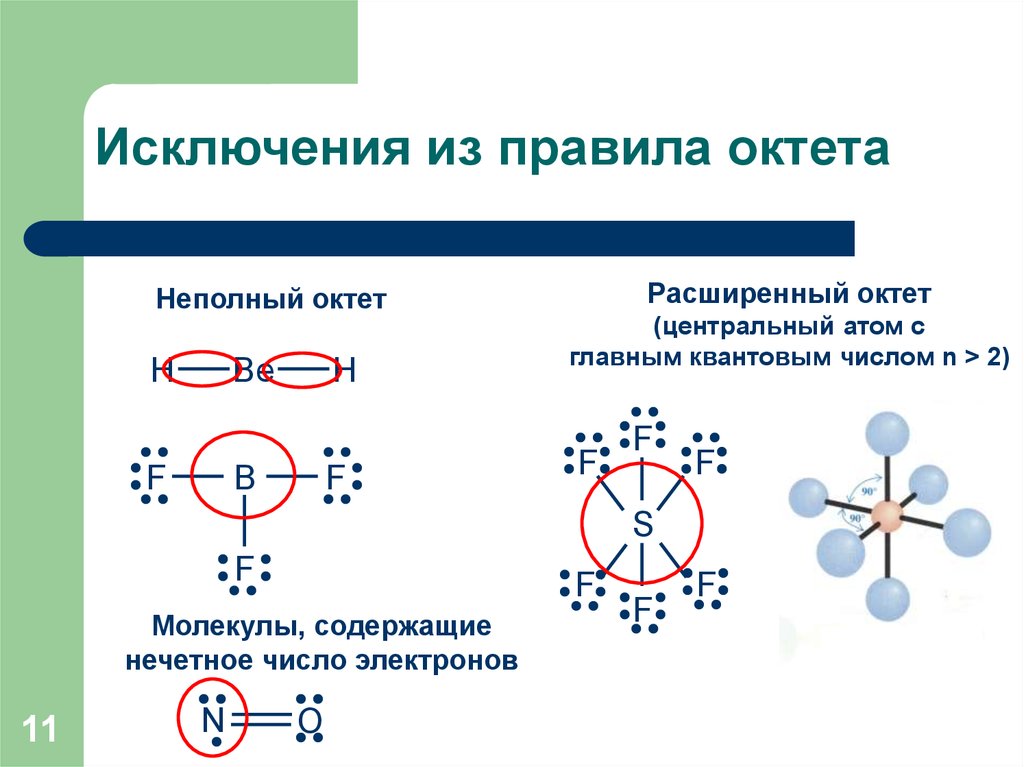
11. Исключения из правила октета
Неполный октетH
Be
F
H
B
F
Расширенный октет
(центральный атом с
главным квантовым числом n > 2)
F
F
F
S
F
F
Молекулы, содержащие
нечетное число электронов
11
N
O
F
F
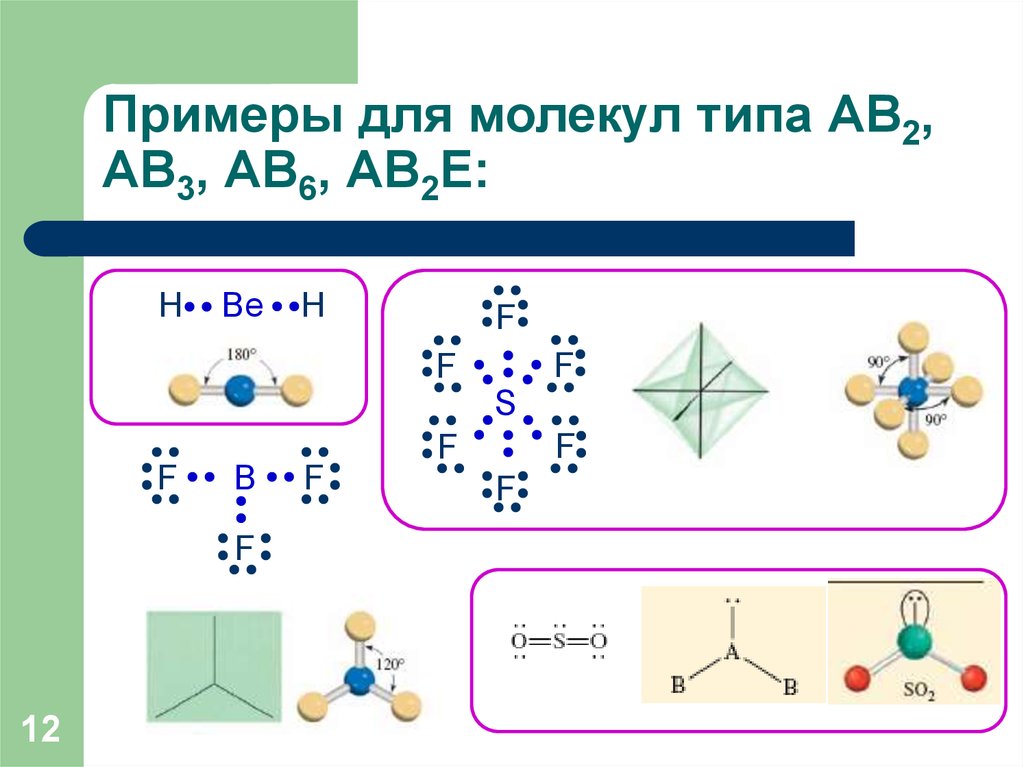
12. Примеры для молекул типа АВ2, АВ3, АВ6, АВ2Е:
HBe
H
F
F
F
S
F
B
F
12
F
F
F
F
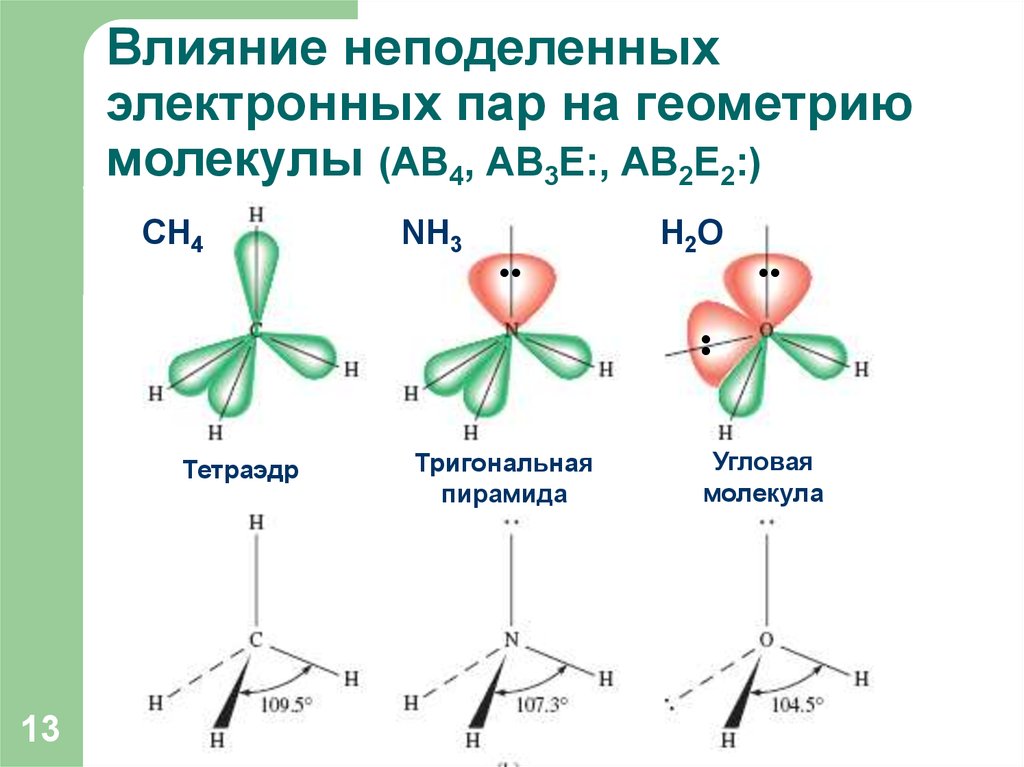
13. Влияние неподеленных электронных пар на геометрию молекулы (АВ4, АВ3Е:, АВ2Е2:)
NH3•
H2O
•
•
CH4
Тетраэдр
13
Тригональная
пирамида
Угловая
молекула
14.
1415.
Теории химической связи.Гибридизация атомных орбиталей
Теории химической связи
Метод валентных
связей (ВС)
15
Метод молекулярных
орбиталей (МО)
Гибридизация атомных орбиталей – изменение формы и
энергии орбиталей атома при образовании ковалентной связи
для достижения более эффективного перекрывания орбиталей
16. Основные положения теории гибридизации
16Гибридизуются орбитали атома, реализующего связи с
другими атомами
Гибридизуются АО с близкой энергией
Число гибридных орбиталей равно суммарному числу
исходных орбиталей
Гибридизация сопровождается изменением формы
электронных облаков, поэтому хим. связи с участием гибр.
орбиталей обладают большей прочностью, чем связи с
“чистыми” АО
Гибридизация атомных орбиталей возможна лишь
для атомов, образующих химические связи, но не для
свободных атомов!
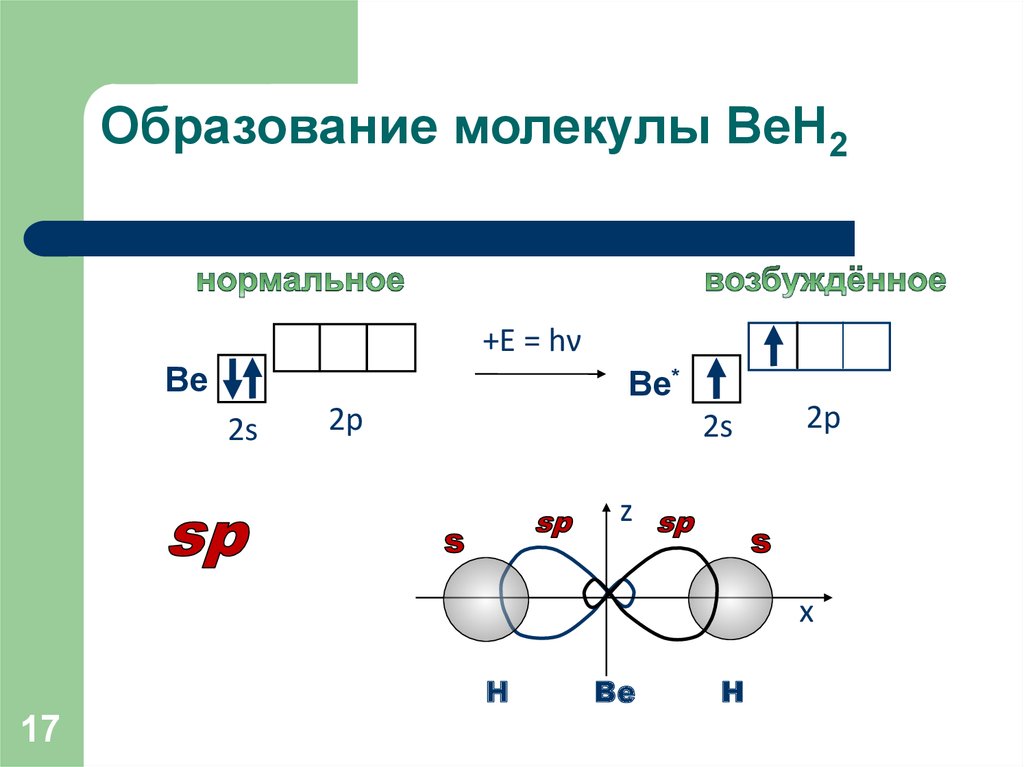
17. Образование молекулы ВеН2
+Ε = hνВе
Ве*
2s
2р
2s
2р
z
x
Н
17
Ве
Н
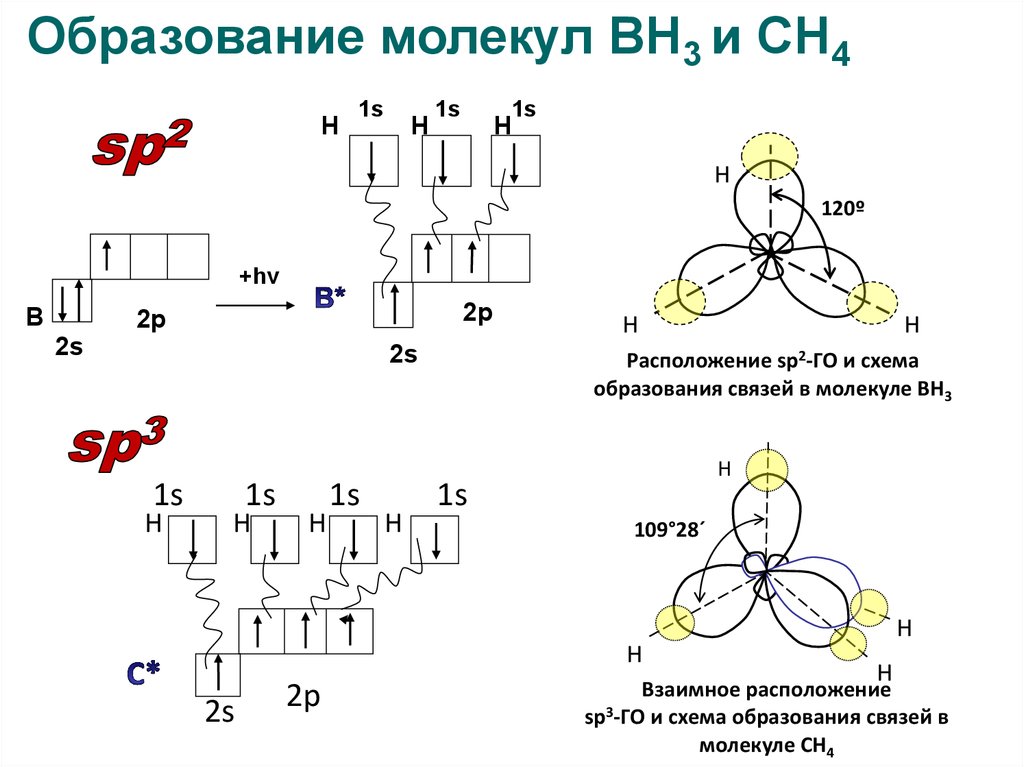
18.
Образование молекул ВН3 и СН4Н
1s
Н
1s
1s
Н
Н
120º
+hν
В
2р
2р
2s
2s
1s
Н
1s
Н
Н
1s
Н
Н
Н
Расположение sp2-ГО и схема
образования связей в молекуле ВН3
Н
1s
109°28´
Н
Н
2s
2р
Н
Взаимное расположение
3
sp -ГО и схема образования связей в18
молекуле СН4
19. Дипольный момент связи
μ = Q×r1D = 3,4·10-30 Кл·м
диполь
19
Чем больше разница электроотрицательностей элементов, тем
полярнее связь
20. Полярные и неполярные молекулы
Все ли молекулы, содержащие полярные связи полярны?Молекулы с полярными связями
Угловая
могут молекула
быть неполярными
μ = 1,79 D
Все
зависит
от геометрии молекулы
Линейная
Тригональная
молекула
пирамида
μ=0D
20
μ = 1,46 D
Плоский
треугольник
μ=0D
21. Полярность молекул с ковалентными связями: Влияние неподеленных электронных пар
Дипольный момент молекулы зависит:• от полярности связей
• от геометрии молекулы
• от наличия неподелённых пар электронов
●
●
sp3
sp3
21
µ = 1,46D
µ = 0,2D











 Химия
Химия








