Похожие презентации:
Химическая связь и строение молекул
1.
Химическая связь истроение молекул
2. План лекции
Образование сложных частиц.Природа химической связи.
Ковалентная связь.
Метод валентных связей.
Донорно-акцепторный
ковалентной связи.
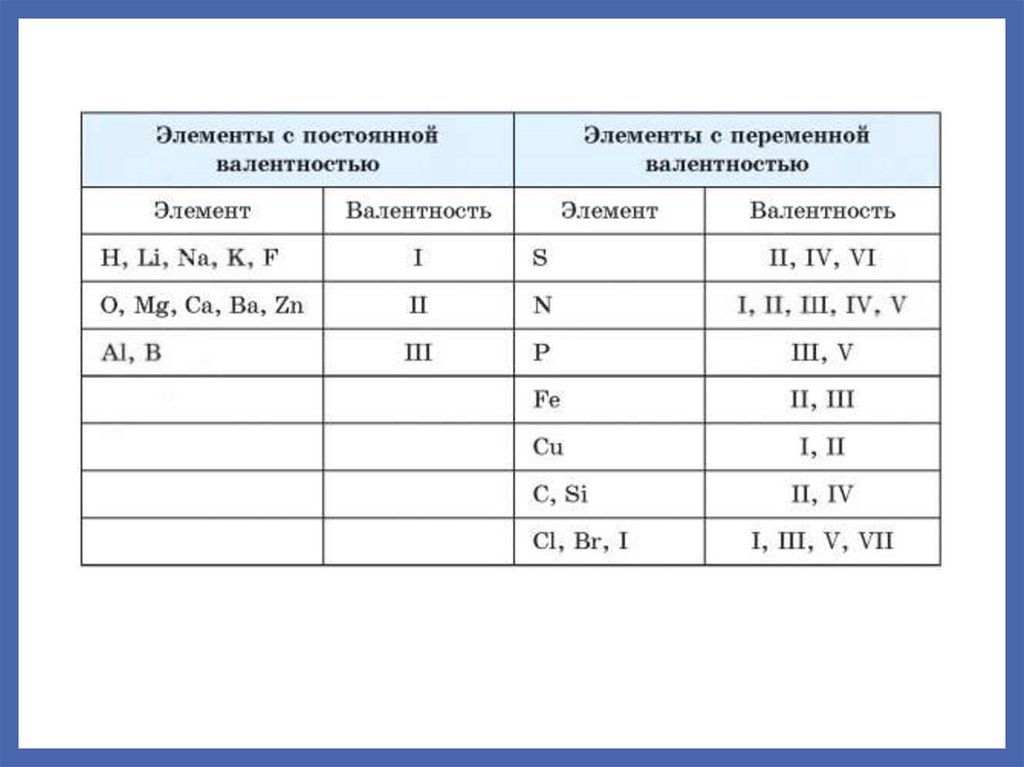
Валентность.
Степень окисления.
Ионная связь.
Металлическая связь.
Водородная связь.
механизм
образования
3.
Химическаясвязь
–
это
различные
виды
взаимодействия,
обуславливающие
устойчивое
существование многоатомных соединений (молекул, ионов,
кристаллических веществ и т.д.)
Виды химической связи
Ковалентная
Ионная
Металлическая
Водородная
4.
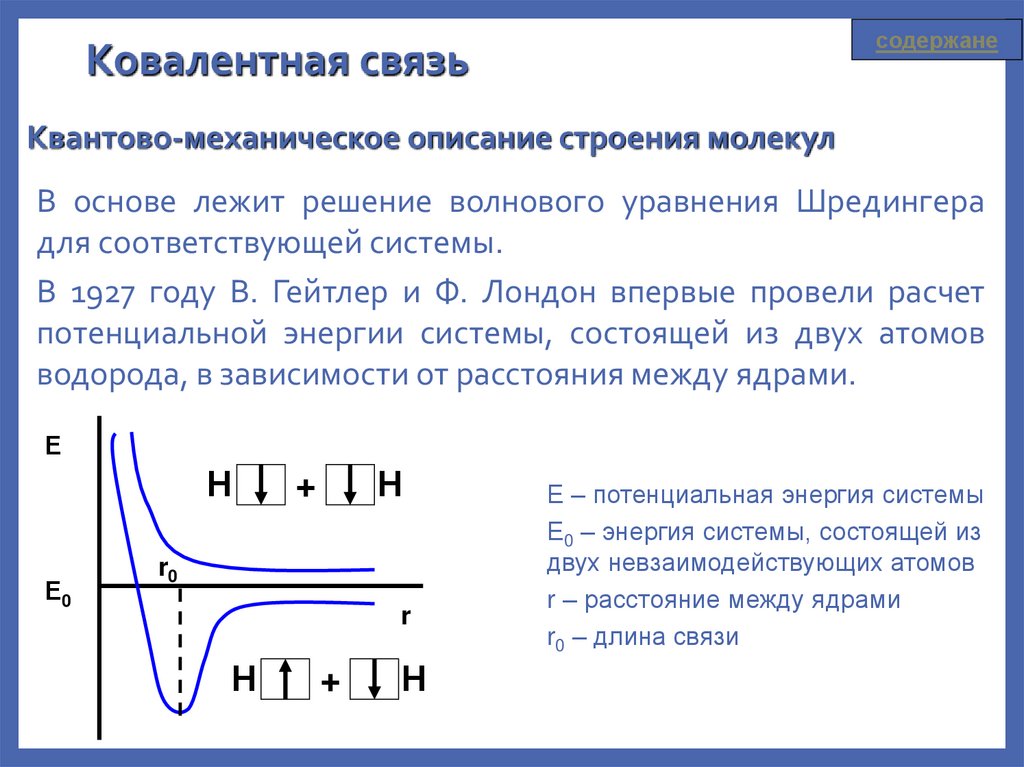
содержанеКовалентная связь
Квантово-механическое описание строения молекул
В основе лежит решение волнового уравнения Шредингера
для соответствующей системы.
В 1927 году В. Гейтлер и Ф. Лондон впервые провели расчет
потенциальной энергии системы, состоящей из двух атомов
водорода, в зависимости от расстояния между ядрами.
Е
Н
Е0
Н
+
r0
r
Н
+
Н
Е – потенциальная энергия системы
Е0 – энергия системы, состоящей из
двух невзаимодействующих атомов
r – расстояние между ядрами
r0 – длина связи
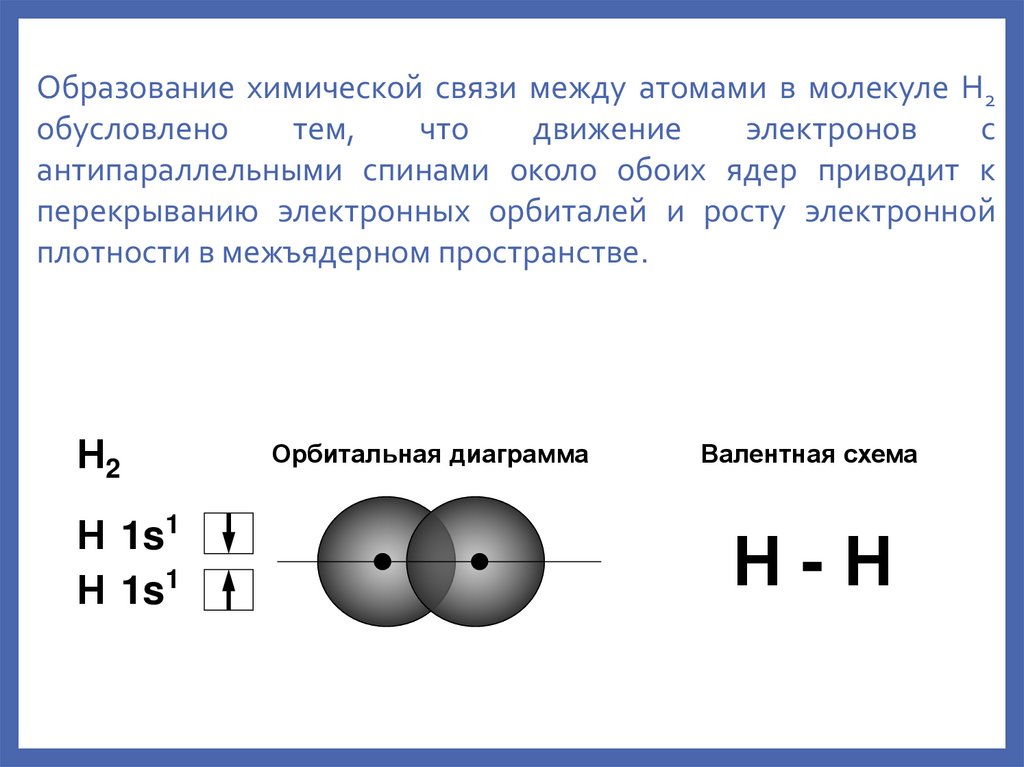
5.
Образование химической связи между атомами в молекуле Н2обусловлено
тем,
что
движение
электронов
с
антипараллельными спинами около обоих ядер приводит к
перекрыванию электронных орбиталей и росту электронной
плотности в межъядерном пространстве.
Н2
Н 1s1
Н 1s1
Орбитальная диаграмма
Валентная схема
Н-Н
6.
Ковалентная связьМетод валентных связей (ВС) основные положения:
Химическая связь между атомами образуется в результате
обобществления валентных электронов, т.е. образования
общих электронных пар.
Общие электронные пары образуют лишь неспаренные
электроны с антипараллельными спинами.
При образовании химических связей происходит частичное
перекрывание атомных орбиталей - АО, что приводит к
увеличению электронной плотности в межъядерном
пространстве.
Химическая связь тем прочнее, чем в большей степени
перекрываются взаимодействующие АО.
7.
В пространстве химическая связь располагается внаправлении, в котором возможность перекрывания АО
наибольшая.
Связь, образованная перекрыванием АО по линии,
соединяющей центры атомов, называется – σ- связью, а по
обе стороны от линии - -связью.
Еσ > Е
Если молекула образуется путём перекрывания двух АО,
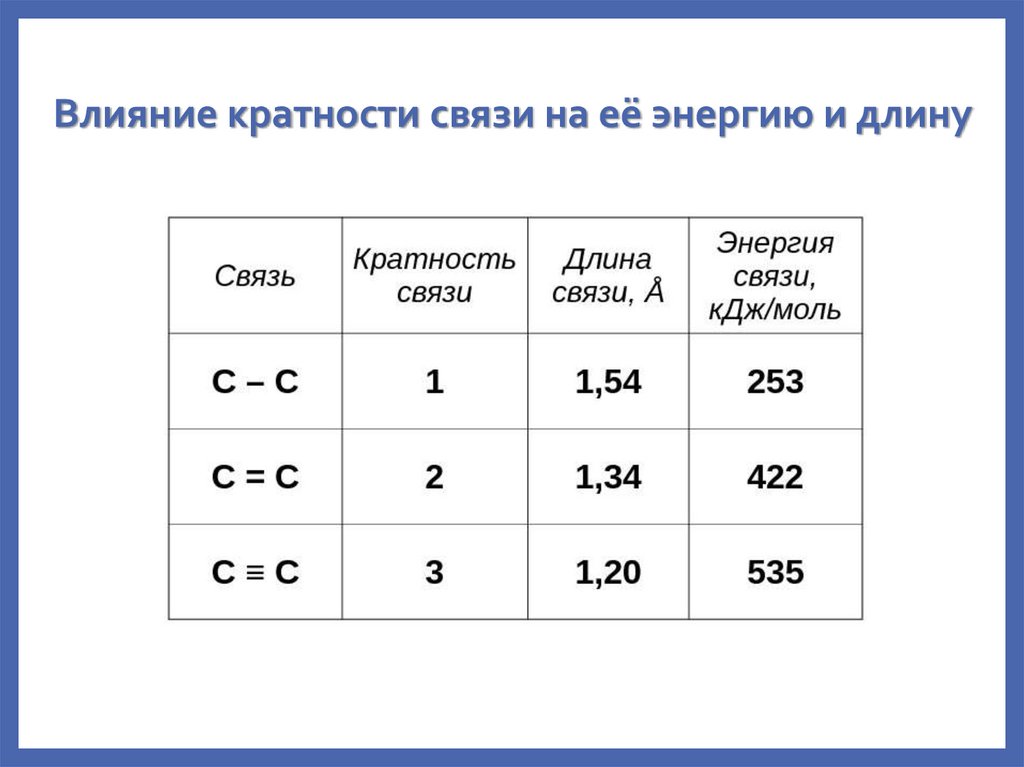
связь называется одинарной, если более двух АО – кратной.
Одинарная связь представлена всегда σ-связью, а кратные
связи включают σ- и -связи.
Общая
электронная
химической связи.
пара
соответствует
единице
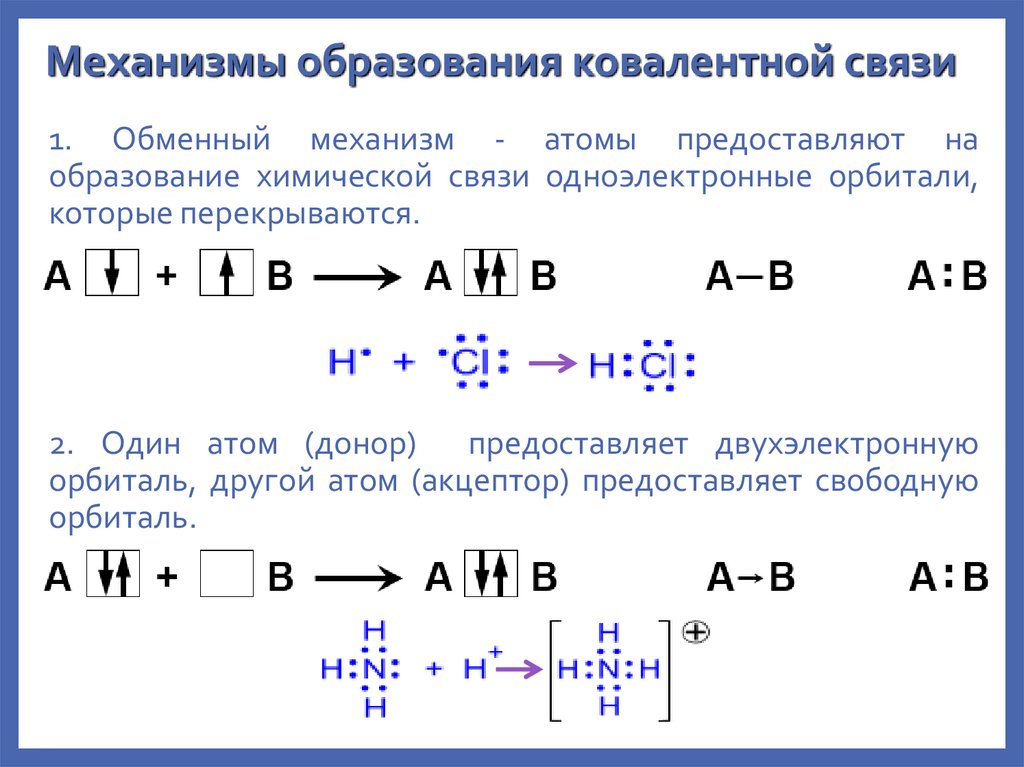
8.
Механизмы образования ковалентной связи1. Обменный механизм - атомы предоставляют на
образование химической связи одноэлектронные орбитали,
которые перекрываются.
2. Один атом (донор)
предоставляет двухэлектронную
орбиталь, другой атом (акцептор) предоставляет свободную
орбиталь.
9.
Свойства связиЭнергия
Длина
Направленность
Кратность
Насыщаемость
Полярность
Поляризуемость
10.
1. Энергия связи– энергия, которая выделяется при
образовании химической связи из нейтральных газообразных
атомов.
H0хим. св. < 0
[кДж/моль]
H + H = H2
H0хим. св. = - 435 кДж/моль
2. Длина связи
– расстояние между ядрами атомов в
молекуле
длина связи < ra1 + ra2
11.
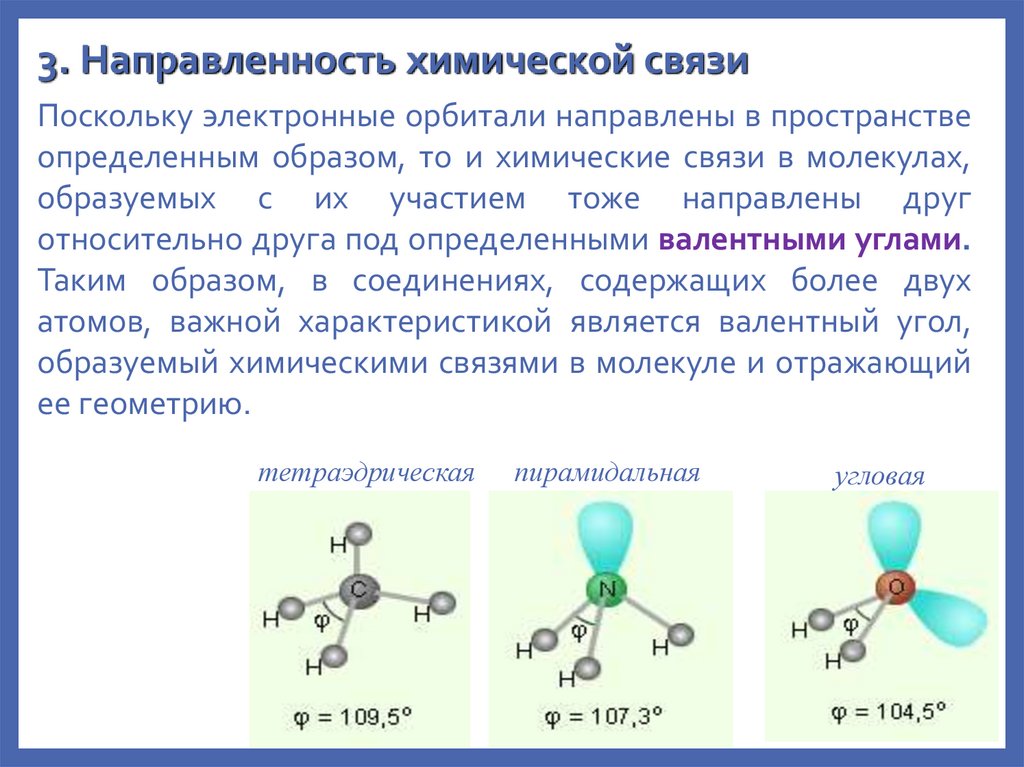
3. Направленность химической связиПоскольку электронные орбитали направлены в пространстве
определенным образом, то и химические связи в молекулах,
образуемых с их участием тоже направлены друг
относительно друга под определенными валентными углами.
Таким образом, в соединениях, содержащих более двух
атомов, важной характеристикой является валентный угол,
образуемый химическими связями в молекуле и отражающий
ее геометрию.
тетраэдрическая
пирамидальная
угловая
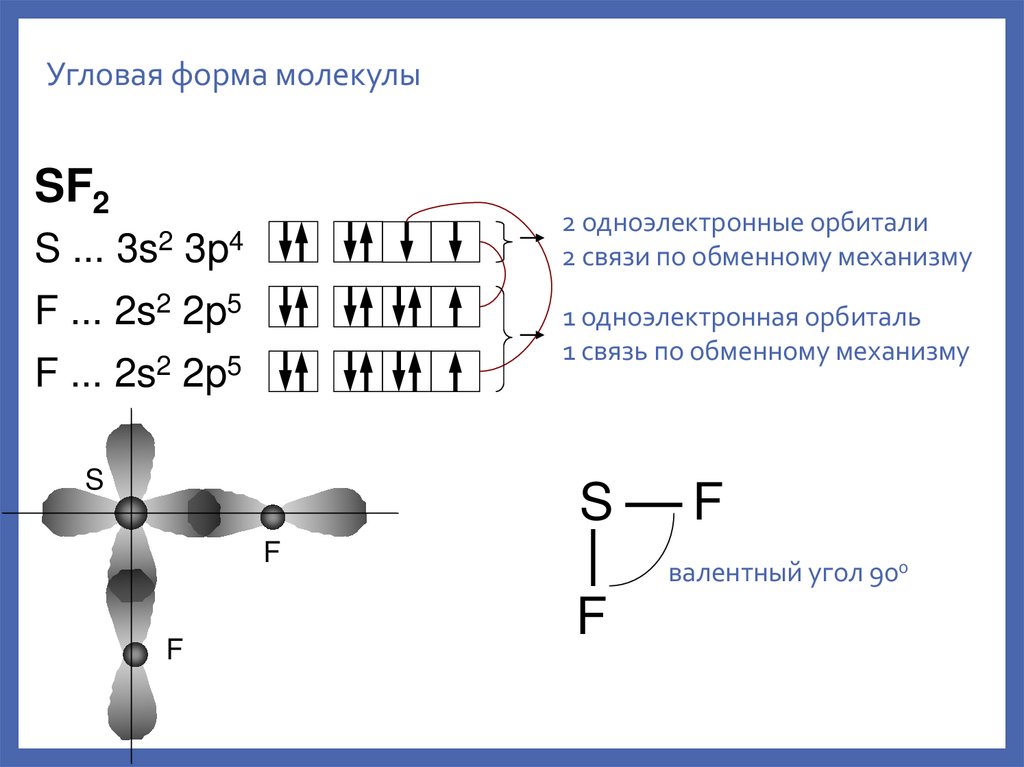
12.
Угловая форма молекулыSF2
2 одноэлектронные орбитали
2 связи по обменному механизму
S ... 3s2 3p4
F ... 2s2 2p5
1 одноэлектронная орбиталь
1 связь по обменному механизму
F ... 2s2 2p5
S
S
F
F
F
валентный угол 900
F
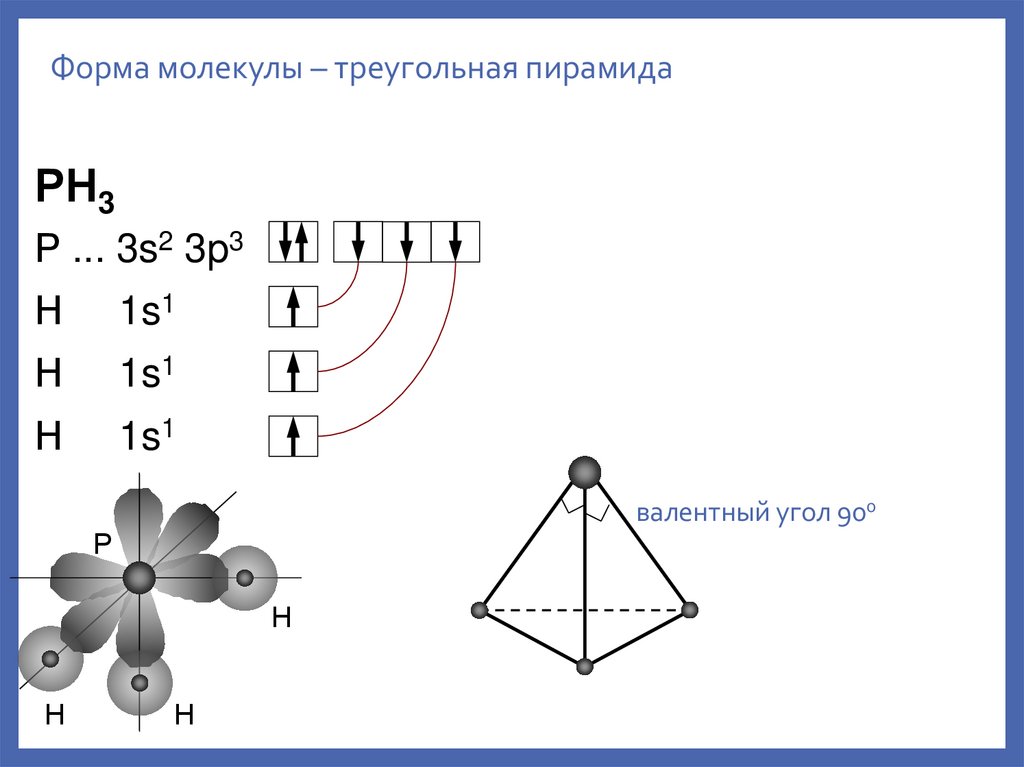
13.
Форма молекулы – треугольная пирамидаРН3
Р ... 3s2 3p3
Н
1s1
Н
1s1
Н
1s1
валентный угол 900
Р
Н
Н
Н
14.
Теория гибридизацияГибридизация – это представление о
выравнивании
валентных атомных орбиталей по форме и по энергии.
Основные положения теории гибридизации:
В процессе гибридизации могут участвовать любые
орбитали: свободные, одноэлектронные, двухэлектронные.
Гибридных орбиталей образуется столько же, сколько
атомных орбиталей участвует в процессе гибридизации.
Гибридные орбитали имеют форму несимметричной
гантели.
Гибридные орбитали располагаются в пространстве
симметрично, отталкиваясь на максимально возможные
равные углы.
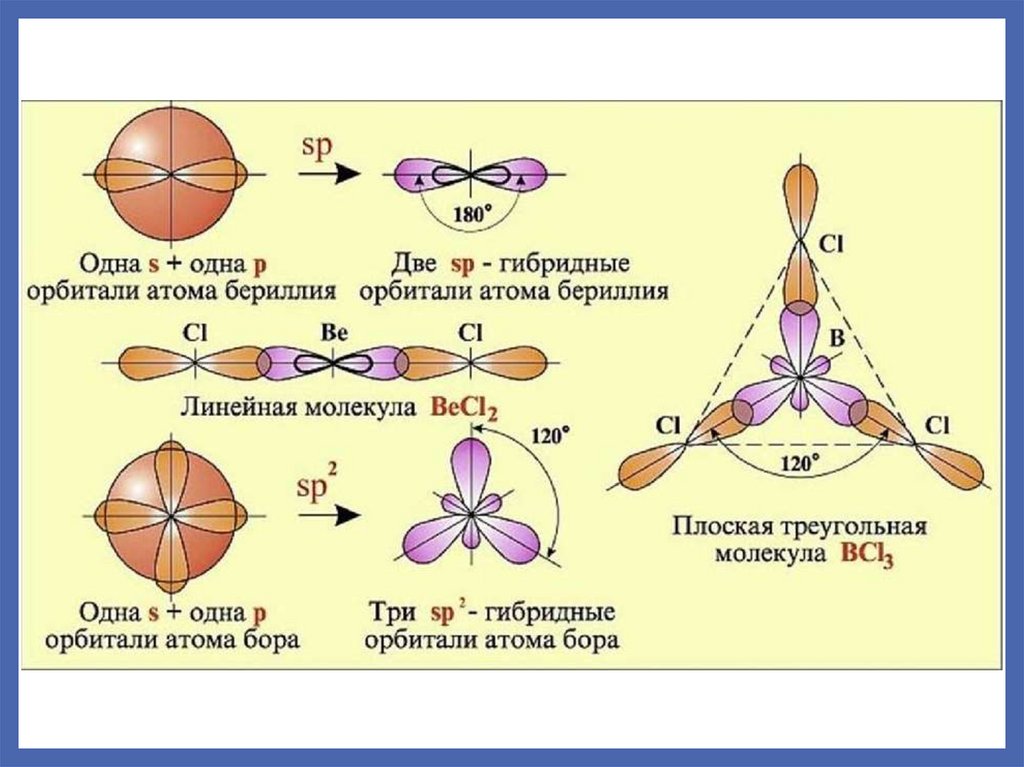
15.
Be* - может образовать две равноценные по энергии связи пообменному механизму благодаря гибридизации
BeCl2
Be ...2s2
sp – гибридизация
Be* ...2s1 2p1
Сl ... 3s2 3p5
Cl ... 3s2 3p5
Cl
Be
Cl
валентный угол 1800
Линейная форма молекулы
16.
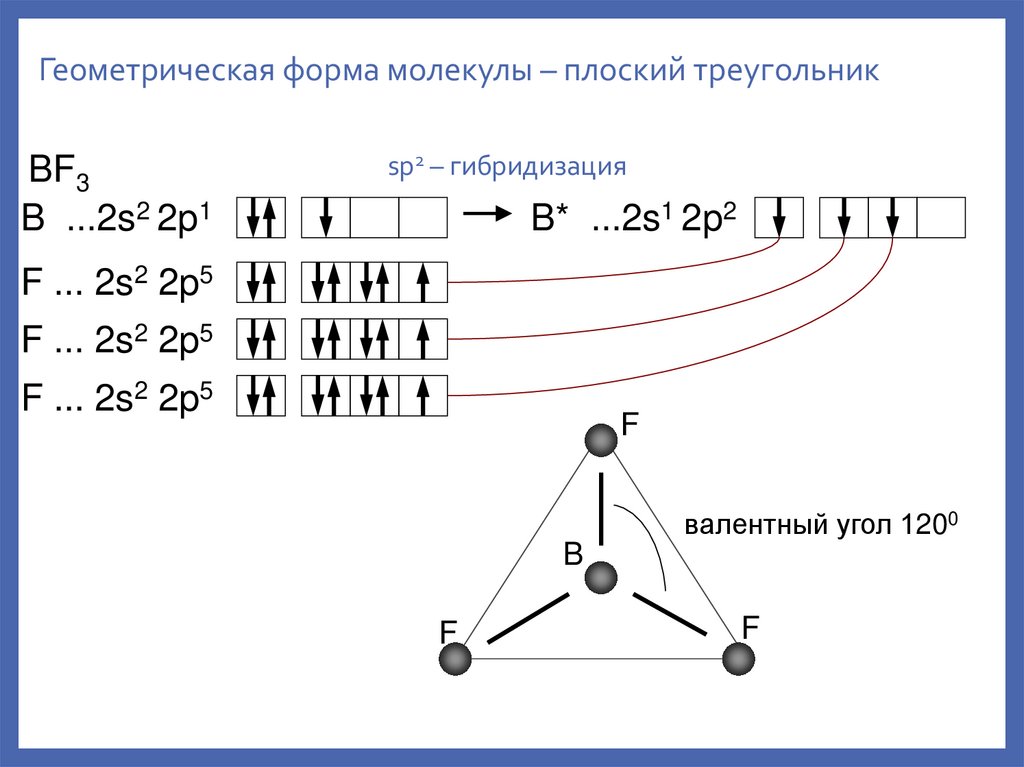
Геометрическая форма молекулы – плоский треугольникBF3
B ...2s2 2p1
sp2 – гибридизация
B* ...2s1 2p2
F ... 2s2 2p5
F ... 2s2 2p5
F ... 2s2 2p5
F
валентный угол 1200
B
F
F
17.
18.
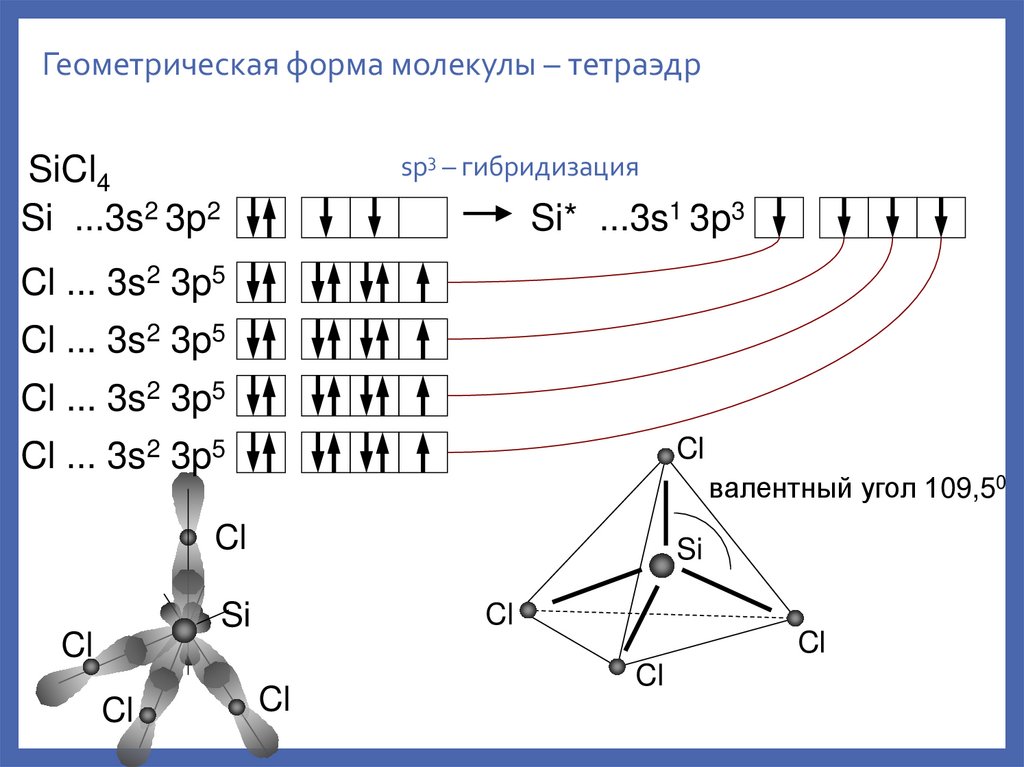
Геометрическая форма молекулы – тетраэдрsp3 – гибридизация
SiCl4
Si ...3s2 3p2
Si* ...3s1 3p3
Cl ... 3s2 3p5
Cl ... 3s2 3p5
Cl ... 3s2 3p5
Cl
Cl ... 3s2 3p5
валентный угол 109,50
Cl
Si
Si
Cl
Cl
Cl
Cl
Cl
Cl
19.
ТипГеометрическая
гибридизации форма
Угол между
связями
Примеры
sp
линейная
180o
BeCl2
sp2
треугольная
120o
BCl3
sp3
тетраэдрическая
109,5o
CH4
sp3d
тригональнобипирамидальная
900 ; 1200
РСl5
sp3d2
октаэдрическая
900
SF6
20.
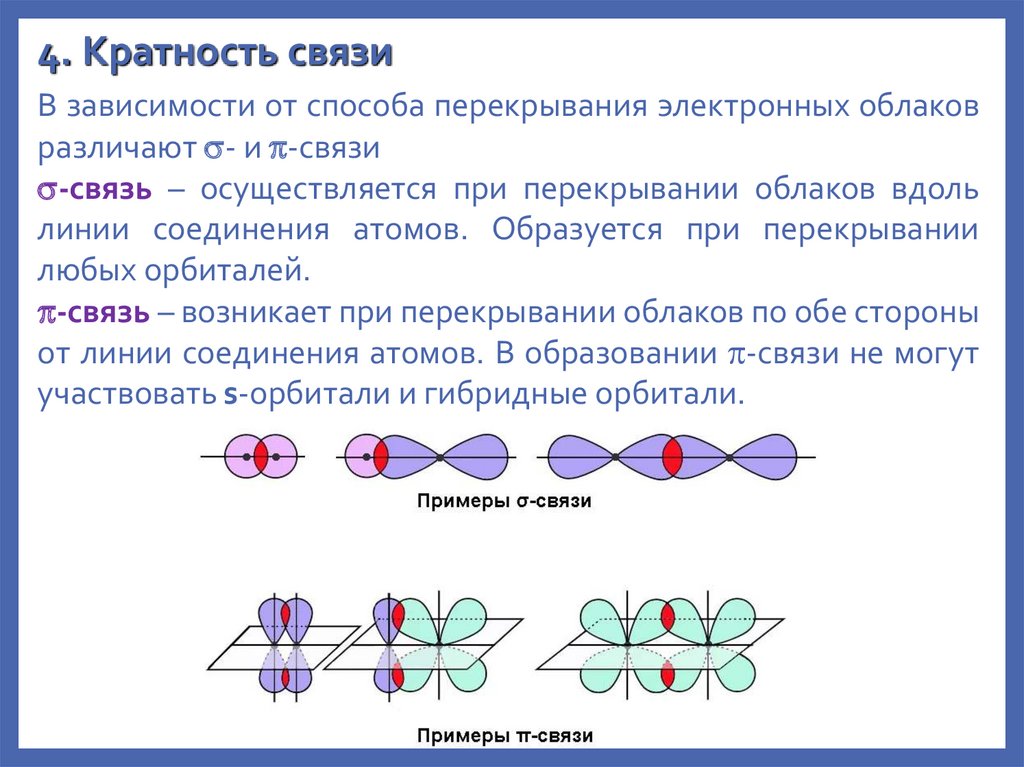
4. Кратность связиВ зависимости от способа перекрывания электронных облаков
различают - и -связи
-связь – осуществляется при перекрывании облаков вдоль
линии соединения атомов. Образуется при перекрывании
любых орбиталей.
-связь – возникает при перекрывании облаков по обе стороны
от линии соединения атомов. В образовании -связи не могут
участвовать s-орбитали и гибридные орбитали.
21.
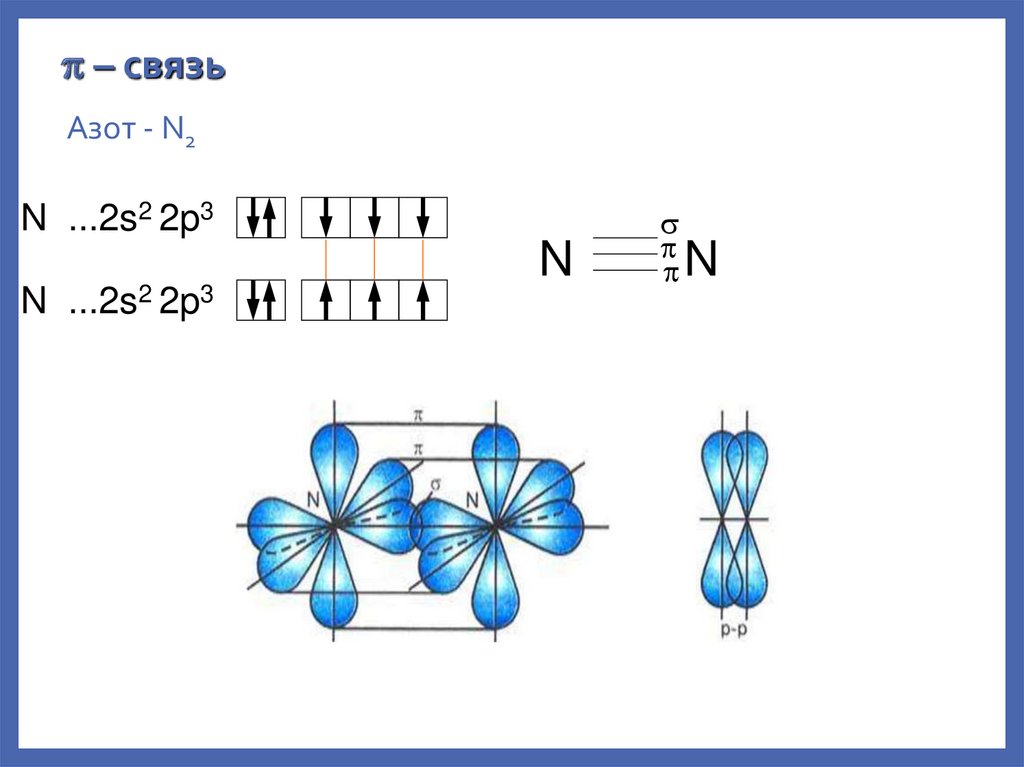
– связьАзот - N2
N ...2s2 2p3
N ...2s2 2p3
N
N
22.
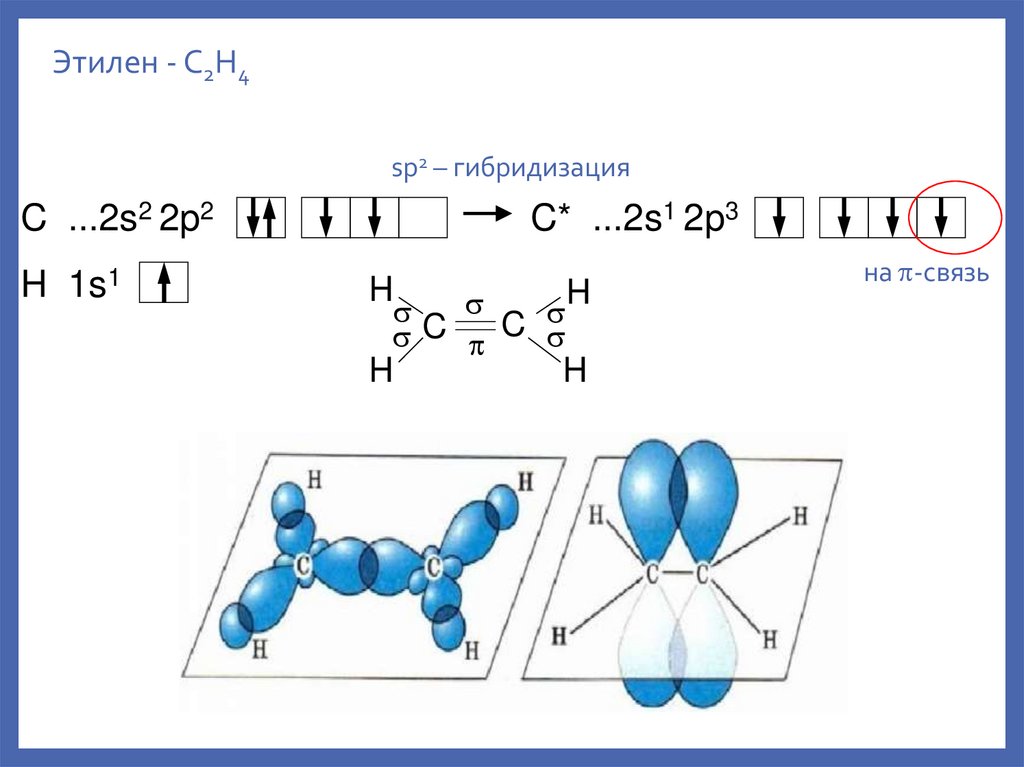
Этилен - C2H4sp2 – гибридизация
C ...2s2 2p2
H 1s1
C* ...2s1 2p3
H
H
C C
H
H
на -связь
23. Влияние кратности связи на её энергию и длину
24.
5. Насыщаемость связи. ВалентностьНасыщаемость – способность атома взаимодействовать только
с определенным числом атомов других элементов.
Валентность – число ковалентных связей, которые элемент
образует или потенциально может образовать.
Валентность определяется:
Числом валентных орбиталей. В первую очередь
реализуются одноэлектронные орбитали, затем свободные
и двуэлектронные.
Доступностью валентных орбиталей для образования
химических
связей.
Конечными
размерами
взаимодействующих атомов
25.
26.
6. Полярность связиэто
смещение
электронной
плотности к одному из атомов.
Неполярная ковалентная связь – связь, образованная атомами
одного элемента. Область повышенной электронной плотности
находится на одинаковом расстоянии от ядер атомов.
Полярная ковалентная связь – связь, образованная атомами
различных элементов. Область повышенной электронной
плотности
смещена
к
атому
с
наибольшей
электроотрицательностью. Один из атомов приобретает
частичный отрицательный заряд, а другой – положительный.
27.
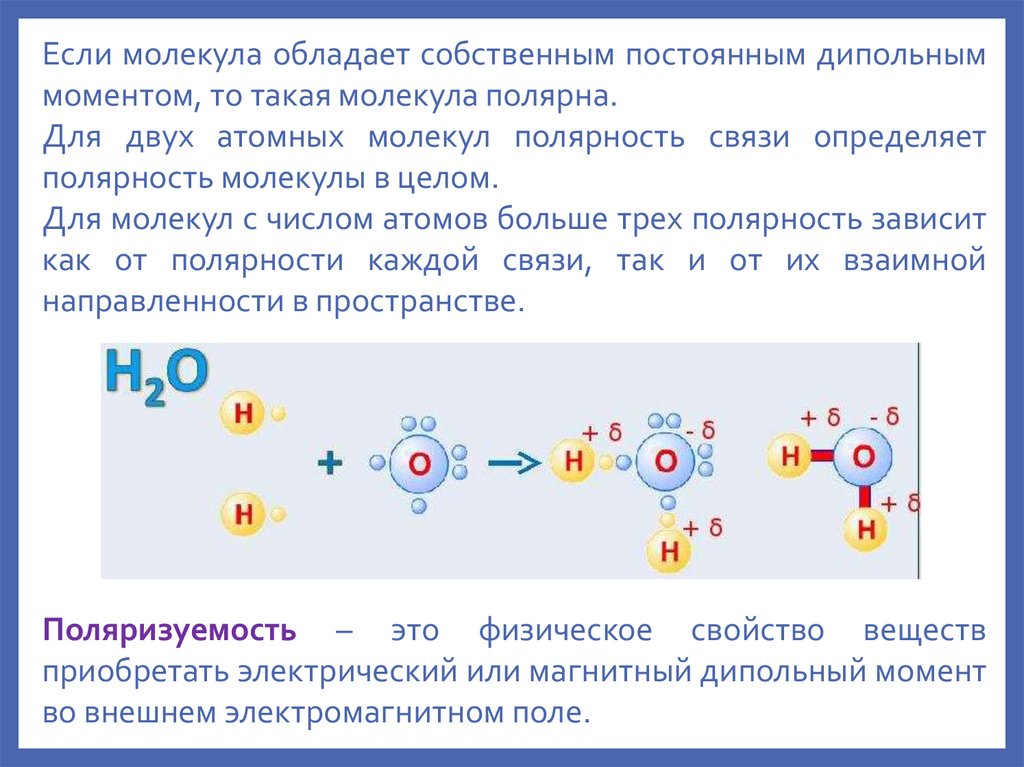
Если молекула обладает собственным постоянным дипольныммоментом, то такая молекула полярна.
Для двух атомных молекул полярность связи определяет
полярность молекулы в целом.
Для молекул с числом атомов больше трех полярность зависит
как от полярности каждой связи, так и от их взаимной
направленности в пространстве.
Поляризуемость – это физическое свойство веществ
приобретать электрический или магнитный дипольный момент
во внешнем электромагнитном поле.
28.
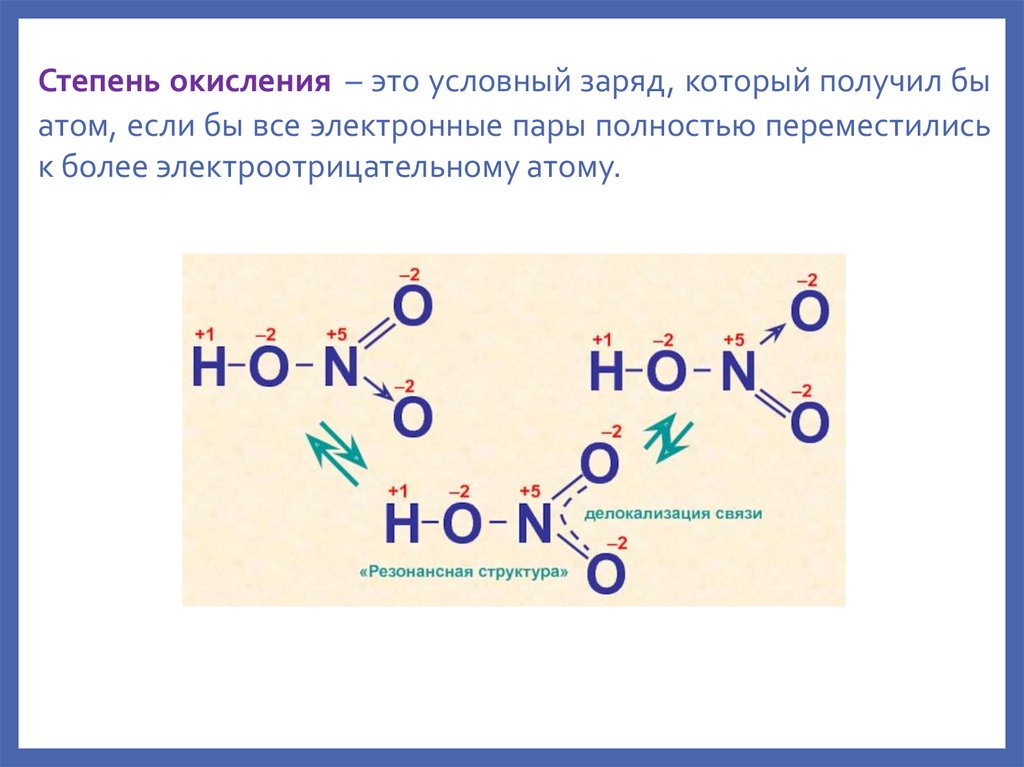
Степень окисления – это условный заряд, который получил быатом, если бы все электронные пары полностью переместились
к более электроотрицательному атому.
29.
Ионная связьИонная связь предельный случай ковалентной полярной связи,
когда электронная пара на 90% принадлежит атому с
наибольшей электроотрицательностью. Осуществляется путем
электростатического взаимодействия между ионами. Она
ненаправленна и ненасыщенна.
30.
31.
Металлическая связьобразуется в металлах и сплавах.
Атомы металлов имеют небольшое число валентных
электронов, которые слабо связаны с ядром и могут легко
отрываться от него. В результате в узлах кристаллической
решетки появляются положительно заряженные ионы, а
между ними свободно перемещаются электроны – образуется
так называемый “электронный газ”. Вид связи между
положительными
ионами,
осуществляемой
за
счет
притяжения электронов, свободно перемещающихся по
кристаллу, называется металлической. Связь обуславливает
высокую электро- и теплопроводность, она ненаправленна,
ненасыщаема, делокализована.
32.
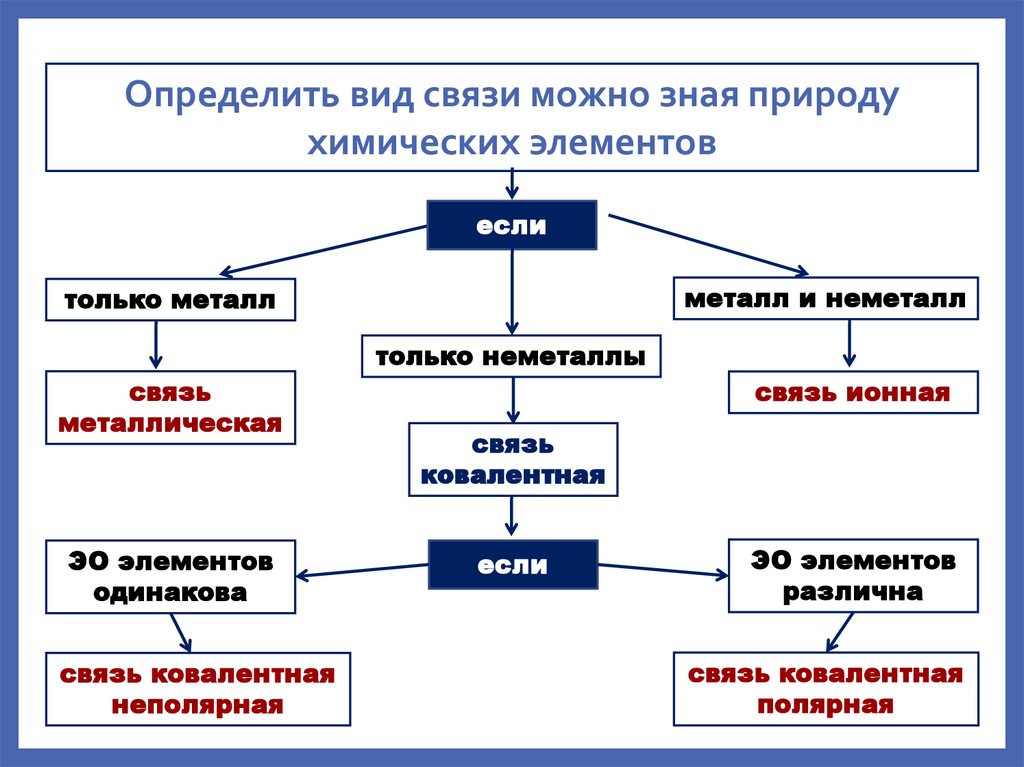
Определить вид связи можно зная природухимических элементов
если
металл и неметалл
только металл
только неметаллы
связь
металлическая
ЭО элементов
одинакова
связь ковалентная
неполярная
связь ионная
связь
ковалентная
если
ЭО элементов
различна
связь ковалентная
полярная
33.
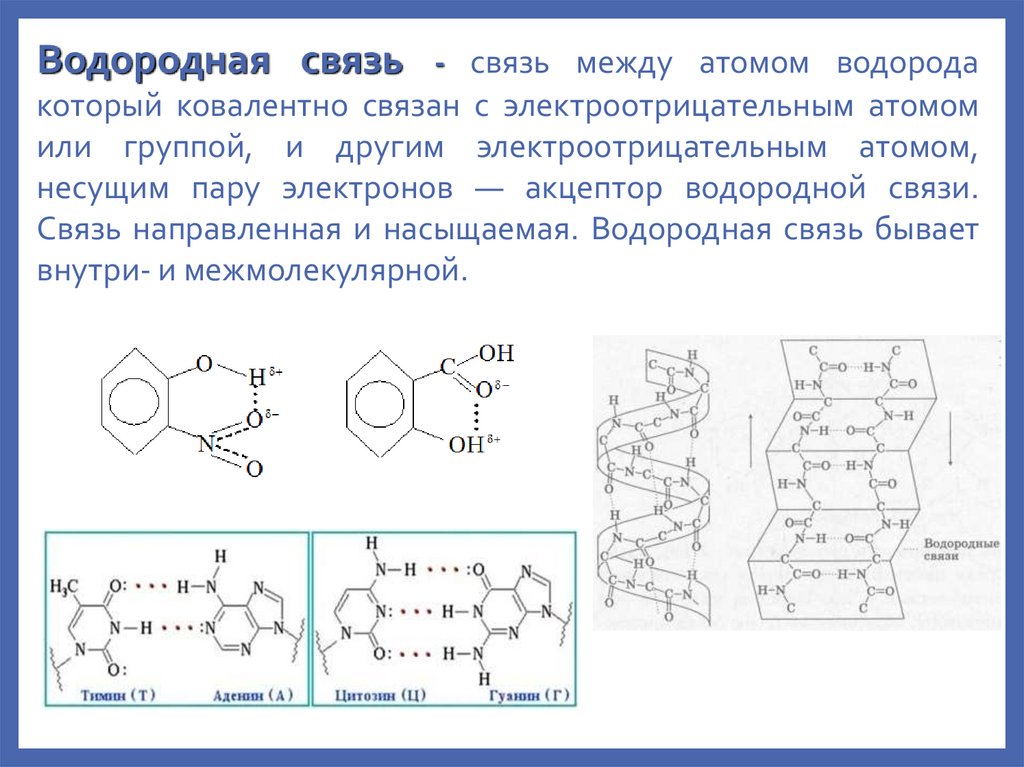
Водородная связь- связь между атомом водорода
который ковалентно связан с электроотрицательным атомом
или группой, и другим электроотрицательным атомом,
несущим пару электронов — акцептор водородной связи.
Связь направленная и насыщаемая. Водородная связь бывает
внутри- и межмолекулярной.

















 Химия
Химия








