Похожие презентации:
Металлы. Общая характеристика
1.
Презентация учителя химии лицея №344
Ипатовой А.Н.
2.
Строятся внешние слоиСтроятся внешние слои
Строятся предвнешние слои
Строятся 3 снаружи слои
3.
1s22s22p63s2Валентные
электроны
1s22s22p63s23p1
Валентные
электроны
1s22s22p63s23p63d54s1
Валентные
электроны
1s22s22p63s23p63d104s24p64d104f1
5s25p65d16s2 Валентные
электроны
4.
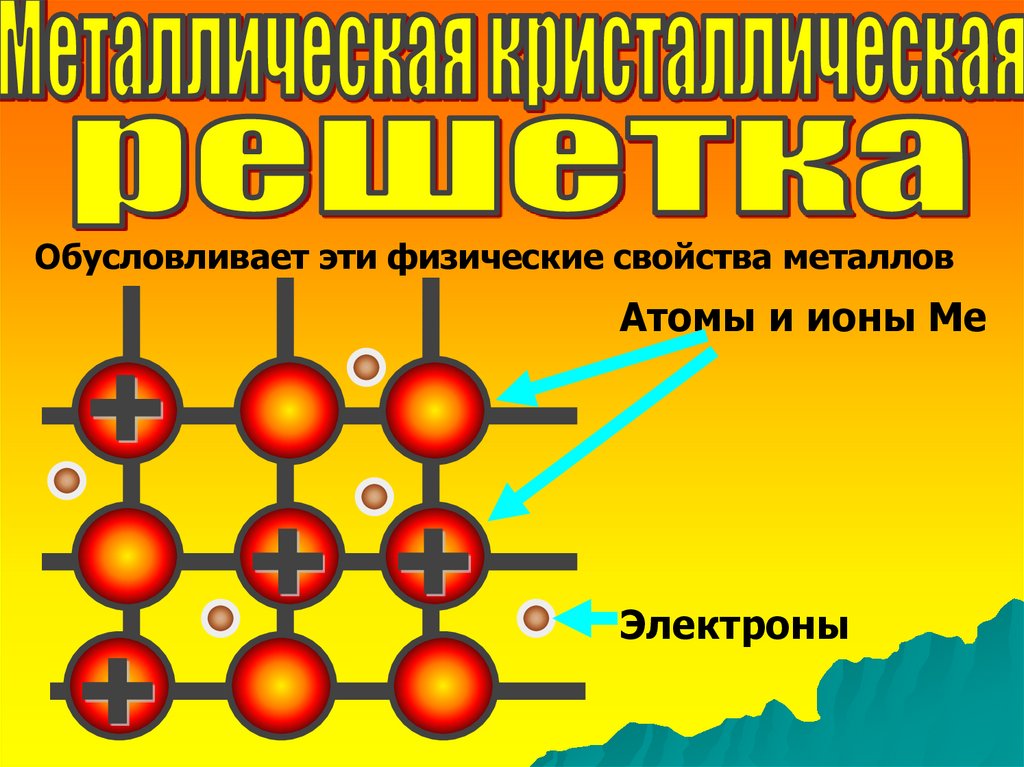
5.
Обусловливает эти физические свойства металловАтомы и ионы Ме
Электроны
6.
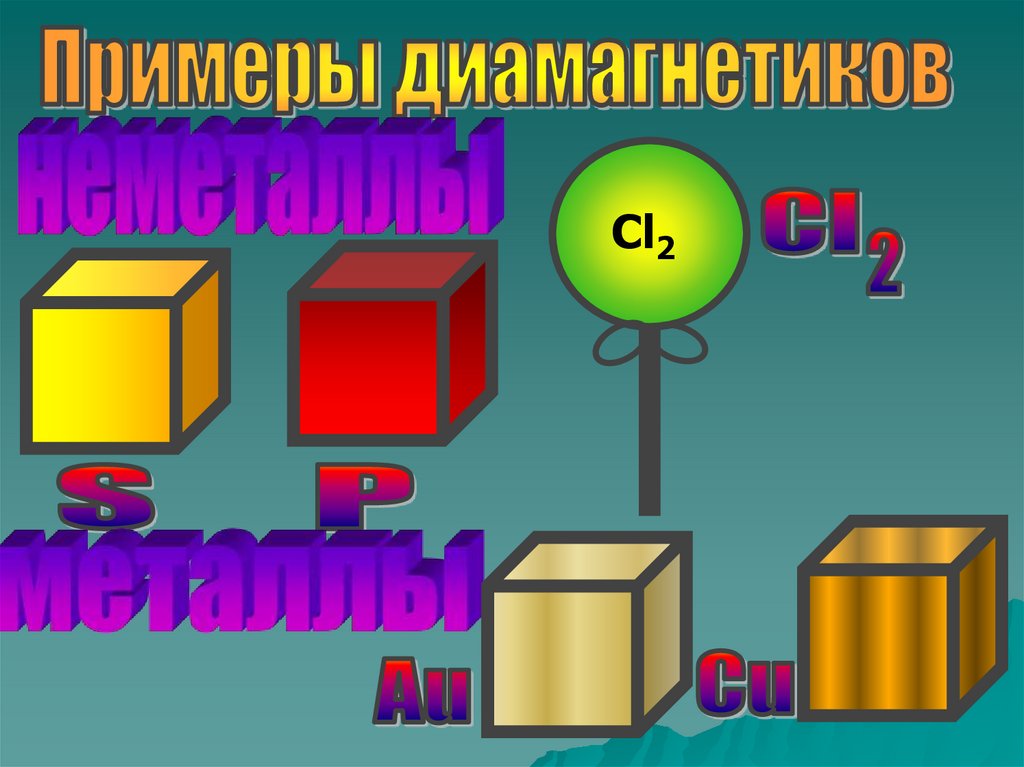
Способны намагничиваться и долго сохранятьмагнитные свойства
Не взаимодействуют с магнитным полем.
Ниже приведены примеры разных диамагнетиков.
7.
Cl28.
Эти вещества слабо втягиваютсямагнитным полем.
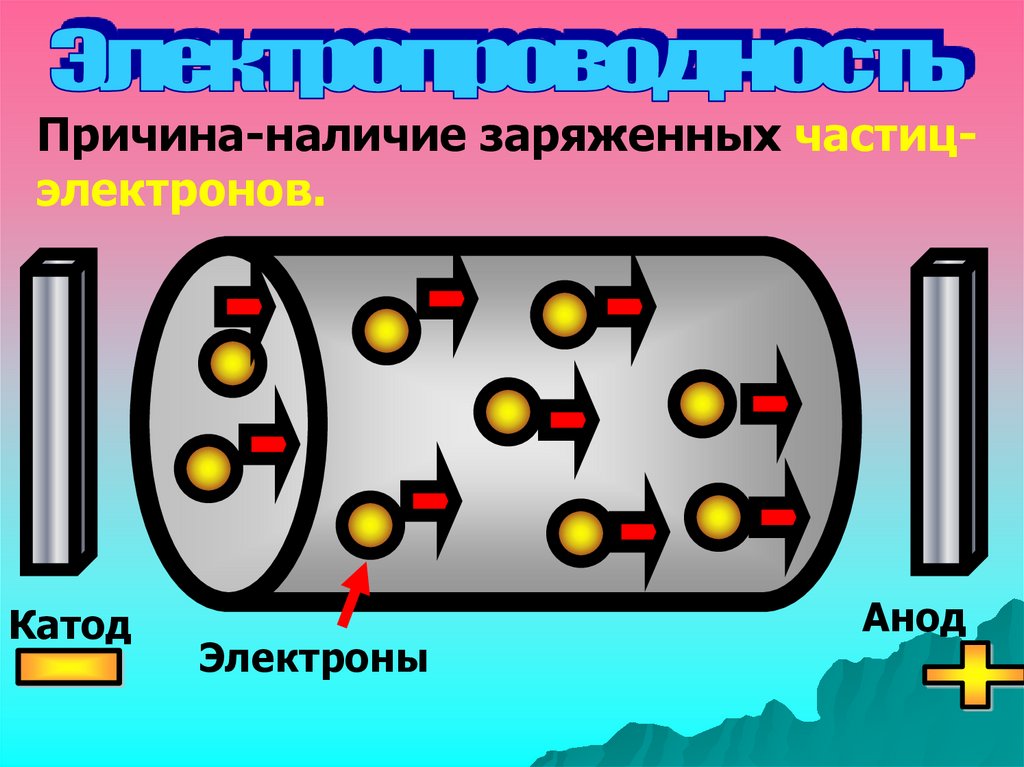
9.
Причина-наличие заряженных частицэлектронов.Катод
Электроны
Анод
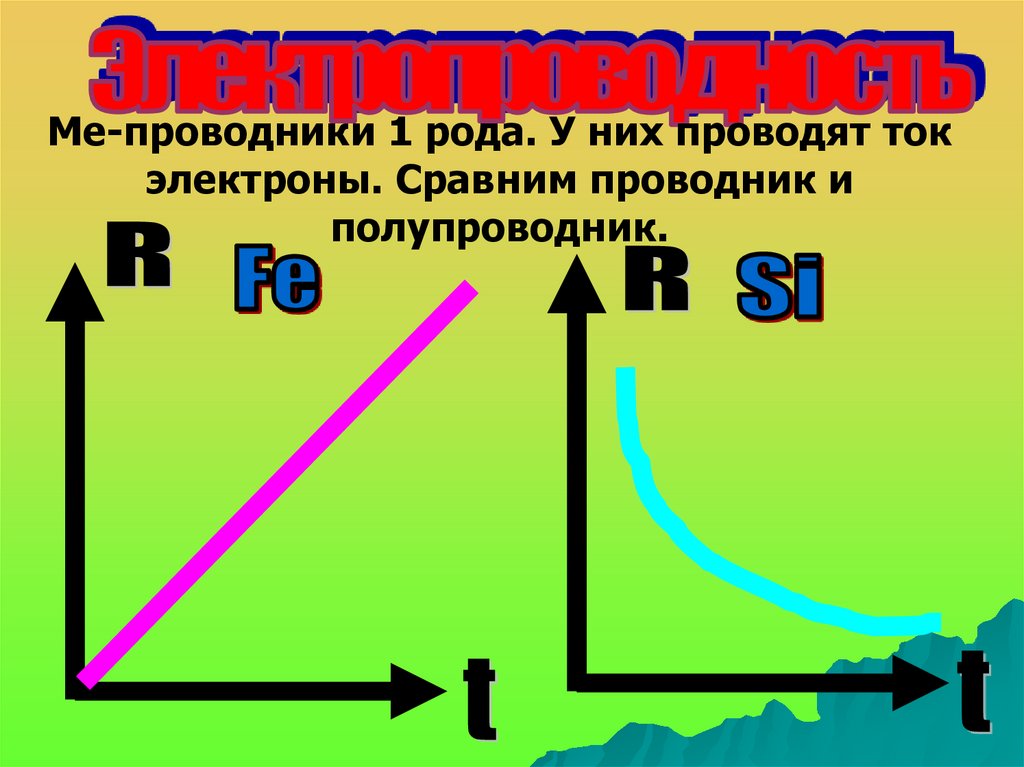
10.
Ме-проводники 1 рода. У них проводят токэлектроны. Сравним проводник и
полупроводник.
11.
Взаимодействие с простыми веществами.Тут Ме являются восстановителями.
4Al+3O2=2Al2O3 Mg+CL2=MgCl2
6Li+N2=2Li3N
Ca+H2=CaH2
Взаимодействие со сложными
веществами.
Тут пригодится электрохимический ряд
напряжений Бекетова.
LI K Ba Ca Mg AL Mn Zn Cr Fe Co Sn Pb (H2) Cu Hg Ag Au
12.
Не реагируют с разбавленными р-рамикислот и солей, так как взаимодействуют с
водой.
2Na+2H2O=2NaOH+H2 Ba+2H2O=Ba(OH)2+H2
Реагируют с разбавленными р-рами
кислот и способны вытеснять стоящий
правее в ЭХРН Ме из р-ра его соли.
2Al+6HCl=2AlCl3+3H2 Fe+CuSO4=FeSO4+Cu
2CH3COOH+Mg=Mg(CH3COO)2+H2
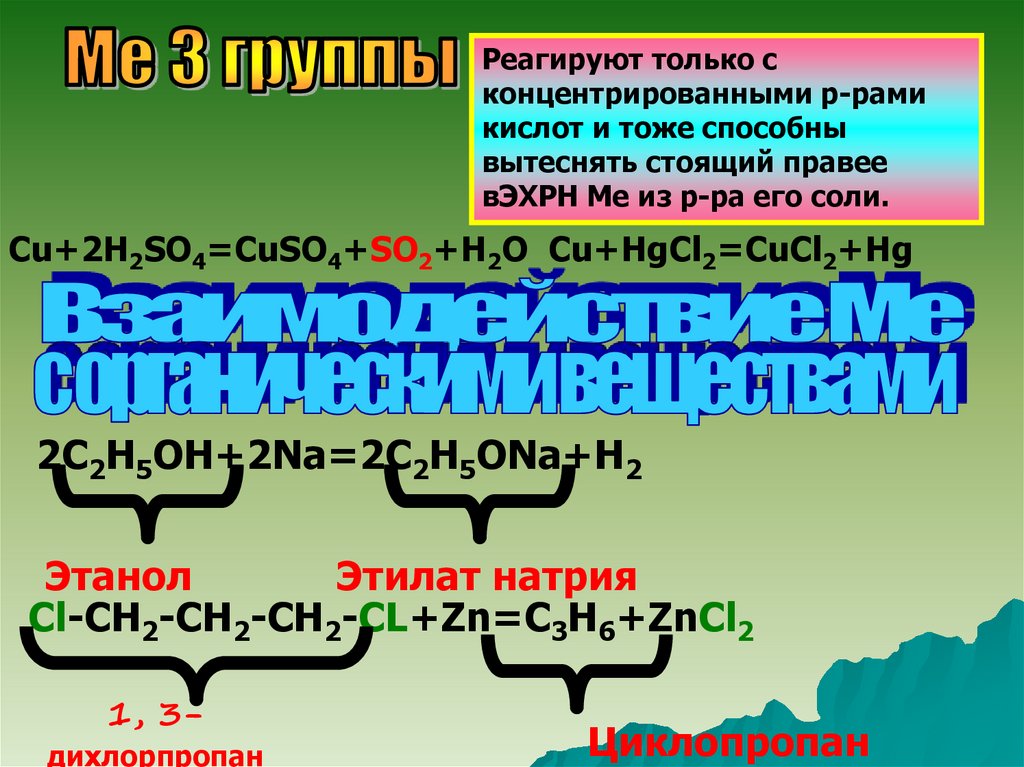
13.
Реагируют только сконцентрированными р-рами
кислот и тоже способны
вытеснять стоящий правее
вЭХРН Ме из р-ра его соли.
Cu+2H2SO4=CuSO4+SO2+H2O Cu+HgCl2=CuCl2+Hg
2C2H5OH+2Na=2C2H5ONa+H2
Этанол
Этилат натрия
Cl-CH2-CH2-CH2-CL+Zn=C3H6+ZnCl2
1, 3дихлорпропан
Циклопропан
14.
Это восстановление Ме из руд поддействием высокой температуры.
Восстановители-неметаллы
SnO2+2C=Sn+2CO
Cu2O+C=2Cu+CO
Восстановителиметаллы(металлотермия)
TiO2+2Mg=Ti+2MgO
3MnO2+4Al=3Mn+2Al2O3
15.
Это восстановление Ме из их солей врастворе.
CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=Cu+FeSO4
Таким способом получают
Ag,Zn,Mo,Au,U
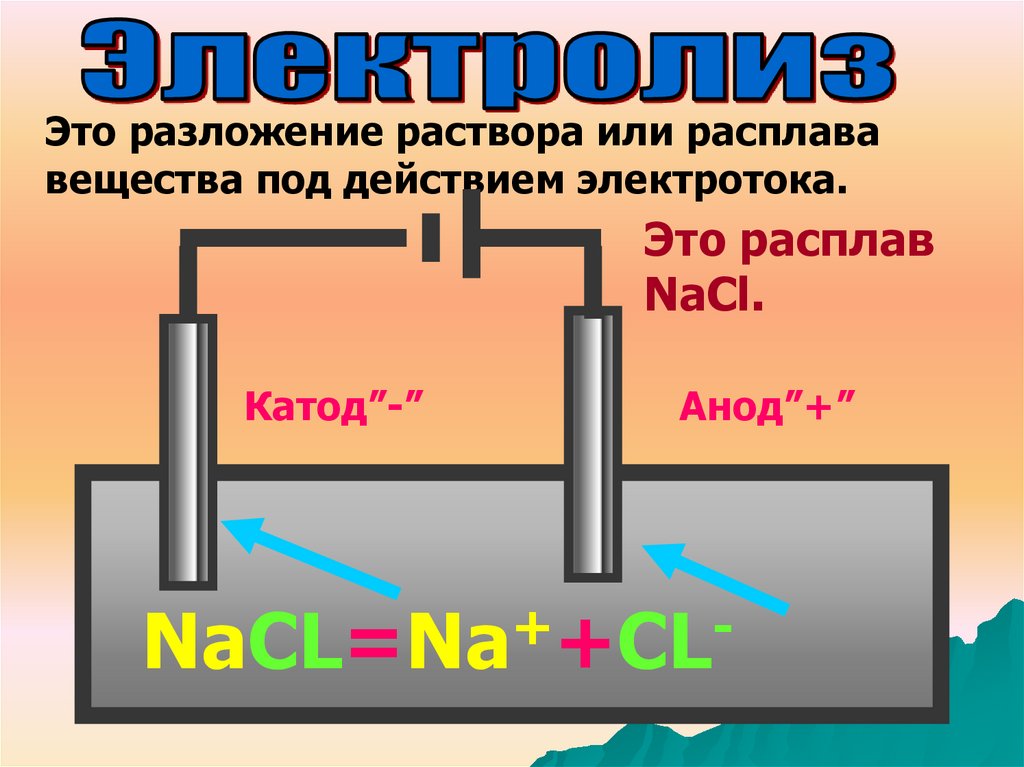
16.
Это разложение раствора или расплававещества под действием электротока.
Это расплав
NaCl.
Катод”-”
Анод”+”
+
NaCL=Na +CL
17.
+o
Na +ē=Na
Общее
уравнение:2NaCl
=2Na+CL2
2Сl -2ē=Сl
2
Так получают щелочные и
щелочноземельные
Ме(Li,K,Na,Ba,Mg)
18.
Au,Cu-первые Ме,освоенные людьми.Au-самый пластичный Ме(из 0,5 г
делают проволоку до 1 км.)
Ag-лучший проводник
Cr-самый твердый
W-самый тугоплавкий(tпл=3420оС)
Hg-самый низкоплавкий(tпл=-38,9оС)
Os-самый тяжелый(ρ=22,5г\см3)
Li-самый легкий(ρ=0,53г\см3)












 Химия
Химия








