Похожие презентации:
Спирти. 3агальна характеристика спиртів
1. СПИРТИ
1.2.
3.
4.
5.
6.
7.
8.
9.
3агальна
характеристика
спиртів.
Будова,
ізомерія,
номенклатура.
Способи одержання одноатомних насичених спиртів.
Хімічні властивості одноатомних насичених спиртів.
Двоатомні спирти (гліколі). Будова, ізомерія, номенклатура.
Способи одержання двоатомних спиртів.
Хімічні властивості двоатомних спиртів.
Триатомні спирти (гліцерини). Будова, ізомерія, номенклатура.
Способи одержання триатомних спиртів.
Хімічні властивості триатомних спиртів.
2.
Спирти (лат. spiritus – дух, душа) – похідні вуглеводнів, вмолекулах яких один або декілька атомів Гідрогену біля
насиченого атома Карбону заміщені на гідроксигрупу – ОН.
Експериментально доведено, що кількість гідроксилів в молекулі
спирту не може перевищувати кількості карбонових атомів, і дві
гідроксильні групи біля одного атома Карбону не можуть бути
стійкими, тобто відщеплюється молекула води і утворюється
нова речовина.
Класифікація
Залежно
від
природи
радикала
розрізняють
ациклічні
(аліфатичного ряду) і циклічні спирти; кількості гідроксильних
груп – одно-, дво-, три- і багатоатомні спирти; насиченості –
насичені і ненасичені; місця розміщення гідроксильної групи в
карбоновому ланцюзі – первинні, вторинні і третинні спирти.
Насичені одноатомні спирти
Насичені одноатомні спирти – похідні алканів, в молекулі яких один
атом Гідрогену заміщений на гідроксигрупу– ОН. Іноді їх
називають алканолами (араб, all-kuhl – тонкий порошок).
3.
Гомологічний рядЗагальна формула – СН2n+1ОН. Гомологічний ряд і історичні
назви такі:
СН3ОН – метиловий спирт,
С2Н5ОН – етиловий спирт,
С3Н7ОН – пропіловий спирт,
С4Н9ОН – бутиловий спирт,
С5Н11ОН – аміловий спирт,
С6Н13ОН – гексиловий спирт,
С7Н15ОН – гептиловий спирт,
С8Н17ОН – октиловий спирт,
С9Н19ОН – ноніловий спирт,
С10Н21ОН– дециловий спирт тощо.
4.
ІзомеріяДля спиртів характерна ізомерія карбонового ланцюга і
положення в ньому групи –ОН. Наприклад, молекулярній
формулі С4Н9ОН відповідає 4 ізомери:
CH3
CH2
CH3
CHOH
CH2
CH2
CH2OH (I)
CH3 (II)
CH3
CH
CH3
CH2OH (III)
CH3
COH
CH3 (IV)
CH3
Номенклатура
За номенклатурою ІЮПАК назви спиртів утворюються від назв
алканів за принципами тієї ж номенклатури з додаванням
суфіксу -ол, після якого цифрою вказують місце розміщення
спиртової групи в карбоновому ланцюзі. Нумерацію ланцюга
починають з того краю, ближче до якого розміщена група – ОН.
Так, ізомер І слід називати 1-бутанол, II – 2-бутанол, III – 2метил-1-пропанол, IV – 2-метил-2-пропанол.
5.
Cпособи одержання1. Гідроліз галогенопохідних алканів. Для проведення даних реакцій беруть
відповідний галогеноалкан і діють на нього КОН, NаОН, AgОН:
R
Cl + NaOH
R
OH + NaCl.
2. Гідратація алкенів. Вихідною сировиною є гази крекінгу (етилен, пропілен,
бутилен). Сірчанокисла гідратація алкенів проходить у дві стадії:
CH2 = CH2
CH3
+
CH2
OH
SO3 H
CH3
CH2
OSO3H
OSO3H + H2O
CH3
CH2OH + H2SO4
Пряму гідратацію проводять з алкенами при 300°С і тиску 8 104 кПа
(каталізатори Н3РО4, алюмосилікат з солями кадмію, міді, кобальту):
CH2=CH2 + H2O
CH3
CH2OH
3. Взаємодія оксиду Карбону (II) і Гідрогену. Метод застосовують для одержання
синтолу – суміші різних спиртів, з якої методом фракційної перегонки виділяють
окремі індивідуальні спирти (каталізатор – Ферум або Кобальт):
nCH + 2nH2
Co
t
CnH2n+1OH + (n - 1 ) H2O.
6.
Хімічні властивостіВони перш за все визначаються наявністю в молекулі спирту гідроксильної групи –ОН, в якій
атом Гідрогену відзначається високою рухливістю. Така рухливість обумовлена його
зв'язком з атомом Оксигену, який є високоелектро-негативним.
1. Реакції атома Гідрогену гідроксигрупи. Гідроген внаслідок високої рухливості
легко вступає в реакції заміщення.
а) Утворення алканолятів (алкоголятів). При дії на спирти металічного Натрію
утворюються тверді й безбарвні речовини – алканоляти (при взаємодії з метанолом –
метанолят, етанолом – етанолят тощо):
2CH 3
2C2H5ONa + H2 .
етанолят натрію
CH2OH + 2Na
б) Утворення етерів. При нагріванні спиртів з водовіднімаю-чими засобами
(наприклад, Н2S04) утворюються ангідриди спиртів – етери:
CH3
CH2O H + HO SO3H
CH3
CH2
OSO3H
t
t
CH3
CH3
CH2
OSO3H + H2O,
етилсульфатна кислота
CH2
O
діетиловий етер
CH2
CH3 + H2SO4.
7.
в) Утворення естерів. Цю реакцію називають реакцією естерифікації, вона має місце привзаємодії молекули спирту з молекулою кислоти (органічної або мінеральної). При взаємодії
спиртів з карбоновими кислотами реакція естерифікації протікає при підвищеній температурі
і в присутності сульфатної кислоти як каталізатора.
O
O
H+
CH3
CH2OH + HO
C
CH3
CH3
C
O
CH2
CH3 + H2O
етилетаноат
Швидкість реакції естерифікації залежить від природи вихідних речовин, кількісного
співвідношення реагентів, каталізатора і наявності домішок у реактивній суміші. Так,
первинні спирти реагують легше вторинних, вторинні – третинних. Реакційна активність
карбонових кислот у таких реакціях теж неоднакова і характеризується рядом:
H
COOH > CH3
COOH > C2H5
COOH > R
CH2
COOH.
2. Реакції гідроксилу, або гідрогеногрупи. Спирти не здатні дисоціювати. Вони
дають нейтральну реакцію. Гідроксильна група в деяких реакціях може
заміщуватися або відщеплюватися.
а) Утворення галогенопохідних вуглевод н і в. Ці сполуки утворюються при взаємодії спиртів з
галогенідами Фосфору, Сульфуру або з галогеноводнями:
CH3
CH2OH + HCl
H2SO4
CH3
CH2Cl + H2O.
8.
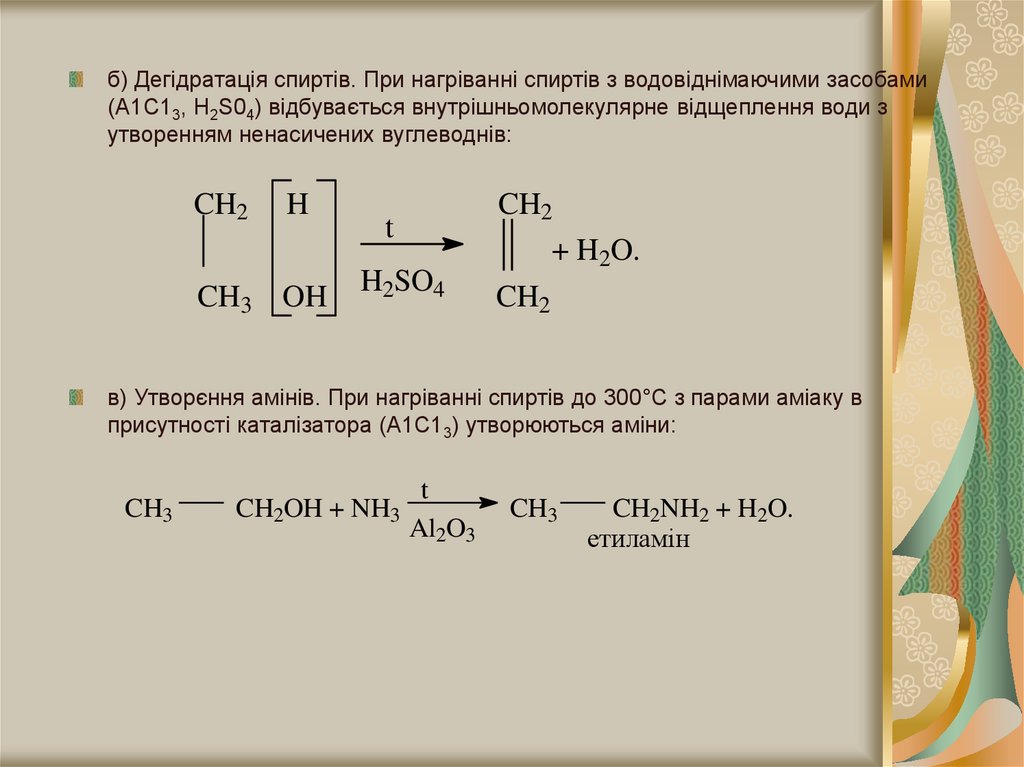
б) Дегідратація спиртів. При нагріванні спиртів з водовіднімаючими засобами(А1С13, Н2S04) відбувається внутрішньомолекулярне відщеплення води з
утворенням ненасичених вуглеводнів:
CH2
H
CH3 OH
t
H2SO4
CH2
+ H2O.
CH2
в) Утворєння амінів. При нагріванні спиртів до 300°С з парами аміаку в
присутності каталізатора (А1С13) утворюються аміни:
CH3
CH2OH + NH3
t
Al2O3
CH3
CH2NH2 + H2O.
етиламін
9.
3. Реакції окиснення. Спирти легко окиснюються, перетворюючись на різніпродукти. Найбільший інтерес викликають такі види окиснення.
а) Горіння спиртів. Кисень повітря при високій температурі окиснює спирти
(метанол і етанол горять світлим полум'ям, інші – кіптявим):
2CO2 + 3H2O + 1374кДж/моль.
C2H5OH + 3O2
б) Помірне окиснення. Спирти можуть окисню-ватися розчинами перманганату
калію, бертолетової солі, хромовою сумішшю тощо, причому легше – первинні,
важче – вторинні, важко – третинні спирти. Внаслідок такого окиснення
утворюються альдегіди (первинні спирти), кетони (вторинні спирти), суміші
альдегідів і кетонів, карбонових кислот та інших речовин (третинні спирти):
OH
O
CH3
CH2OH
етанол
O
t
CH3
C
OH
H
- H2O
CH3
C
H
етаналь
10.
4. Реакції радикала спирту. Атоми Гідрогену радикала здатні
заміщуватися різними атомами та групами атомів, внаслідок чого
утворюються нові класи сполук.
а) Заміщення атома Гідрогену галогенами. Прикладом може бути
одержання нарколану, або авертину – наркотичної речовини, яку
застосовують у медицині та ветеринарії:
CH3
CH2OH + 3Br
CBr3CH2OH + 3HBr.
нарколан
б) Одержання аміноспиртів. Реакція протікає у два етапи: спочатку
утворюється галогенопохідне спирту, потім – аміноспирт
CH3
CH2Br
CH2OH + Br
CH2OH + NH3
:
CH2Br
CH2OH + HBr.
брометиловий спирт
CH2NH2
CH2OH + HBr.
11.
Двоатомні спирти (гліколі, або алкандіоли)Двоатомні насичені спирти, або гліколі,– похідні алканів, в молекулах яких два
атоми Гідрогену біля двох атомів Карбону заміщені на гідроксигрупи.
Гомологічний ряд
Загальна формула – СnН2n(ОН)2. Гомологічний ряд: СН2ОН-СН2ОН, СН2ОН-СН2СН2ОН тощо.
Ізомерія і номенклатура
Для гліколів характерна ізомерія карбонового радикала і розміщення в
карбоновому ланцюзі груп –ОН. За основу раціональної номенклатури гліколей
беруть тривіальну назву алкену, до якої додають слово «гліколь». Наприклад,
СН2ОН–СН2ОН – етиленгліколь.
За номенклатурою ІЮПАК до назви відповідного алкану додають суфікс -діол,
перед назвою цифрами вказують місце розміщення спиртових груп у ланцюзі:
СН3 - СНОН - CH2 - СН2ОН.
1,3-бутандіол
12.
Способи одержання1. Гідроліз дигалогенопохідних алканів:
CH3
CHCl
CH2
2,4-дихлорпентан
CHCl
CH3 + 2HOH -2HCl
CH2
CHOH
2,4-пентадіол
2. Гідроксилювання алкенів (реакція Вагнера):
CH3
CH3
CH
пропен
CHOH
CH2 + H2O + O(KMnO4)
CH3.
CH3
CHOH
CH2OH.
1,2-пропандіол
3. Гідроліз галогеногідринів:
CH2CI
CH2OH + H2O
хлорентанол
CH2OH
CH2OH + HCl.
1,2-етанол
13.
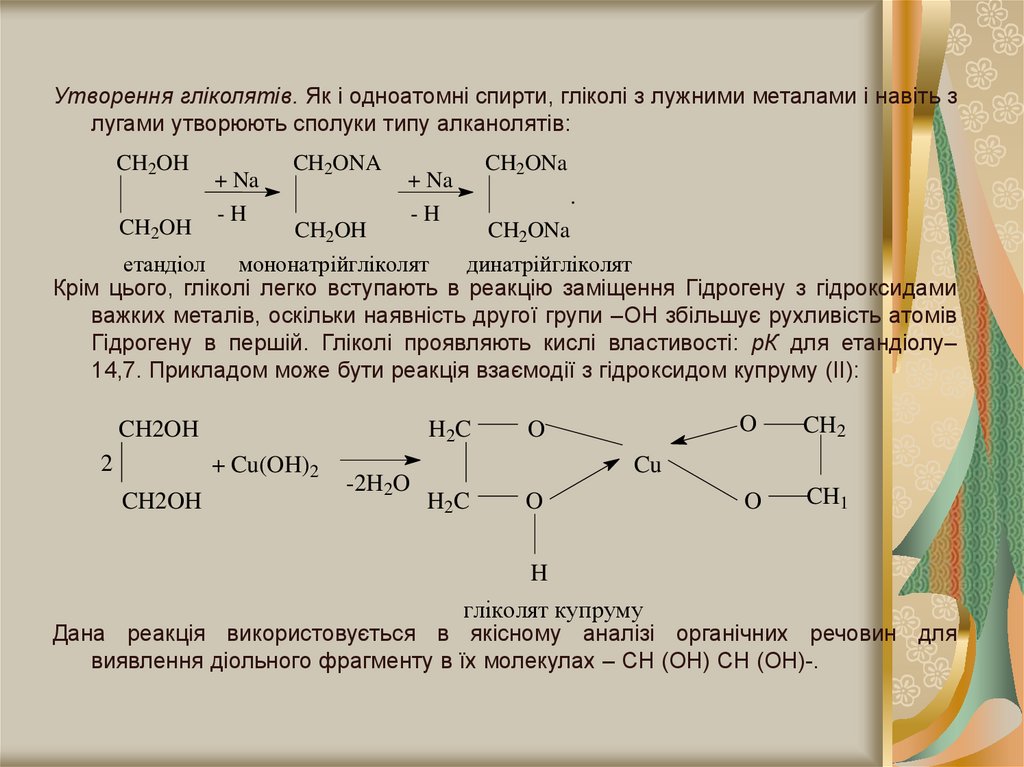
Утворення гліколятів. Як і одноатомні спирти, гліколі з лужними металами і навіть злугами утворюють сполуки типу алканолятів:
CH2OH
CH2OH
+ Na
-H
CH2ONA
CH2ONa
+ Na
-H
.
CH2OH
CH2ONa
етандіол мононатрійгліколят
динатрійгліколят
Крім цього, гліколі легко вступають в реакцію заміщення Гідрогену з гідроксидами
важких металів, оскільки наявність другої групи –ОН збільшує рухливість атомів
Гідрогену в першій. Гліколі проявляють кислі властивості: рК для етандіолу–
14,7. Прикладом може бути реакція взаємодії з гідроксидом купруму (II):
CH2OH
2
H2C
+ Cu(OH)2
CH2OH
-2H2O
O
O
CH2
O
CH1
Cu
H2C
O
H
гліколят купруму
Дана реакція використовується в якісному аналізі органічних речовин для
виявлення діольного фрагменту в їх молекулах – СН (ОН) СН (ОН)-.
14.
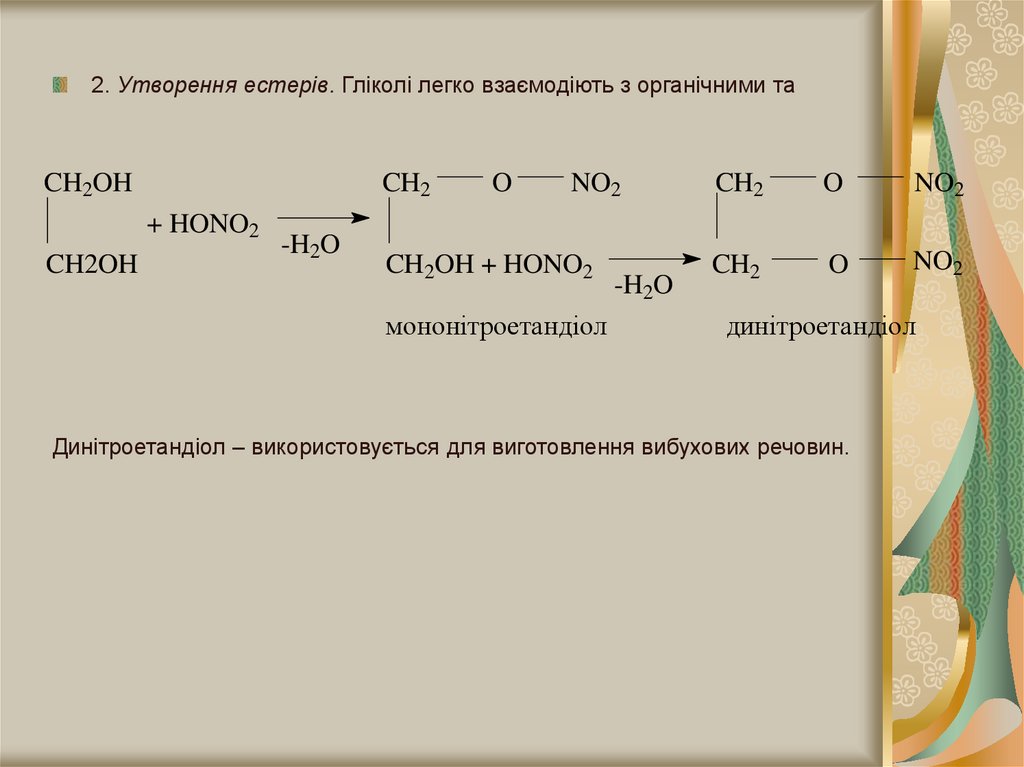
2. Утворення естерів. Гліколі легко взаємодіють з органічними таCH2OH
CH2
+ HONO2
CH2OH
-H2O
O
NO2
CH2OH + HONO2
мононітроетандіол
-H2O
CH2
O
NO2
CH2
O
NO2
динітроетандіол
Динітроетандіол – використовується для виготовлення вибухових речовин.
15.
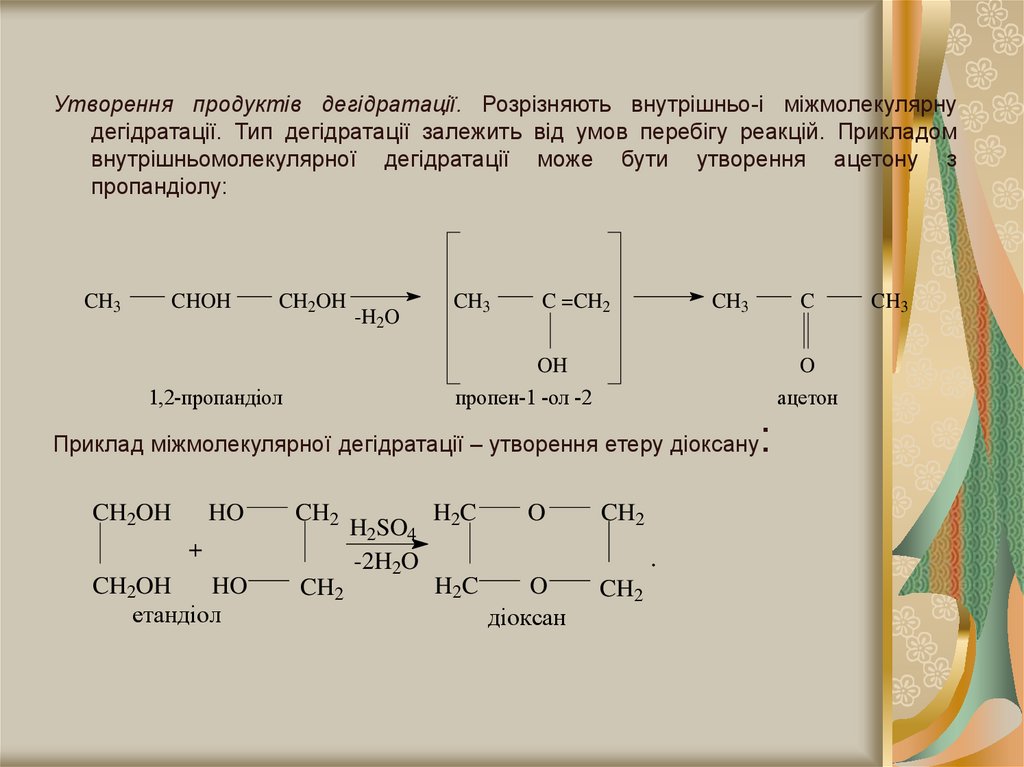
Утворення продуктів дегідратації. Розрізняють внутрішньо-і міжмолекулярнудегідратації. Тип дегідратації залежить від умов перебігу реакцій. Прикладом
внутрішньомолекулярної дегідратації може бути утворення ацетону з
пропандіолу:
CH3
CHOH
CH2OH
-H2O
CH3
C =CH2
CH3
C
OH
пропен-1 -ол -2
1,2-пропандіол
O
ацетон
:
Приклад міжмолекулярної дегідратації – утворення етеру діоксану
CH2OH
HO
CH2
+
CH2OH
HO
етандіол
CH2
H2SO4
-2H2O
H2C
O
CH2
.
H2C
O
діоксан
CH2
CH3
16.
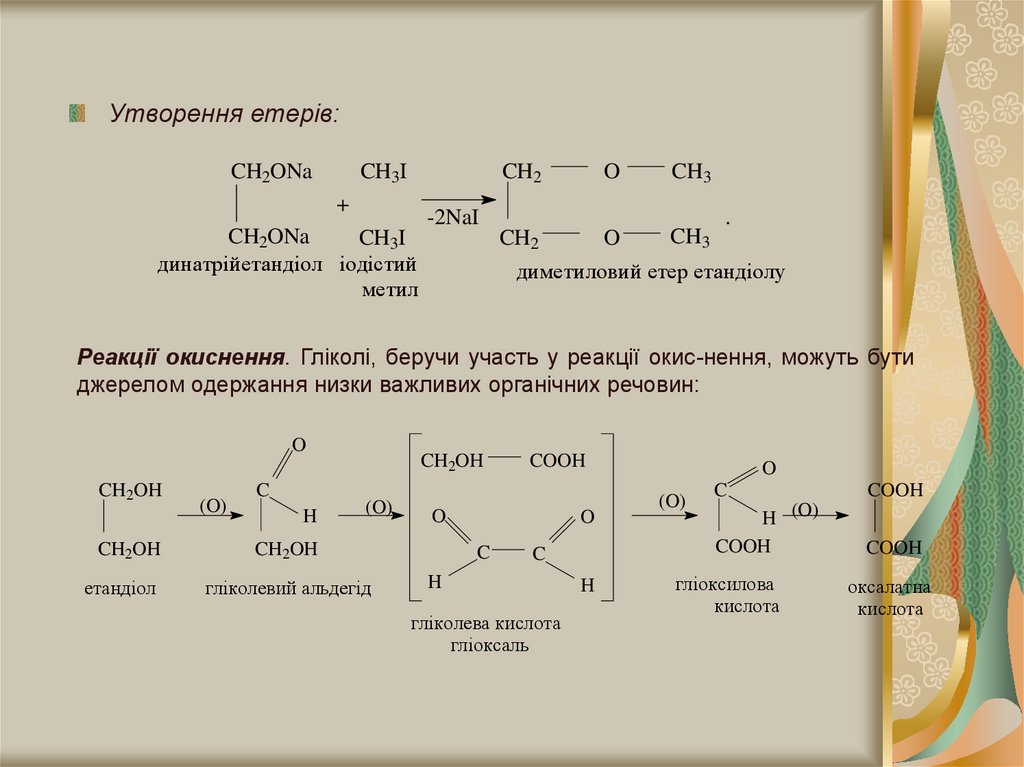
Утворення етерів:CH2ONa
CH3I
CH2
+
CH2ONa
CH3I
динатрійетандіол іодістий
метил
O
-2NaI
CH3
CH3
.
CH2
O
диметиловий етер етандіолу
Реакції окиснення. Гліколі, беручи участь у реакції окис-нення, можуть бути
джерелом одержання низки важливих органічних речовин:
O
CH2OH
(O)
C
H
CH2OH
(O)
CH2OH
CH2OH
етандіол
гліколевий альдегід
COOH
O
O
C
C
H
гліколева кислота
гліоксаль
H
O
(O)
C
COOH
H (O)
COOH
COOH
гліоксилова
кислота
оксалатна
кислота
17.
Триатомні спирти (гліцерини, або алкантріоли)Алкантріоли – похідні алканів, у молекулах яких три атома Гідрогену біля
різних атомів Карбону заміщені на гідроксигрупу – ОН.
Гомологічний ряд
Загальна формула – СnН2n-1(ОН)3. Гомологічний ряд: СН2ОН- СНОНСН2ОН, СН2ОН- СНОН--СНОН- СН3, СН2ОН- СНОН- СН2- СН2ОН тощо.
Ізомерія і номенклатура
Для найменування спиртів найчастіше використовується номенклатура
ІЮПАК. Називаючи спирт, до найменування вуглеводню додають суфікс
-тріол, перед яким цифрами вказують місце розміщення спиртових груп
у карбоновому ланцюзі. Згідно з цим наведені вище перші дві формули
спиртів за номенклатурою ІЮПАК називаються так: 1,2,3-пропантріол,
1,2,3-бутантріол, 1,2,4-бутантріол.
18.
Способи одержання1. Гідроліз жирів (одержання гліцерину):
CH2
O
CO
R1
CH2OH
R1
COOH
CH2
O
CO
R2 + 3H2O
CHOH
+ R2
COOH
CH2
O
CO
R3
CH2OH
R3
COOH
гліцерин
вищі жирні
кислоти
жир
19.
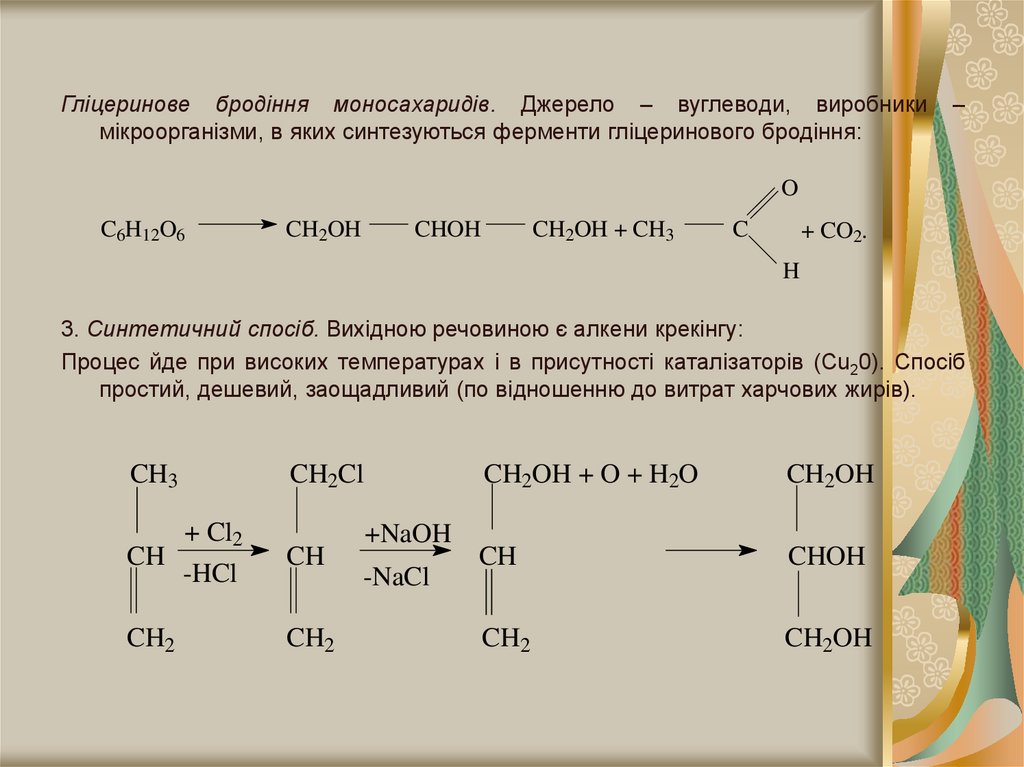
Гліцеринове бродіння моносахаридів. Джерело – вуглеводи, виробникимікроорганізми, в яких синтезуються ферменти гліцеринового бродіння:
–
O
C6H12O6
CH2OH
CHOH
CH2OH + CH3
C
+ CO2.
H
3. Синтетичний спосіб. Вихідною речовиною є алкени крекінгу:
Процес йде при високих температурах і в присутності каталізаторів (Сu20). Спосіб
простий, дешевий, заощадливий (по відношенню до витрат харчових жирів).
CH3
CH2Cl
+ Cl2
CH
-HCl
CH
CH2
CH2
+NaOH
-NaCl
CH2OH + O + H2O
CH2OH
CH
CHOH
CH2
CH2OH
20.
Хімічні властивостіТріоли вступають у ті ж самі реакції, що й алкандіоли.
1. Утворення гліцератів. Гліцерин і всі триатомні спирти здатні утворювати
гліцерати з лужними і лужноземельними металами:
CH2OH
CHOH
CH2OH + Cu(OH)2
CH2
CH
O
O
Cu
гліцерат купруму
CH2OH + H2O
21.
Утворення естерів. При взаємодії з жирними кислотами тріоли утворюютьтригліцериди (жири, олії):
CH2OH
CHOH
CH2
O
CO
C17H35
+ 3C17H35COOH
CH
O
CO
C17H35 + 3H2O.
CO
C17H35
стеаринова кислота
O
CH2
тристеарин
CH2OH
22.
Вони можуть взаємодіяти з мінеральними кислотами. Наприклад, привзаємодії з нітратною кислотою утворюється три-нітрогліцерин – хімічна
основа динаміту. В медицині та ветеринарії він застосовується для
лікування серцево-судинних захворювань у вигляді спиртових розчинів:
CH2O H
HO NO2
CH2
O
NO2
CHO H + HO NO2
CH
O
NO2 + 3H2O
CH2O H
CH2
O
NO2
тринітрогліцерин
HO NO2
23.
На особливу увагу заслуговують естери гліцерину і ортофосфорної кислоти –гліцерофосфати:
Гліцерофосфати – продукти проміжного обміну вуглеводів і ліпідів у організмі
людини і тварин. З них в тканинах і клітинах утворюються нейтральні жири,
фосфатиди, глюкоза і глікоген. Гліцерофосфати – джерело хімічної енергії, що
виділяється при реакціях окислювального фосфорилування у вигляді
аденозинтрифосфорної кислоти (АТФ) та її структурних аналогів.
CH2
OH
OH
CH
OH + HO
P
O
CH2
OH
CH
OH
+ H2O
OH
CH2
OH
OH
CH2
ортофосфатна
кислота
O
P
гліцерофосфат
O
OH
Кальцієву сіль -гліцерофосфату – білий кристалічний порошок, розчинний у воді (1
: 40), в медицині та ветеринарії застосовують як серцево-судинний лікувальний
засіб:
CH2 OH
CH
OH
O
CH2
O
P
Ca . H2O
O
O
24.
.Окиснення. При дії окиснювачів (хромової
перманганату калію) тріоли окиснюються:
суміші,
бертолетової
солі,
O
CH2OH
2 CHOH + 2O
CH2OH
CH2OH
C
H
C
C
OH + H2O
O +H
CH2OH
діоксиацетон
CH2OH
гліцериновий альдегід
CH2OH
CH2Cl
CH2Cl
+HCl
CHOH
+H2O
+HCl
CHOH
-H2O
CHOH
CH2OH
CH2OH
CH2Cl
монохлоргідрин дихлоргідрин
Утворення галогенопохідних. При взаємодії молекул спиртів з галогеноводнями
утворюються моно- і дигалогенопохідні тріодів:


















 Химия
Химия








