Похожие презентации:
Основы термодинамики
1.
company nameОсновы
термодинамики
1) теплота и работа
3) изопроцессы
2) первое начало
термодинамики
4) адиабатический
процесс
2.
Основытермодинамики
Теплота и работа
Энергия, передаваемая от одного тела к другому при контакте
(непосредственно или через третье тело) или путем излучения
называется количеством теплоты или просто теплотой.
company name
Теплота – это энергия, передаваемая на молекулярном уровне от
молекул одного тела молекулам другого.
Теплота – мера передачи энергии микроскопического (молекулярного)
движения от одного тела к другому
Q
Дж
3.
Основытермодинамики
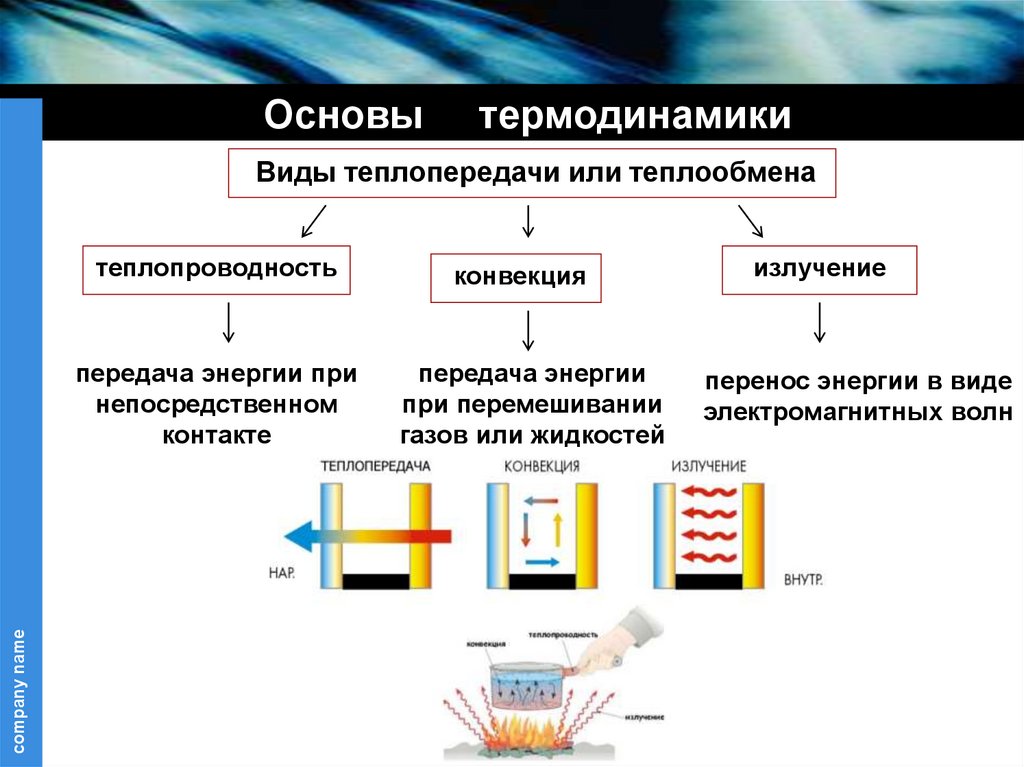
company name
Виды теплопередачи или теплообмена
теплопроводность
конвекция
передача энергии при
непосредственном
контакте
передача энергии
при перемешивании
газов или жидкостей
излучение
перенос энергии в виде
электромагнитных волн
4.
Основытермодинамики
Работа – мера передачи энергии макроскопического движения
Газ совершает работу перемещая поршень
A
Дж
Элементарная работа при изменении
объема газа:
F
dA Fdx PSdx PdV
F - сила давления газа на поршень
F PS, P - давление газа, S - площадь поршня,
company name
Fвнеш - внешняя сила, действующая на поршень
dx - элементарное перемещение поршня
dV Sdx - изменение объема газа
5.
Основытермодинамики
dA PdV
Элементарная работа при изменении объема газа:
dV 0
газ расширяется
dA 0
dV 0
газ сжимается
dA 0
Теплоемкость
Теплоемкость тела – физическая величина, численно равная
количеству теплоты, которое необходимо подвести к телу для
изменения его температуры на 1 K
Дж
company name
dQ
cT
dT
К
Удельная теплоемкость – физическая величина, численно равная
количеству теплоты, которое необходимо для нагревания единицы
массы вещества на 1 K
1 dQ
c уд
m dT
Дж
кг К
6.
Основытермодинамики
Молярная теплоемкость – физическая величина, численно равная
количеству теплоты, которое необходимо для нагревания единицы
количества вещества (1 моля) на 1 K
Дж
моль К
Связь между удельной и молярной теплоемкостями
1 dQ M dQ
cm
dT m dT
1 dQ
c уд
m dT
company name
1 dQ
cm M
M c уд
m dT
m
M
M - молярная масса
cm M c уд
7.
Первоеначало
термодинамики
это закон сохранения энергии, связывающий изменения энергий
макро и микроскопического движений термодинамической системы
Количество теплоты, сообщенное системе
идет на увеличение внутренней энергии
системы и на совершение системой работы
над внешними силами.
Q A dU
company name
dU Q A
A Q dU
Изменение внутренней энергии тела равно
количеству теплоты, сообщенной системе, и
работе,
совершаемой
над
системой
внешними силами.
Работа,
совершаемая
системой
равна
разности между количеством теплоты,
сообщенной системе, и изменением ее
внутренней энергии.
8.
Первоеначало
термодинамики
Невозможен вечный двигатель первого рода, совершающий работу в
большем количестве, чем получаемая им извне энергия.
Полная энергия замкнутой системы тел остается постоянной .
Полная энергия равна сумме механической энергии движения тел
системы и энергии частиц, образующих тела (внутренней энергии).
Q A dU
A P dV
company name
Q dU P dV
Первое начало термодинамики не указывает направление процессов
превращения энергии.
9.
Изопроцессы в газахИзопроцессы – процессы, происходящие при условии постоянства
одного из термодинамических параметров P , V , T
1) изотермический
2) изобарический
3) изохорический
T const
P const
V const
Изохорический процесс
Уравнение изохорического процесса
company name
m
PV
RT , V const
M
P
const
T
V const
dV 0
P,T const
m R
P
T
MV
10.
Изопроцессы в газахИзохорический процесс
1-ый закон термодинамики:
Q A dU
A P dV 0
V const
dV 0
P,T const
Работа в изохорном процессе:
A P dV 0
Молярная теплоемкость в изохорном процессе:
company name
dQ
cv
dT v const
dU i
cv
R
dT 2
Q dU
i
U RT
2
dU cv dT
Q dU
Вся подводимая
теплота идет на
увеличение
внутренней
энергии газа
11.
Изопроцессы в газахИзобарический процесс
m
PV
RT
M
P const
1-ый закон термодинамики:
company name
Q A dU
A P dV
V
const
T
P const
dP 0
V ,T const
Q dU PdV
Подводимая теплота идет на
увеличение внутренней энергии
газа и на совершение работы
m R
V
T
M P
12.
Изопроцессы в газахИзобарический процесс
Работа в изобарном процессе:
P const
dP 0
V ,T const
A dA
V2
A P dV P V2 V1
V1
Молярная теплоемкость в изобарном процессе:
company name
dQ
cp
dT
p const
Q dU PdV
i
U RT , PV RT
2
dU PdV
cp
dT
dT
dU i
R
dT 2
PdV
R
dT
cp
i 2
R
2
13.
Изопроцессы в газахМолярные теплоемкости
cv
c p и cv
связаны уравнением Майера:
i 2
cp
R
2
i
R
2
c p cv R
Изотермический процесс
company name
Уравнение
изотермического процесса:
m
PV
RT
M
T const
PV const
T const
dT 0
P,V const
14.
Изопроцессы в газахИзотермический процесс
1-ый закон термодинамики:
Q A dU
U
i
RdT 0
2
Q A PdV
Подводимая
теплота
целиком
расходуется
на совершение работы
company name
m R 1
P
M
P
V
15.
Изопроцессы в газахИзотермический процесс
Работа в
изотермическом процессе:
2
A dA
V2
RT
V
A
dV RT lnV V2
1
V
V
1
A RT lnV2 lnV1
1
dA PdV
RT
P
V
A RT ln
V2
V1
company name
Работа
изотермического расширения:
1 моля газа
V2
A RT ln
V1
произв.
кол-ва
m
V2
A
RT ln
M
V1
16.
Изопроцессы в газахИзотермический процесс
Теплоемкость в
изотермическом процессе:
cT
dQ
cT
dT
T const
T 0
Адиабатический процесс
это процесс, происходящий без теплообмена с окружающей средой
Q 0
company name
1-ый закон термодинамики:
Q A dU
Q 0
P,V ,T const
A dU
Газ совершает работу за счет
убыли своей внутренней
энергии
17.
Изопроцессы в газахАдиабатический процесс
A dU
dU cv dT
При адиабатическом расширении газ
охлаждается, при адиабатическом
сжатии - нагревается
Теплоемкость в
адиабатическом процессе:
dQ
cад
dT
Q 0
cад 0
company name
Q 0
Получим уравнение адиабатического процесса, .т.е. установим связь
между параметрами P, V, T
18.
Изопроцессы в газахАдиабатический процесс
Из 1-го закона термодинамики:
dA dU
dA PdV
Уравнение состояния ид. газа:
PV RT
Дифференцируем:
dU cv dT
2) PdV VdP RdT
1) PdV cv dT
company name
Делим второе уравнение на первое:
PdV VdP
RdT
PdV
cv dT
V dP
R
1
P dV
cv
VdP
R
1
PdV
cv
19.
Изопроцессы в газахАдиабатический процесс
Выполняем преобразования:
R cv R
1
cv
cv
По уравнению Майера:
c p cv R
Обозначим:
cv
После замены:
VdP
R
1
PdV
cv
company name
Разделяем переменные:
dP
dV
P
V
cp
V dP
P dV
коэффициент
Пуассона
Преобразуем:
d ln P d lnV
Вносим под знак дифференциала:
d ln P d lnV
20.
Изопроцессы в газахАдиабатический процесс
Упрощаем:
d ln P d lnV
Объединяем дифференциалы:
d ln P lnV 0
Сумма логарифмов равна
логарифму произведения
d ln P V
0
Окончательно:
PV const
Уравнение Пуассона уравнение
адиабатического процесса
или
PV const
PV RT
company name
TV 1 const
ln P V const
21.
Изопроцессы в газахАдиабатический процесс
Работа газа в адиабатическом процессе
Элементарная работа в адиабатическом процессе:
dA dU
Изменение внутренней энергии:
dU cv dT
2
T2
1
T1
cледовательно,
company name
A dA cv dT
A cv T2 T1
или с учетом преобразований
c p cv R
cp
cv
R
cv
1
R
A
T1 T2
1
22.
Изопроцессы в газахАдиабатический процесс
Работа газа в адиабатическом процессе
R
A
T1 T2
1
C учетом уравнения состояния газа и
уравнения Пуассона
PV RT ,
company name
R T1 T2
A
1
1 T1
PV const
Получим
PT
T2
1 1
A
1
1 T1
1
PT
V
A 1 1 1 1
1 V2
23.
Второе начало термодинамикиУказывает направление процессов превращения энергии
«Теплота не может сама собой переходить от тела с более низкой
температурой к телу с более высокой температурой»
Клаузиус
«В природе невозможен процесс, полный эффект которого состоял
бы в охлаждении теплового резервуара и совершении
эквивалентной работы»
Томсон, Планк
Невозможен вечный двигатель II рода, т.е. периодически
действующий двигатель, который давал бы работу за счет
охлаждения одного источника теплоты.
company name
Статистический смысл II начала термодинамики
Состояние термодинамической системы (макросостояние) с
параметрами P, V, T осуществимо различными способами
(микросостояниями), отличающимися распределением молекул по
объему, скоростям, энергиям молекул.
24.
Второе начало термодинамикиСтатистический смысл II начала термодинамики
Чем
больше
микросостояния
соответствуют
макросостоянию, тем оно более вероятно.
данному
Термодинамическая вероятность W данного макросостояния
системы равна числу микросостояний, соответствующих этому
макросостоянию.
S k ln W - энтропия системы
company name
Все процессы в замкнутой системе
протекают в сторону увеличения
термодинамической
вероятности
состояния системы.
«Энтропия
замкнутой
системы
при
любых
происходящих
в
ней
процессах
не
может
убывать»
Клаузиус
S 0
Второе начало термодинамики указывает на невозможность
перехода от менее к более вероятным состояниям системы.
25.
Второе начало термодинамикиСтатистический смысл II начала термодинамики
1) переход энергии механического движения путем совершения
работы во внутреннюю энергию тела, т.е. в энергию
беспорядочного движения молекул идет с увеличением числа
микросостояний.
Термодинамическая вероятность, энтропия
увеличивается – процесс невозможен.
company name
2) переход внутренней энергии (тепловой) в механическую означает
переход энергии хаотического движения в энергию беспорядочного
движения.
Термодинамическая
вероятность,
энтропия
уменьшаются - процесс невозможен.
26.
Закон изменения давления газа с высотой.Барометрическая формула.
Атмосфера существует благодаря силам тяготения и тепловому
движению молекул.
Без теплового движения молекулы воздуха образовали бы на
поверхности Земли слой порядка 10 м толщины.
Давление с высотой уменьшается, найдем зависимость давления P
от высоты h.
P f h
Давление столба жидкости или газа
(закон Паскаля), с высотой плотность
воздуха и его состав изменяются
company name
P gh
С увеличением высоты на dh давление
уменьшается на dP
dP gdh
27.
company nameБарометрическая
формула
28.
Барометрическаяформула
Из уравнения состояния идеального газа
m
PV
RT
M
Выражаем плотность газа
m
V
m RT RT
P
V M
M
Подставляем
Разделяем переменные
PM
dP gdh
gdh
RT
company name
Интегрируем
PM
RT
P
h
dP
gM
P RT dh
P
0
0
dP
gM
dh
P
RT
gM
ln P ln P0
h
RT
29.
Барометрическаяформула
P
gM
ln
h
P0
RT
gM
ln P ln P0
h
RT
Потенциируем, получаем закон изменения давления газа с высотой
P P0 e
P gM
ln
h
P0 RT
gM
h
RT
RT P0
h
ln
gM P
company name
Барометрическая формула
(позволяет определить высоту с помощью барометра)
30.
Барометрическаяформула
Получим закон изменения концентрации молекул газа с высотой
P P0 e
gM
h
RT
P nkT
Примеры:
1) Давление воздуха падает в 2 раза
на высоте h=6000 м
(T=300 K, M=29 г/моль)
M m Na m
R k Na k
n n0e
mgh
kT
company name
2) Содержание кислорода (концентрация молекул) падает в 2 раза
на высоте h=5400 м (T=300 K, M=32 г/моль)
3) Содержание водорода (концентрация молекул) падает в 2 раза на
высоте h=90000 м (T=300 K, M=2 г/моль)
31.
Распределение БольцманаЭто распределение молекул по значениям потенциальной энергии в
поле консервативных сил
n n0e
mgh
kT
Частный случай: концентрация молекул газа в поле сил тяжести
уменьшается с высотой по экспоненциальному закону.
mgh - потенциальная энергия молекул в поле сил тяжести
Wпот mgh
n n0e
пот
kT
W
Распределение
Больцмана
company name
n n0 Wпот 0
Распределение Больцмана справедливо не только для поля сил
тяготения, но и для любых консервативных сил для совокупности
любых одинаковых частиц в состоянии хаотического теплового
движения.






























 Физика
Физика








