Похожие презентации:
Химия биологически активных веществ и химфармпрепаратов
1.
Химия биологически активныхвеществ и химфармпрепаратов
Лекция 9
Биологически активные вещества –
производные фурана и тиофена
O
S
Лектор – профессор каф. органической и биомолекулярной химии,
д.х.н. Носова Э.В.
1
2.
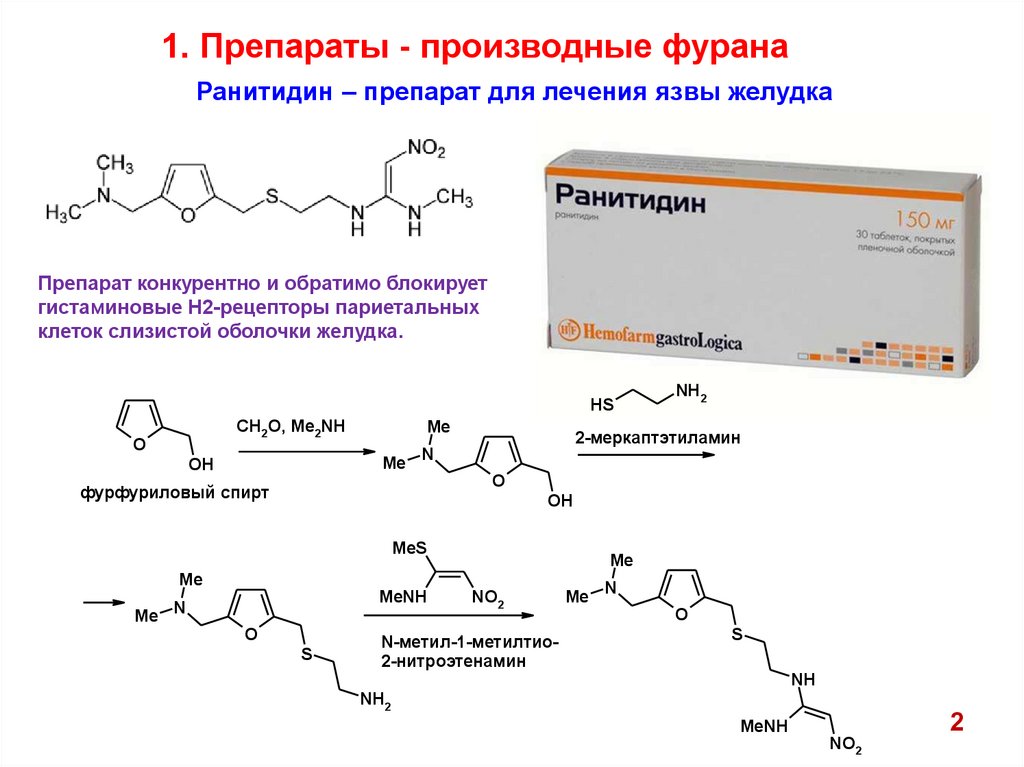
1. Препараты - производные фуранаРанитидин – препарат для лечения язвы желудка
Препарат конкурентно и обратимо блокирует
гистаминовые Н2-рецепторы париетальных
клеток слизистой оболочки желудка.
HS
CH2O, Me2NH
O
Me
Me
OH
2-меркаптэтиламин
N
O
фурфуриловый спирт
OH
MeS
Me
Me
Me
NH2
MeNH
N
O
S
NO2
N-метил-1-метилтио2-нитроэтенамин
Me
N
O
S
NH
NH2
2
MeNH
NO2
3.
Н2-блокатор лафутидин в 2000 году выведенна рынок Японии и продаётся фирмой «Taiho
Pharmaceutical Company Ltd» под торговым
наименованием «Protecadin»
лафутидин
Н2-блокатор ниперотидин при исследованиях с
помощью суточной рН-метрии показал хорошие
результаты по угнетению кислотопродукции,
однако в результате дальнейших испытаний
выяснилось его отрицательное влияние
на печень человека
Ниперотидин
3
4.
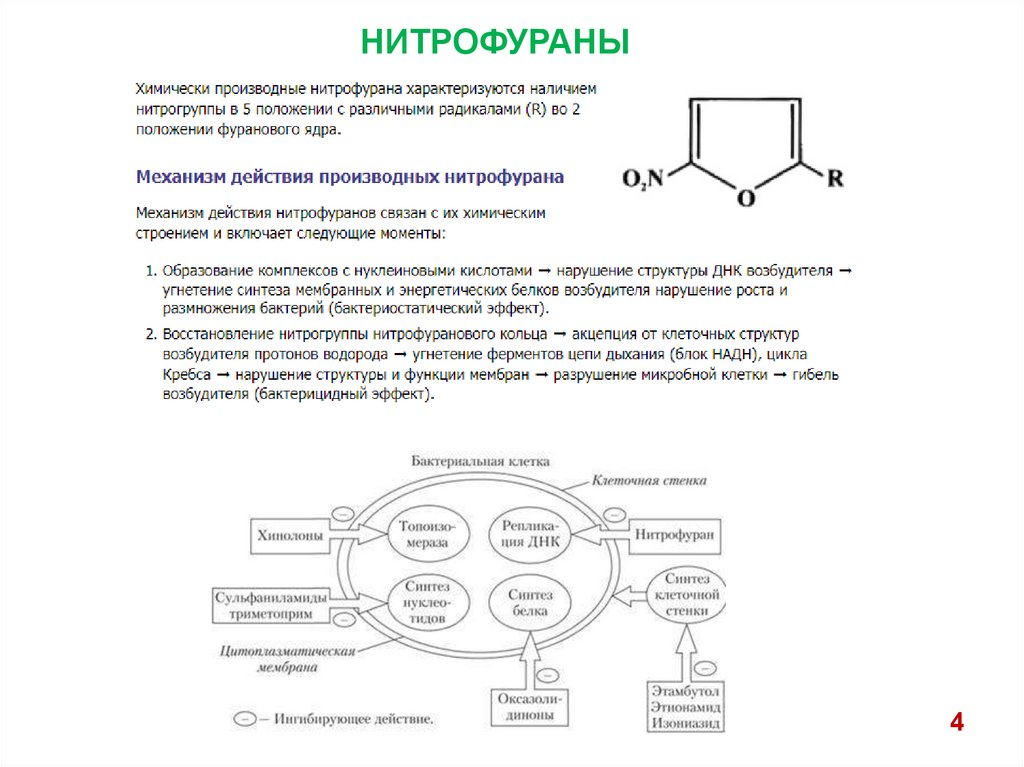
НИТРОФУРАНЫ4
5.
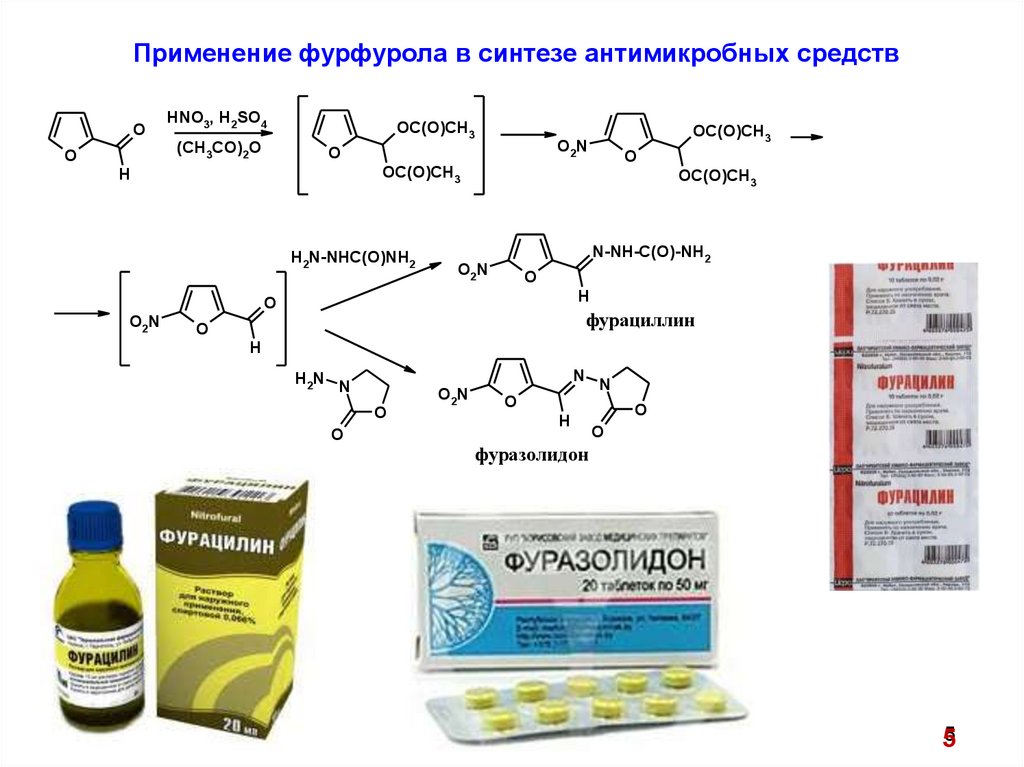
Применение фурфурола в синтезе антимикробных средствO
HNO3, H2SO4
OC(O)CH3
(CH3CO)2O
O
O
O
OC(O)CH3
H
H2N-NHC(O)NH2
OC(O)CH3
N-NH-C(O)-NH2
O2N
O
H
O
O2N
OC(O)CH3
O2N
фурациллин
O
H
H2N
N
N
O
O
O2N
O
H
N
O
O
фуразолидон
55 14
6.
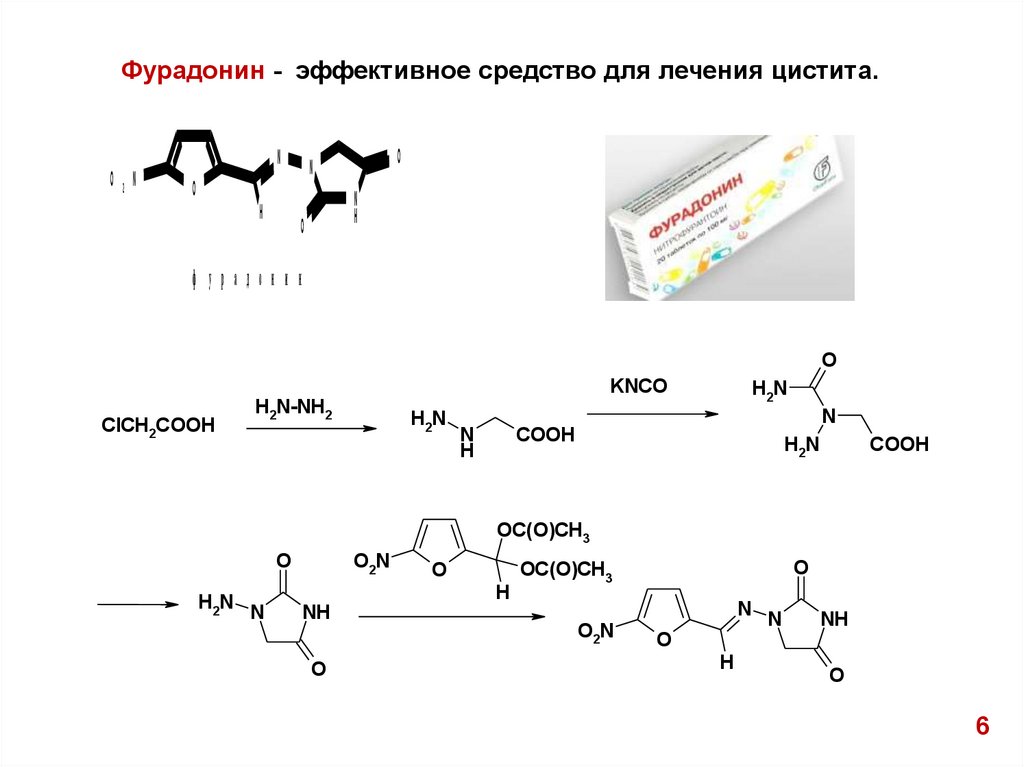
Фурадонин - эффективное средство для лечения цистита.N
O 2 N
O
H
O
N
N
H
O
ф у р а д о н и н
O
KNCO
ClCH2COOH
H2N-NH2
H2N
H2N
N
N
H
COOH
H2N
COOH
OC(O)CH3
O
H2N
O2N
O
OC(O)CH3
O
H
N
N
NH
O2N
O
N
NH
O
H
O
6
7.
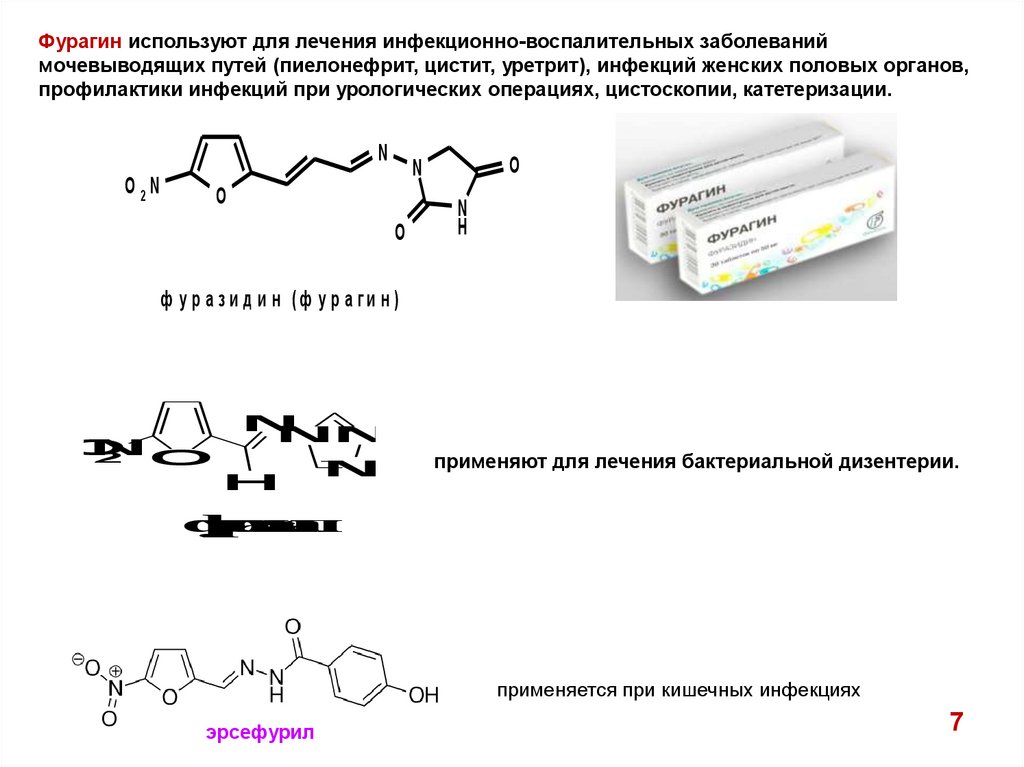
Фурагин используют для лечения инфекционно-воспалительных заболеваниймочевыводящих путей (пиелонефрит, цистит, уретрит), инфекций женских половых органов,
профилактики инфекций при урологических операциях, цистоскопии, катетеризации.
N
O2N
O
N
O
O
N
H
ф у р а з и д и н (ф у р а ги н )
O
N
2
O
N N
N
H
N
применяют для лечения бактериальной дизентерии.
ф
у
р
а
з
о
н
а
л
применяется при кишечных инфекциях
эрсефурил
7
8.
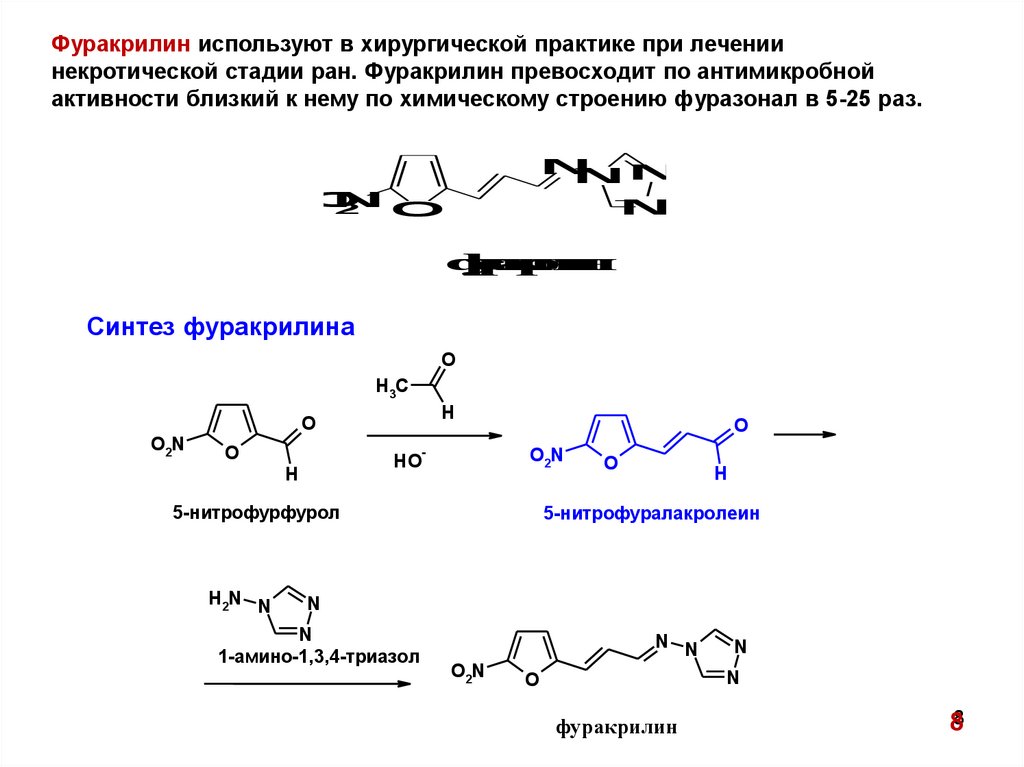
Фуракрилин используют в хирургической практике при лечениинекротической стадии ран. Фуракрилин превосходит по антимикробной
активности близкий к нему по химическому строению фуразонал в 5-25 раз.
N
NN
O
N
2
O
N
ф
у
р
а
к
р
и
л
и
н
Синтез фуракрилина
O
H3C
H
O
O2N
O
-
O2N
HO
H
O
5-нитрофурфурол
H2N N
O
H
5-нитрофуралакролеин
N
N
1-амино-1,3,4-триазол
N N
O2N
N
N
O
фуракрилин
88
9.
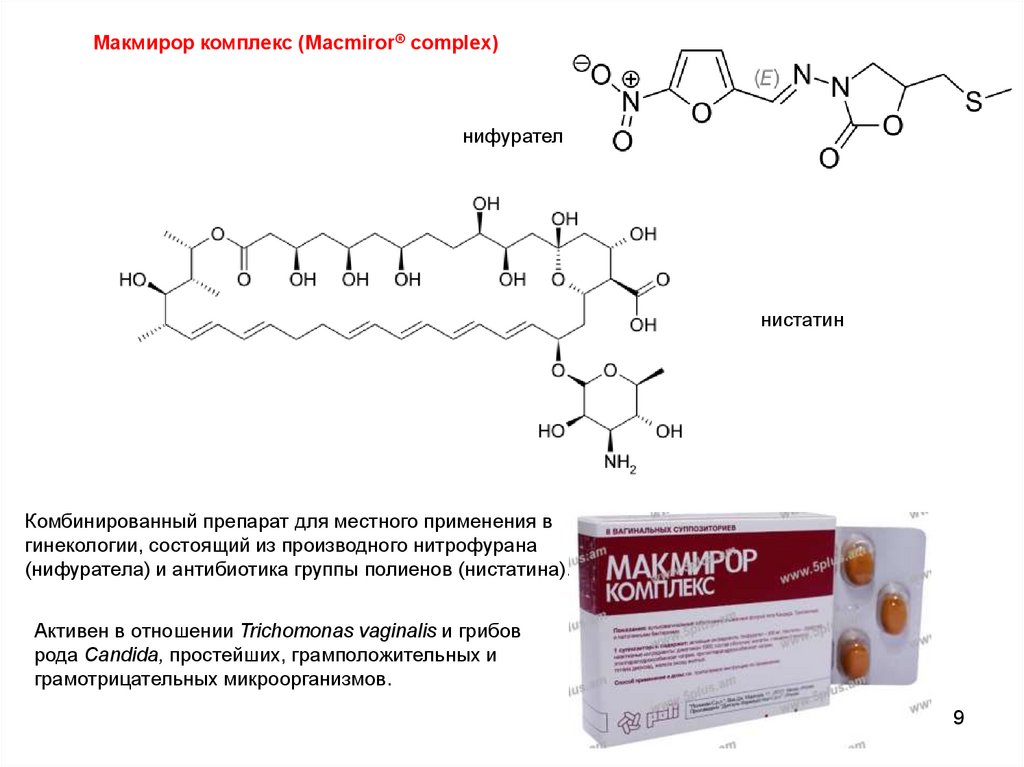
Макмирор комплекс (Macmiror® complex)нифурател
нистатин
Комбинированный препарат для местного применения в
гинекологии, состоящий из производного нитрофурана
(нифуратела) и антибиотика группы полиенов (нистатина).
Активен в отношении Trichomonas vaginalis и грибов
рода Candida, простейших, грамположительных и
грамотрицательных микроорганизмов.
9
10.
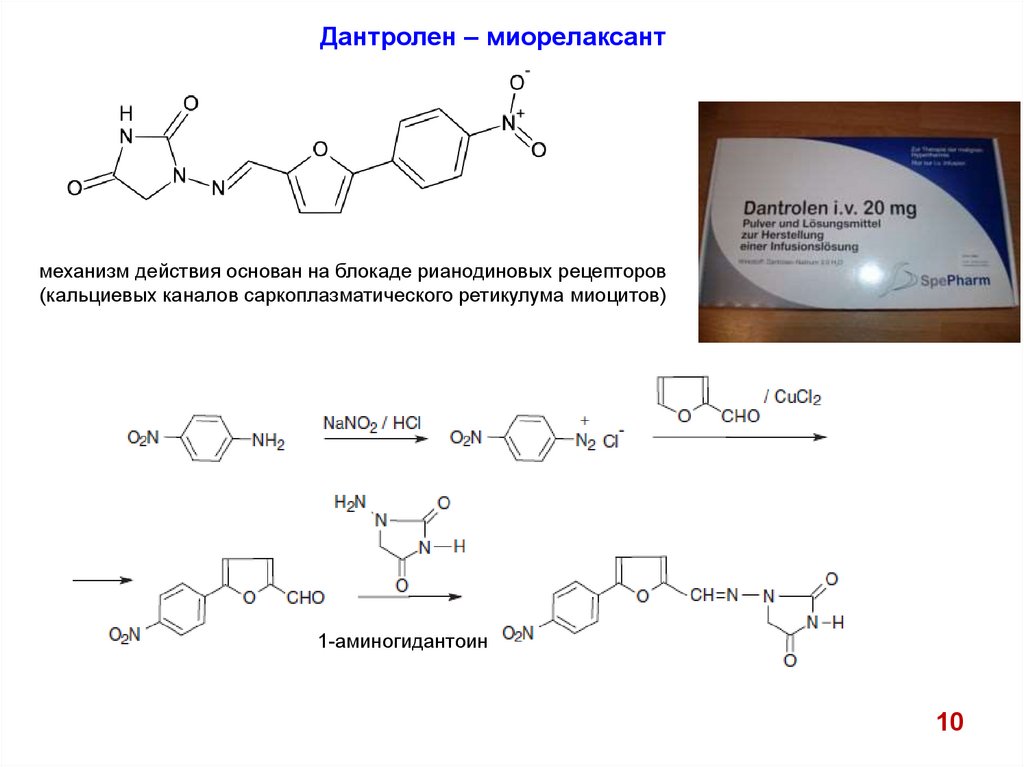
Дантролен – миорелаксантмеханизм действия основан на блокаде рианодиновых рецепторов
(кальциевых каналов саркоплазматического ретикулума миоцитов)
1-аминогидантоин
10
11.
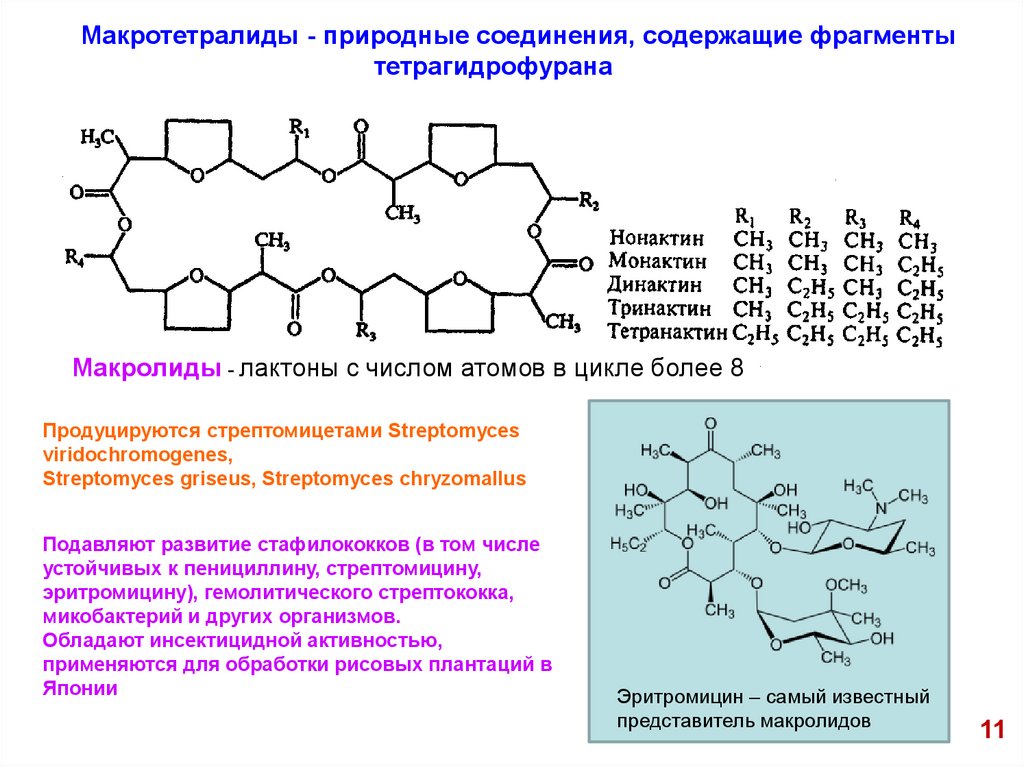
Макротетралиды - природные соединения, содержащие фрагментытетрагидрофурана
Макролиды - лактоны с числом атомов в цикле более 8
Продуцируются стрептомицетами Streptomyces
viridochromogenes,
Streptomyces griseus, Streptomyces chryzomallus
Подавляют развитие стафилококков (в том числе
устойчивых к пенициллину, стрептомицину,
эритромицину), гемолитического стрептококка,
микобактерий и других организмов.
Обладают инсектицидной активностью,
применяются для обработки рисовых плантаций в
Японии
Эритромицин – самый известный
представитель макролидов
11
12.
Ионофоры – мобильные переносчики ионов(укрывают заряд для переноса через фосфолипидный бислой
В калиевом комплексе нонактина форма цепи молекулы антибиотика напоминает
бороздку теннисного мяча, а восемь кислородных атомов сложноэфирных и простых
Эфирных группировок расположены в вершинах куба и связывают ион за счет
ион-дипольных взаимодействий. Существенно, что макротетралиды являются
наиболее селективными переносчиками для ионов аммония (NH4+)
12
13.
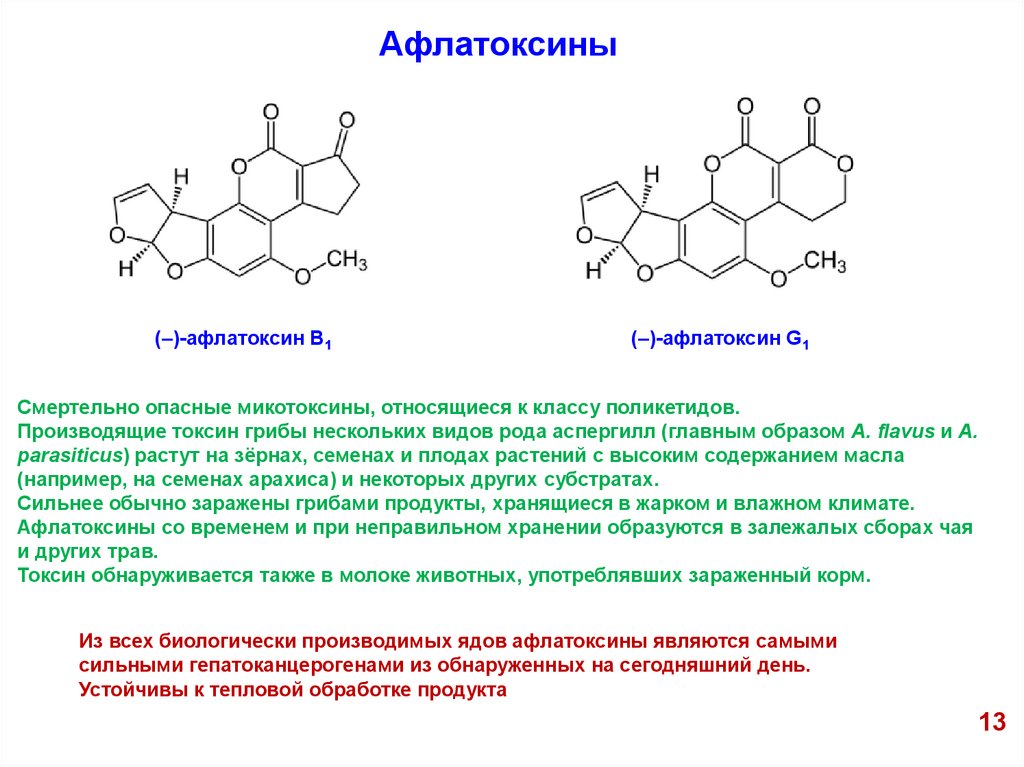
Афлатоксины(–)-афлатоксин В1
(–)-афлатоксин G1
Смертельно опасные микотоксины, относящиеся к классу поликетидов.
Производящие токсин грибы нескольких видов рода аспергилл (главным образом A. flavus и A.
parasiticus) растут на зёрнах, семенах и плодах растений с высоким содержанием масла
(например, на семенах арахиса) и некоторых других субстратах.
Сильнее обычно заражены грибами продукты, хранящиеся в жарком и влажном климате.
Афлатоксины со временем и при неправильном хранении образуются в залежалых сборах чая
и других трав.
Токсин обнаруживается также в молоке животных, употреблявших зараженный корм.
Из всех биологически производимых ядов афлатоксины являются самыми
сильными гепатоканцерогенами из обнаруженных на сегодняшний день.
Устойчивы к тепловой обработке продукта
13
14.
Аскорбиновая кислотагамма-лактон 2,3-дегидро-L-гулоновой кислоты
O
O
HO
- 2H
O
HO
HOCH2
OH
аскорбиновая кислота
(восстановленная форма)
+ 2H
O
O
O
HOCH2
OH
дегидроаскорбиновая кислота
(окисленная форма)
Оптические изомеры аскорбиновой кислоты:
1a — L-аскорбиновая кислота, 2a — L-изоаскорбиновая кислота,
1b — D-изоаскорбиновая кислота, 2b — D-аскорбиновая кислота
Содержание витамина С в некоторых растениях:
Пищевой
продукт
Содержание
витамина,
мкг/г
Пищевой
продукт
Содержание
витамина,
мкг/г
Шиповник
Облепиха
Черная
смородина
Перец красный
Хрен
2100
500
300
Клюква
Капуста
Картофель
Помидоры
100
70
30
25
250
200
Функции в организме:
антиоксидант,
участие в гидроксилировании
пролина и лизина
(при образовании коллагена),
коферментная функция
в составе фермента
тиоглюкозидазы.
Тиоглюкозид + H2O <=> сахар + тиол
При участии витамина С
происходит транспорт железа
и его включение в состав
ферритина тканей.
14
15.
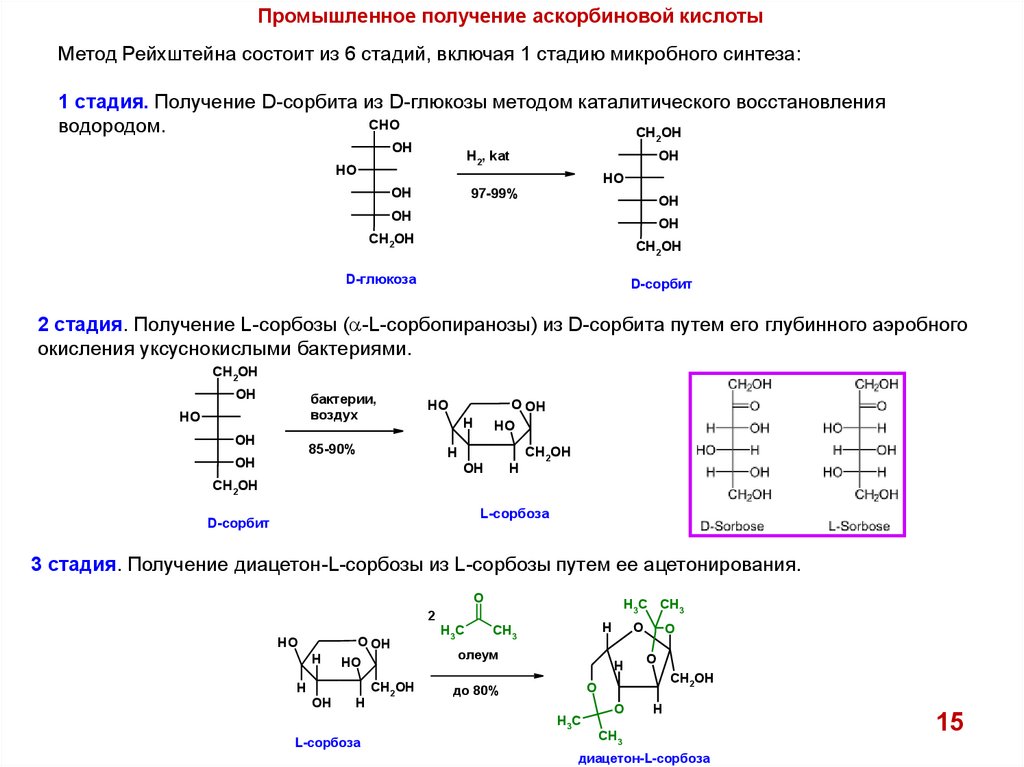
Промышленное получение аскорбиновой кислотыМетод Рейхштейна состоит из 6 стадий, включая 1 стадию микробного синтеза:
1 стадия. Получение D-сорбита из D-глюкозы методом каталитического восстановления
CHO
водородом.
CH2OH
OH
OH
H2, kat
HO
HO
OH
97-99%
OH
OH
OH
CH2OH
CH2OH
D-глюкоза
D-сорбит
2 стадия. Получение L-сорбозы (a-L-сорбопиранозы) из D-сорбита путем его глубинного аэробного
окисления уксуснокислыми бактериями.
CH2OH
OH
бактерии,
воздух
HO
OH
O OH
HO
85-90%
H
HO
OH
H
H
OH
CH2OH
CH2OH
L-сорбоза
D-сорбит
3 стадия. Получение диацетон-L-сорбозы из L-сорбозы путем ее ацетонирования.
O
H3C CH3
2
O OH
HO
H
HO
H
OH
H
CH2OH
H3C
H
CH3
олеум
H
O
O
CH2OH
O
до 80%
H3C
L-сорбоза
O
O
H
CH3
диацетон-L-сорбоза
15
16.
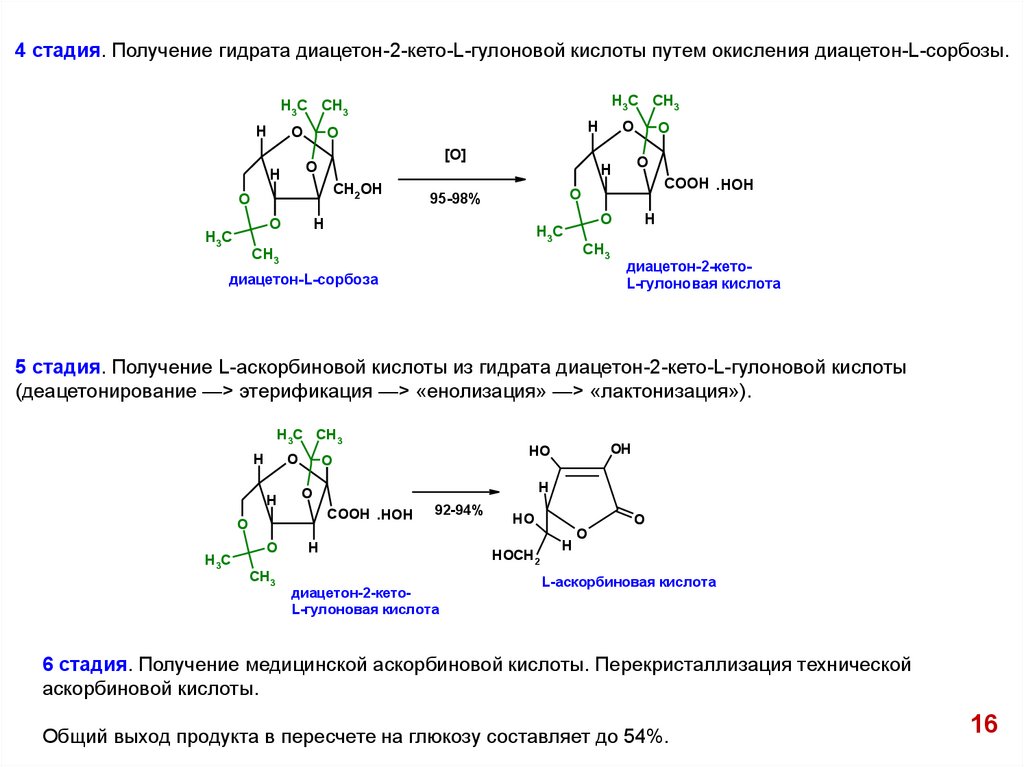
4 стадия. Получение гидрата диацетон-2-кето-L-гулоновой кислоты путем окисления диацетон-L-сорбозы.H3C CH3
H3C CH3
H
O
CH2OH
O
O
H
O
O
O
[O]
O
H
H3C
H
O
COOH .HOH
O
95-98%
H
H3C
CH3
O
CH3
диацетон-L-сорбоза
H
диацетон-2-кетоL-гулоновая кислота
5 стадия. Получение L-аскорбиновой кислоты из гидрата диацетон-2-кето-L-гулоновой кислоты
(деацетонирование —> этерификация —> «енолизация» —> «лактонизация»).
H3C CH3
H
O
H
H3C
H
O
COOH .HOH
O
O
CH3
OH
HO
O
92-94%
H
диацетон-2-кетоL-гулоновая кислота
HO
HOCH2
O
H
O
L-аскорбиновая кислота
6 стадия. Получение медицинской аскорбиновой кислоты. Перекристаллизация технической
аскорбиновой кислоты.
Общий выход продукта в пересчете на глюкозу составляет до 54%.
16
17.
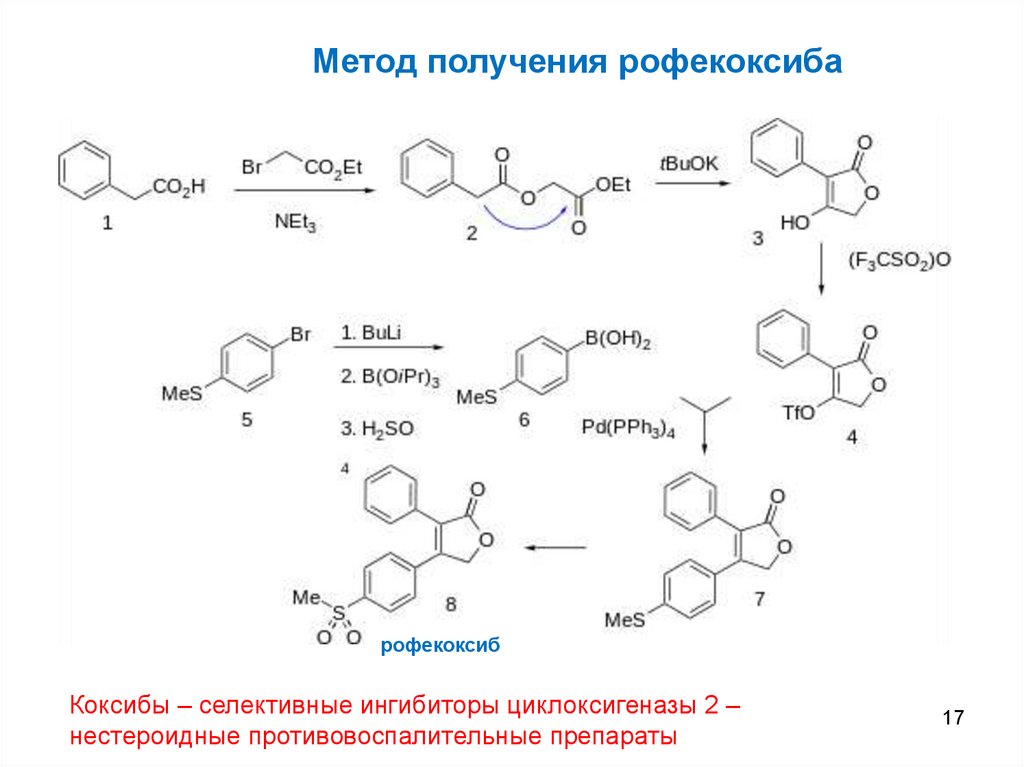
Метод получения рофекоксибарофекоксиб
Коксибы – селективные ингибиторы циклоксигеназы 2 –
нестероидные противовоспалительные препараты
17
18.
Витамин Н(биотин)
2. Препараты – производные тиофена
Из 8 оптических изомеров и 4 рацематов биологической
активностью обладает только (+)-биотин.
Наиболее важные реакции, происходящие в организме с участием биотина
1. Карбоксилирование уксусной к-ты в виде ацетил-КоА с образованием малонил-КоА:
O
OH
+ АТФ + CO2
H3C
O
KoA
+ АДФ +
H3PO4
KoA
O
Эта реакция, катализируемая ацетил-КоА-карбоксилазой,— важнейший этап
в биосинтезе жирных кислот.
2. Карбоксилирование пропионовой к-ты в виде пропионил-КоА, в результате чего
последний превращается в метилмалонил-КоА:
H3C
O
+ АТФ + CO2
KoA
H3C
O
O
KoA
+ АДФ +
H3PO4
OH
Реакция катализируется пропионил-КоА-карбоксилазой и обеспечивает утилизацию
пропионовой к-ты, образующейся при окислении жирных кислотт с разветвленным
углеродным скелетом или с нечетным числом атомов С и в других реакциях.
3. Карбоксилирование пировиноградной к-ты с образованием щавелевоуксусной кислоты
O
H3C
(оксалоацетата):
COOH + АТФ + CO2
O
+ АДФ +
O
COOH
H3PO4
OH
С помощью этой реакции, катализируемой пируваткарбоксилазой, осуществляется
непрерывное пополнение щавелевоуксусной к-ты, необходимой для бесперебойной
работы цикла трикарбоновых к-т. Кроме того, эта р-ция - начальный этап глюконеогенеза.
18
19.
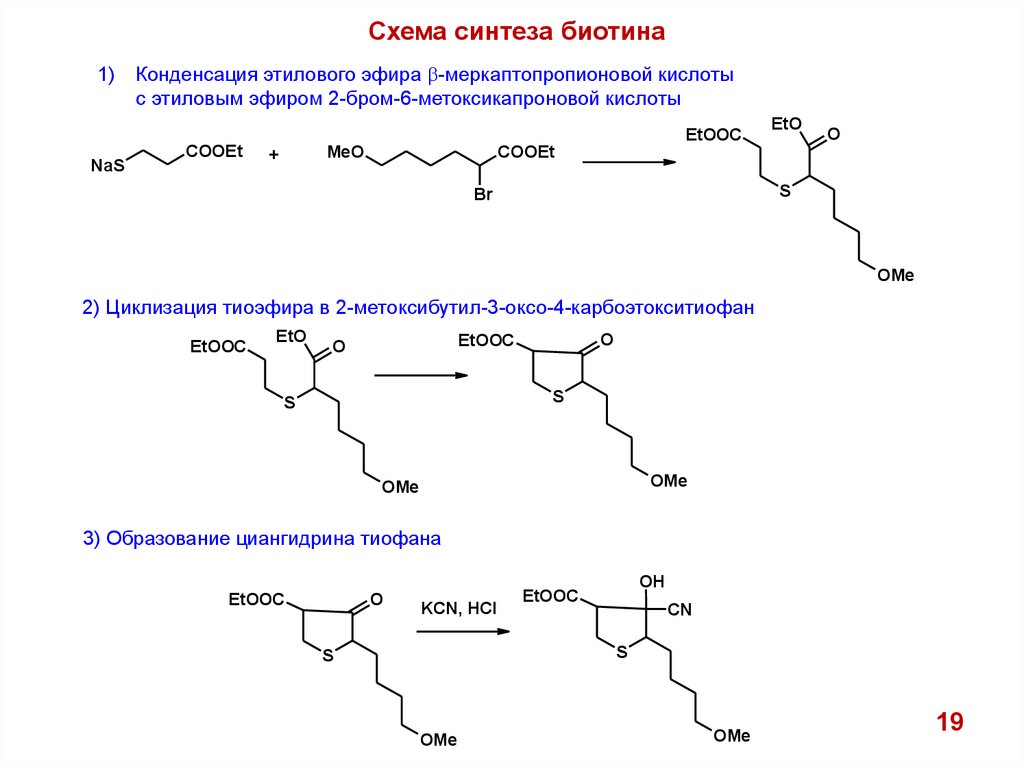
Схема синтеза биотина1)
Конденсация этилового эфира b-меркаптопропионовой кислоты
с этиловым эфиром 2-бром-6-метоксикапроновой кислоты
EtOOC
NaS
COOEt
MeO
+
EtO
O
COOEt
S
Br
OMe
2) Циклизация тиоэфира в 2-метоксибутил-3-оксо-4-карбоэтокситиофан
EtOOC
EtO
O
EtOOC
O
S
S
OMe
OMe
3) Образование циангидрина тиофана
O
EtOOC
KCN, HCl
OH
EtOOC
CN
S
S
OMe
OMe
19
20.
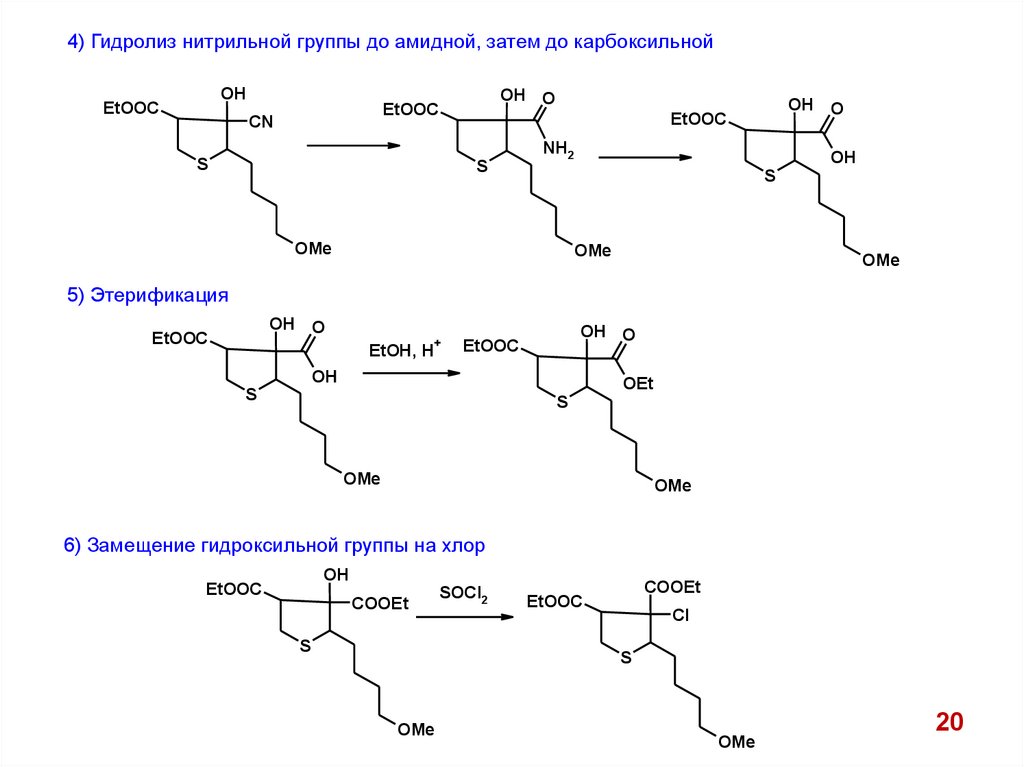
4) Гидролиз нитрильной группы до амидной, затем до карбоксильнойOH
EtOOC
OH O
EtOOC
CN
OH O
EtOOC
S
S
NH2
OH
S
OMe
OMe
OMe
5) Этерификация
OH O
EtOOC
EtOH, H
+
OH O
EtOOC
OH
OEt
S
S
OMe
OMe
6) Замещение гидроксильной группы на хлор
OH
EtOOC
COOEt
S
SOCl2
COOEt
EtOOC
Cl
S
OMe
OMe
20
21.
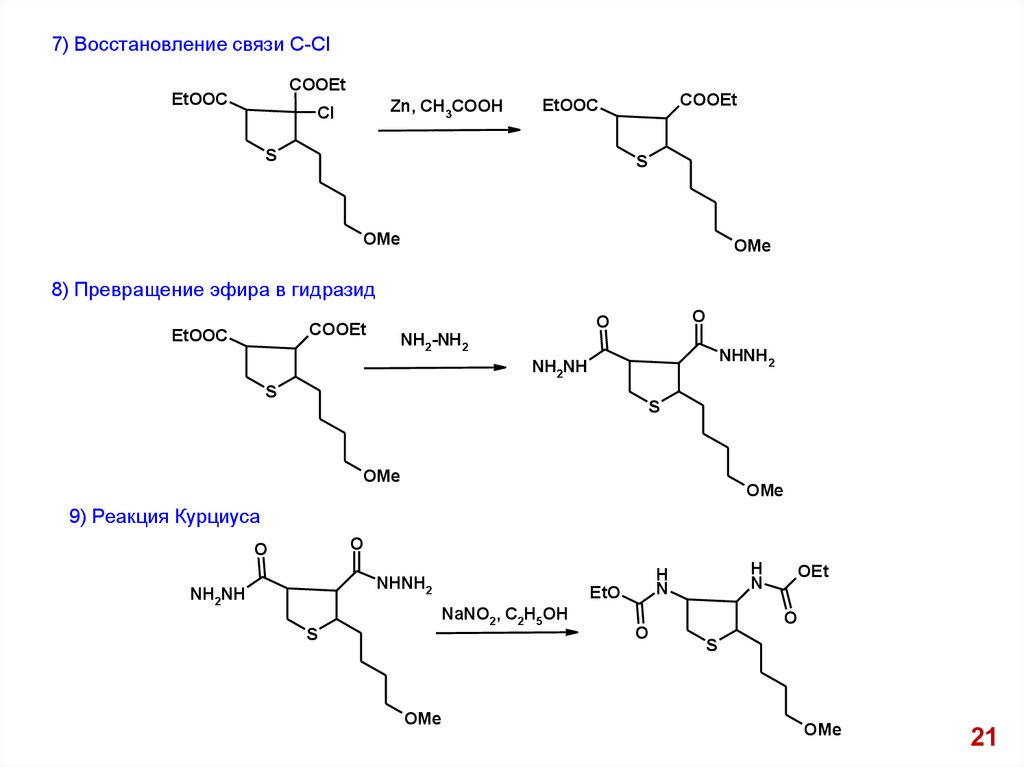
7) Восстановление связи С-СlCOOEt
EtOOC
Zn, CH3COOH
Cl
COOEt
EtOOC
S
S
OMe
OMe
8) Превращение эфира в гидразид
COOEt
EtOOC
O
O
NH2-NH2
NHNH2
NH2NH
S
S
OMe
OMe
9) Реакция Курциуса
O
O
NHNH2
NH2NH
EtO
NaNO2, C2H5OH
S
OMe
H
N
H
N
O
OEt
O
S
OMe
21
22.
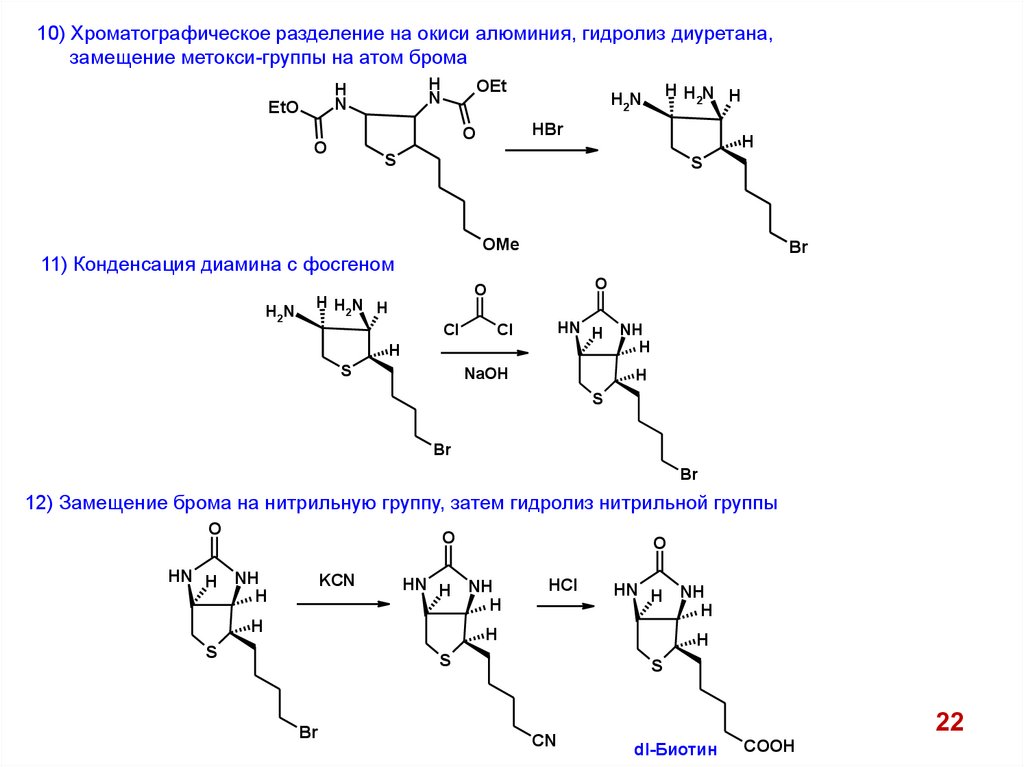
10) Хроматографическое разделение на окиси алюминия, гидролиз диуретана,замещение метокси-группы на атом брома
H
N
H
N
EtO
OEt
H
S
S
OMe
11) Конденсация диамина с фосгеном
H2N
HBr
O
O
HHN H
2
H2N
Br
O
O
HHN H
2
Cl
HN H
Cl
H
S
NaOH
NH
H
H
S
Br
Br
12) Замещение брома на нитрильную группу, затем гидролиз нитрильной группы
O
O
HN H NH
H
KCN
O
HN H NH
H
H
HCl
HN H NH
H
H
S
H
S
Br
S
CN
22
dl-Биотин
COOH
23.
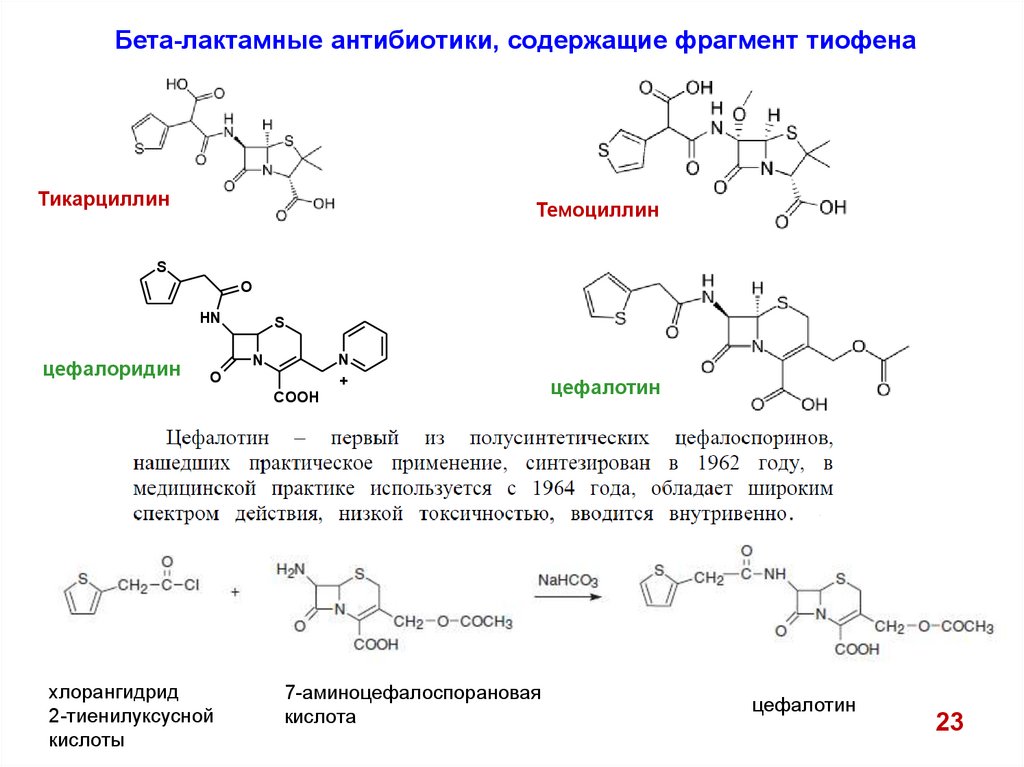
Бета-лактамные антибиотики, содержащие фрагмент тиофенаТикарциллин
Темоциллин
S
O
HN
цефалоридин
S
N
+
N
O
COOH
хлорангидрид
2-тиенилуксусной
кислоты
7-аминоцефалоспорановая
кислота
цефалотин
цефалотин
23
24.
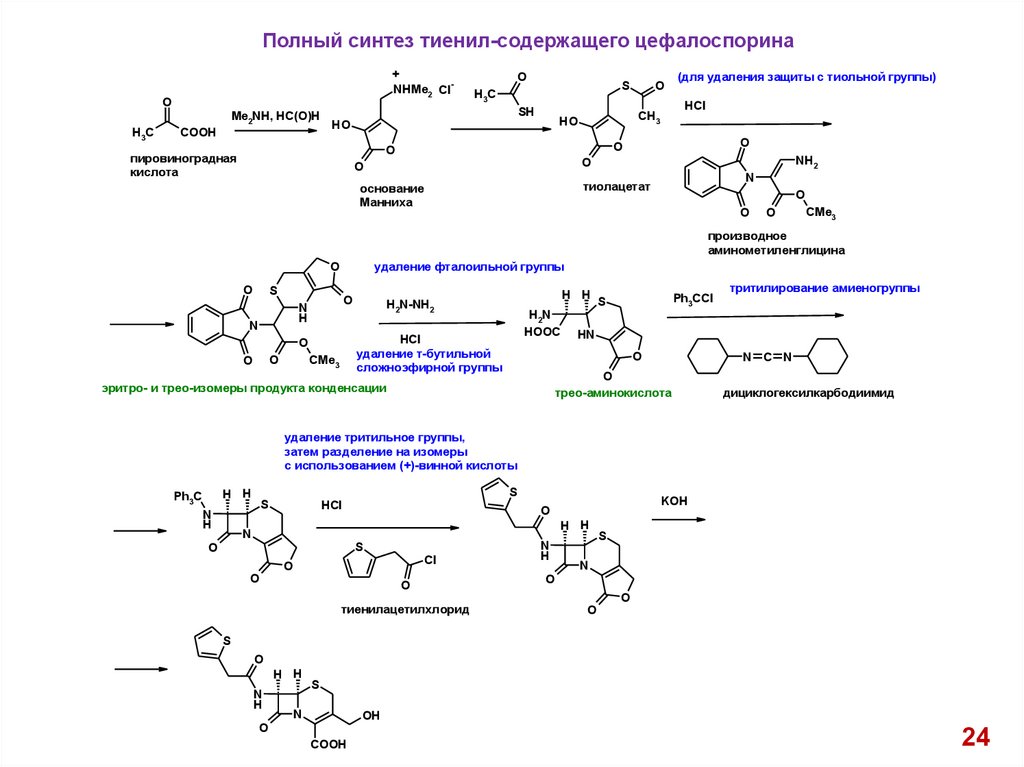
Полный синтез тиенил-содержащего цефалоспорина+
NHMe2 Cl
O
Me2NH, HC(O)H
H3C
COOH
O
S
H3C
SH
O
O
O
пировиноградная
кислота
(для удаления защиты с тиольной группы)
HCl
CH3
HO
HO
O
NH2
O
O
N
тиолацетат
основание
Манниха
O
O
O
CMe3
производное
аминометиленглицина
удаление фталоильной группы
O
O
S
O
N
H
N
CMe3
O
H2N
HOOC
HCl
удаление т-бутильной
сложноэфирной группы
O
O
H H
H2N-NH2
Ph3CCl
S
HN
O
N C N
O
трео-аминокислота
эритро- и трео-изомеры продукта конденсации
тритилирование амиеногруппы
дициклогексилкарбодиимид
удаление тритильное группы,
затем разделение на изомеры
с использованием (+)-винной кислоты
S
H H
Ph3C
N
H
S
HCl
KOH
O
H H
N
S
O
Cl
O
O
O
тиенилацетилхлорид
N
H
S
N
O
O
O
S
O
H H
N
H
S
N
OH
O
COOH
24
25.
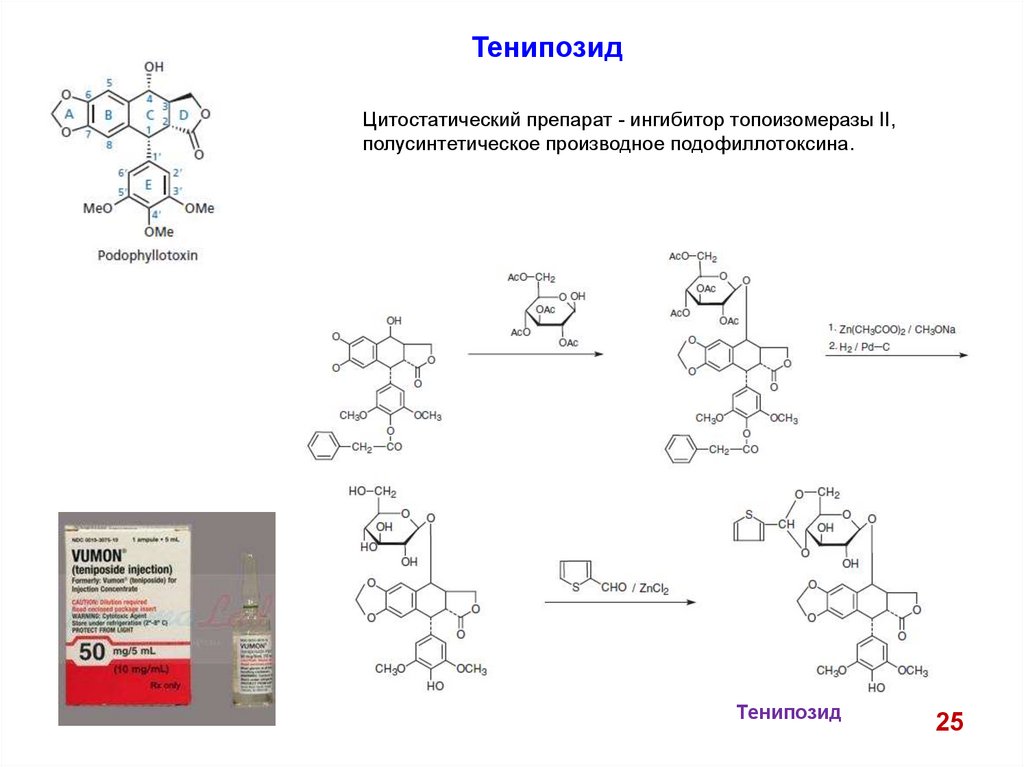
ТенипозидЦитостатический препарат - ингибитор топоизомеразы II,
полусинтетическое производное подофиллотоксина.
Тенипозид
25





 Химия
Химия








