Похожие презентации:
Окислительно- восстановительные реакции в органической химии
1.
Окислительновосстановительныереакции в органической
химии.
МАОУ «ЛИЦЕЙ» г.о. Балашиха
Учитель химии
высшей категории
Курбатова Н.В.
2.
Окислительно-восстановительные реакциис участием органических веществ в ЕГЭ
встречаются в заданиях С3 и вызывают
наибольшие затруднения у обучающихся.
Например:
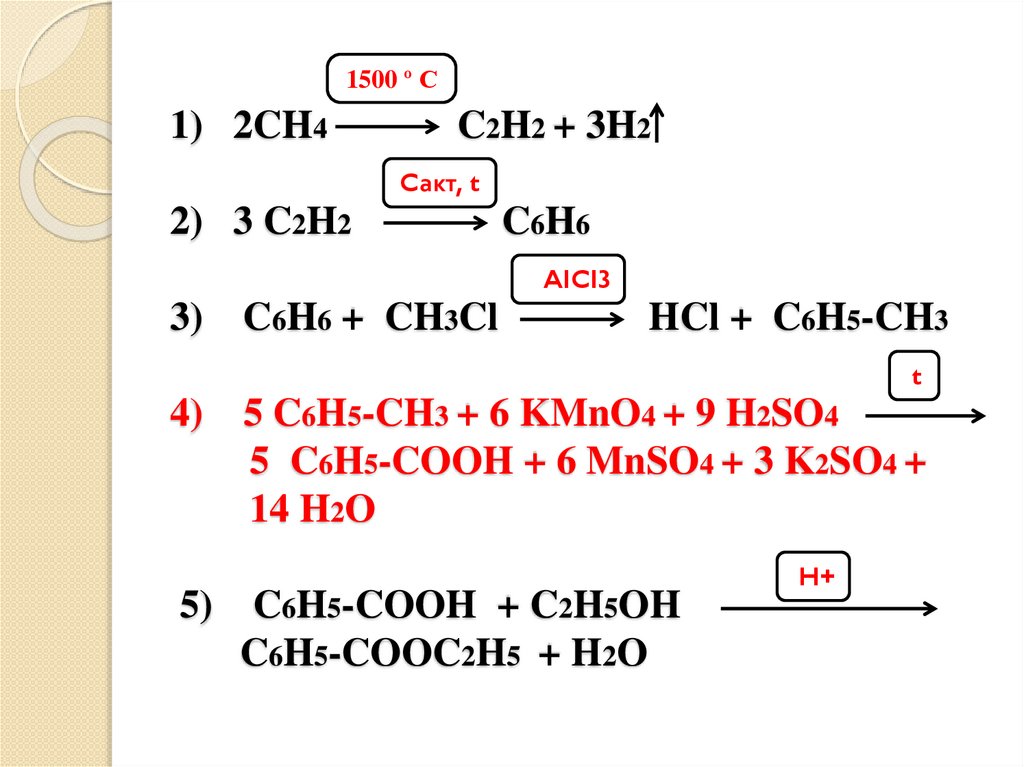
CH4
C6H6
X2
C2H5OH, H+
X3
KMnO4, H2SO4, t
CH3Cl, AlCl3
1500 º С
X4
3.
1500 º С1) 2CH4
C2H2 + 3H2
Cакт, t
2) 3 C2H2
C6H6
AlCl3
3)
C6H6 + CH3Cl
HCl + C6H5-CH3
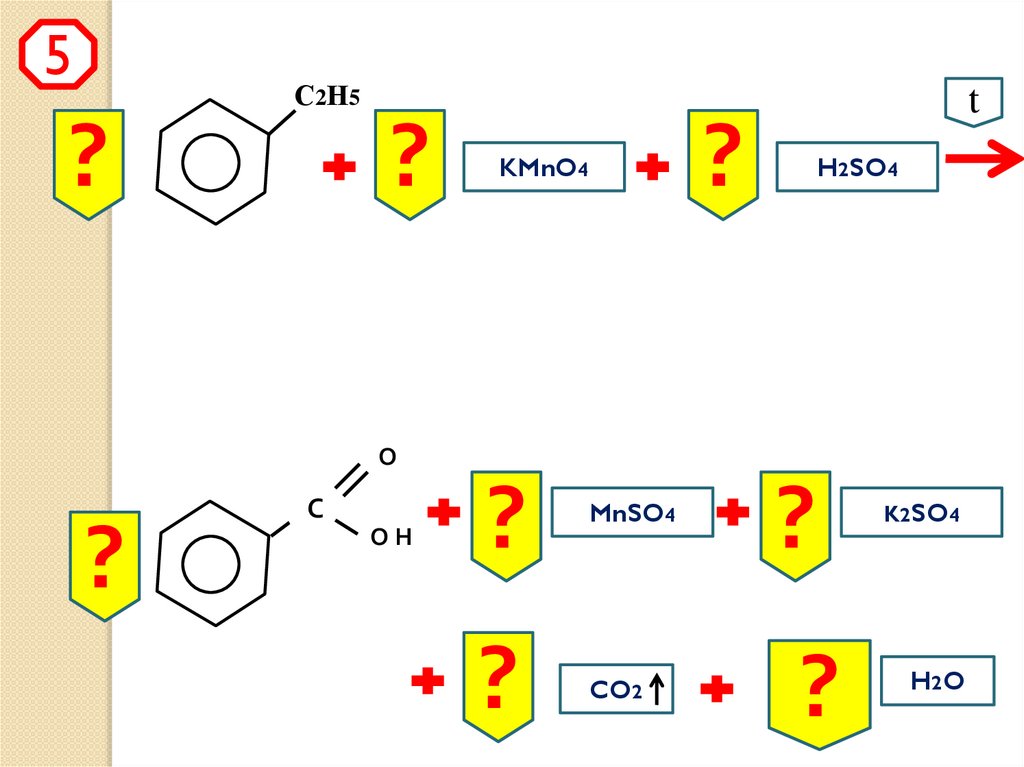
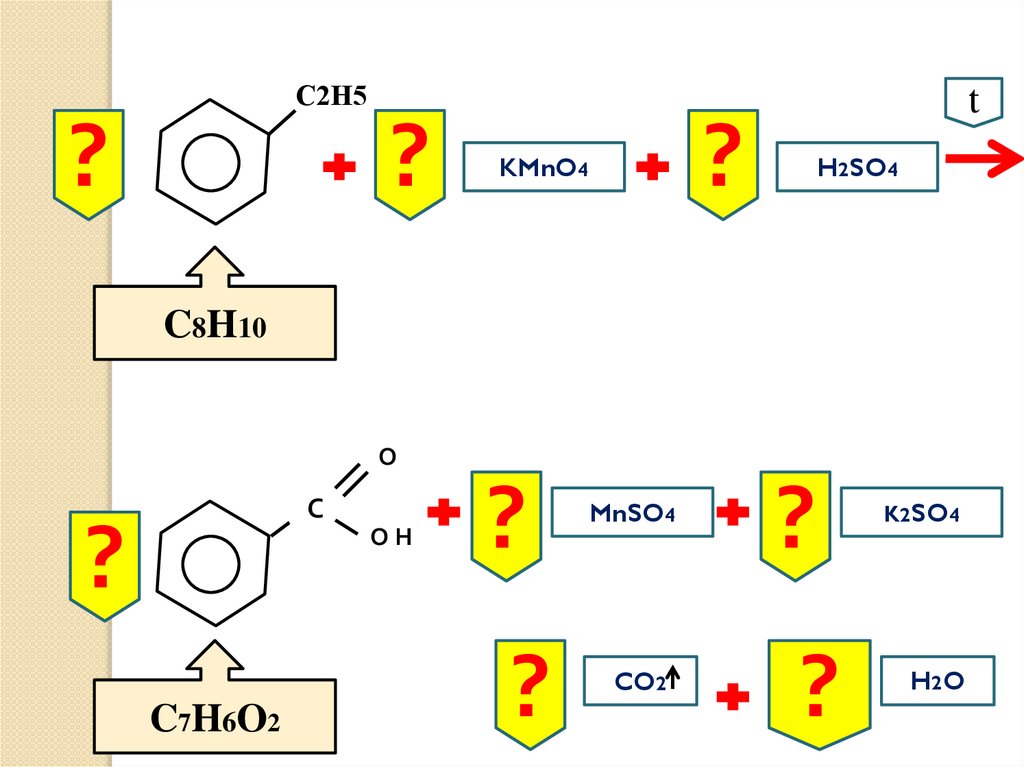
t
4)
5)
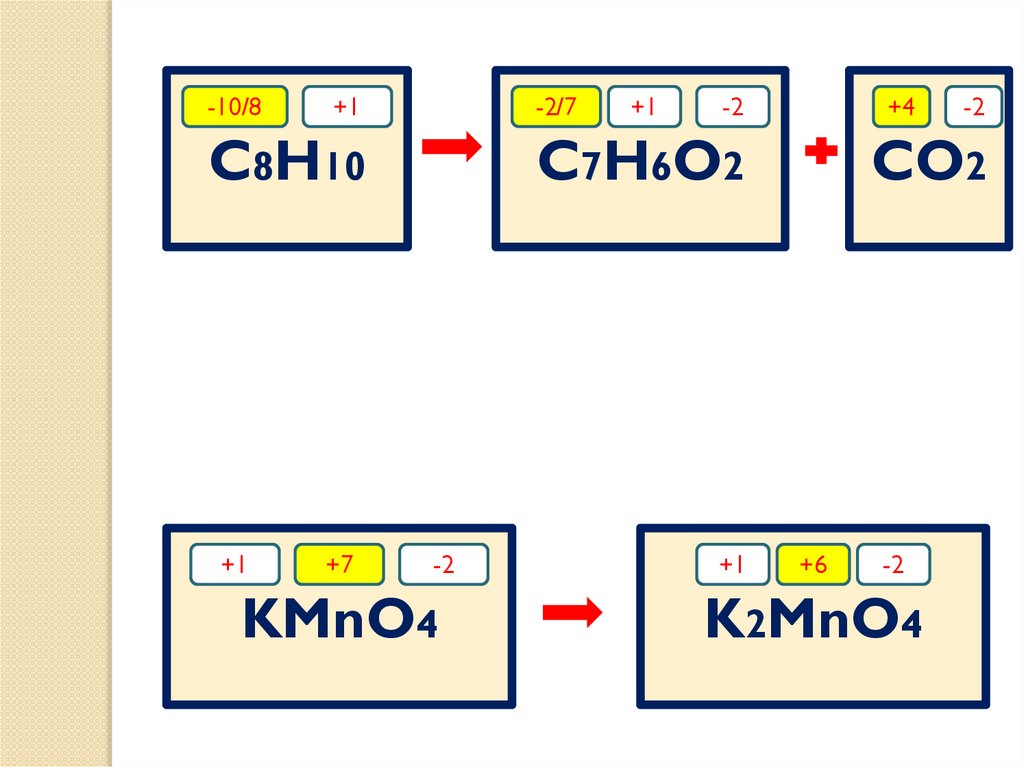
5 C6H5-CH3 + 6 KMnO4 + 9 H2SO4
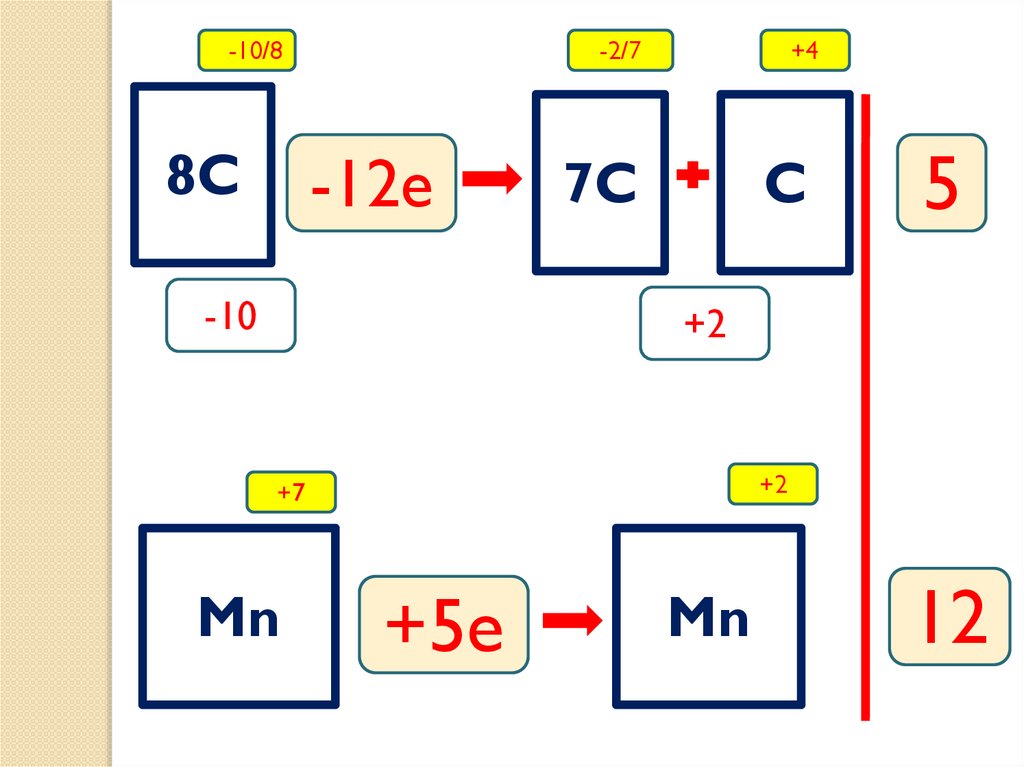
5 C6H5-COOH + 6 MnSO4 + 3 K2SO4 +
14 H2O
C6H5-COOH + C2H5OH
C6H5-COOC2H5 + H2O
H+
4.
В органических веществахможно определять степени
окисления элементов
алгебраическим методом,
при этом получается
усредненное значение
степени окисления.
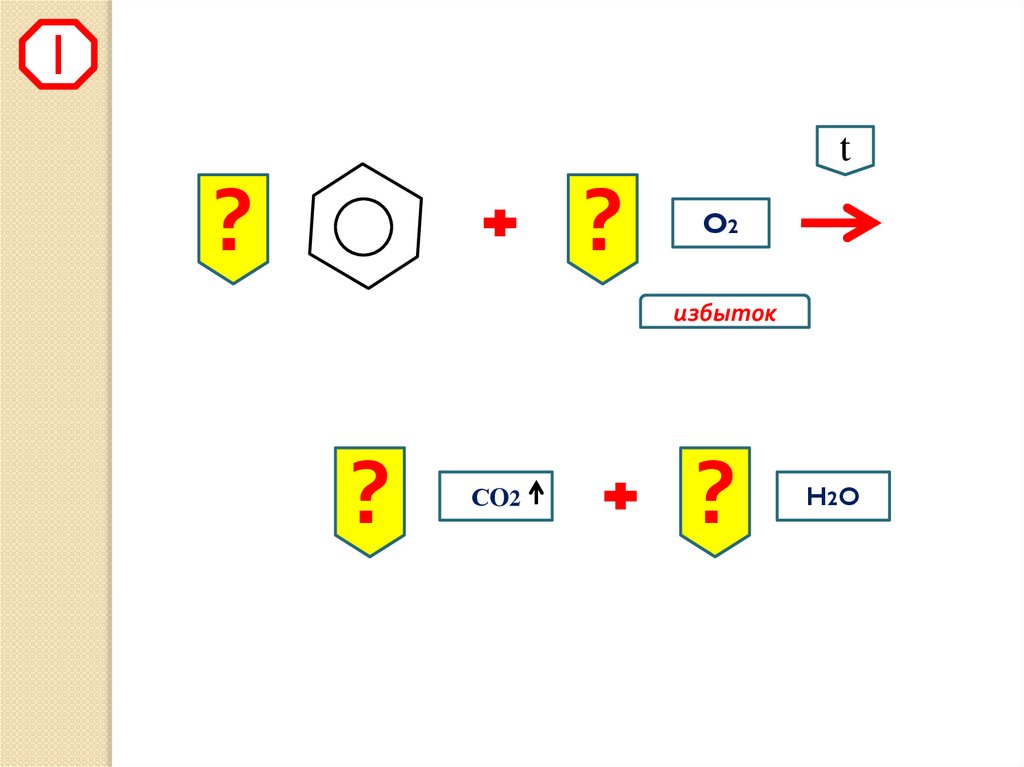
5.
1t
?
?
O2
избыток
?
СO2
?
H2 O
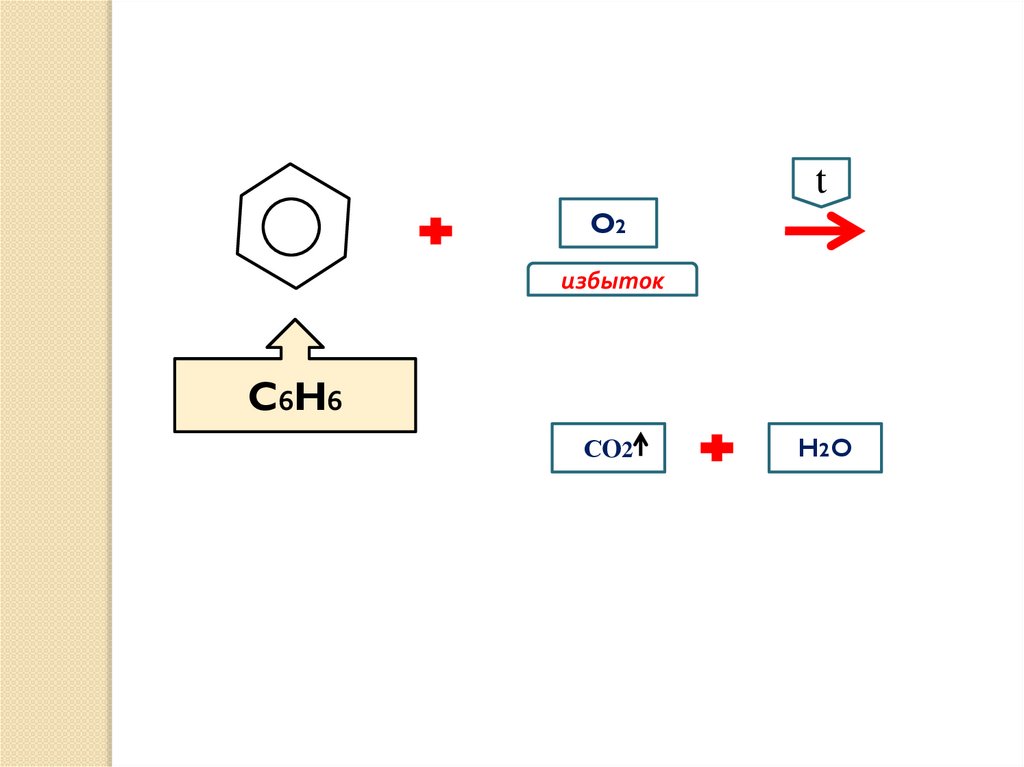
6.
tO2
избыток
C6H6
СO2
H2 O
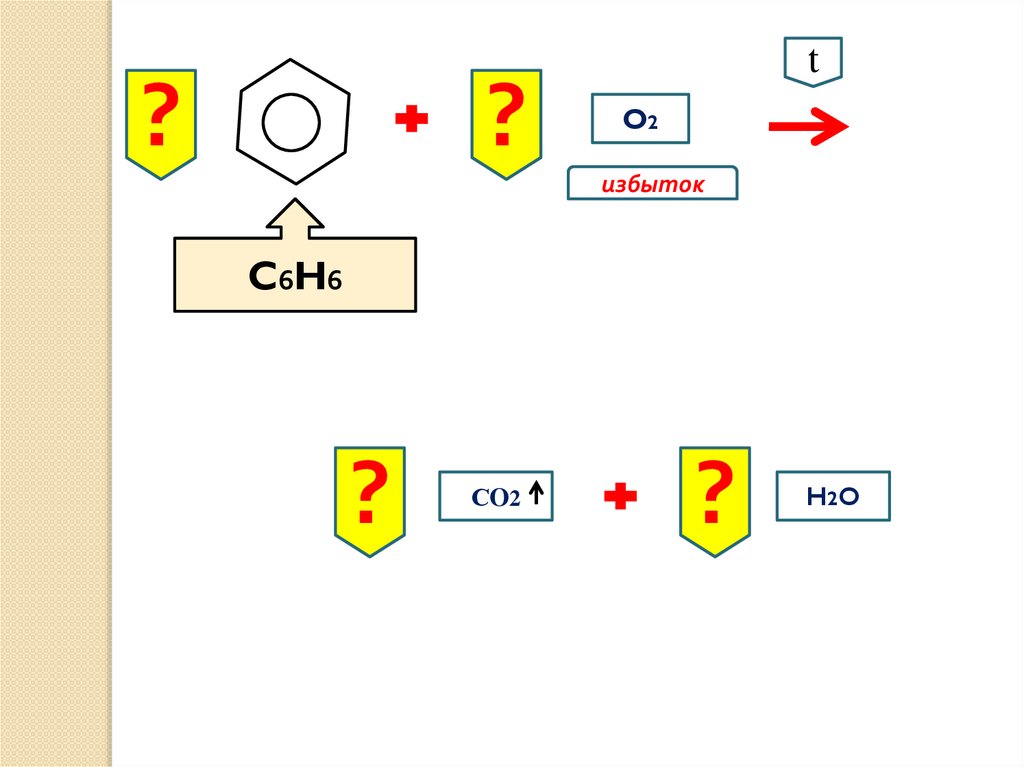
7.
??
t
O2
избыток
C6H6
?
СO2
?
H2 O
8.
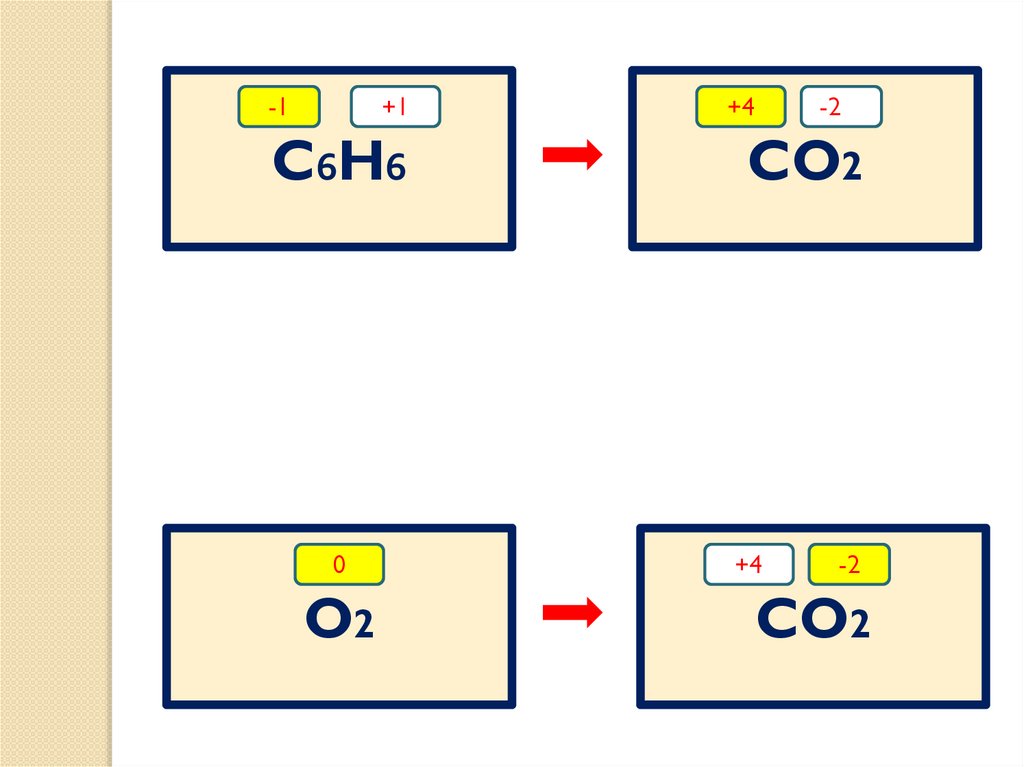
-1+1
C6H6
0
O2
+4
-2-_
CO2
+4
-2
CO2
9.
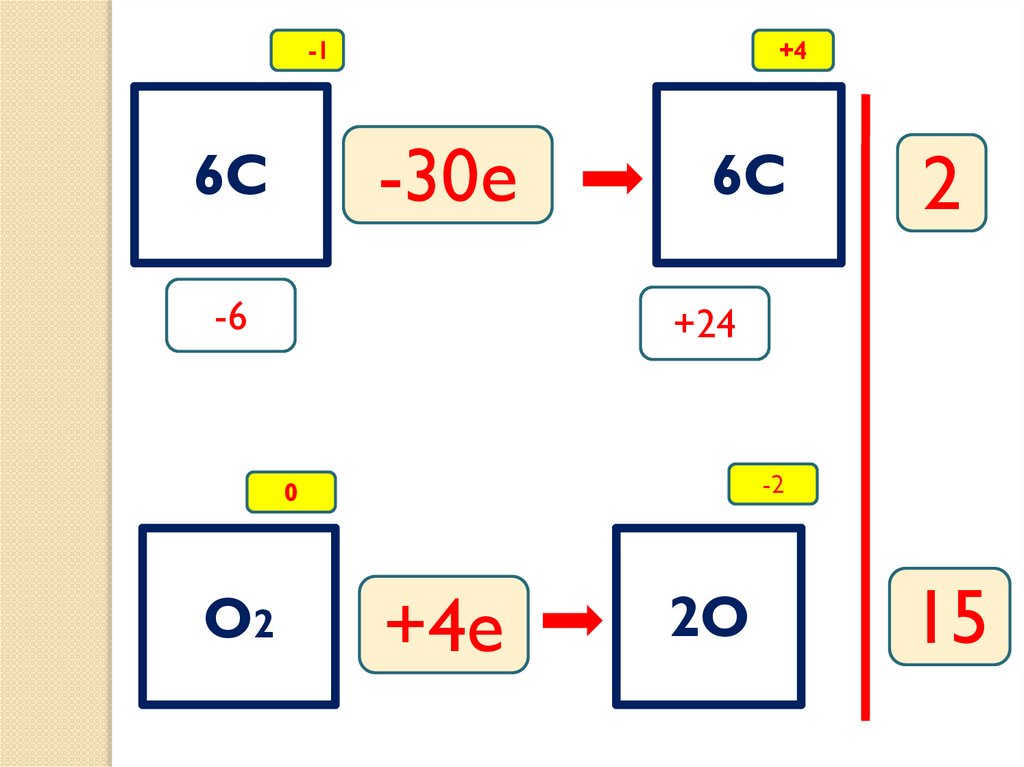
-1+4
-30e
6C
-6
6C
+24
-2
0
O2
2
+4e
2O
15
10.
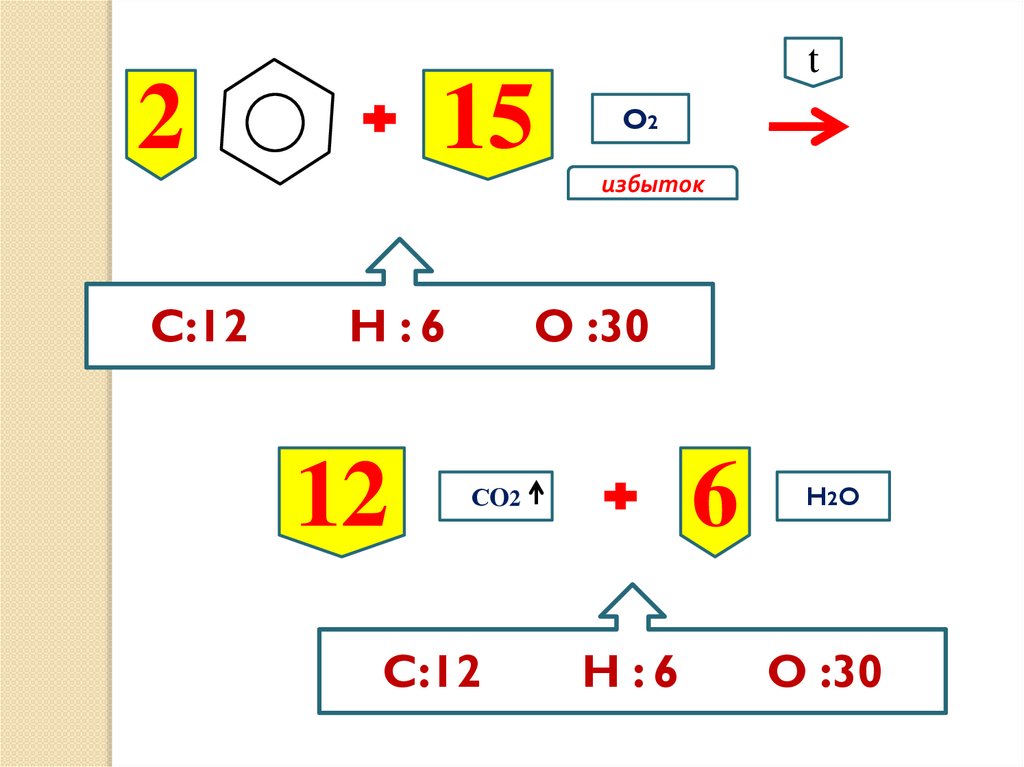
t2
15
O2
избыток
C:12
H :6
12
O :30
6
СO2
C:12
H :6
H2 O
O :30
11.
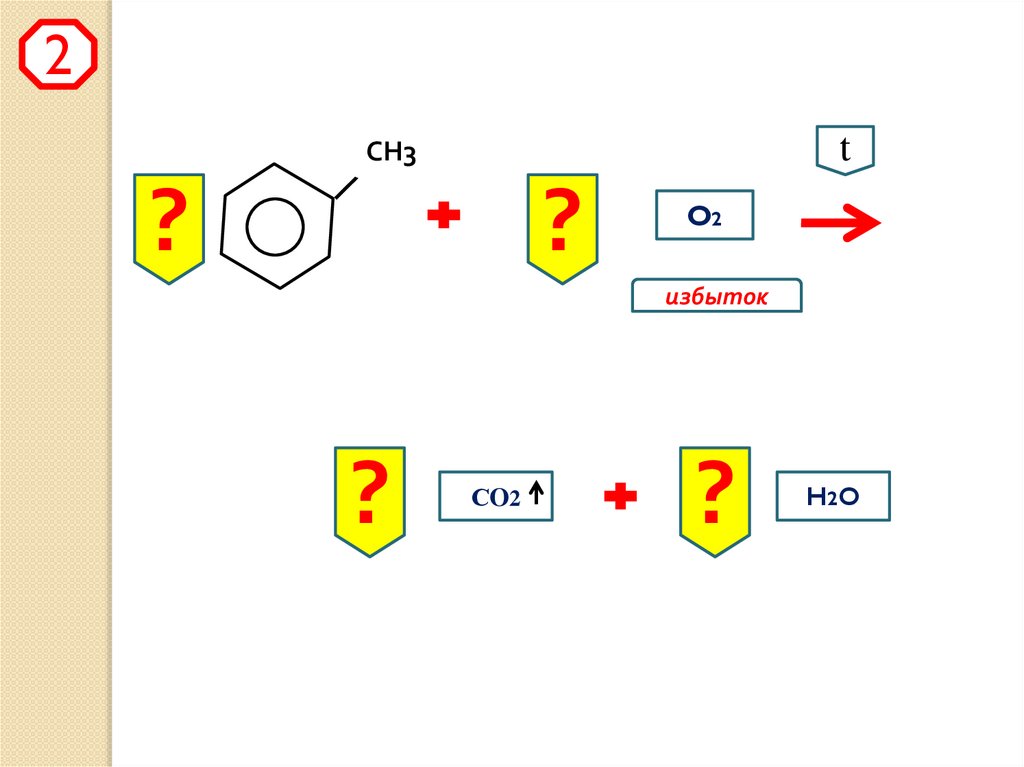
2t
СН3
?
?
O2
избыток
?
СO2
?
H2 O
12.
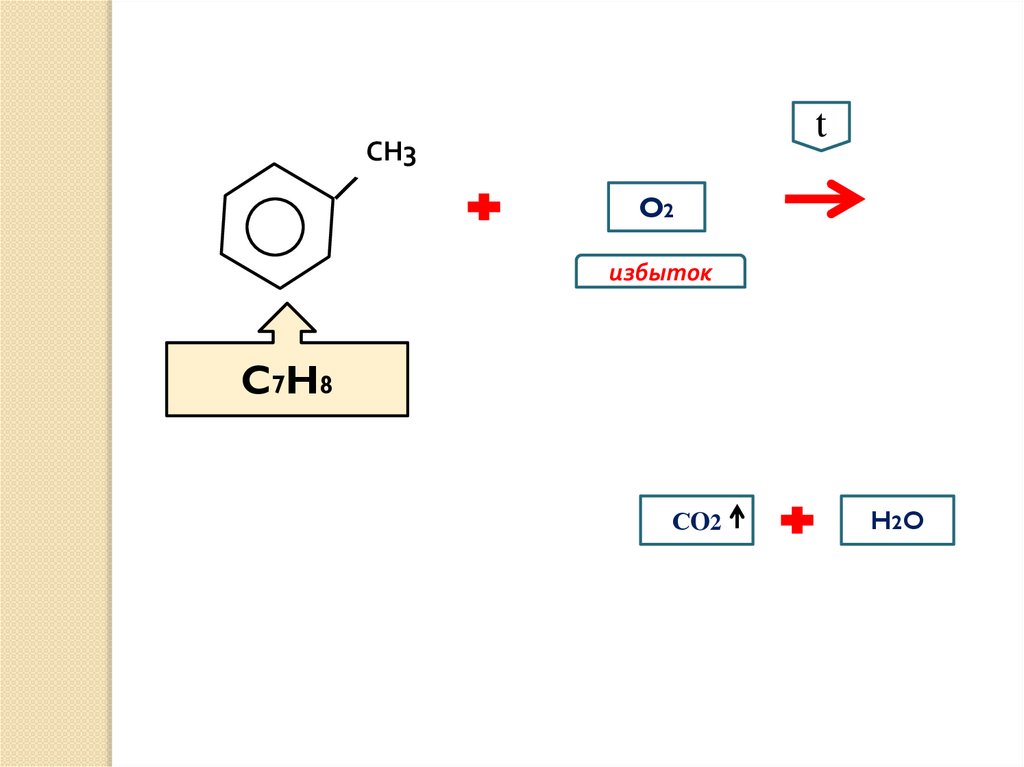
tСН3
O2
избыток
C7H8
СO2
H2 O
13.
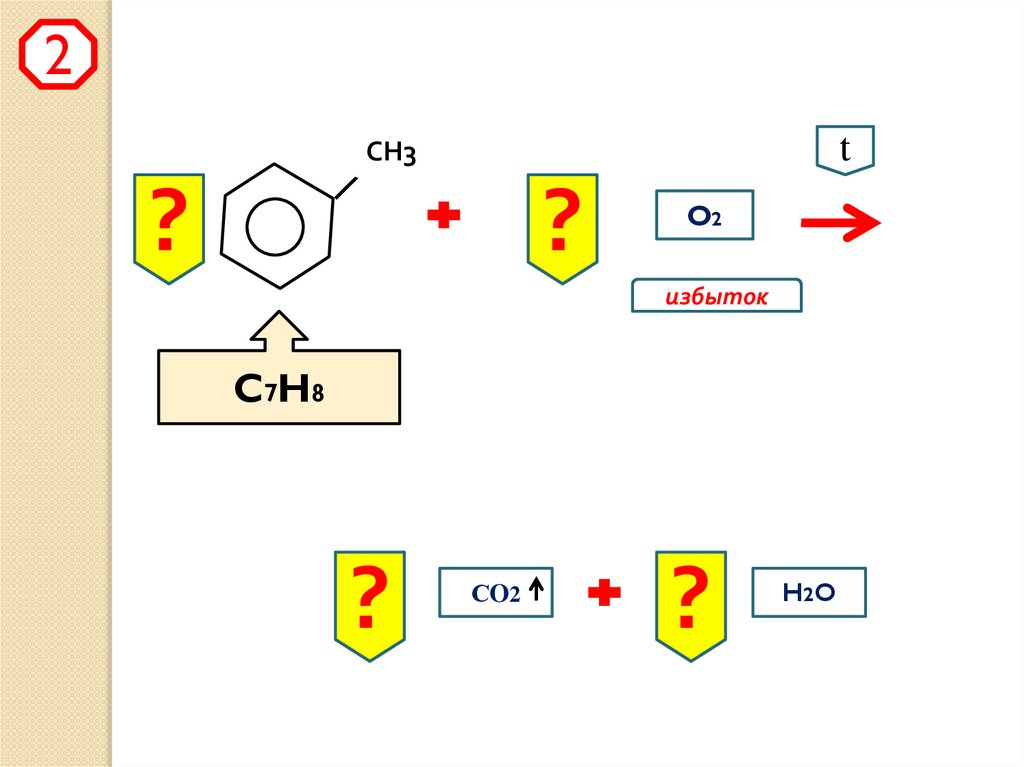
2t
СН3
?
?
O2
избыток
C7H8
?
СO2
?
H2 O
14.
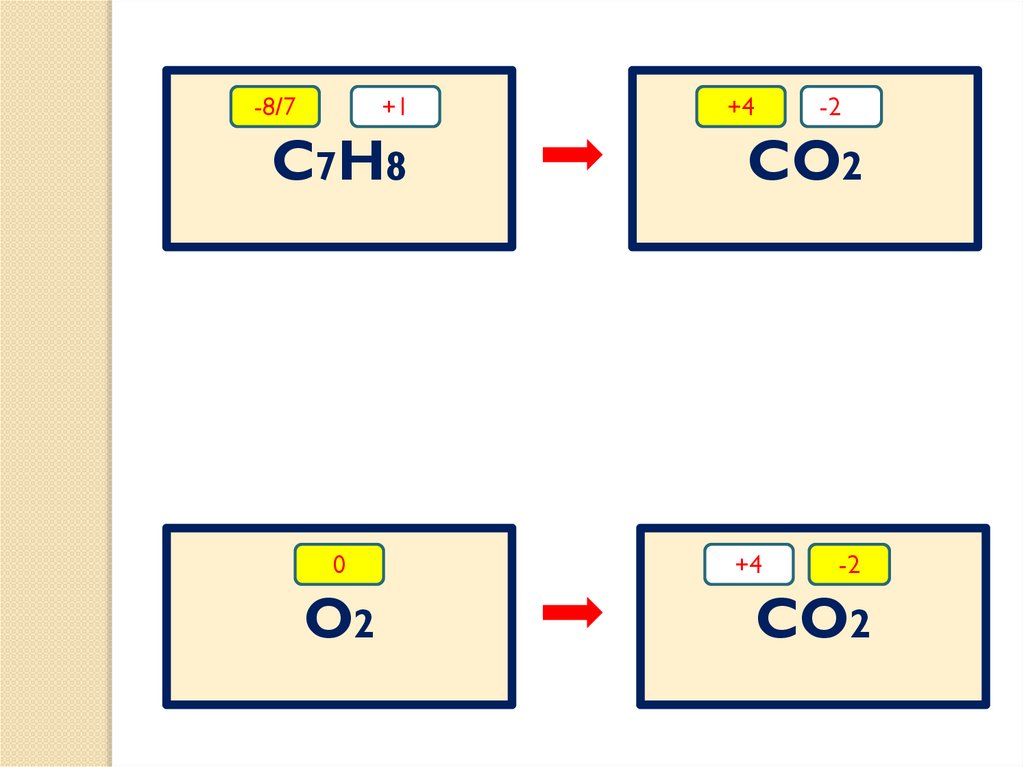
-8/7+1
C7H8
0
O2
+4
-2-_
CO2
+4
-2
CO2
15.
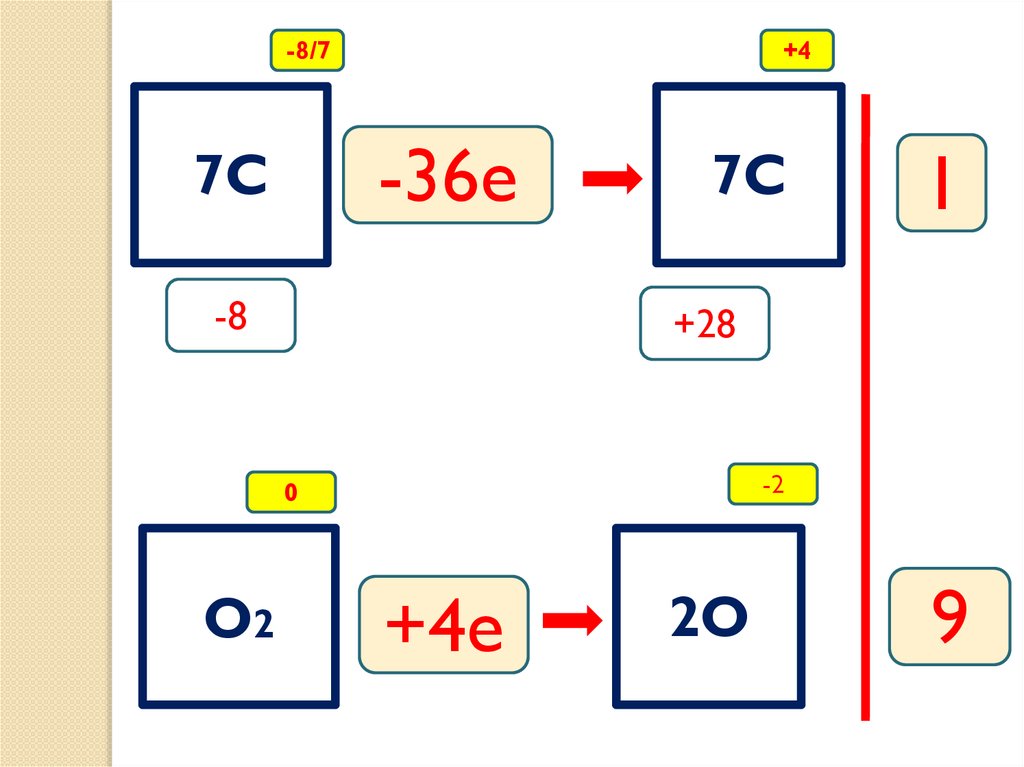
-8/7+4
-36e
7C
-8
7C
+28
-2
0
O2
1
+4e
2O
9
16.
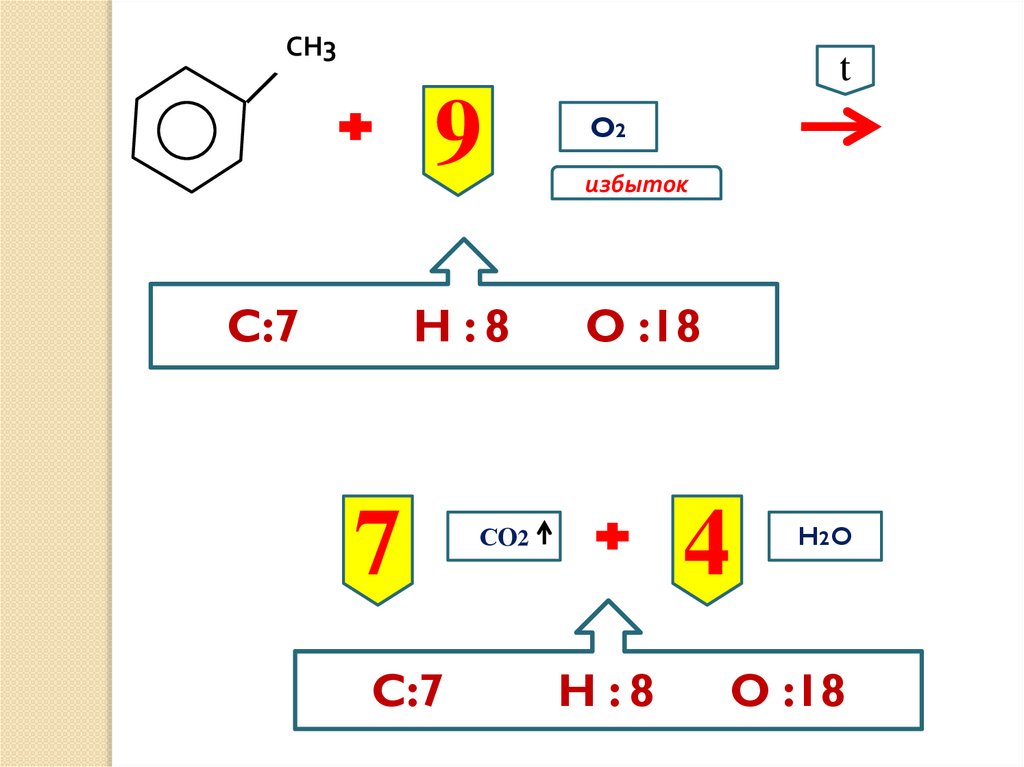
СН3t
9
C:7
H :8
7
C:7
O2
избыток
O :18
4
СO2
H :8
H2 O
O :18
17.
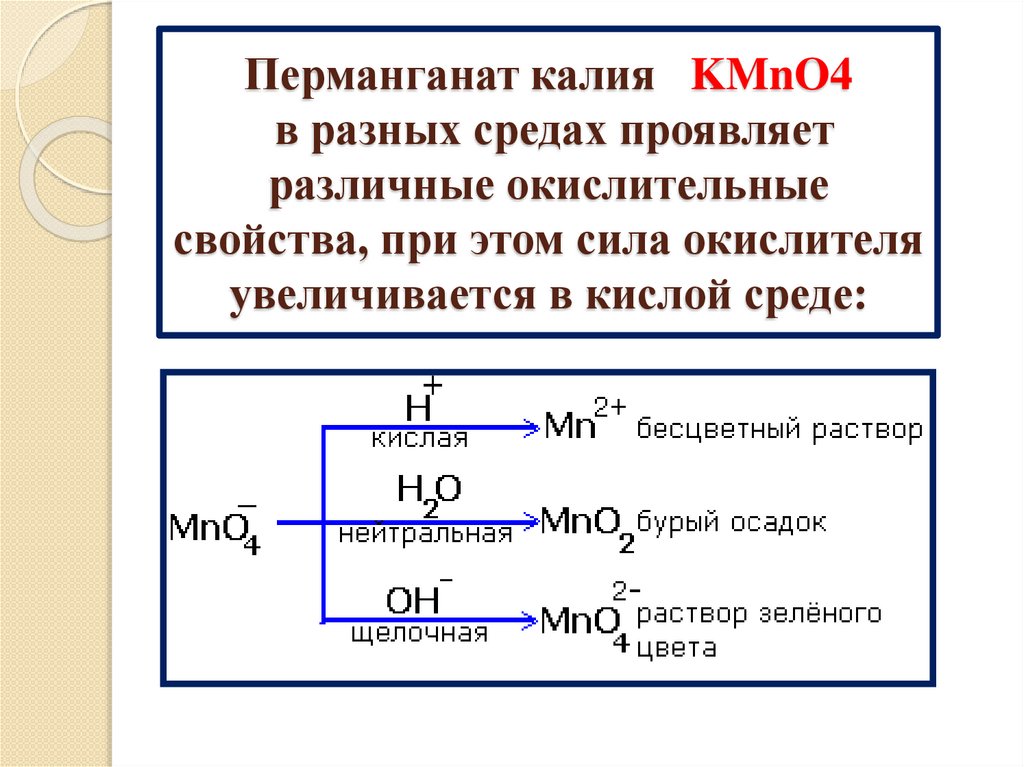
Перманганат калия KMnO4в разных средах проявляет
различные окислительные
свойства, при этом сила окислителя
увеличивается в кислой среде:
18.
RО
KMnO4
С
ОН
Кислая среда
R
О
KMnO4
С
ОК
Щелочная среда
R
О
KMnO4
Нейтральная
среда
С
ОК
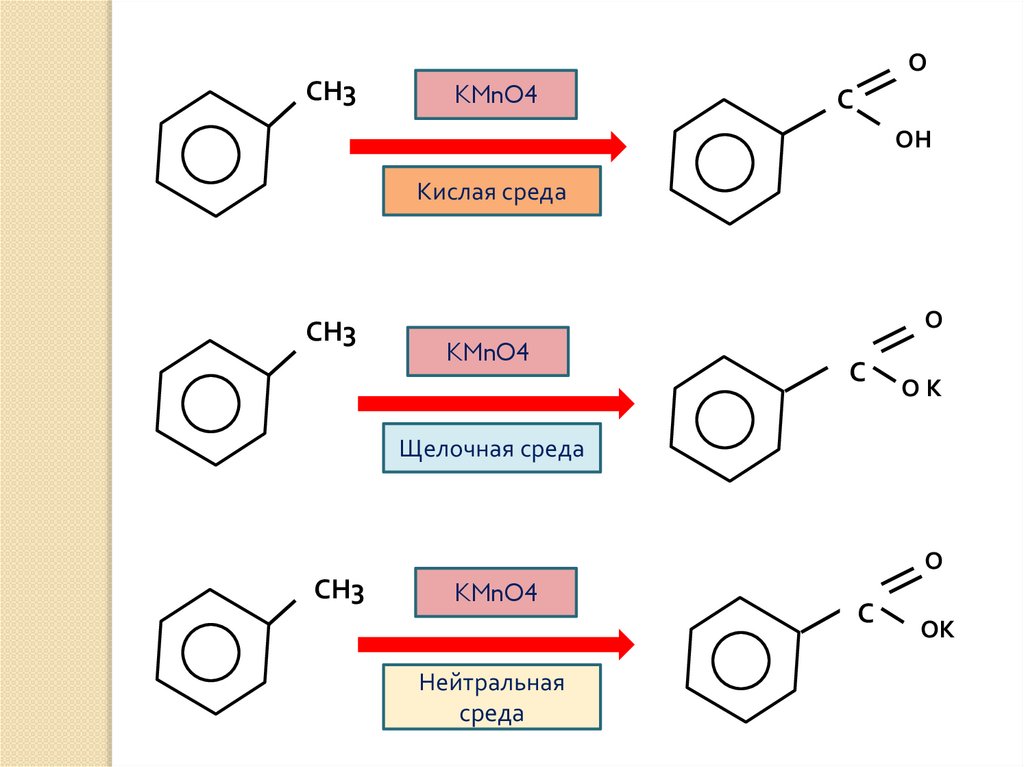
19.
ОСН3
KMnO4
С
ОН
Кислая среда
СН3
О
KMnO4
С
ОК
Щелочная среда
О
СН3
KMnO4
Нейтральная
среда
С
ОК
20.
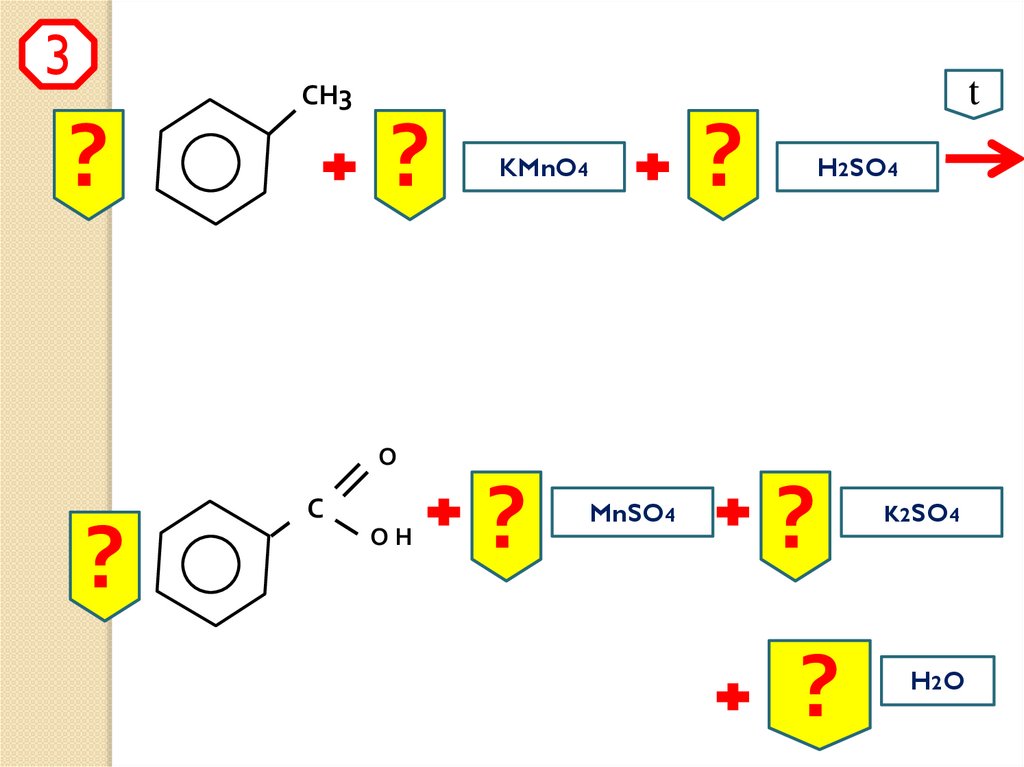
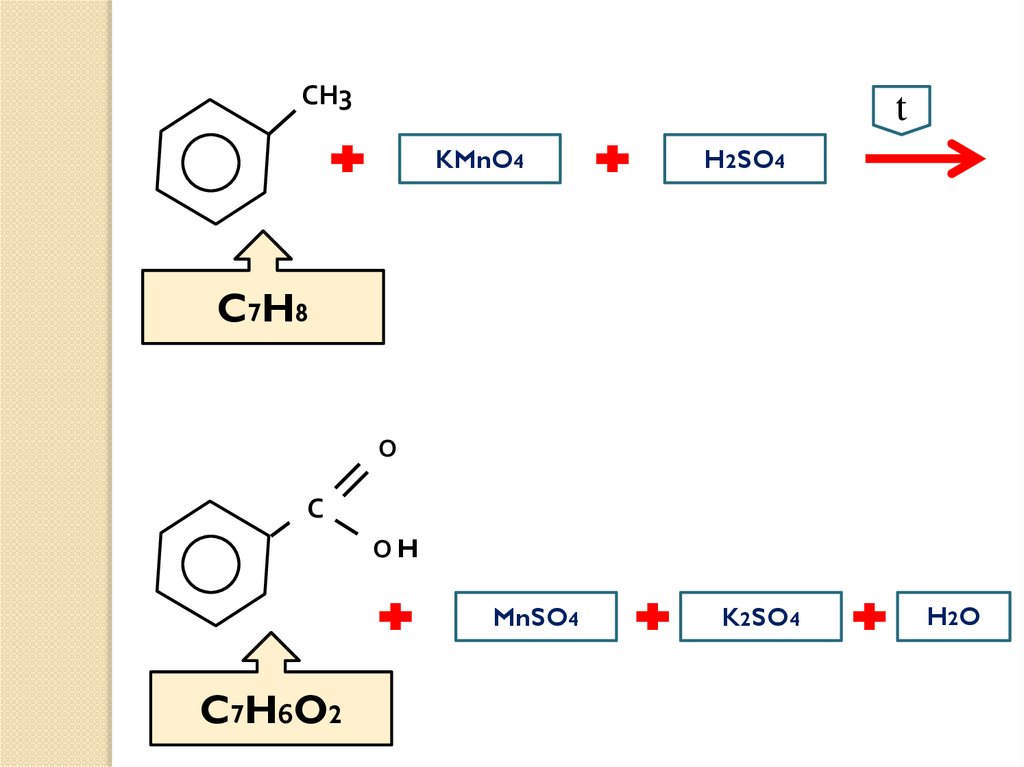
3t
СН3
?
?
?
KMnO4
H2SO4
О
?
С
ОН
?
MnSO4
?
?
K2SO4
H2 O
21.
СН3t
KMnO4
H2SO4
C7H8
О
С
ОH
MnSO4
C 7 H6O2
K2SO4
H2 O
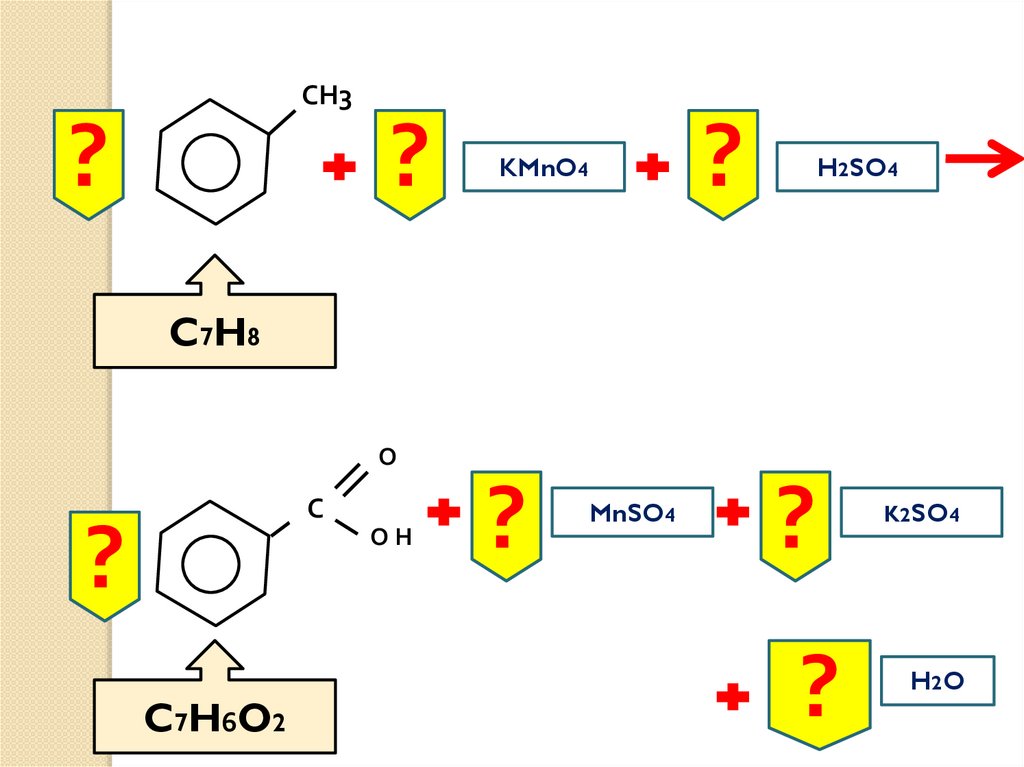
22.
СН3?
?
?
KMnO4
H2SO4
C7H8
О
С
?
ОН
C 7 H6 O 2
?
MnSO4
?
?
K2SO4
H2 O
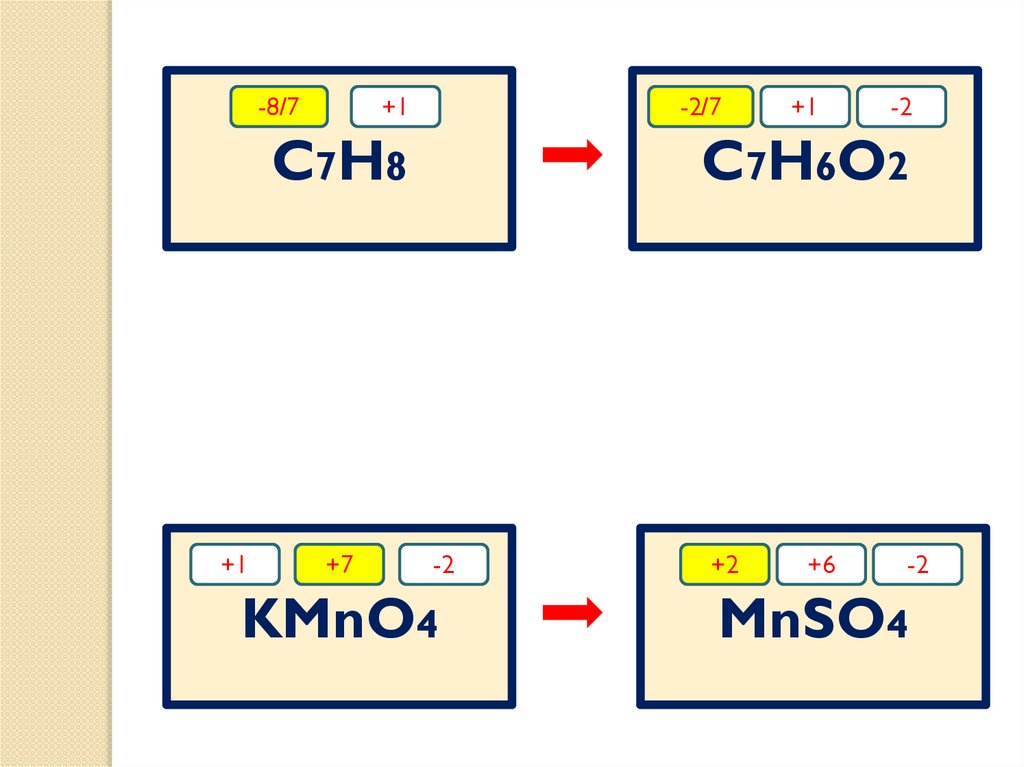
23.
-8/7+1
-2/7
C7H8
+1
+7
+1
-2
C7H6O2
-2
KMnO4
+2
+6
-2
MnSO4
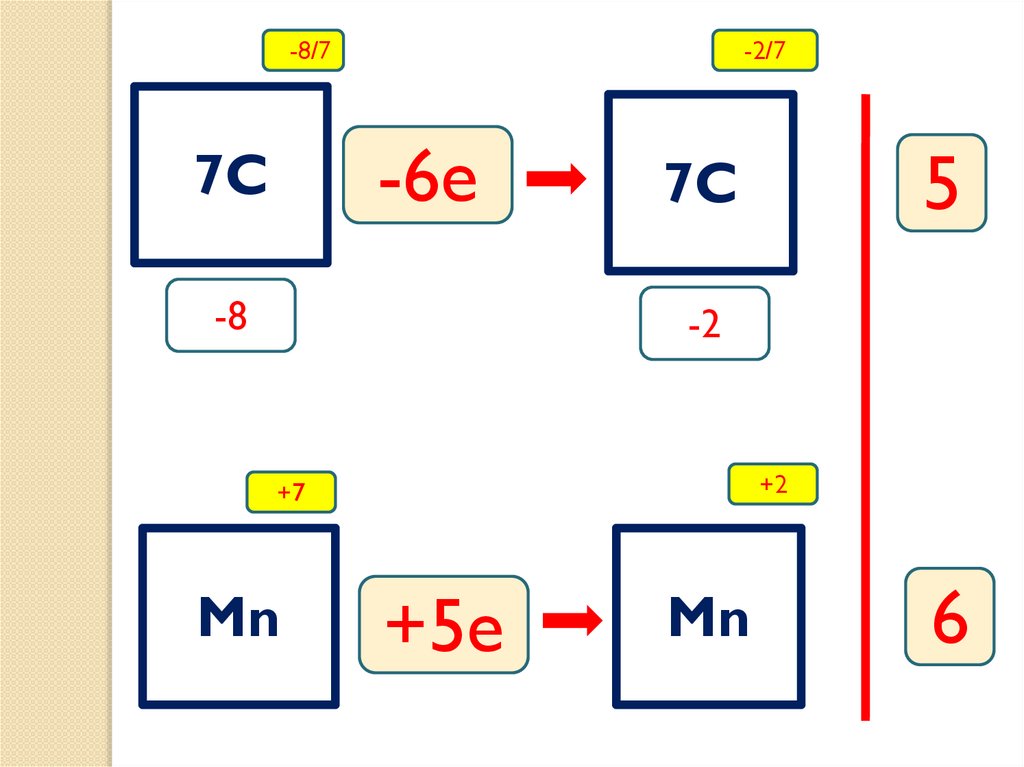
24.
-8/7-2/7
-6e
7C
-8
5
7C
-2
+2
+7
Mn
+5e
Mn
6
25.
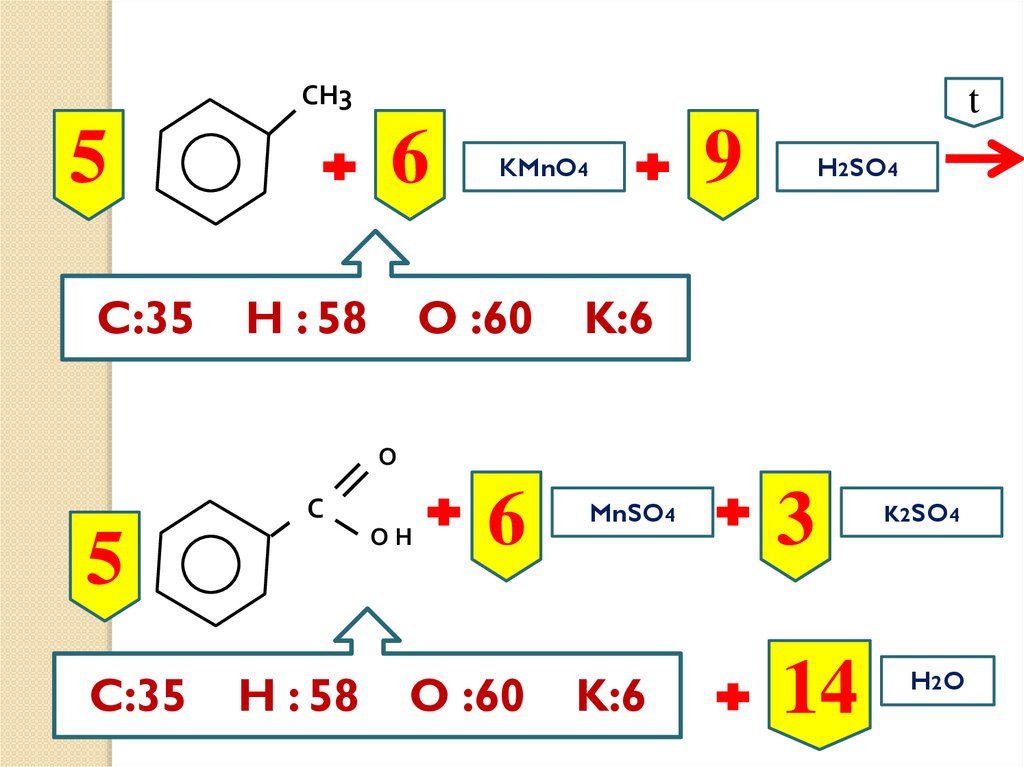
СН35
C:35
t
6
H : 58
9
KMnO4
O :60
H2SO4
K:6
О
С
ОН
5
C:35
H : 58
6
O :60
MnSO4
K:6
3
14
K2SO4
H2 O
26.
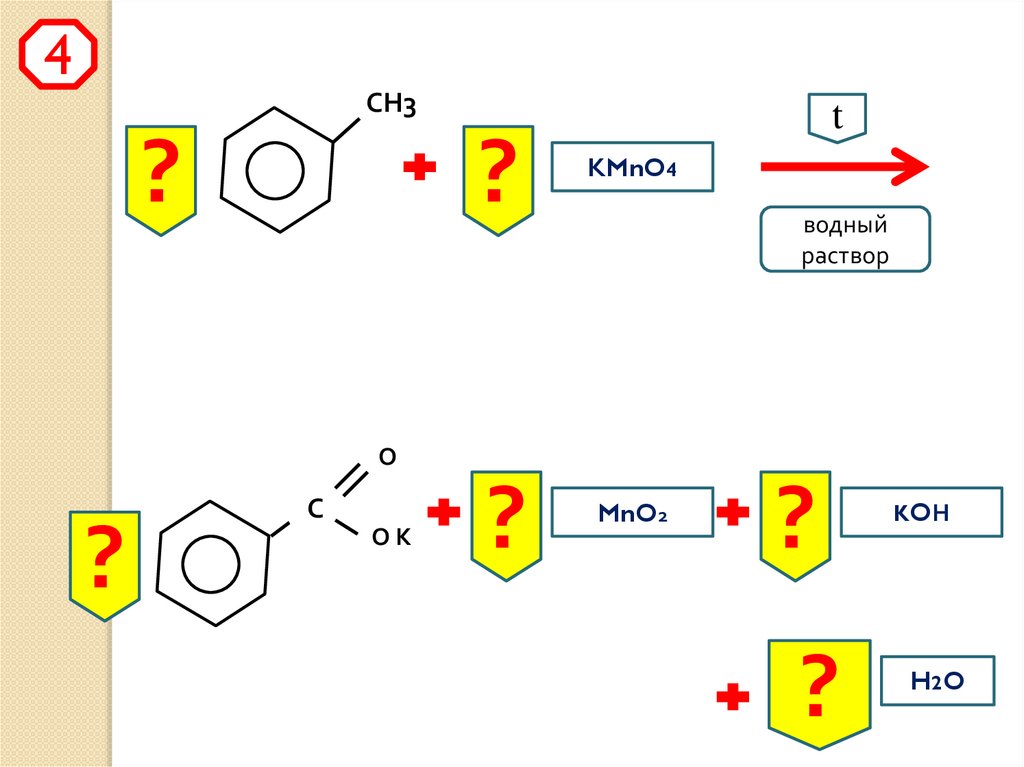
4СН3
?
?
t
KMnO4
водный
раствор
О
?
С
ОК
?
MnO2
?
?
KOН
H2 O
27.
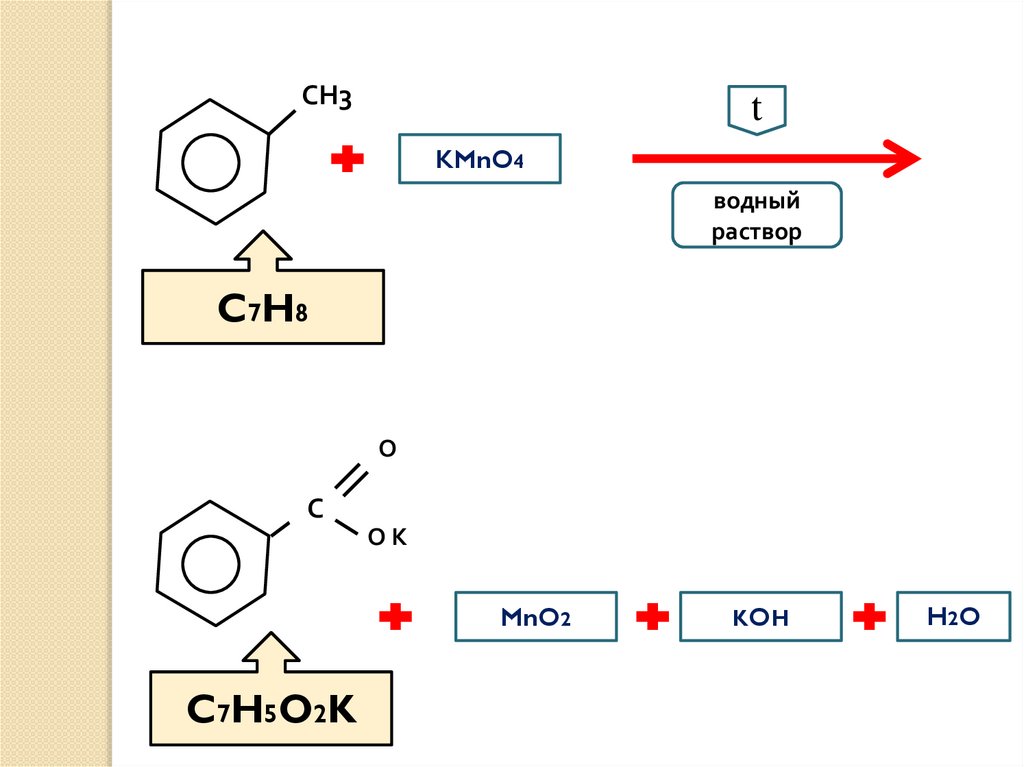
СН3t
KMnO4
водный
раствор
C7H8
О
С
ОК
MnO2
C7H5O2K
KOH
H2 O
28.
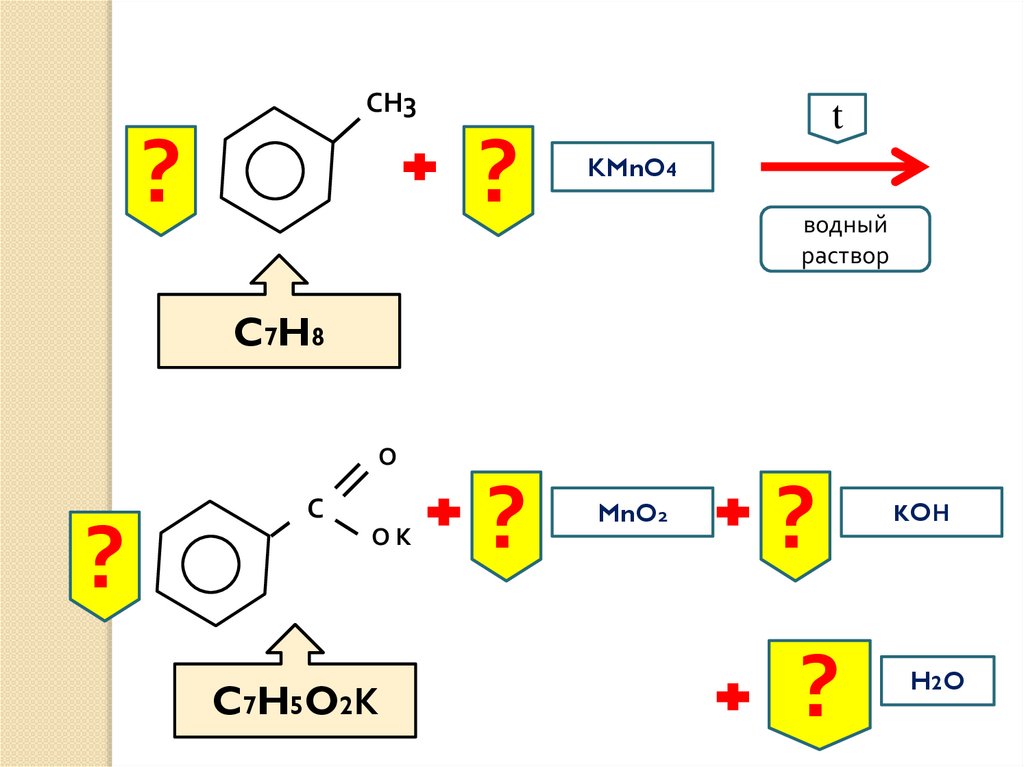
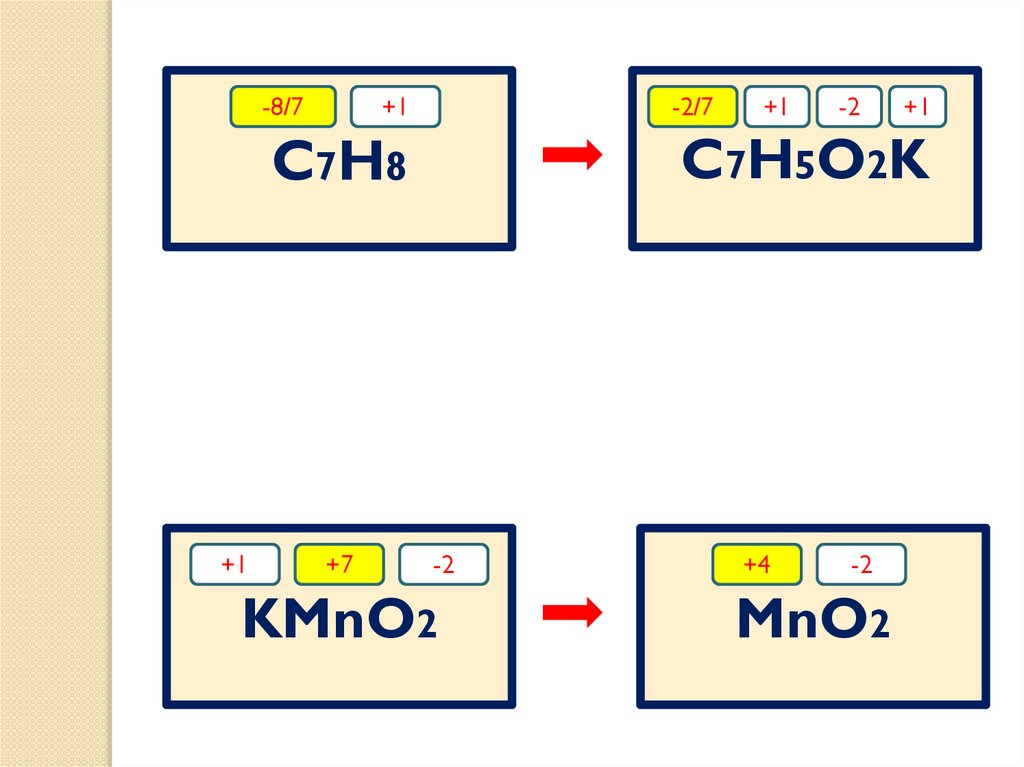
СН3?
?
t
KMnO4
водный
раствор
C7H8
О
?
С
ОК
C7H5O2К
?
MnO2
?
?
KOН
H2 O
29.
-8/7+1
-2/7
+7
-2
+1
C7H5O2K
C7H8
+1
+1
-2
KMnO2
+4
-2
MnO2
30.
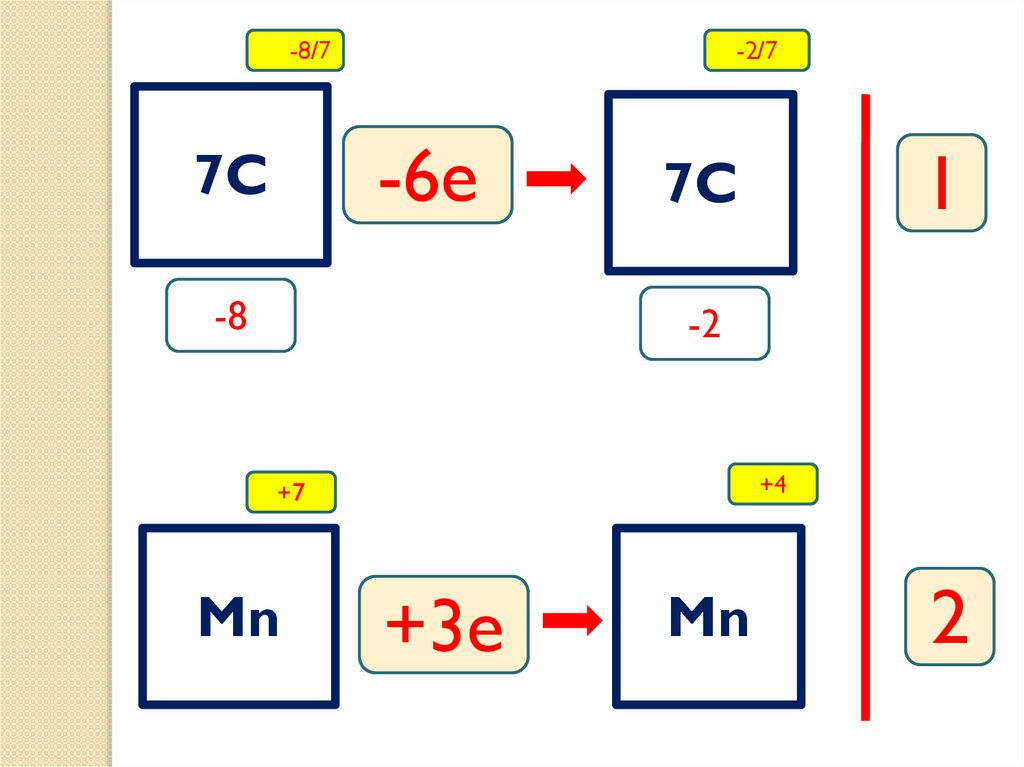
-8/7-2/7
-6e
7C
-8
1
7C
-2
+4
+7
Mn
+3e
Mn
2
31.
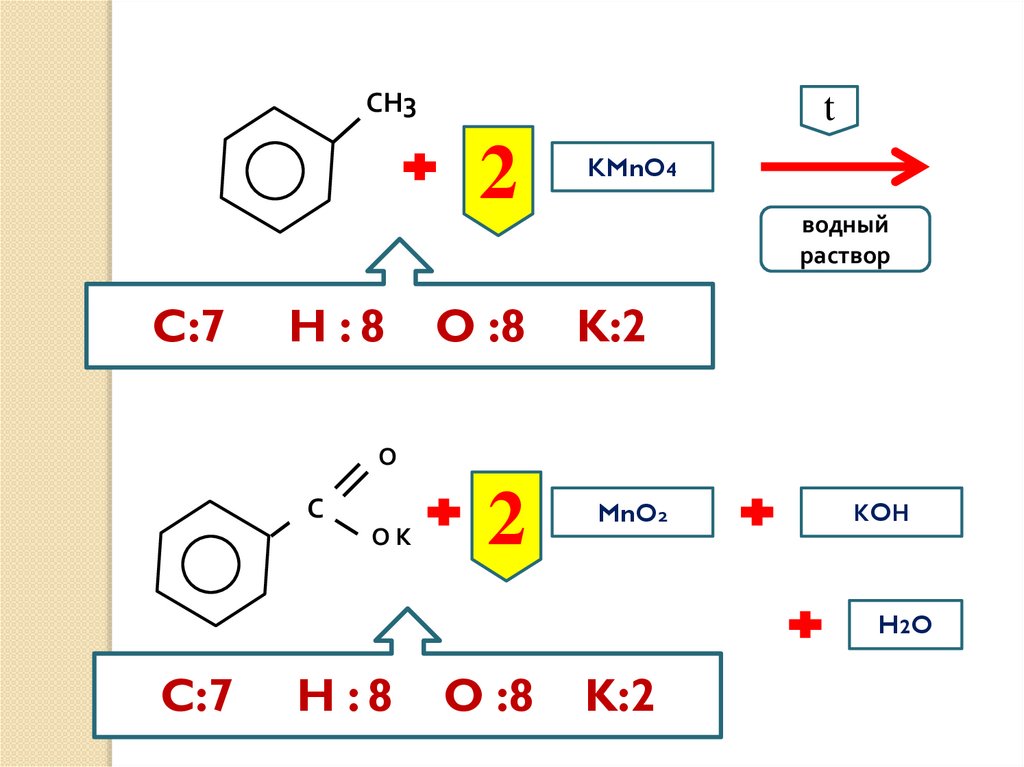
СН3t
2
C:7
H :8
O :8
KMnO4
водный
раствор
K:2
О
С
ОК
2
MnO2
КOН
H2 O
C:7
H :8
O :8
K:2
32.
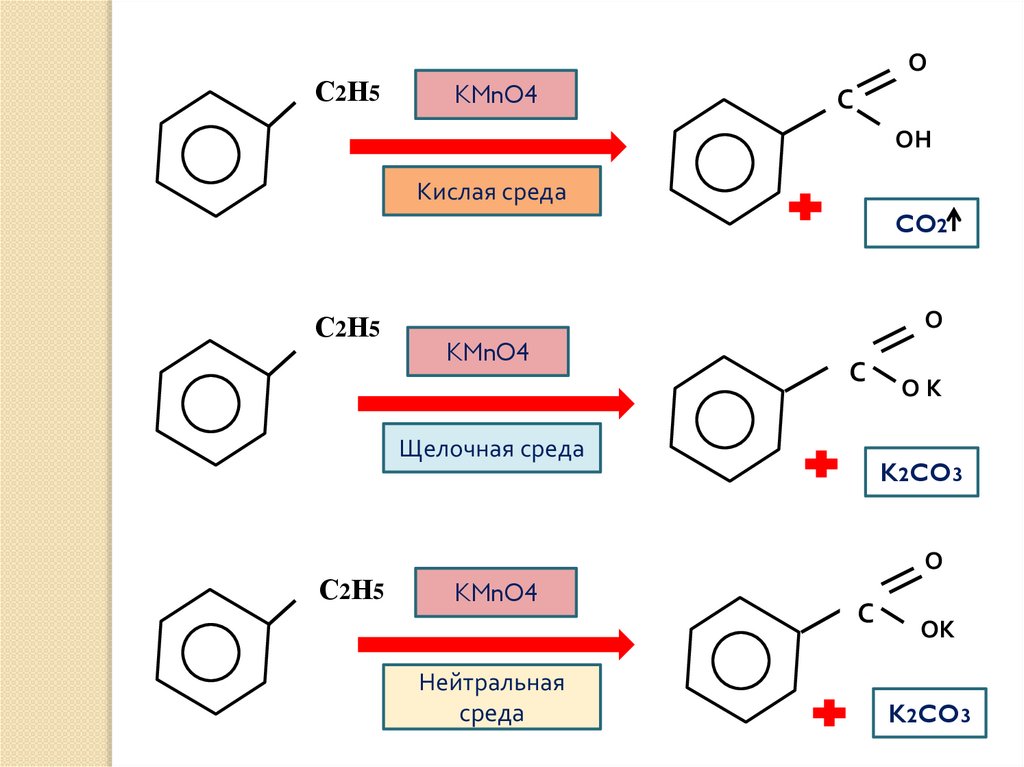
С 2 Н5О
KMnO4
С
ОН
Кислая среда
CO2
С2Н5
О
KMnO4
С
Щелочная среда
С 2 Н5
ОК
K2CO3
О
KMnO4
Нейтральная
среда
С
ОК
K2CO3
33.
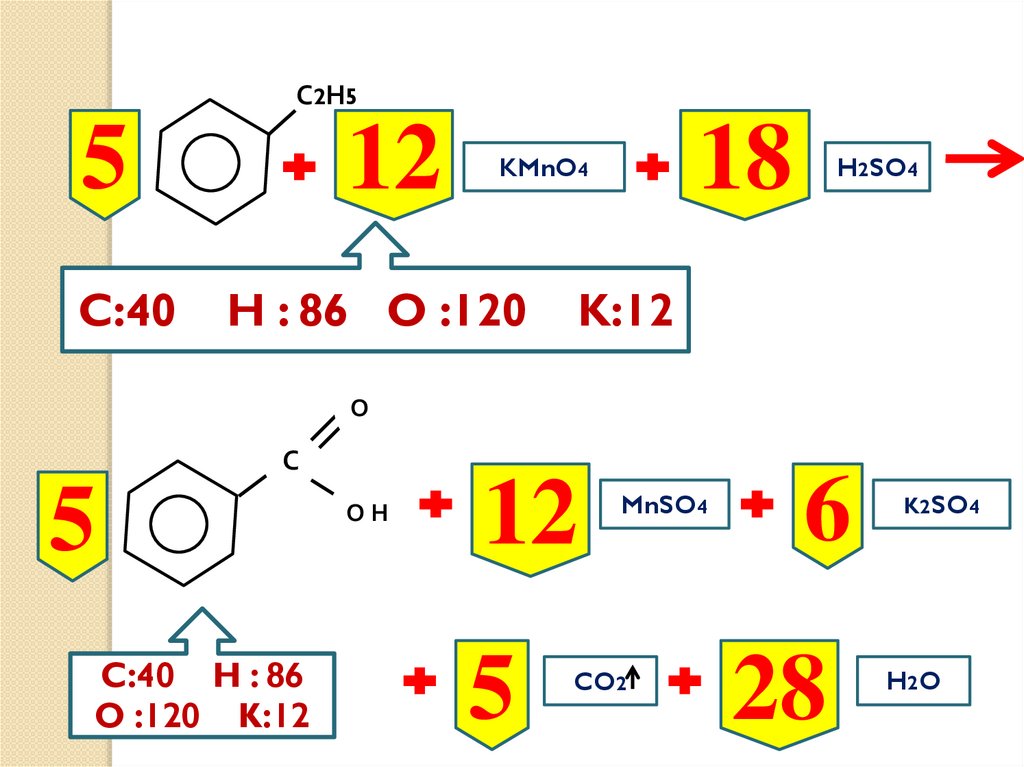
5С 2 Н5
?
?
t
?
KMnO4
H2SO4
О
?
С
ОН
?
?
MnSO4
CO2
?
?
K2SO4
H2 O
34.
С 2 Н5t
KMnO4
H2SO4
C8H10
О
С
ОH
MnSO4
C7H6O2
K2SO4
H2 O
СO2
35.
С2Н5?
?
t
?
KMnO4
H2SO4
C8H10
О
С
?
ОН
C7H6O2
?
?
MnSO4
CO2
?
?
K2SO4
H2 O
36.
-10/8+1
-2/7
C8H10
+1
+7
+1
-2
+4
C7H6O2
-2
KMnO4
+1
-2
CO2
+6
-2
K2MnO4
37.
-10/88C
-2/7
-12e
-10
+4
7C
C
5
+2
+2
+7
Mn
+5e
Mn
12
38.
С2Н55
C:40
12
18
KMnO4
H : 86 O :120
H2SO4
K:12
О
С
5
C:40 H : 86
O :120 K:12
ОН
12
5
MnSO4
CO2
6
28
K2SO4
H2 O
39.
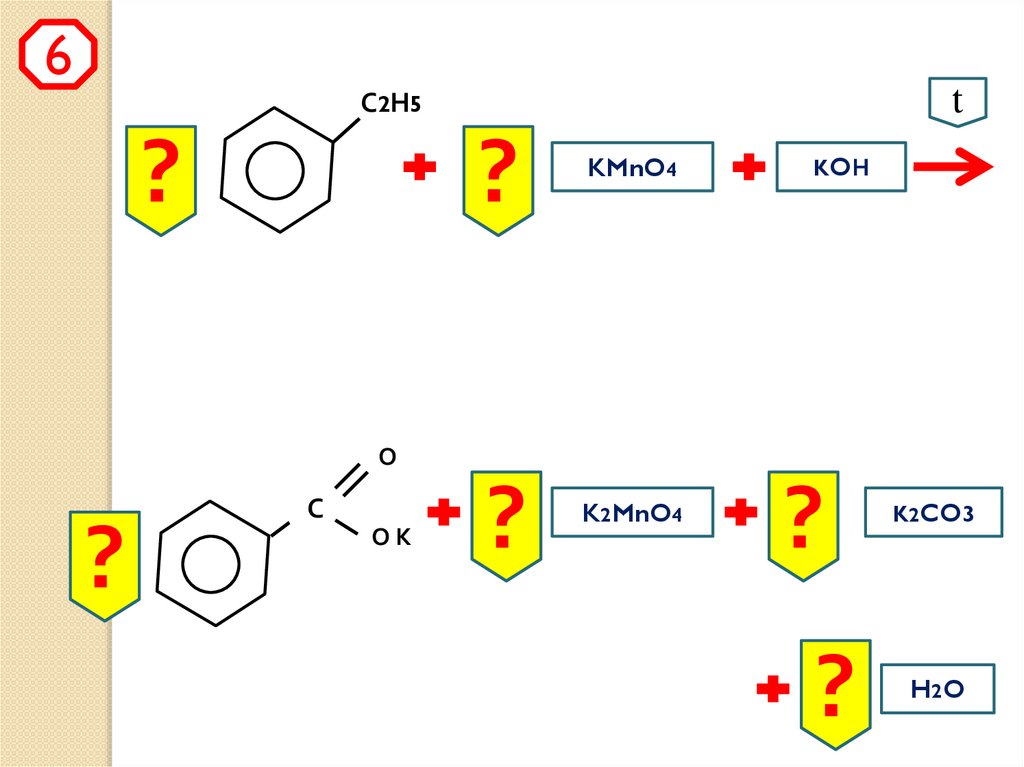
6t
С2Н5
?
?
KMnO4
KOН
О
?
С
ОК
?
K2MnO4
?
?
K2CO3
H2 O
40.
С2Н5t
KMnO4
KOH
C8H10
О
С
ОК
K2MnO4
C7H5O2K
K2CO3
H2 O
41.
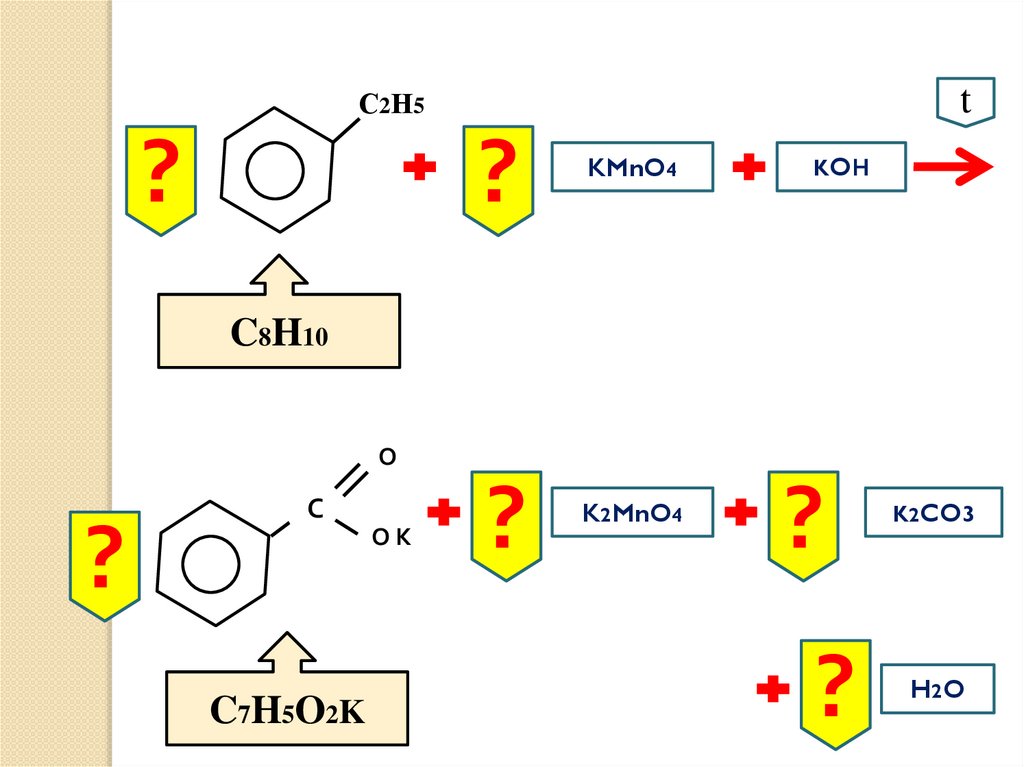
tС 2 Н5
?
?
KMnO4
KOН
C8H10
О
?
С
ОК
C7H5O2K
?
K2MnO4
?
?
K2CO3
H2 O
42.
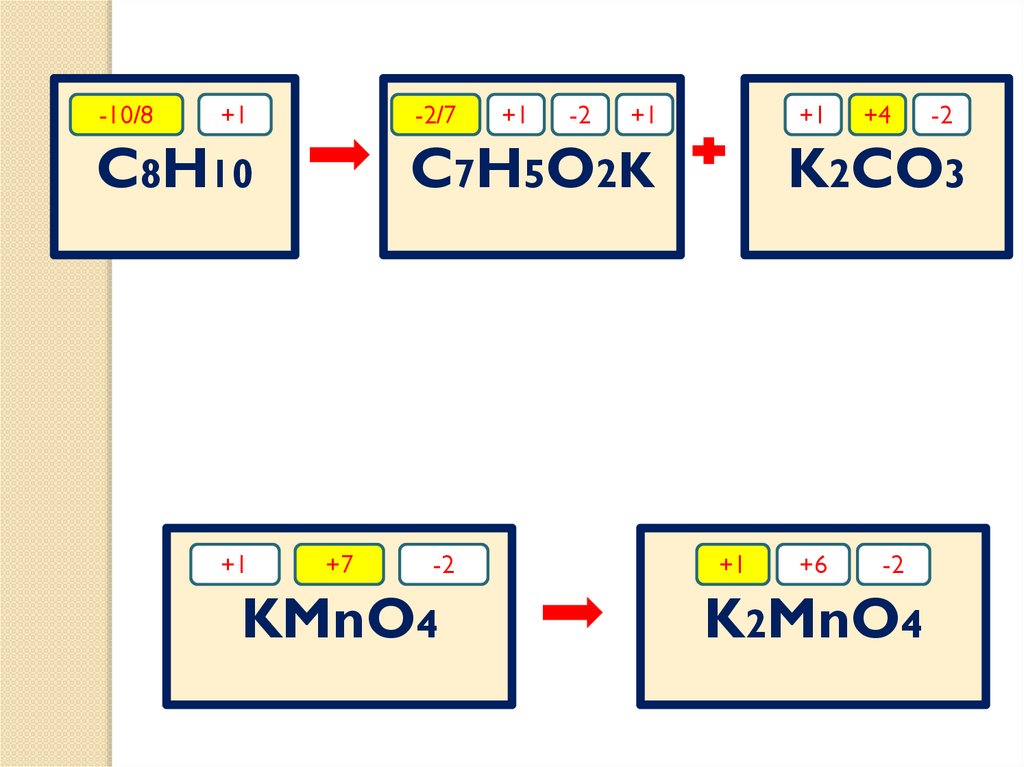
-10/8+1
-2/7
C8H10
+1
+1
-2
+1
+1
C7H5O2K
+7
-2
KMnO4
+4
-2
K2CO3
+1
+6
-2
K2MnO4
43.
-10/8-2/7
8C
-12e
-10
+4
7C
C
1
+2
+6
+7
Mn
+1e
Mn
12
44.
tС 2 Н5
12
C:8
H : 25
KMnO4
15
KOН
O :63 K:27
О
С
ОК
C:8
H : 25
12
O :63 K:27
K2MnO4
10
K2CO3
H2 O
45.
7С2Н5
?
t
?
KMnO4
водный
раствор
О
?
С
ОК
?
MnO2
?
KOH
?
?
K2CO3
H2 O
46.
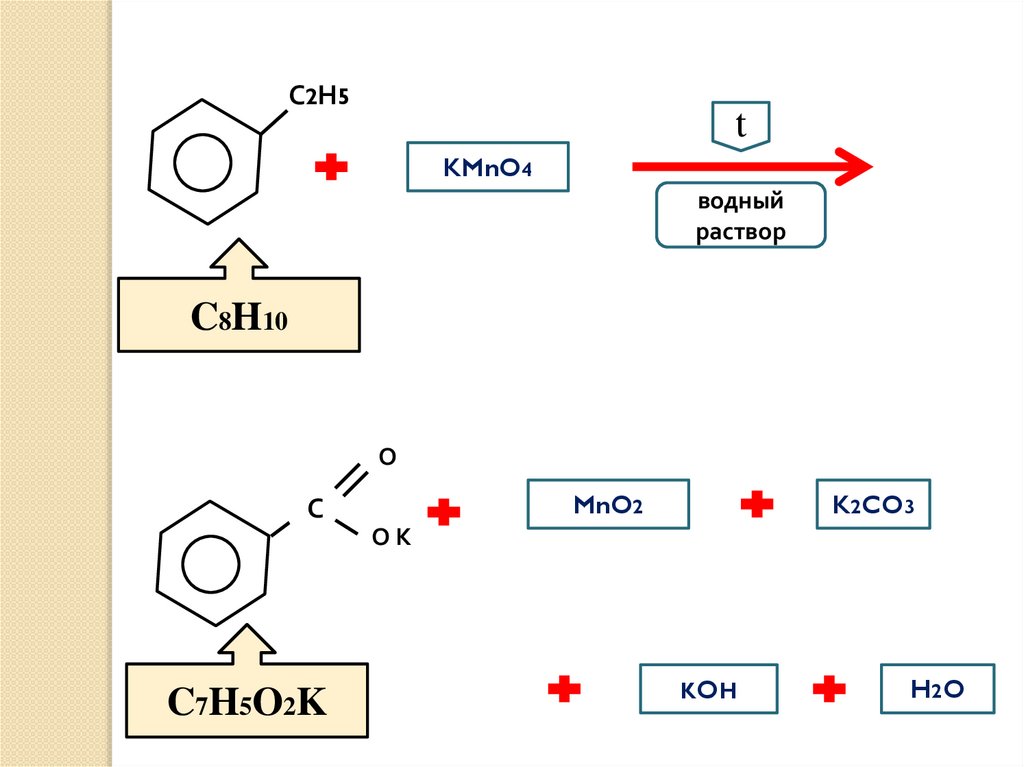
С2Н5t
KMnO4
водный
раствор
C8H10
О
MnO2
С
K2CO3
ОК
C7H5O2K
KOH
H2 O
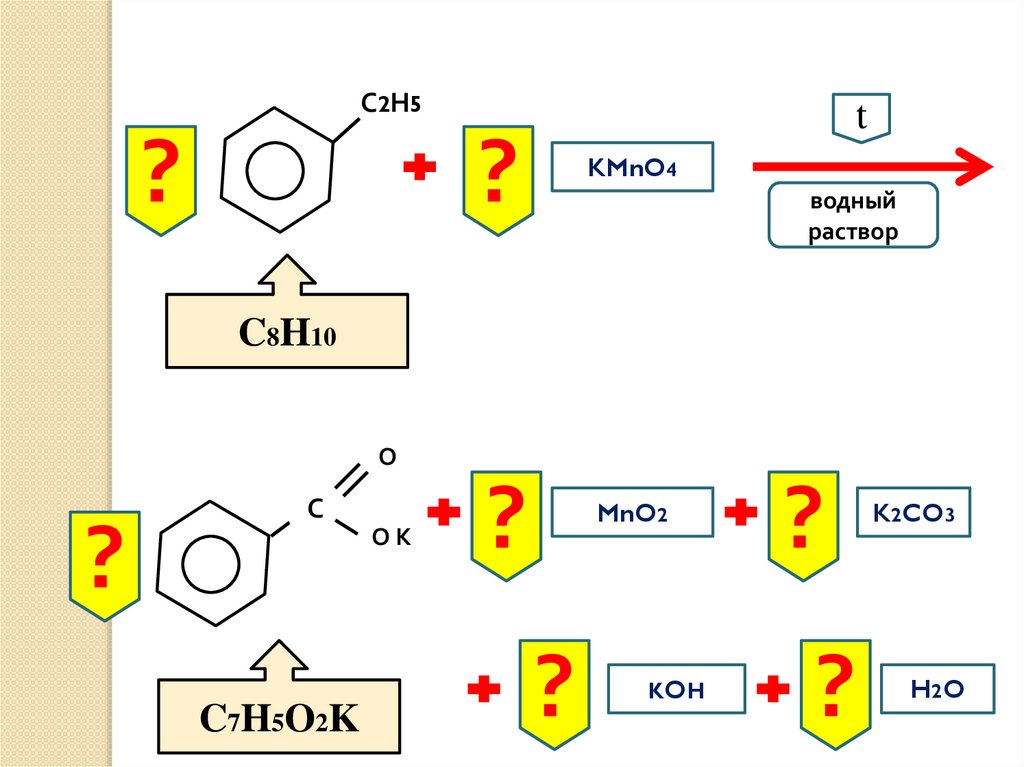
47.
С2Н5?
t
?
KMnO4
водный
раствор
C8H10
О
?
С
ОК
C7H5O2K
?
MnO2
?
KOH
?
?
K2CO3
H2 O
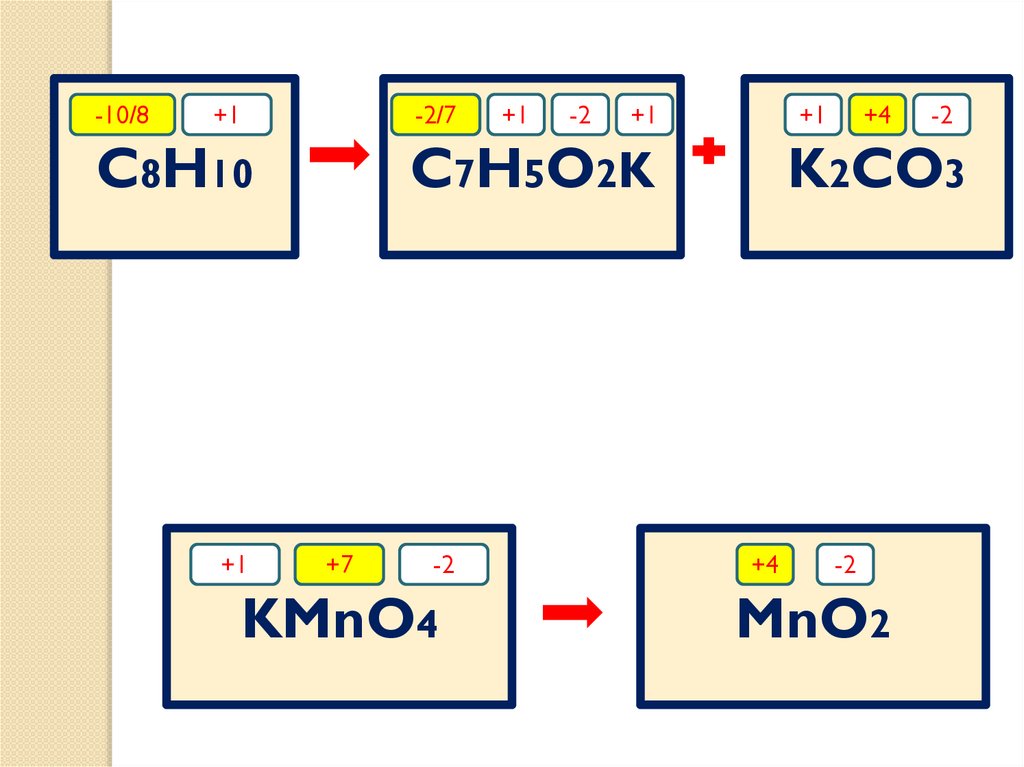
48.
-10/8+1
-2/7
C8H10
+1
+1
-2
+1
+1
C7H5O2K
+7
-2
KMnO4
+4
-2
K2CO3
+4
-2
MnO2
49.
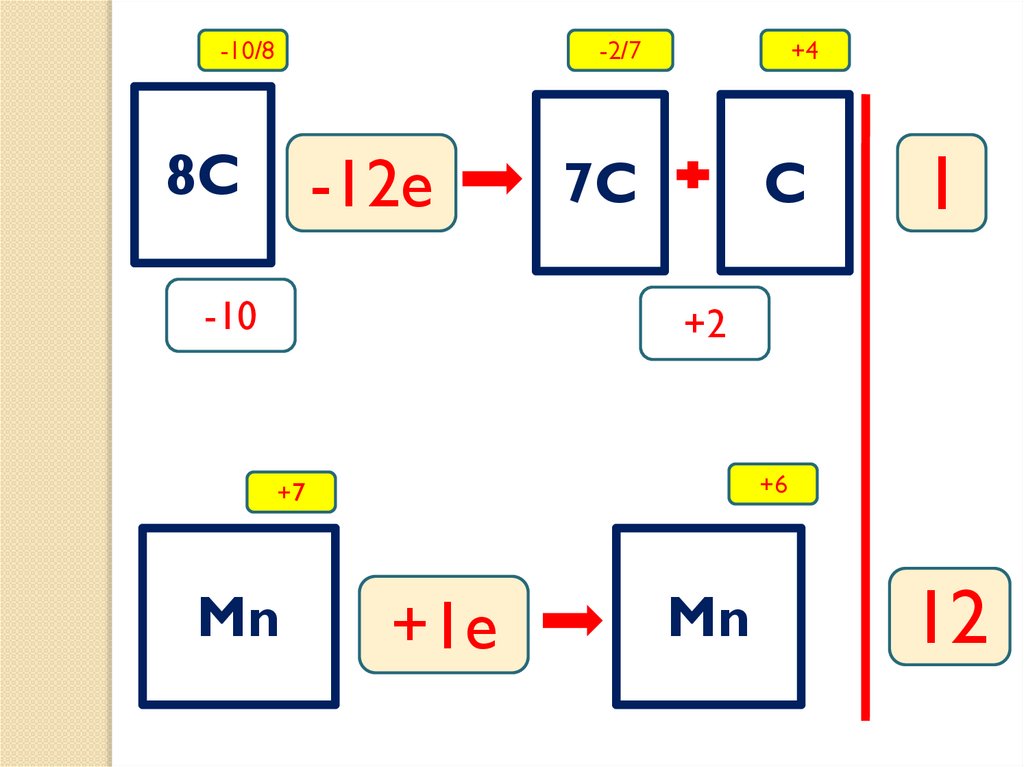
-10/8-2/7
8C
-12e
-10
+4
7C
C
1
+2
+4
+7
Mn
+3e
Mn
4
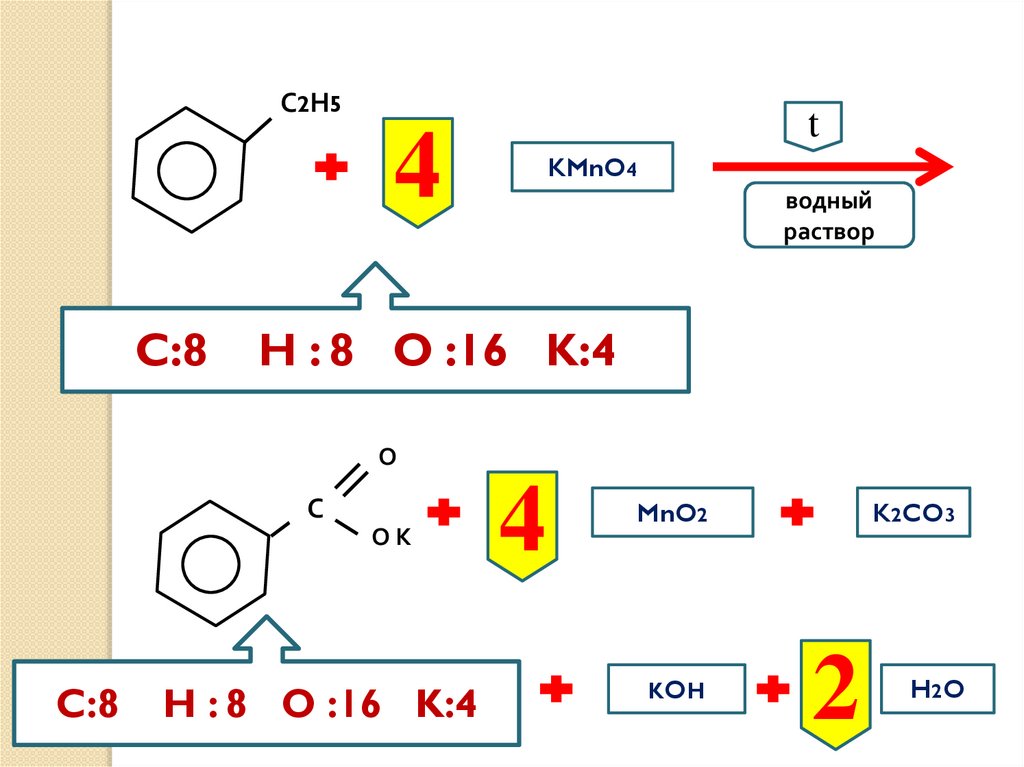
50.
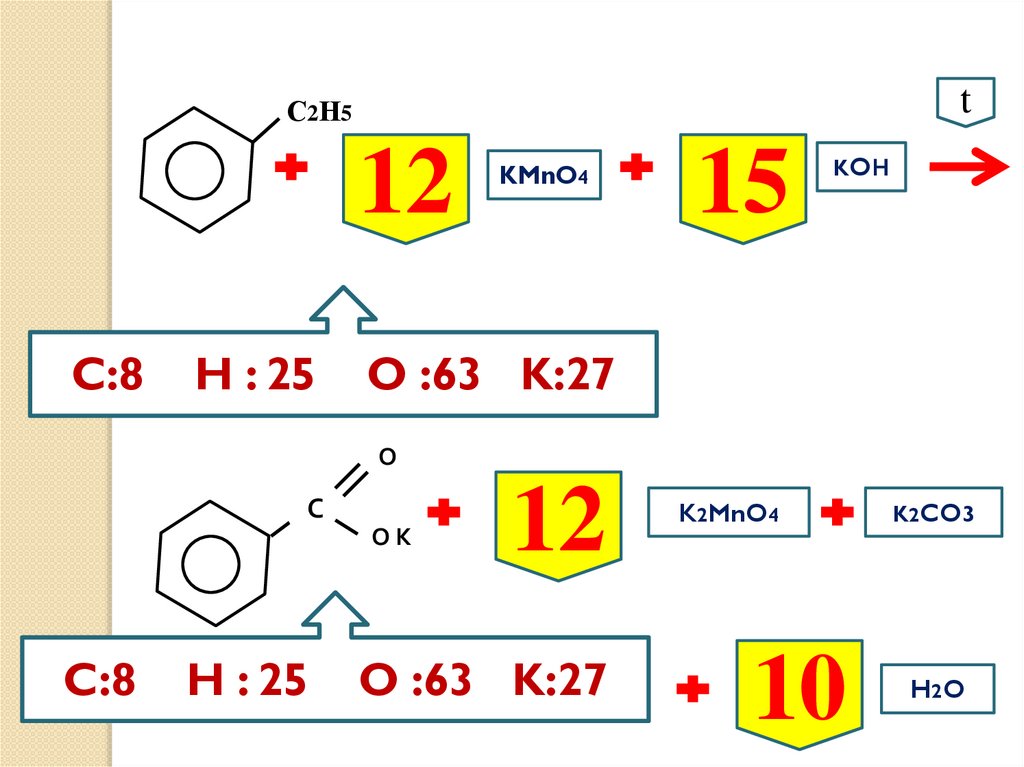
С2Н5t
4
C:8
KMnO4
водный
раствор
H : 8 O :16 K:4
О
С
ОК
C:8
H : 8 O :16 K:4
4
MnO2
KOH
K2CO3
2
H2 O









 Химия
Химия








