Похожие презентации:
Алюминий
1.
Что объединяет этиизображения?
2.
№133.
Если на улице оставить топор(сталь, сплав железа) и алюминиевую ложку, что сними будет через месяц?
КАКОЙ ИЗ
МЕТАЛЛОВ
АКТИВНЕЕ?
Можно сделать вывод, что Fe! Но…
Аl в ряду активности Ме находится перед Fe,следовательно он активней!
Алюминий практически такой же активный металл, как Mg! Но его активность
прячется под его прочной оксидной пленкой, как наше тело- под защищающей его
кожей. Она настолько тонкая и прочная, что металл не теряет блеск, при её
нарушении она мгновенно восстанавливается в присутствии воздуха.
4.
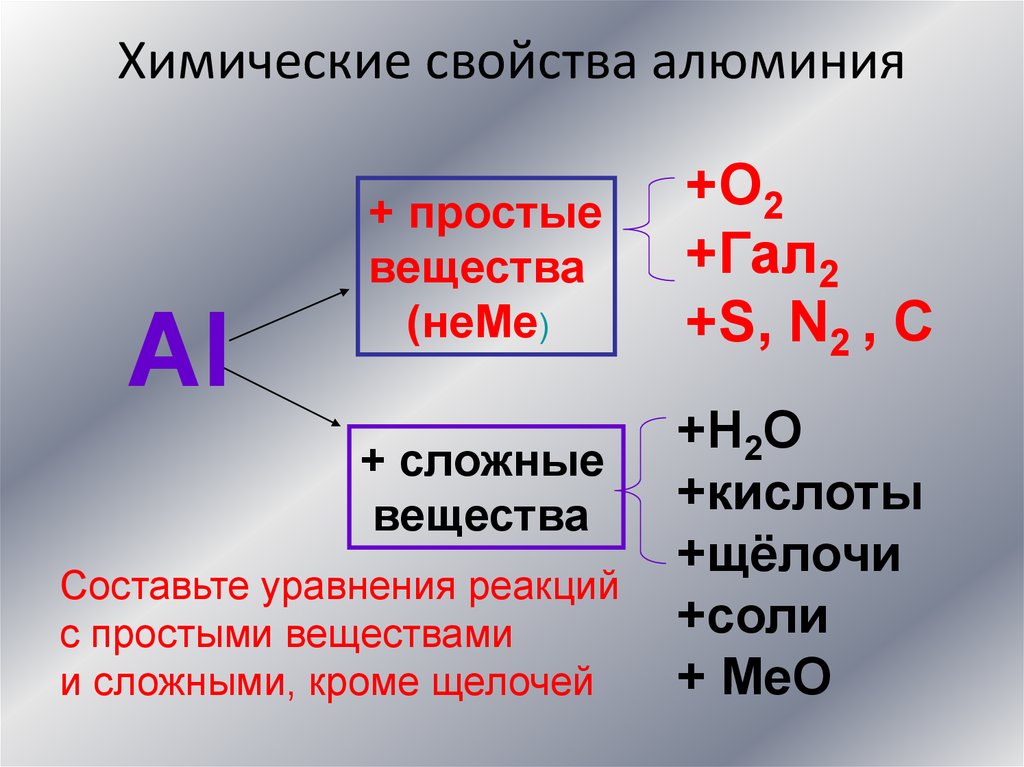
Химические свойства алюминияАl
+ простые
вещества
(неМе)
+ сложные
вещества
Составьте уравнения реакций
с простыми веществами
и сложными, кроме щелочей
+O2
+Гал2
+S, N2 , С
+Н2О
+кислоты
+щёлочи
+соли
+ МеО
5.
https://youtu.be/4EhSeRv_WHo - с бромомhttps://youtu.be/cl5u1N3aGTs с йодом
https://youtu.be/jV9e93_TYnw с водой
https://youtu.be/ir8k6gRxmG0 - с оксидом железа
(алюмотермия)
http://school-collection.edu.ru/catalog/res/0aba29f2-418511db-b0de-0800200c9a66/view/ -со щелочью
https://youtu.be/xDQ-MmVYW8U- фильм об алюминии 20 мин
https://youtu.be/kYzn0D5WNCs амфотерность гидроксида
, с водой, горение на воздухе
6.
Проверь себя:• 2 Al + 3 Cl2 = 2 AlCl3
• 2Al + 6H2O = 2Al(OH)3 + 3H2
• 2 Al + N2 = 2AlN
• 2 Al + 3S = Al2S3
7.
Проверь себя:• 4Al + 3C = Al4C3
• 2Al+6HCl = 2AlCl3 + 3H2
• 2Al+Cr2O3 = Al2O3 + 2Cr
2Al+3HgCl2 = 2AlCl3 + 3Hg
8.
«Амфос» - и тот, и другой9.
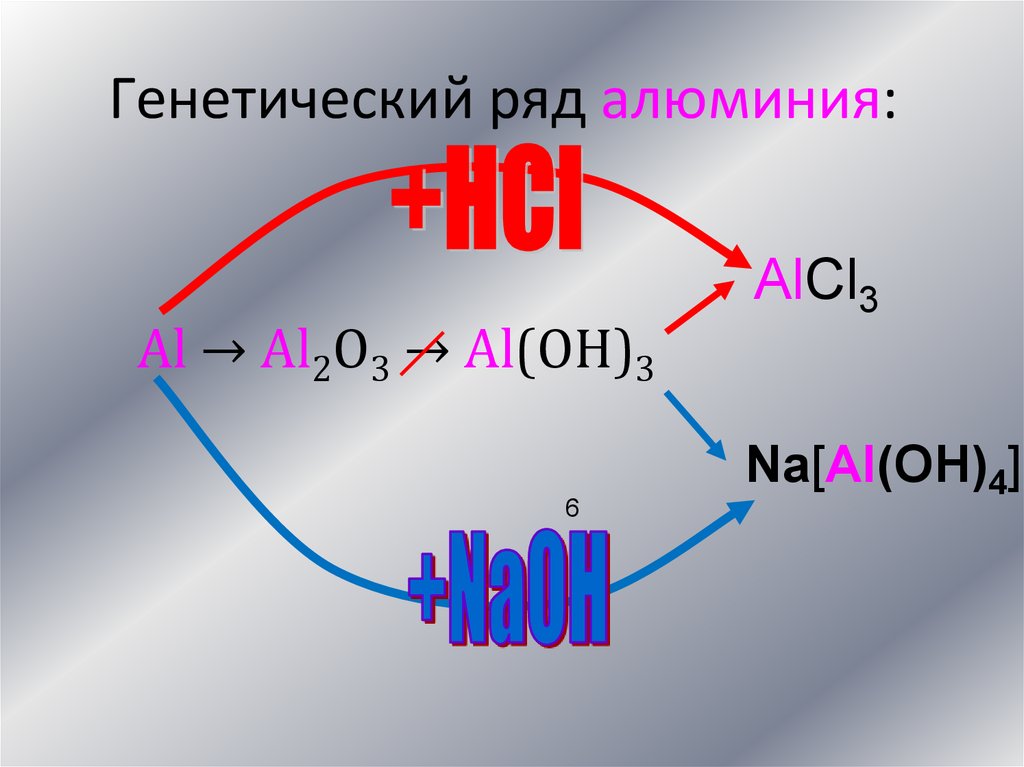
Генетический ряд алюминия:Al → Al2O3 → Al(OH)3
6
AlCl3
Na[Al(OH)4]
10.
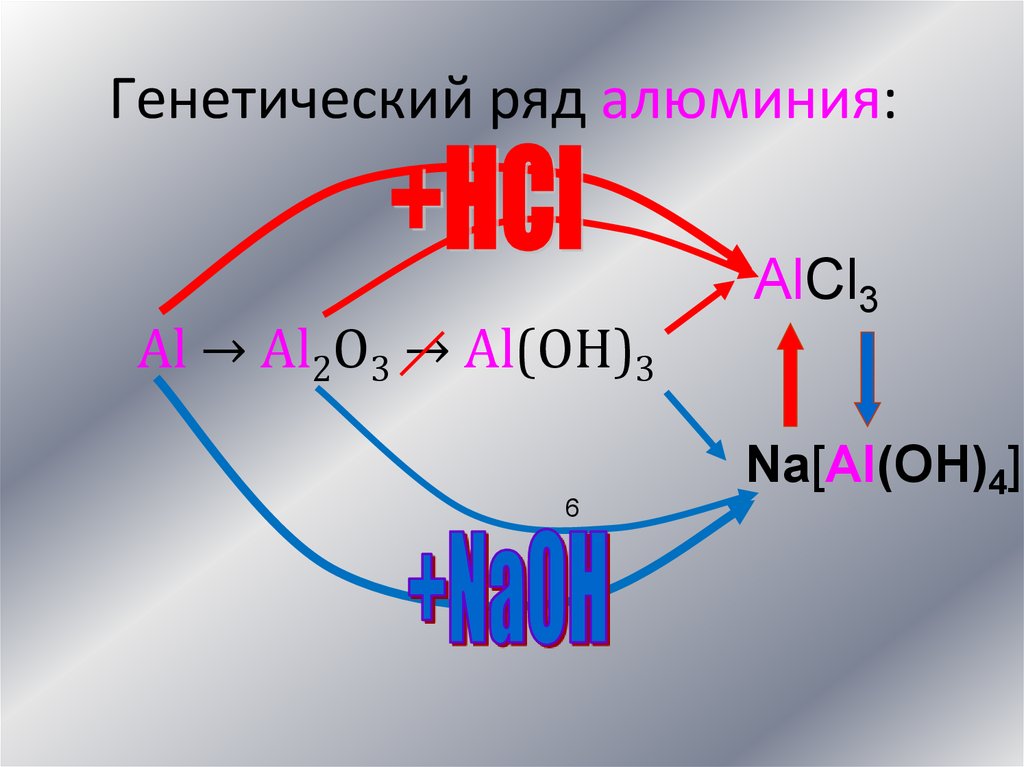
Генетический ряд алюминия:Al → Al2O3 → Al(OH)3
6
AlCl3
Na[Al(OH)4]
11.
ДиктантВопрос
1 Встречается в свободном виде
2 Легкий металл
3 Реагирует и с кислотами, и со
4
щелочами
Подвергается коррозии
5 Восстанавливает металлы из
оксидов
+ или
-
12.
ДиктантВопрос
1
Встречается в свободном виде
2
Легкий металл
3
Реагирует и с кислотами, и со
щелочами
4
Подвергается коррозии
5
Восстанавливает металлы из
оксидов
Ответ
+
+
+
13.
Следующий слайд только длятех, кто сдает экзамен!
Остальным просьба не
волноваться!
14.
Алюминий со щёлочьюAl + NaOH + H2O=?
2Al + 6H2O = 2Al(OH)3 + 3H2
NaOH +Al(OH)3= Na[Al(OH)4]• 2
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2
15.
А теперь Внимание! Attention! Achtyng!Надоело читать ГДЗ по большинству фото; кто делает д/з сам,
я вижу. Поэтому по алюминию цепочка (упр 4) для самопроверки на след
уроке будет открыта, а упр.1,2, можете прислать(свои мысли, не ГДЗ! )
Если выйдем на реальную учебу с 20.04(странно, но мне
очень хочется!), то 22.04 по плану д.б. проверочная работа по
Аl. Заданий три, оценок две. Пример работы:
1.Составьте уравнения реакций:
1)Al + O2 = 2)Al + H2O = 3)Al + N2 = (т.е. проверяю упр 3)
2.Осуществить превращения(т.е. упр4. Судя по полученным д/з, все с
цепочками справятся на отлично!)
3. ответить на вопрос(1):варианты вопросов: Почему алюминий, будучи
активным металлом, стоек к коррозии? Где используют высокую
коррозионную стойкость алюминия? Каким способом получают
алюминий? Почему в алюминиевой посуде нельзя хранить щелочные и
кислотные растворы? Где применяют алюминий в технике и в быту? На
каких свойствах основаны области его применения?
Вторая оценка -по желанию:Cоставьте уравнения , рассмотрите их как
ОВР: укажите окислитель и восстановитель,* число отданных(принятых)
электронов(без баланса, как делали перед каникулами, со стрелочкой)
1)FeO +CO→ 2) 2)Алюминий и оксид хрома (III) →
16.
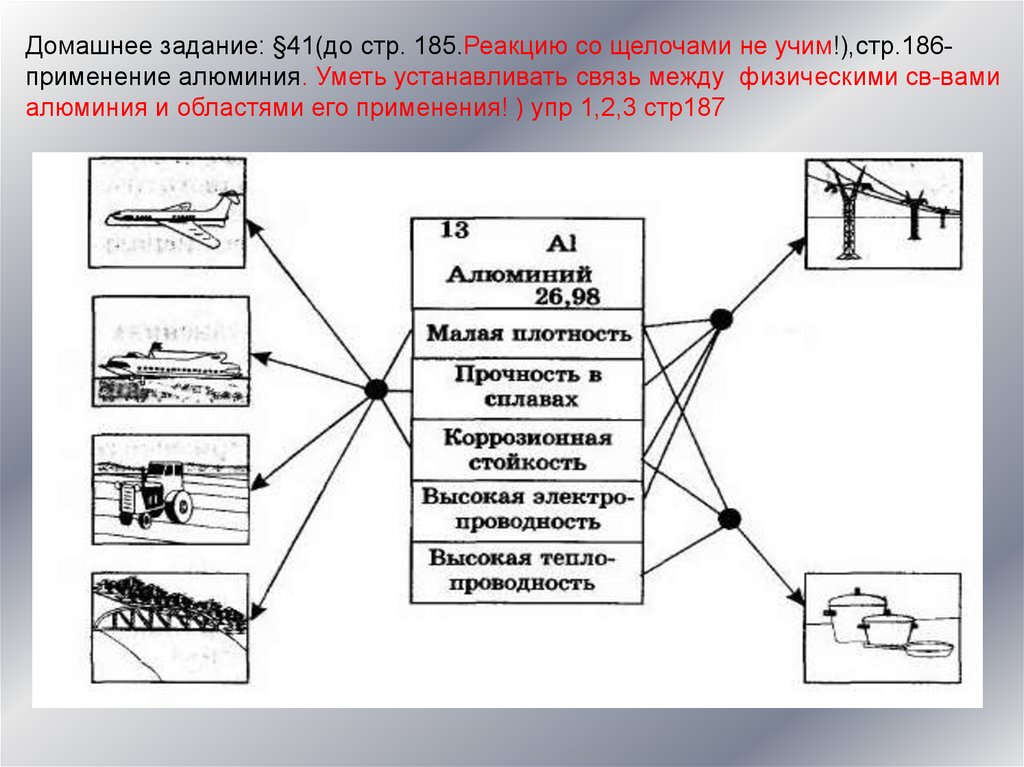
Домашнее задание: §41(до стр. 185.Реакцию со щелочами не учим!),стр.186применение алюминия. Уметь устанавливать связь между физическими св-вамиалюминия и областями его применения! ) упр 1,2,3 стр187












 Химия
Химия








