Похожие презентации:
Электроотрицательность химических элементов. Виды химической связи
1. Электроотрицательность химических элементов. Виды химической связи
2. План характеристики химического элемента
1. Положение в ПСХЭ (порядковый номер, относительнаяатомная масса, период (какой), группа и подгруппа).
2. Состав ядра атома, общее число электронов в
электронной оболочке, схема строения электронной
оболочки.
3. Металл, неметалл, переходный металл.
4. Сравнение металлических (неметаллических) свойств с
соседними по периоду и подгруппе элементами.
5. Формула высшего оксида, характер его свойств
(основный, кислотный, амфотерный).
6. Формула высшего гидроксида (основание, кислота,
амфотерный гидроксид).
7. Формула летучего водородного соединения (для
неметалла).
3. Изменение свойств в ПСХЭ
Металлические свойства уменьшаются,неметаллические свойства увеличиваются
Неметаллические свойства уменьшаются,
металлические свойства увеличиваются
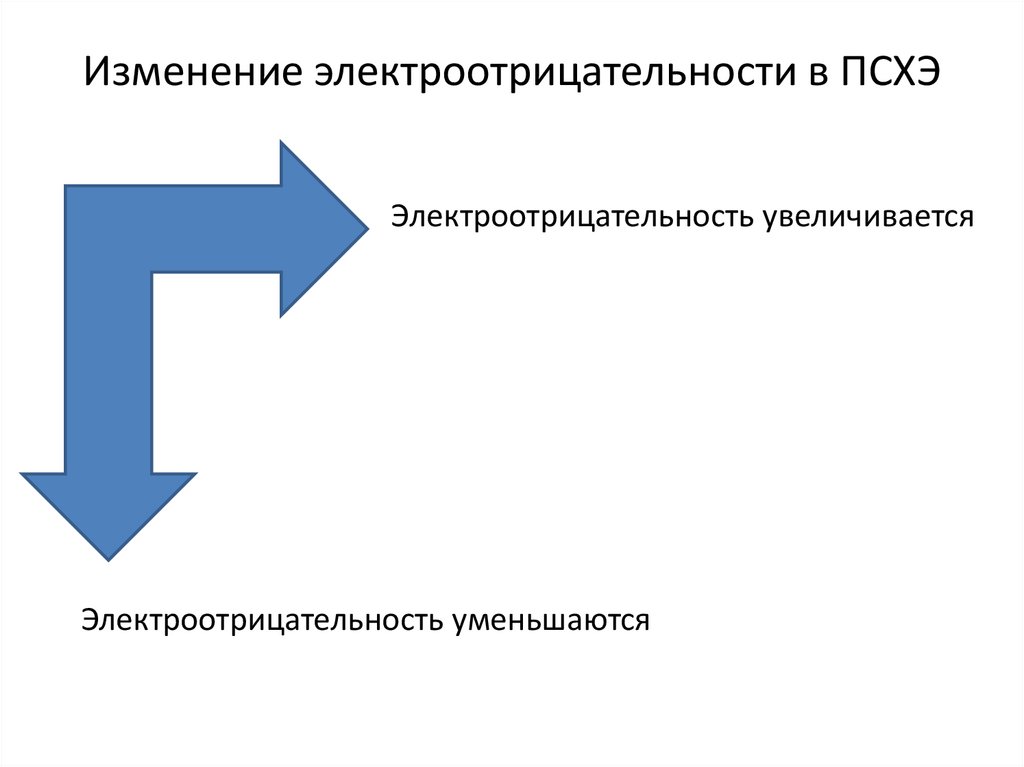
4. Изменение электроотрицательности в ПСХЭ
Электроотрицательность увеличиваетсяЭлектроотрицательность уменьшаются
5. Строение электронных оболочек
Электроны внешнего слоя движутся попарно(спаренные электроны), или отдельно
(свободные, неспаренные электроны).
Количество неспаренных электронов (для
неметалла) = 8 - номер группы.
∙
∙∙
∙∙
∙
Например, : P ∙
:S∙
: Cl ∙
∙C ∙
∙
∙
∙∙
∙
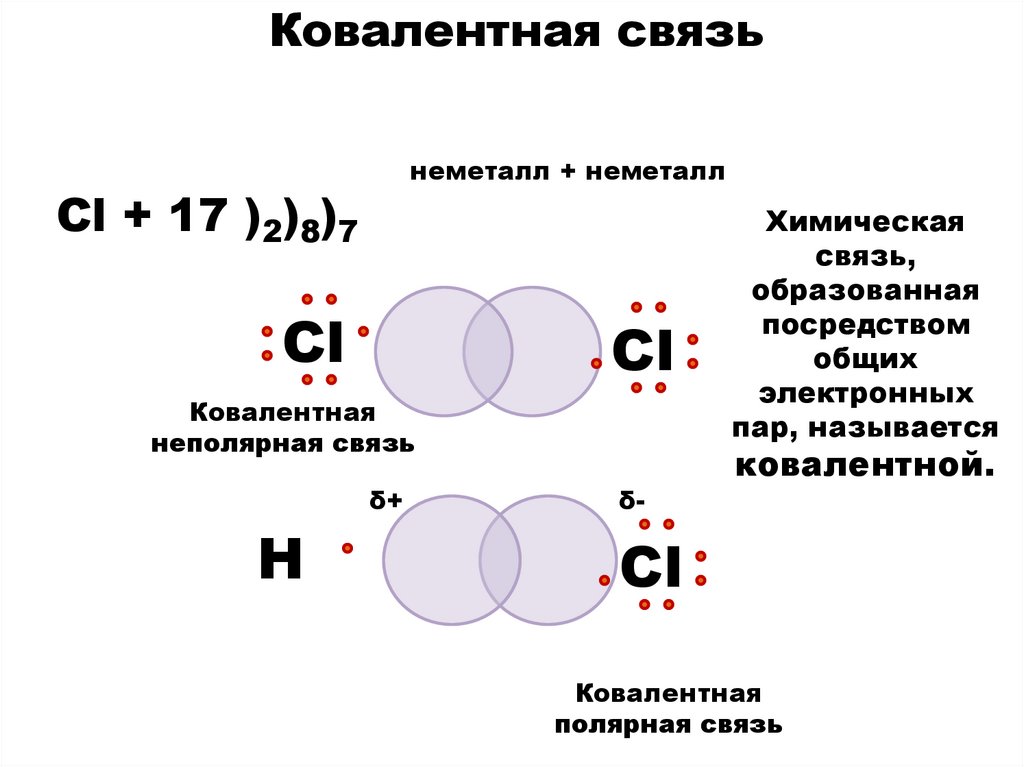
6.
Ковалентная связьнеметалл + неметалл
Cl + 17 )2)8)7
Сl
Сl
Ковалентная
неполярная связь
δ+
Н
δ-
Химическая
связь,
образованная
посредством
общих
электронных
пар, называется
ковалентной.
Сl
Ковалентная
полярная связь
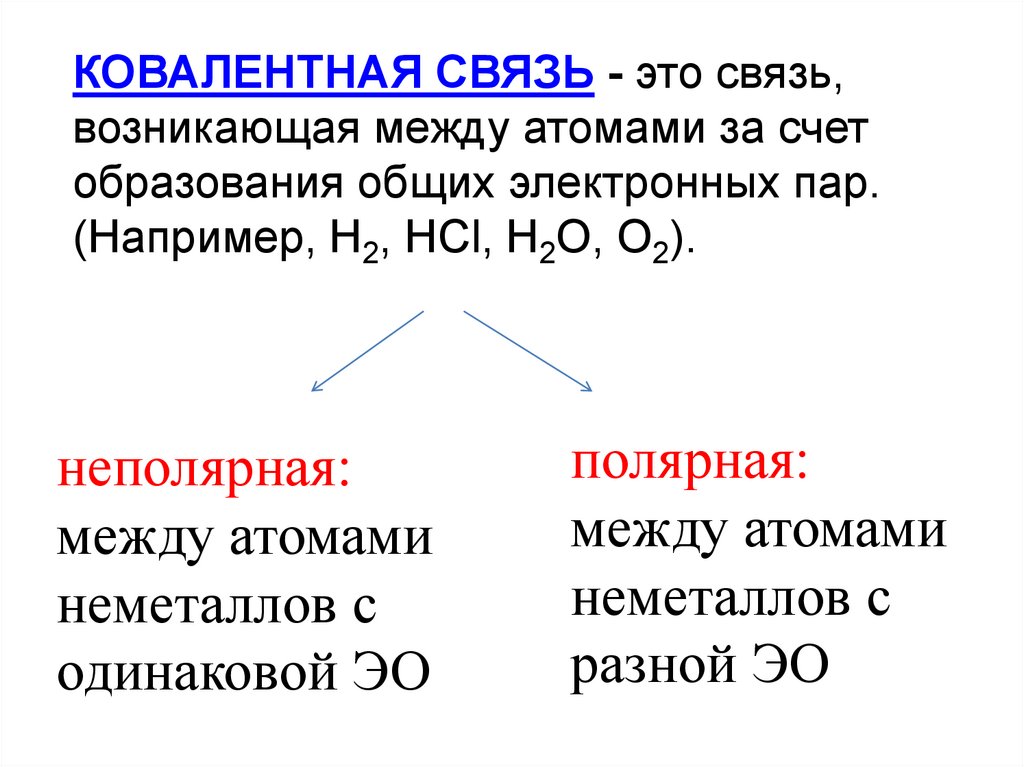
7.
КОВАЛЕНТНАЯ СВЯЗЬ - это связь,возникающая между атомами за счет
образования общих электронных пар.
(Например, H2, HCl, H2O, O2).
неполярная:
между атомами
неметаллов с
одинаковой ЭО
полярная:
между атомами
неметаллов с
разной ЭО
8.
Ковалентная связь может быть образовананесколькими парами электронов
N
N
N
N
Количество связей у атома равно количеству
электронов, которых не достает у атома до
октета.
9.
Ионной называется химическаяобразующаяся между ионами.
связь,
Ион – это частица, образующаяся в результате
отдачи или принятия электрона.
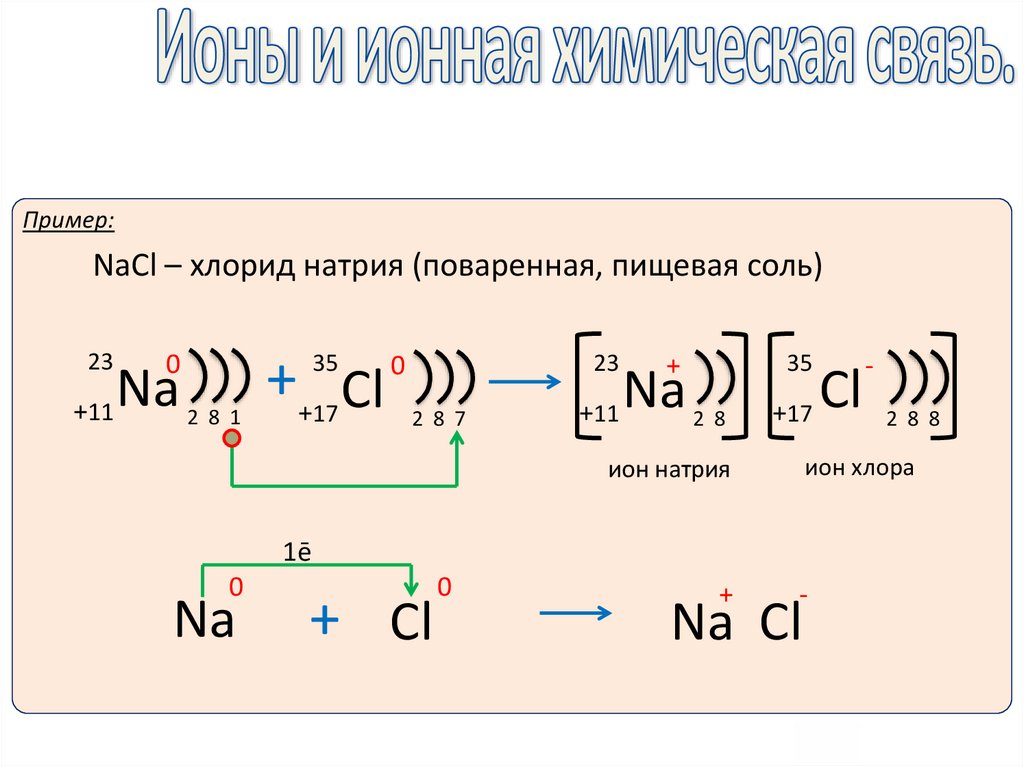
10.
Пример:NaCl – хлорид натрия (поваренная, пищевая соль)
23
0
Na
+11
++17 Cl
35
2 8 1
23
0
2 8 7
+11
35
+
Na
2 8
+17
1ē
Na
+ Cl
0
+
2 8 8
ион хлора
ион натрия
0
Cl
-
-
Na Cl
11.
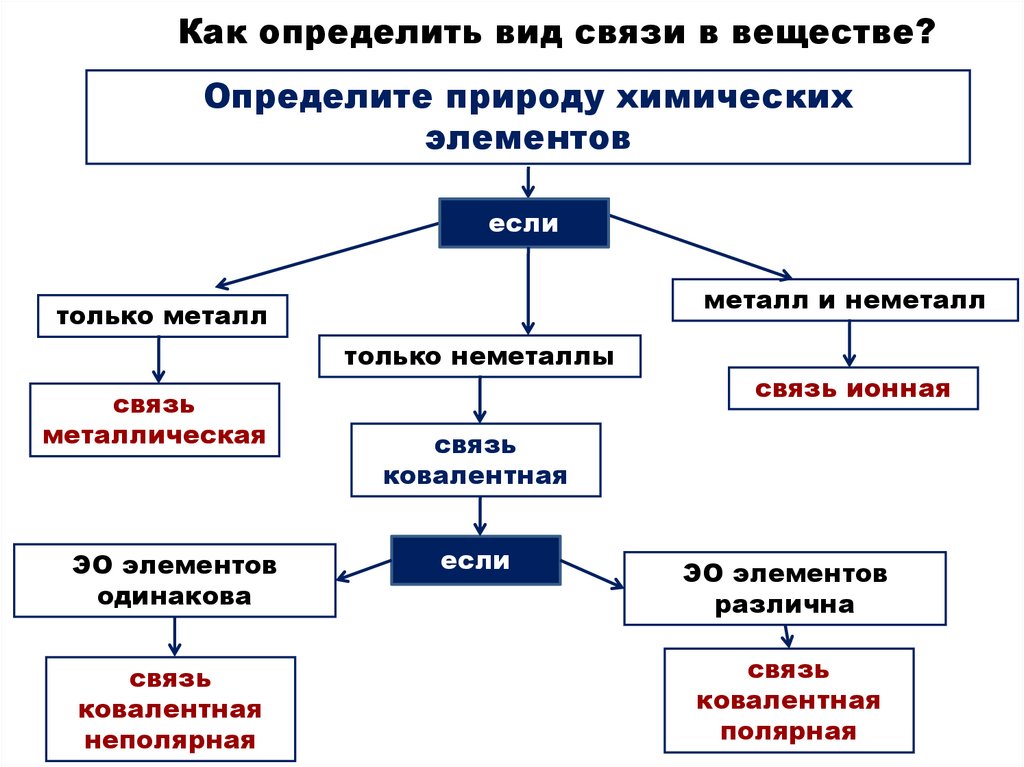
Как определить вид связи в веществе?Определите природу химических
элементов
если
металл и неметалл
только металл
только неметаллы
связь
металлическая
ЭО элементов
одинакова
связь
ковалентная
неполярная
связь ионная
связь
ковалентная
если
ЭО элементов
различна
связь
ковалентная
полярная
12. Закрепление
1. Выпишите отдельно формулы веществ сковалентной полярной и неполярной
связями, ионной связью: H2S, KCl, O2, Na2S,
Na2O, N2, NH3, CH4, BaF2, LiCl, O3, CO2, SO3,
CCl4, F2.
2. Напишите механизм образования молекул
с ковалентным типом связи: H2S, KCl, O2,
Na2S, Na2O, N2, NH3, CH4, BaF2, LiCl, CCl4, F2.








 Химия
Химия








