Похожие презентации:
Химическая связь
1. Химическая связь
2. Химическая связь
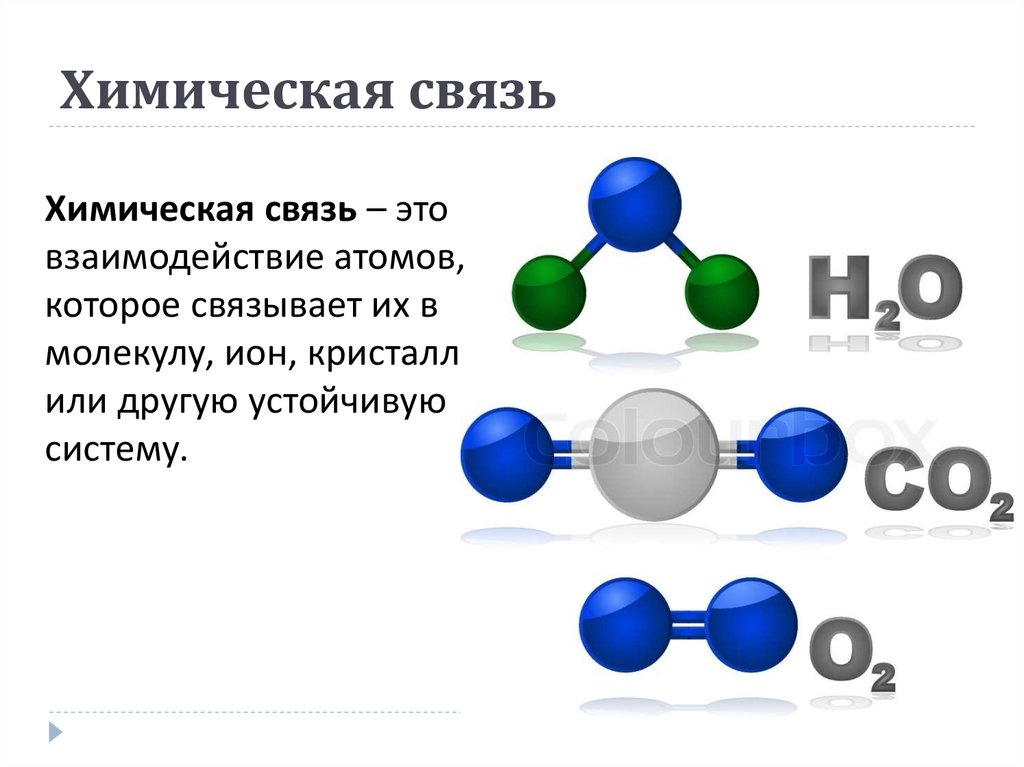
Химическая связь – этовзаимодействие атомов,
которое связывает их в
молекулу, ион, кристалл
или другую устойчивую
систему.
3. Виды химических связей
1) Внутримолекулярная:• Ионная
• Ковалентная
2) Межмолекулярная:
• Металлическая
• Водородная
• Ван-дер-ваальсова
4. Ионная связь
Меn+ (NH4+) – неМевнутримолекулярная связь
образуется между ионами
основана на электростатическом притяжении
между катионом и анионом
NaCl, KF, CaCO3, Al2(SO4)3
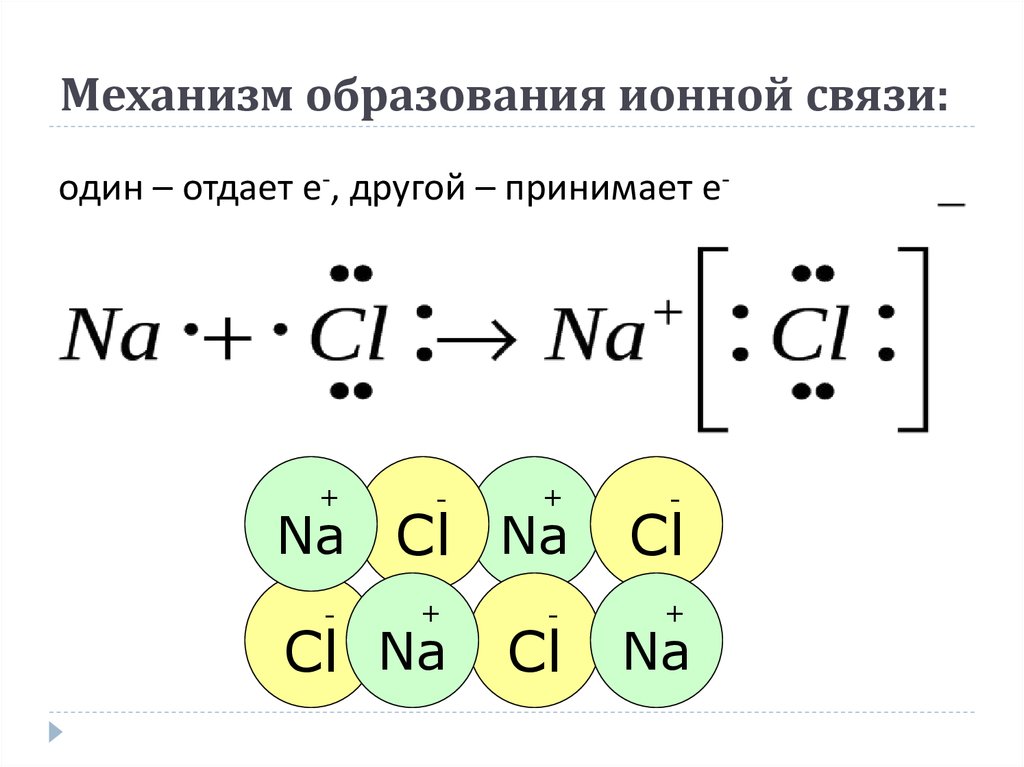
5. Механизм образования ионной связи:
один – отдает е-, другой – принимает е-+
-
+
-
+
-
Na Cl Na
Cl Na
Cl
-
Cl
+
Na
6. Ковалентная связь
неМе - неМевнутримолекулярная связь
образуется между атомами неметаллов
основана на взаимодействии электрических полей,
создаваемых электронами и ядрами атомов
HCl, OF2, CO2, H2SO4
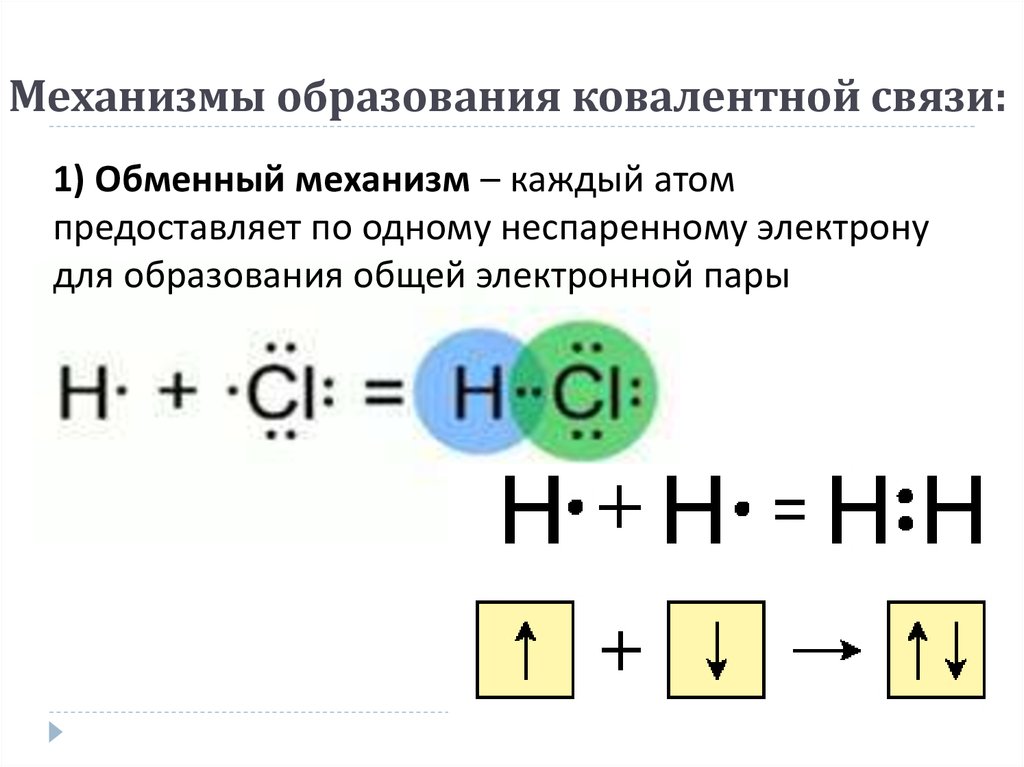
7. Механизмы образования ковалентной связи:
1) Обменный механизм – каждый атомпредоставляет по одному неспаренному электрону
для образования общей электронной пары
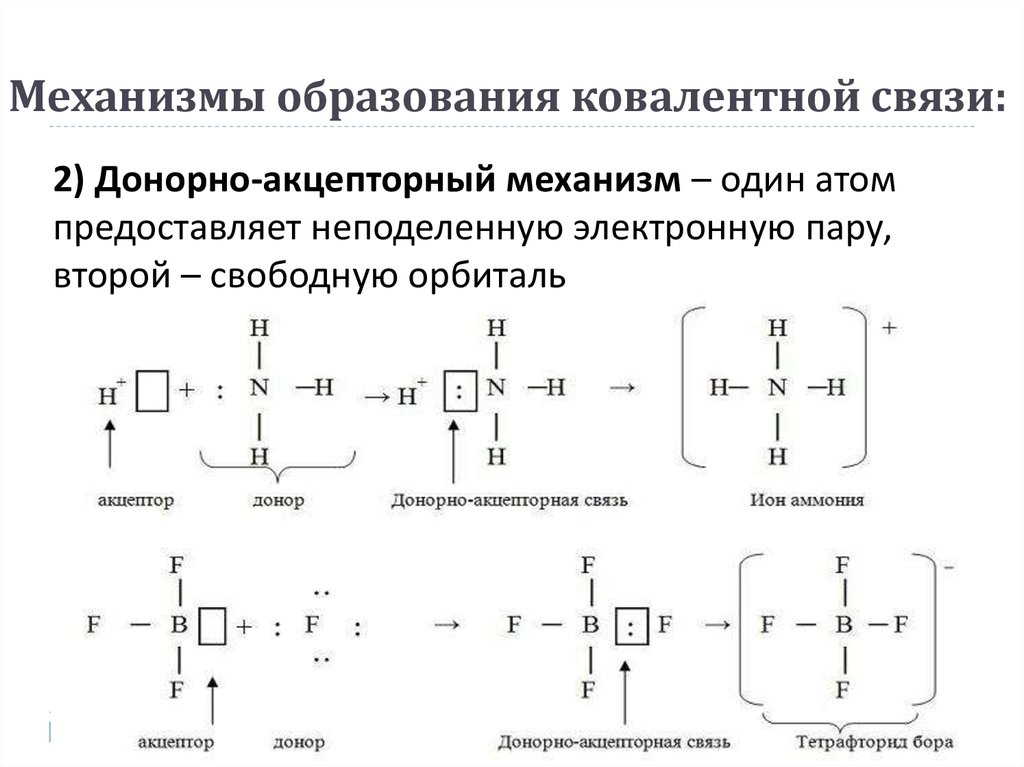
8. Механизмы образования ковалентной связи:
2) Донорно-акцепторный механизм – один атомпредоставляет неподеленную электронную пару,
второй – свободную орбиталь
9. Ковалентная связь
1) Ковалентно-неполярная связь – связь междуатомами одного неметалла.
общая электронная пара находится по середине
H2, P4, O2, S8
2) Ковалентно-полярная связь – связь между
атомами разных неметаллов.
общая электронная пара смешается к более
электроотрицательному элементу
H2O, HCl, N2O, NO2
10. Металлическая связь
Ме - Мемежмолекулярная связь
образуется между атомами металлов
основана на электростатическом притяжении
между электронами и ядрами атомов
Na, Fe, Cu
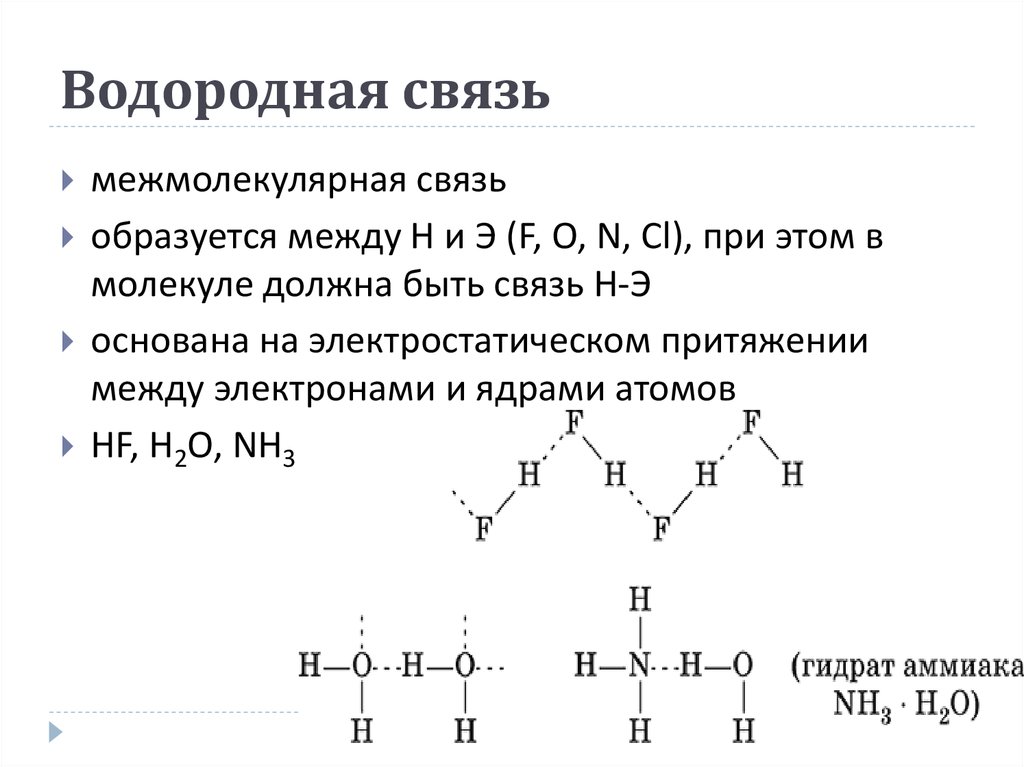
11. Водородная связь
межмолекулярная связьобразуется между H и Э (F, O, N, Cl), при этом в
молекуле должна быть связь Н-Э
основана на электростатическом притяжении
между электронами и ядрами атомов
HF, H2O, NH3
12. Ван-дер-ваальсова связь
межмолекулярная связьобразуется между молекулами с ковалентным
характером внутримолекулярного взаимодействия






 Химия
Химия








